Física
Termodinámica y Entropía
Termodinámica y Entropía
Origen y Fin del Universo
Índice
| Introducción…………………………………………………………………………….. | 3 | ||
|
Desarrollo del tema………………………………………………………………….... | 4 | ||
| Calor…………………………………………………. | 4 | ||
| Kelvin…………………………………………………. | 4 | ||
| Leyes de la termodinámica………………………… | 5 | ||
| Primera Ley de la Termodinámica………………... | 5 | ||
| Segunda Ley de la Termodinámica………………. | 6 | ||
| Tercera Ley de la Termodinámica………………… | 7 | ||
| Ley Cero de la Termodinámica……………………. | 7 | ||
| Procesos termodinámicos para gases ideales….. | 8 | ||
| Ciclo de Carnot……………………………………… | 9 | ||
| Entropía……………………………………………… | 10 | ||
| Origen del Universo………………………………… | 11 | ||
| Fin del Universo…………………………………….. | 13 | ||
| Síntesis de conceptos…………..……………………………………………………. | 15 | ||
| Conclusión…………….……………………………………………………………….. | 16 | ||
| Glosario…………………………………………………………………………………. | 17 | ||
| Bibliografía……………………………………………………………………………… | 18 | ||
| Apéndice………………………………………………………………………………... | 19 | ||
Introducción
Puede que más de alguna vez hayamos escuchado el concepto de termodinámica, o entropía, pero talvez nunca lo relacionaríamos con una tetera, o quizás con nuestro propio cuerpo. Cuando se hierve agua en una tetera estamos en presencia de un proceso termodinámico, ya que el calor aportado por el fuego hace que el agua hierva y al mismo tiempo que entregue calor al medio ambiente. Por otra parte observamos entropía al disiparse la energía calorífica y aportar desorden al Universo.
Se denomina termodinámica a la relación entre el movimiento (dinámica) y el calor (termo), es decir, el estudio del movimiento o transformación del calor. Implica procesos dentro de sistemas, que gastan o acumulan energía calorífica. Procesos que además de la energía calorífica, tienen un efecto ineludible sobre el resto del ambiente, por muy pequeño e insignificante que sea el sistema. A esto último se le llama entropía, ya que se relaciona con el desorden, es decir, la entropía es una medida del desorden que puede tener internamente o producir un sistema. Esta puede ser aplicada desde un sistema pequeño, como una caja con dos compartimientos cuya agua -fría y caliente- se juntan y llegan a su grado máximo de desorden (entropía), hasta el infinito Universo. Para esto esta la teoría del caos, o muerte térmica del Universo, en donde toda la materia del universo se expande hasta desintegrarse o bien se contrae hasta formar una mínima materia como lo era en un principio.
Como podemos ver, no estamos frente a un tema sencillo o un simple concepto con el cual nos hallamos topado alguna vez, sino que la termodinámica, la entropía y todas las raíces que se pueden sacar de ellas influyen tanto en nuestras vidas que hasta está en juego el fin del Universo.
En definitiva, la termodinámica es el fundamento para muchas ciencias y principios físicos.
Desarrollo del tema
Los procesos son fundamentales y básicos dentro de la termodinámica, ya que de los procesos se desprenden sus efectos y generan reacciones en su entorno. Se le llama proceso termodinámico a cualquier cambio de estado de un sistema. Estos procesos termodinámicos se clasifican de dos formas principalmente:
Procesos reversibles: Son todos aquellos procesos que son reproducibles con exactitud, ya que se conocen los pasos del proceso. En teoría son reversibles y se podría devolver un objeto a su estado inicial, aunque en la práctica esto no ocurre por efecto de la entropía.
Procesos irreversibles: Cuando los sistemas son sometidos a procesos rápidos y no se conocen los pasos que se siguieron. No implica que no se pueda volver al estado inicial, si no que no se puede volver por el mismo camino.
Encontramos procesos en nuestro entorno constantemente. En realidad, se podría considerar que todo el universo es un solo gran proceso que contiene subprocesos.
Calor
El calor (Q) es la energía intercambiada entre objetos, por lo general por estar a diferente temperatura. Es energía en tránsito, por lo que se analiza usando los términos básicos de la energía. Su unidad de medida puede ser Joule (unidad de energía) como también Kilocaloría (Kcal.).
El calor viaja en ondas electromagnéticas, llamadas también infrarrojas o térmicas, a través del espacio al ser ondas electromagnéticas, no es necesario que exista materia para que se traslade. Es por esta razón que el calor del sol se traslada a través del espacio (en el cual la materia es casi nula) y llega a la tierra. Las ondas térmicas se producen por la vibración de los electrones de las capas superiores de ciertos elementos, estas ondas son absorbidas fácilmente por la mayoría de los materiales. La energía infrarroja que absorbe una sustancia aparece como calor, ya que la energía agita los átomos del cuerpo e incrementa su movimiento de vibración o translación, lo cual da por resultado un aumento de la temperatura.
Cero absoluto Kelvin
La escala de temperatura Celsius establece que, bajo una atmósfera de presión, el punto de congelación del agua corresponde a los cero grados, y el de ebullición a cien. Para simplificar esto, la comunidad científica se puso de acuerdo en utilizar un sistema en el cual la temperatura 0 corresponda a la temperatura mínima alcanzable, o teóricamente posible. El cero absoluto corresponde a 273,15 ºC bajo cero (cero en la escala termodinámica “Escala Kelvin”)
El concepto de un cero absoluto de temperatura surgió por vez primera en relación a experimentos con gases; cuando se enfría un gas sin variar su volumen, su presión decrece con la temperatura. Aunque este experimento no puede realizarse más allá del punto de condensación del gas, la gráfica de los valores experimentales de presión frente a temperatura se puede extrapolar hasta presión nula. La temperatura a la cual la presión sería cero es el cero absoluto de temperatura. Posteriormente se demostró que este concepto deducido experimentalmente era consistente con las definiciones teóricas del cero absoluto. A esta nueva escala se le llamó escala Kelvin (K), y en la cual la temperatura cero correspondería a la temperatura mínima teóricamente posible.
Leyes de la termodinámica
La Termodinámica es la parte de la física que estudia la energía, la transformación entre sus distintas manifestaciones, como el calor, y de su capacidad para producir un trabajo, a nivel macroscópico. Sus fundamentos se encuentran en principios básicos, denominados Leyes de la Termodinámica, que constan de tres leyes principales más la ley cero.
Primera Ley
La primera trata acerca del calor entregado, la energía y el trabajo dentro de un mismo sistema que ha sido sometido a un proceso (cualquier cambio en el estado). Esta ley está basada en el principio de la conservación de la energía y se puede enunciar de la siguiente manera:
| En cualquier proceso termodinámico, el calor neto absorbido por un sistema es igual a la suma de el trabajo realizado por el sistema y la variación de su energía interna |
| Q | Transferencia de calor del sistema |
| W | Trabajo efectuado |
| U | Cambio de energía interna |
![]()
Segunda Ley
La segunda ley tiene relación con la entropía y afirma que ésta crece con el tiempo hasta llegar a un nivel máximo, ya que solamente el trabajo es realizable mediante el traspaso de calor de un cuerpo con mayor temperatura a uno con menor temperatura, por lo que la energía calorífica se está disipando constantemente y es un proceso irreversible.
Para entenderlo mejor, imagine la siguiente situación; una casa se encuentra con todas sus ventanas abiertas en medio de la noche y posee sistema de calefacción encendido. Pero la casa no logra una temperatura agradable. ¿Se debe esto a que el frío entra en la casa o el calor se disipa en el frío de la noche? Siguiendo la segunda ley de la termodinámica, es el calor que se traslada desde la casa hacia fuera por las ventanas, disipando la energía.
Del ejemplo anterior también se podría afirmar que la calidad de la energía se va deteriorando y los sistemas se van degenerando, ya que el calor liberado hacia el exterior es tan insignificante en la temperatura de la noche, que no generará ningún cambio. Lo mismo ocurre al verter un vaso de agua hirviendo al mar. No se distinguiría el efecto del agua hirviendo en el mar. Al mar o la noche (ejemplo anterior) se les suele llamar “depósitos de calor”, ya que son sistemas de gran tamaño que se les puede extraer o añadir una cantidad ilimitada de calor sin alterar notablemente su temperatura.
De esta manera, el segundo principio fue planteado a mediados del siglo XIX por dos físicos, ambos enunciados equivalentes entre si.
Enunciado de Rudolf Clausius
| No es posible proceso alguno cuyo único resultado sea la transferencia de calor desde un cuerpo frío a otro más caliente |
Enunciado de Kelvin-Planck
| No es posible un proceso cuyo único resultado sea la absorción de calor procedente de un foco y la conversión de este calor en trabajo. |
Ejemplo
El Refrigerador
Un refrigerador, en términos generales, es un extractor de calor de una región que ya está fría. A partir del trabajo aportado por la energía eléctrica, el refrigerador activa un gas refrigerante (freón) ante un alza de temperatura en su interior (apertura de la puerta). El gas refrigerante lleva el calor desde el interior del refrigerador hacia sus paredes externas. Así esta energía calorífica se descarga hacia su entorno, permitiendo el funcionamiento del refrigerador. Podemos observar que mediante el trabajo aportado por la energía eléctrica, es posible la extracción de frío desde una zona hacia otra caliente, lo que concuerda con el enunciado de la segunda ley.
Tercera Ley
El tercer principio de la termodinámica afirma que el cero absoluto no puede alcanzarse por ningún procedimiento que conste de un número finito de pasos. Es posible acercarse indefinidamente al cero absoluto, pero nunca se puede llegar a él. En el cero absoluto el sistema tiene la mínima energía mecánica posible, ya que siguiendo el primer principio de la termodinámica, si la temperatura disminuye, la energía calorífica también.
Ley cero
Si un sistema está en equilibrio con otros dos, estos últimos, a su vez, también están en equilibrio. Cuando los sistemas pueden intercambiar calor, la ley cero postula que la temperatura es una variable de estado, y que la condición para que dos sistemas estén en equilibrio térmico es que se hallen a igual temperatura.
Siguiendo el segundo principio, es posible evitar que dos sistemas en contacto igualen temperatura, a través del trabajo y energía, como se explicó en el ejemplo anterior del refrigerador.
Procesos termodinámicos para gases ideales
A continuación, se aplicarán los conceptos de termodinámica a gases ideales sometidos a presión, volumen y temperatura.
Proceso isotérmico
Proceso donde la temperatura permanece constante. Si ello ocurre, el cambio de energía interna permanece constante (U) al pasar de un estado a otro, es decir , por lo tanto . El calor añadido al gas es igual al trabajo efectuado por el gas.
Proceso isobárico
Proceso donde la presión es constante
Significa que al expandirse el gas por aumento de la temperatura, la energía interna (U) aumenta y si el gas se contrae por disminución de la temperatura, la variación de energía interna disminuye.
Proceso isovolumétrico
El volumen permanece constante. Por lo tanto si V2 = V1 significa que el gas no de desplazó, por lo que
Puesto que el gas no efectúa trabajo, si se añade calor aumenta la temperatura y , y ocurre lo contrario si se extrae calor
Proceso adiabático
Proceso en el que no se transfiere calor hacia el interior ni hacia el exterior del sistema. Esta condición se cumple en un sistema aislado, como por ejemplo un termo de agua (), por lo que . Al no aumentar ni disminuir Q, se hace trabajo (W) a expensas de la energía interna.
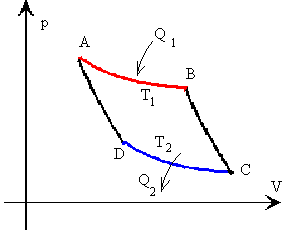
Ciclo de Carnot
Una máquina de Carnot es perfecta, es decir, convierte la máxima energía térmica posible en trabajo mecánico. Carnot demostró que la eficiencia máxima de cualquier máquina depende de la diferencia entre las temperaturas máxima y mínima alcanzadas durante un ciclo. Cuanto mayor es esa diferencia, más eficiente es la máquina.
Por ejemplo, un motor de automóvil sería más eficiente si el combustible se quemara a mayor temperatura o los gases de escape salieran a menor temperatura.
Así pues entonces, el Ciclo de Carnot consiste en dos isotermas y dos adiabatas. Se absorbe calor durante la expansión isotérmica y se despide calor durante la compresión isotérmica.
La eficiencia de este ciclo es más alta que cualquier otra máquina de calor podría alcanzar, entre dos extremos de temperatura. La figura anterior representa el ciclo de Carnot, y se puede graficar, en términos de volumen y presión, de la siguiente manera:
|
| Donde
A - B Isoterma B - C Adiabática C - D Isoterma D - A Adiabática Q1 > Q2 T1 > T2
| |||
Entropía
Rudolf Clausius fue el primero en introducir la propiedad de entropía a la ciencia. La entropía es una de las variables termodinámicas más importantes. Su relación con la teoría del caos abre un nuevo campo de estudio e investigación a este concepto. Se define de diversas maneras, pero todas las definiciones son congruentes y no se contradicen entre ellas:
Medida de capacidad de un sistema para efectuar trabajo útil
Determina la dirección del tiempo. Distingue los sucesos en el tiempo
Medida del desorden de un sistema
La entropía, en el caso de medida del orden (o desorden) de un sistema, no está definida como una cantidad absoluta, sino lo que se puede medir es la diferencia entre la entropía inicial de un sistema y la entropía final del mismo. No tiene sentido hablar de entropía sino en términos de un cambio en las condiciones de un sistema.
En el segundo principio (Clausius), podemos encontrar la relación con la entropía y la energía liberada en un proceso. Si pensamos en un motor, notamos que necesita una fuente de energía para obtener trabajo. La gasolina, junto con el sistema del motor, proporciona energía química de combustión, capaz de hacer que un automóvil se mueva. La energía utilizada por el automóvil para realizar desplazarse, fue consumida, por lo que la energía liberada ya no es utilizable para que un motor produzca trabajo. Al consumirse la energía del motor, esta energía no desaparece por el principio de conservación de la energía, sino que se disipa y transfiere al medio donde se encuentra como calor.
De forma generalizada, la entropía se define de la siguiente manera:
| Todos los procesos naturales tienden a un estado de mayor desorden, y por tanto aumenta la entropía total del Universo |
Por lo tanto la entropía en un sistema aislado siempre aumenta cuando el sistema experimenta un proceso irreversible o reversible, pero en menor grado éste último. La fórmula que permite calcular la entropía es la siguiente
| S | Cambio de Entropía |
| Q | Cantidad de calor |
| T | Temperatura |
Unidad SI de entropía Joule/Kelvin (J/K)
Ejemplo
El efecto mariposa
Hacia 1960, el meteorólogo Edwars Lorenz se dedicaba a estudiar el comportamiento de la atmósfera, tratando de encontrar un modelo matemático que permitiera formular predicciones climatológicas a partir de variables sencillas.
Lorenz sufrió una gran sorpresa cuando observó que pequeñas diferencias en los datos de partida llevaban a grandes diferencias en las predicciones del modelo, alterando el resultado. Logró ejemplificarlo de la siguiente manera; el simple aleteo de una mariposa al otro lado del planeta podría introducir perturbaciones en el sistema que llevarán a la predicción de una tormenta. Tal aleteo de la mariposa trae consigo un modo genuinamente nuevo de pensar la realidad y surge así que el “desorden” o la alteración del orden ya no serán vistos como una ridiculez, o como una arruga en el mantel del universo, sino como una característica nada excepcional, que demuestra que hasta la variación mas mínima dentro de un sistema altera el resultado final.
En otras palabras, se puede afirmar que los “fenómenos caóticos” son aquellos en los cuales muy pequeñas causas son capaces de provocar grandes diferencias en los efectos. De tal modo, dentro de un sistema existente con múltiples relaciones entre sus diversas partes, a pesar de lo lejano que puedan encontrarse, si una parte se altera produce un efecto en dicho sistema inesperado y de mucha mayor envergadura que su causa inicial.
Origen del Universo
¿Cómo se creó el universo? ¿De dónde venimos? ¿Cómo empezó todo? Son preguntas que alguien se hizo antes que nosotros. Edwin Hubble en 1929 determinó que las galaxias estaban más cerca de lo pensado; postuló la “teoría de la expansión del Universo”.
Existe la teoría de que hace 14 millones de años todas las galaxias se encontraban en un mismo punto, y si bien un gas al expandirse se enfría, durante esta compresión debió de haber existido una temperatura altísima.
El cosmologista belga Georges Lemaître y el físico ruso-estadounidense George Gamow propusieron que el Universo había empezado con un gran estallido: el Big - Bang. La explosión habría afectado al átomo primitivo, que poseía una altísima densidad y una elevada temperatura. Más tarde se comprobó que era muy probable que el hidrógeno y helio se hayan creado en el momento inicial del universo. Pero el resto de los elementos químicos se habrían formado en el interior de las estrellas y supernovas. Por este motivo, el planteamiento de Georges Lemaître y George Gamow fue desestimado y cayó en el olvido por varios años. Gracias a las ondas radiales se comprobó que la teoría del Big-Bang podía ser cierta; utilizando una antena espacial se captó un ruido de fondo en la banda de las ondas de radio. El ruido parecía venir de todas partes del Universo. De inmediato fue identificado como la radiación de la gran explosión inicial. Las ondas radiales fueron utilizadas para calcular la temperatura actual del universo. Se estableció así que la radiación recibida corresponde a la misma que emite un cuerpo a -270º C; por lo tanto, esa sería la temperatura del cosmos después de haberse expandido y el termómetro aún seguiría bajando. Es difícil de entender que una explosión se haya originado el universo. Sólo se necesita ver imágenes del universo como aquellas imágenes capturadas por satélites de las distintas galaxias, con sus diferentes e impresionantes formas, para preguntarse: ¿Cómo? O simplemente el sólo hecho de pensar que la tierra es una aguja en un pajar dentro de la Vía Láctea, y que la Vía Láctea lo es en el universo, ¿no es acaso difícil entender cómo se originó todo? ¿Un Universo infinito? La explosión fue el inicio para la creación de La Tierra, que goza de una hermosa perfección y en la cual habitan seres con vida; nosotros.
Es cierto que luego de la explosión sucedieron muchas cosas, muchos cambios, para que finalmente existiésemos nosotros, pero por qué no pensar que nosotros provenimos de polvo cósmico, que alguna partícula dentro de aquella inmensa masa comprimida algún día se convertiría en nosotros.
Para entender mejor nuestro Universo he aquí una reflexión, en la cual podremos ver reflejado lo tratado anteriormente acerca de las leyes de termodinámica:
Situación ficticia: Se considera que el espacio entero está ocupado por un gas uniforme de partículas. Antes de aplicar las leyes de termodinámica a este gas que llena el Universo, hay que explicar la diferencia que existe entre un objeto cerrado con gas en su interior y el Universo; El universo a diferencia del objeto, no tiene límites y es infinito, es decir, se encierra sobre sí mismo.
El universo se expande por si mismo y no porque su límite se mueva. Si se situase un triángulo colosal flotando en el espacio, el triángulo se iría expandiendo a medida que el universo envejece. Lo mismo sucede con el gas en el universo. El gas de fotones que llena el Universo tiene presión, pero no hay paredes que lo contengan. ¿Cuál es entonces la causa de esa presión? Resulta tentadora quizás la idea de que lo que provoca esta presión es la expansión del Universo. Pero esa idea no es correcta. La expansión del Universo es la expansión del propio espacio, no la de algo que esté en el espacio del Universo. La presión del gas de fotones se debe entonces a que los fotones son partículas con energía que se mueven a la velocidad de la luz, siguiendo cada una su trayectoria y chocando con todo lo que encuentren en ella. Aquel bombardeo de fotones produce una presión de radiación.
La correcta aplicación de la termodinámica al conjunto del Universo se convierte entonces en un poderoso instrumento conceptual y de cálculo. Aplicando este enfoque termodinámico al Universo tal como aparece hoy, los físico consideran como un gas que lo llenase todo a todo cuanto hay en el Universo.
El Universo está compuesto por dos elementos principales. El primer elemento es la materia: las galaxias, las estrellas y toda la materia oscura invisible (básicamente como un “gas” de objetos de gran masa que no se mueve mucho). El segundo componente del universo es la radiación: el gas de fotones micro-ondulares (Descubierto por los científicos Penzias y Wilson).
Ahora bien, de los dos elementos mencionados, según la teoría de gravedad de Einstein, la densidad másica del Universo determina su índice de expansión: cuanto mayor es la densidad de la masa, más lenta es la expansión. Si calculamos el aporte de la materia a la densidad de la masa universal de hoy y la comparamos con la densidad de masa-energía de los fotones, vemos que la densidad de la materia es por lo menos mil veces mayor, por lo tanto se concluye que en el universo domina la materia, y no la radiación lo que lleva a deducir que la dinámica gravitatoria universal de hoy (la expansión) la controla el contenido de la materia y no la radiación.
Teoría del fin del universo
Desde el momento en que somos creados, los seres vivos sufrimos un inevitable proceso de degeneración. Nuestras células se deterioran, envejecen y mueren. Cabe preguntarse: ¿pasará lo mismo con el universo? Si fuese así, ¿tiene algo que ver la 2ª ley de la termodinámica y por ende la entropía?
Los científicos apuntan a que en un futuro muy lejano, el universo dejaría de existir. Según unos, moriremos congelados a 0 K o achicharrados a miles de millones de grados. Por supuesto estas afirmaciones no se basan en ideas o pensamientos filosóficos, sino en datos y experimentos científicos. ¿Qué tiene que ver la 2ª ley de la termodinámica y la entropía en el fin del universo? Cuando se mezcla una sustancia fría con otra caliente y se deja pasar el tiempo necesario, ambas llegarán a estar exactamente a la misma temperatura. Este sencillo hecho es, sin embargo, clave para entender las causas de la futura muerte del universo. La existencia de planetas, estrellas, galaxias y de la vida depende precisamente del desequilibrio termodinámico. Mientras haya diferencia de temperatura, hay energía que puede transformarse y utilizarse. Cuando se ha alcanzado el total equilibrio térmico, ya no es posible extraer energía ni aprovecharla para ningún fin concreto.
El segundo principio de la termodinámica está sumamente ligado a otro importante concepto: la entropía. Ésta puede describirse como el desorden inherente a un sistema. La entropía del universo aumenta siempre, y no puede hacerse nada para evitarlo. Todo lo que existe pasa gradualmente de un estado ordenado a otro desordenado. Veamos un ejemplo de esto:
Imaginemos una caja, dividida en dos mitades herméticamente cerradas. En cada una de las dos mitades se ha vertido agua caliente y fría, respectivamente. En ese estado, podemos decir que la caja es un sistema ordenado. Pero cuando se elimina el panel central que divide la caja en dos, el agua caliente y la fría empiezan a mezclarse aleatoriamente. Cuando el agua se mezcla, el estado ordenado desaparece. La entropía del sistema aumenta a medida que el orden disminuye. Al final, cuando toda el agua no esté ni fría ni caliente, el estado ordenado inicial habrá desaparecido por completo, y el sistema se encontrará en su momento de máxima entropía.
De igual manera que en el ejemplo, el espacio interestelar es frío -se encuentra a 0 K-, pero está moteado por una infinidad de cuerpos muy calientes: estrellas, cúmulos globulares, planetas y galaxias emanan continuamente calor al espacio. De la misma manera que en el ejemplo de la caja y el agua, llegará un momento en que calor y frío se equilibren. Cuando todo esté a la misma temperatura, las estructuras ordenadas del universo -sistemas planetarios, galaxias, personas, coches, átomos, etc.- habrán desaparecido, y la entropía será máxima.
Ahora bien, el cosmos puede llegar a su final de varias formas, fundamentalmente de dos. Todo depende de si su tendencia a la expansión se mantiene, o si, por el contrario, llega a invertirse en algún momento. Estas dos teorías se conocen como modelo del universo abierto y modelo de universo cerrado. La primera plantea que el universo se seguirá expandiendo hasta desintegrarse hasta el último protón (antes que esto suceda toda los cuerpos celestes serán atraídos y consumidos por los hoyos negros, los cuales finalmente se desintegrarían según el físico Stephen Hawking). La segunda, también llamada teoría del Big-Crunch, dice que si la expansión se detiene en algún momento, comenzará un proceso de contracción. El universo irá haciéndose cada vez más pequeño, hasta quedar reducido a un punto menos que microscópico, pero de infinita densidad; un punto similar al que, hace cerca de 15.000 millones de años, explotó para dar origen a todo lo que hoy existe. Todo esto depende de la materia que halla en el universo, dígase, si esta -formando la gravedad- es o no capaz de resistir la expansión.
Si el Universo resultara ser abierto, es decir, en el caso de que no hubiera la materia necesaria para detener la expansión, su muerte se desarrollaría en seis etapas. Al final, según predice el segundo principio de la termodinámica, se alcanzará el equilibrio térmico y el estado de entropía máxima. La primera de las fases se produce una vez transcurridos cien trillones de años a partir de la Gran Explosión. Hasta ahora sólo han pasado 15.000 millones de años. Para entonces todas las estrellas se habrán quedado sin combustible y se apagarán. En una segunda etapa, las estrellas, convertidas en una especie de brasas, apagándose, perderán sus planetas por la conmoción gravitatoria que supondrá el cruce con otras estrellas. Se calcula que este proceso habrá terminado cuando hayan pasado 1017 años.
Ciertamente ninguna de las personas que viven en la actualidad, ni de las que vivirán en los próximos miles de millones de años, podrá ver cómo muere el universo. La cuestión del fin cósmico no es algo que nos afecte a corto plazo, aunque sí como especie y como forma de vida general. Si la humanidad sigue existiendo para cuando llegue el momento de preocuparse, es lógico pensar que dispondrá de una tecnología hoy por hoy inimaginable, gracias a la que podrá sobrevivir prácticamente hasta el fin. Aunque, que nadie tenga la más mínima duda, el final se producirá tarde o temprano. Contra eso no hay nada que el hombre, por muy evolucionado que esté, pueda hacer.
Conclusión
A modo de conclusión se podría afirmar que definitivamente la termodinámica está presente en nuestra vida, ya sea desde el ejemplo de una simple tetera hasta lo infinito, el Universo. Por otro lado, la entropía está presente en todos los procesos diarios que se realizan, colaborando con la entropía total del Universo, y acercándonos cada vez más al caos. Con la continua expansión del Universo, este se irá enfriando, por lo que se encamina hacia un estado de temperatura constante, en el cual toda la energía estará completamente degradada y la entropía habrá alcanzado su nivel máximo, no siendo posible entonces proceso real alguno.
Además, se tiene en cuenta la teoría de un Universo cerrado, en el cual llegaría un punto en que el Universo comenzaría a contraerse y se generaría lo que muchos conocen como el Big-Crunch.
Considerando la teoría del Big-Crunch podríamos hacernos la idea de un eterno ciclo. Quizás el universo ya ha pasado por varios Big-Bang, y quizás hayan habido muchos Universos con distintas características al que nosotros creemos o decimos conocer.
La verdad es que del Universo no se tienen conocimientos certeros; existen muchas preguntas sin responder. Si bien los científicos han descubierto mucho sobre él, la gran incógnita que el ser humano siempre se ha planteado sigue ahí, sin respuesta; ¿De dónde venimos y a dónde vamos?
¿Sabrán lo suficiente para poder sobrevivir las generaciones futuras al gran caos, o aún peor, la desintegración del Universo?
Por ahora dediquémonos a investigar, estudiar nuestro universo para que antes de dejar este lugar hayamos respondido alguna de nuestras interrogantes.
Glosario
Densidad: la cantidad de masa contenida en una longitud, superficie o volumen específico.
Energía térmica: se denomina así a la energía liberada en forma de calor, normalmente mediante la combustión de algún combustible fósil.
Extrapolación: a partir de los datos de un grafico, observar cual es la tendencia y hacer una prolongación de la tendencia
Fotones: cuando un rayo de luz es absorbido por la materia, la energía que ésta retiene son cantidades finitas, o quantos. Un quanto de luz es llamado fotón.
Leyes o enunciados: reglamentos o principios elementales para el estudio de una ciencia.
Ondas electromagnéticas: ondas que a diferencia de otras no necesita un medio físico para desplazarse.
Presión: relación entre una fuerza actuando sobre una superficie y el área de la propia superficie.
Sistema: conjunto de elementos dinámicamente relacionados formando una actividad para alcanzar un objetivo.
Temperatura: la temperatura es la medida del grado de calor de una sustancia, es decir, su nivel de energía calorífica.
Volumen: espacio que ocupa un cuerpo
Procesos irreversibles: proceso cuyos pasos intermedios no son estados de equilibrio (volumen y temperatura conocidos). No implica que el sistema no pueda volver a su estado inicial solo que no es posible volver por el mismo camino.
Procesos reversibles: proceso en que el sistema puede llevarse a sus condiciones iniciales recorriendo el camino opuesto volviendo a crear todos los estados intermedios.
Kilocaloría: unidad de calor que eleva la temperatura de un kilogramo de agua a un grado Celsius o la cantidad de calor necesaria para elevar la temperatura de un kilogramo de agua a un grado Celsius.
Calor neto: es la diferencia entre el calor que se aplica a un cuerpo y el necesario para que este eleve su temperatura a lo que sea necesario.
Energía interna: energía que posee internamente un sistema o la diferencia entre el calor añadido o quitado a un sistema y el trabajo efectuado o realizado por el sistema.
Teoría: es la explicación de un fenómeno a partir de enunciados , hipótesis , tesis y para que esta sea valida tiene que poder ser demostrable.
Entropía: desorden que poseen las partículas de un sistema. Puede medir la capacidad de un sistema para efectuar trabajo útil o también indica al dirección del tiempo distinguiendo sucesos del pasado y del futuro.
Sistema aislado: es aquel que no transfiere calor hacia el interior y el exterior de éste.
Ciclo: periodo de tiempo en el cual se produce un fenómeno. Marca el inicio, desarrollo y final de dicho proceso y una vez que comienza otro el proceso empieza a realizarse de nuevo.
Bibliografía
“Física” Wilson Buffa - Capítulo 12 (Quinta Edición)
16
![]()
![]()
Descargar
| Enviado por: | Sebastian Fuenzalida |
| Idioma: | castellano |
| País: | Chile |