Química
Tabla periódica moderna
Tabla Periódica Moderna
La tabla periódica moderna está relacionada con la configuración electrónica de los átomos. En ella se encuentran todos los elementos químicos conocidos, tanto los 92 que se encontraron en la Naturaleza como los que se obtuvieron en el laboratorio por medio de reacciones nucleares.
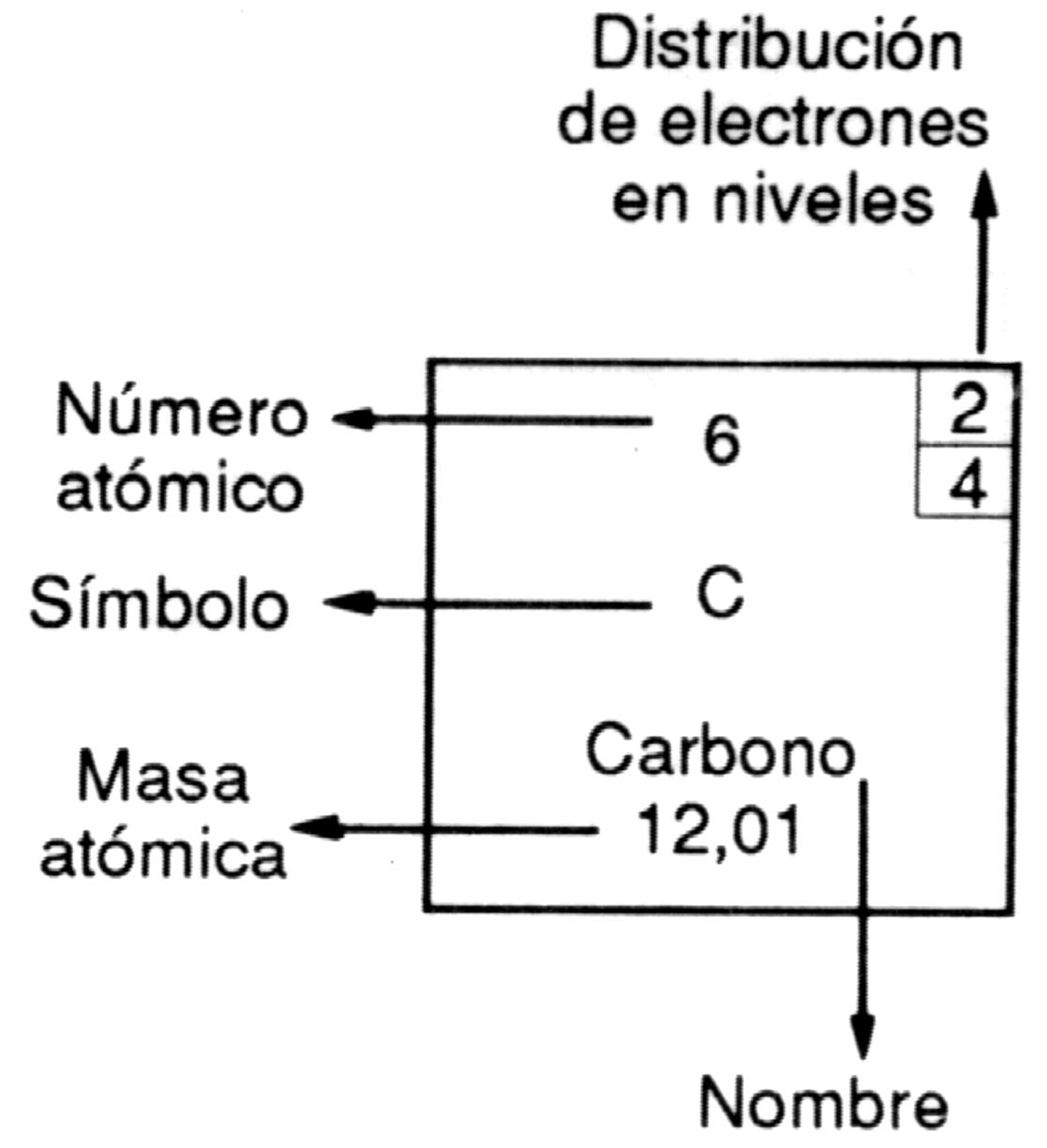
Los elementos están ordenados por su número atómico creciente, de izquierda a derecha. Comienza por el 1H, sigue con el 2He, 3Li, 4Be, 5B, 6C, 7N, 80, etcétera.
A cada elemento le corresponde un casillero, donde figuran el correspondiente símbolo y otros datos, tales como el número atómico, la masa atómica, la distribución de los electrones, etcétera.
Las filas horizontales se denominan períodos y las columnas verticales reciben el nombre de grupos.
Períodos
En total existen siete períodos, numerados del 1 al 7 de arriba hacia abajo.
-
En el primer período sólo hay dos elementos: Hidrógeno y Helio. Sus átomos tienen un solo nivel de energía y sus configuraciones electrónicas son l y 2, respectivamente.
Período 1 = una órbita = 2 elementos
-
En el segundo período hay ocho elementos: Li, Be, B, C, N. O, F y Ne. Todos ellos tienen completo su primer nivel (2) y van completando el segundo nivel del siguiente modo: Li = 2-1, Be = 2-2, B = 2-3, C = 2-4, N = 2-5, 0 = 2-6, F = 2-7, Ne = 2-8.
Periodo 2 = dos órbitas = 8 elementos
-
En el tercer periodo también hay ocho elementos: Na, Mg, Al, Si, P, S, Cl y Ar. Presentan sus dos primeras órbitas completas (2-8) y los electrones van llenando la tercera órbita. El último elemento es el Ar cuya configuración electrónica es 2-8-8.
Período 3 = tres órbitas = 8 elementos
-
El cuarto período es más largo, está formado por dieciocho elementos.
Período 4 = cuatro órbitas = 18 elementos
-
El quinto período es análogo al anterior y también cuenta con dieciocho elementos.
Período 5 = cinco órbitas = 18 elementos
-
El sexto período es el más largo de todos, pues tiene 32 elementos.
Período 6 = seis órbitas = 32 elementos
-
El período séptimo es análogo al sexto aunque no se ha producido la cantidad necesaria de elementos para completarlo.
Período 7 = siete órbitas = ? elementos
El número del período indica la cantidad de niveles energéticos (órbitas) que tienen los átomos de los elementos que se ubican en dicho período. Así, el H y el He que están en el período 1 tienen una sola órbita; el Li al estar en el período 2 cuenta con dos órbitas, etcétera.
Grupos
Hay en total 18 grupos, numerados del 1 al 18 de izquierda a derecha.
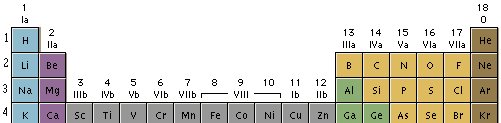
-
Todos los elementos de un mismo grupo presentan igual configuración electrónica externa. Por ejemplo, todos los elementos del grupo 1 tienen 1 e" en su última órbita.
-
Los elementos ubicados en un mismo grupo tienen propiedades químicas similares y sus propiedades físicas están relacionadas.
-
En el grupo 18 se encuentran los gases inertes (He, Ne, Ar, Kr, Xe, y Rn), también conocidos como gases raros o nobles, que se caracterizan por su inactividad química.
-
A los elementos ubicados en el grupo 1 se los suele denominar metales alcalinos, con excepción del hidrógeno. Los elementos del grupo 17, reciben también el nombre de halógenos.
El número del grupo (para los elementos representativos) indica:
-
Para los elementos de los grupos 1 y 2, la cantidad de electrones en su última órbita.
-
Para los elementos de los grupos 13 al 17, ocurre lo mismo que los anteriores pero con la segunda cifra del número. Por ejemplo, los del grupo 13 tienen 3 electrones en su última órbita, los del 14 tienen 4, y así sucesivamente.
Observaciones generales
-
Al hidrógeno no se lo ha encontrado una ubicación satisfactoria, pues por su estructura electrónica le corresponde el grupo 1, pero sus propiedades se asemejan más al grupo 17.
-
Los metales se encuentran a la izquierda de la tabla. El primer elemento de cada periodo (Li, Na, K, etc.) presenta carácter metálico muy evidente, el cual disminuye a medida que se avanza horizontalmente hacia la derecha, mientras se van manifestando las características propias de los no metales. Los elementos del grupo 17 son francamente no metales.

-
Una línea quebrada que pasa entre el boro y el aluminio y desciende hasta el polonio y el astato señala la separación entre metales y no metales. Esta separación no debe ser considerada como un limite absoluto entre metales y no metales: cerca de este límite arbitrario, hay elementos que presentan características tanto de los metales como de los no metales, y por ello a veces reciben el nombre de metaloides (Al, Si, Ge, As, etc.)
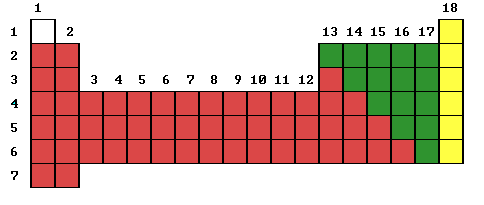
Tabla I: En ROJO se muestran los METALES, en VERDE los NO METALES y en AMARILLO los GASES INERTES
-
A partir de su ubicación en la tabla, se puede deducir la estructura atómica del elemento.
-
Los elementos situados después del uranio, reciben el nombre de transuránidos. Estos elementos no existen en la Naturaleza y han sido obtenidos artificialmente por reacciones nucleares.
Clasificación de los elementos según su configuración electrónica
Sobre la base de su configuración electrónica, los elementos químicos se pueden clasificar en cuatro grupos:
Gases inertes: presentan su órbita electrónica externa completa con ocho electrones, con excepción del He, que tiene dos electrones. Ocupan el grupo 18 de la Tabla Periódica.
Elementos representativos: son aquellos que tienen su órbita externa incompleta. Comprende a los elementos que ocupan los grupos 1, 2, 13, 14, 15, 16 y 17 de la Tabla Periódica.
Elementos de transición: se caracterizan por presentar su dos últimas órbitas incompletas. Corresponden a esta clase los elementos de los grupos 3 al 12 de la Tabla.
Elementos de transición interna: son los que presentan sus tres últimas órbitas incompletas. Constituyen las denominadas tierras raras (lantánidos y actínidos) ubicadas generalmente al pie de la Tabla.
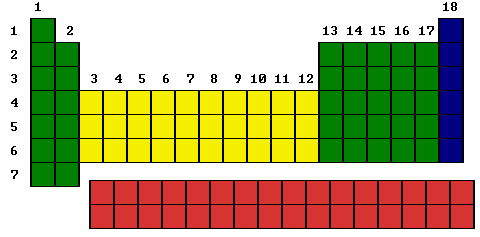
Tabla II: En VERDE se muestran los ELEMENTOS REPRESENTATIVOS, en AMARILLO los ELEMENTOS DE TRANSICIÓN, en AZUL los GASES INERTES y en ROJO los ELEMENTOS DE TRANSICIÓN INTERNA
Propiedades periódicas
En la Tabla Periódica, donde los elementos están ordenados por sus números atómicos (Z) crecientes, se observa una repetición periódica de las propiedades. Algunas de las propiedades en las que se muestra dicha periodicidad son el radio atómico, el radio iónico, el potencial de ionización y la afinidad electrónica.
5
Radio atómico
El radio atómico es la distancia existente entre el centro del núcleo y la órbita electrónica externa del átomo.
Al comparar los radios atómicos de los elementos en la Tabla Periódica se observa:
a) En un mismo período de la Tabla Periódica el radio atómico disminuye de izquierda a derecha.
Así, en el segundo período se tiene:
| Z | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| Elemento | Li | Be | B | C | N | O | F |
| Radio atómico (A) | 1,52 | 1,11 | 0,88 | 0,77 | 0,70 | 0,66 | 0,64 |
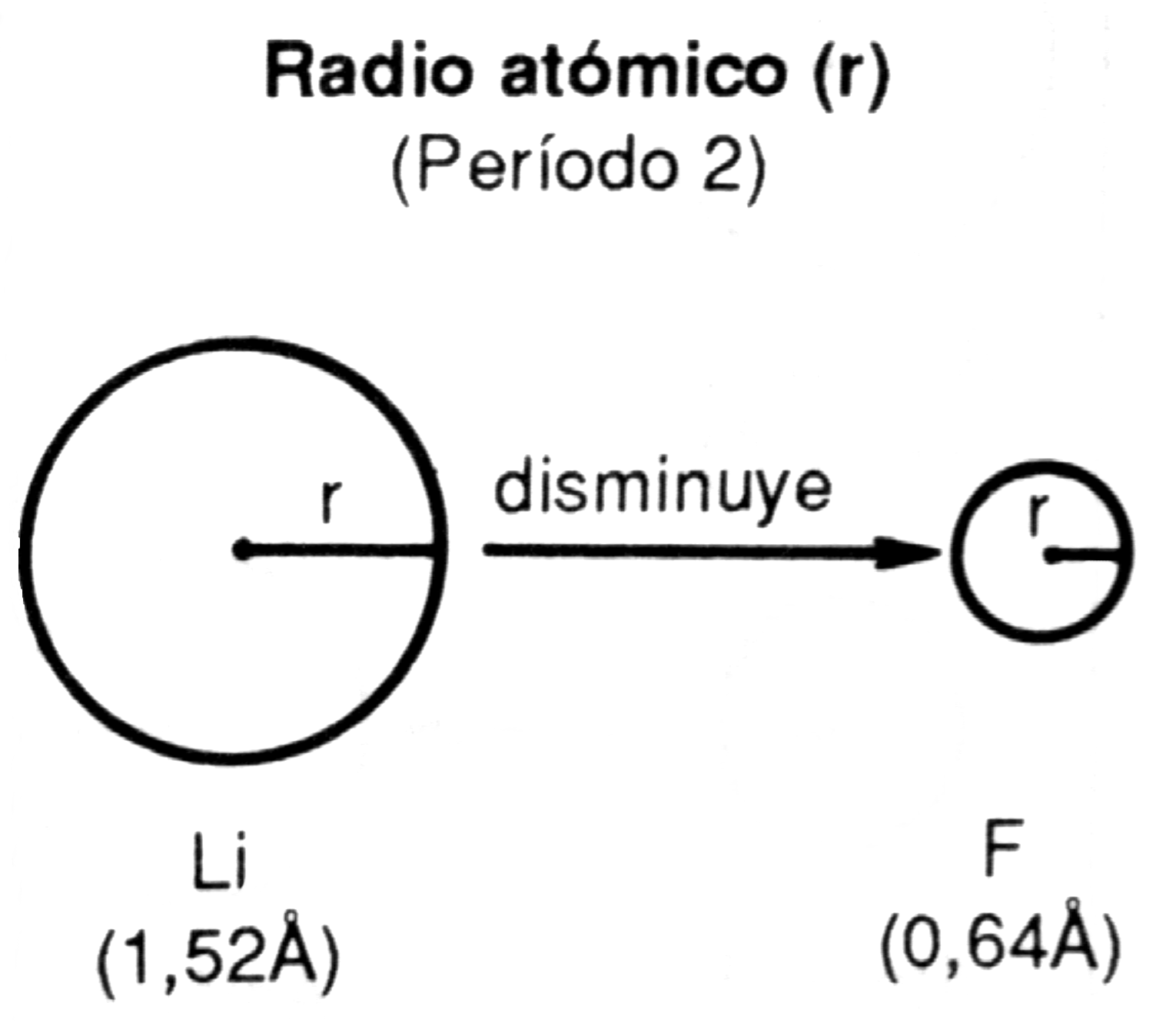
El modo como varía el radio atómico se atribuye al aumento de la carga nuclear que, en este período, va de +3 en el Li a +9 en el F. Al ser mayor la carga nuclear, los electrones que están en la misma órbita son atraídos con mayor intensidad por el núcleo y entonces el radio disminuye.
Los gases inertes constituyen una excepción a este comportamiento, pues al tener un número mayor de electrones en su última órbita, la repulsión eléctrica que se establece entre ellos produce un incremento del radio atómico. Así, el 10Ne, que completa el segundo período, tiene un radio atómico de 1,12 A.
b) En un mismo grupo de la Tabla Periódica, el radio atómico aumenta de arriba hacia abajo.
En el caso del grupo 1 se observa:
| Período | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Z | 1 | 3 | 11 | 19 | 37 | 55 | 87 |
| Elemento | H | Li | Na | K | Rb | Cs | Fr |
| Radio atómico (A) | 0,30 | 1,52 | 1,86 | 2,31 | 2,44 | 2,62 | 2,70 |
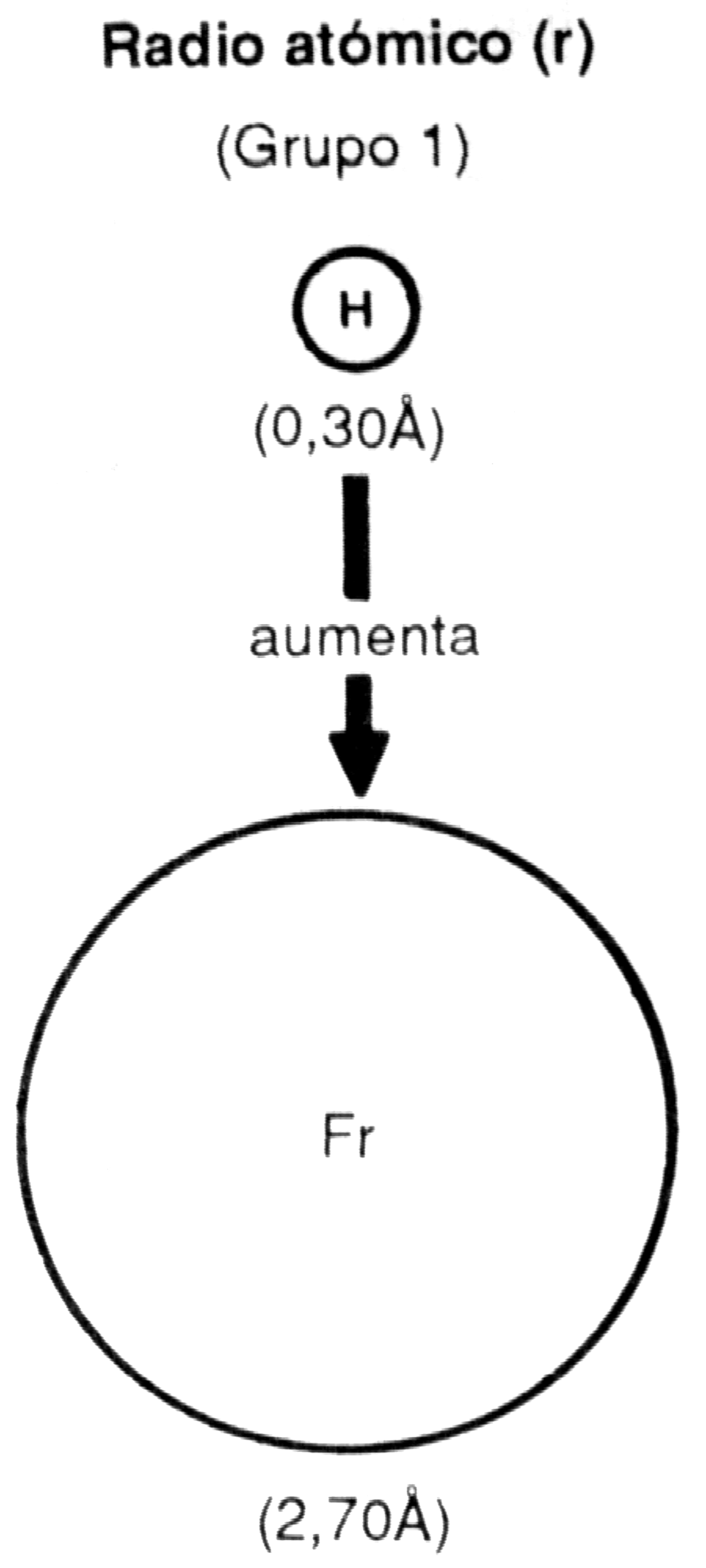
El incremento del radio atómico es consecuencia del aumento del número de órbitas. Si bien la carga nuclear aumenta de +l en el H a+87 en el Fr, las capas electrónicas producen un "efecto pantalla" que reduce la atracción que ejerce sobre los electrones el núcleo positivo.
La variación del radio atómico de los elementos en la Tabla Periódica puede esquematizarse así:
Radio iónico
Se entiende por radio iónico a la distancia entre el centro del núcleo y la órbita electrónica externa del ion.
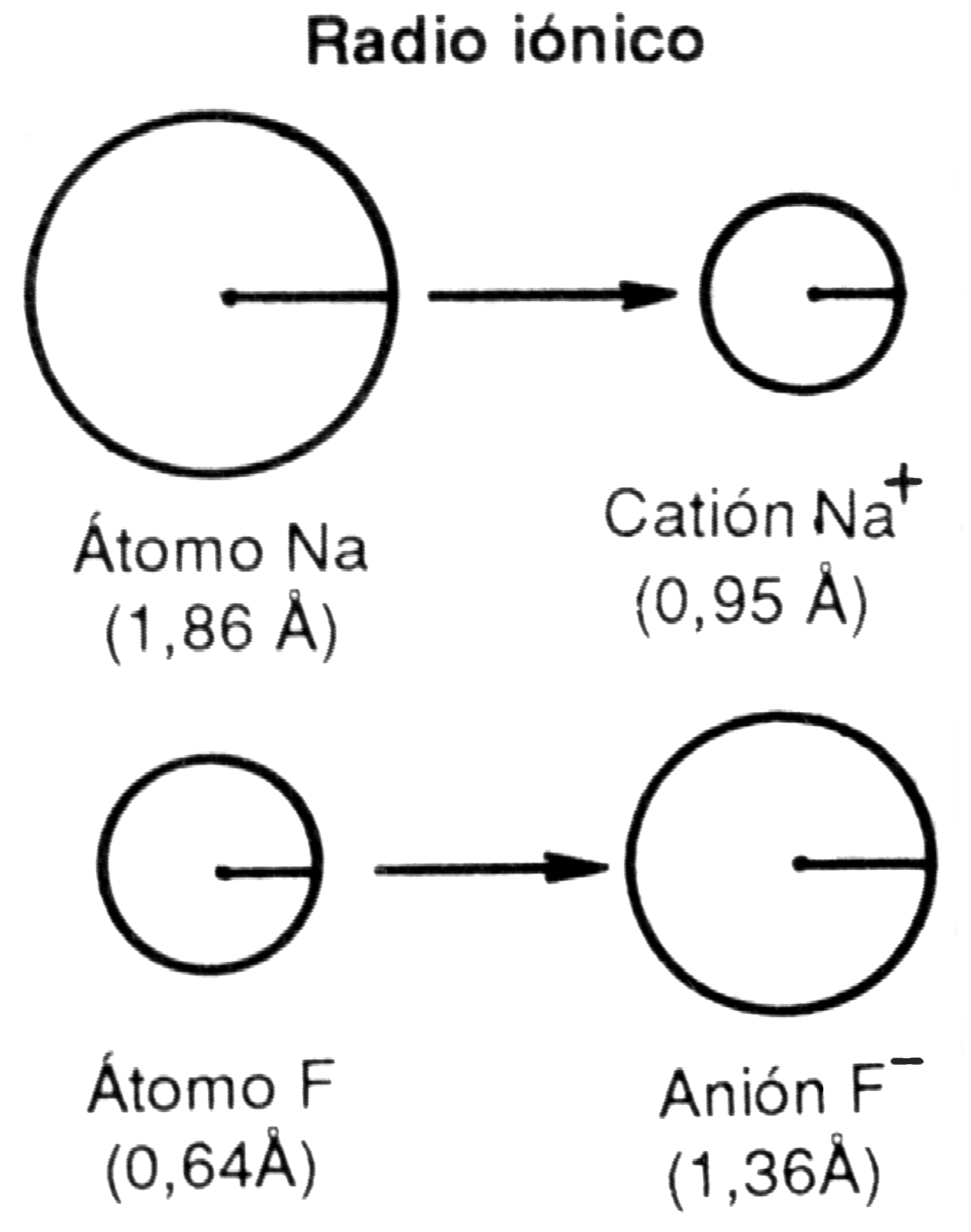
Cuando un átomo neutro cede electrones, transformándose en catión, su radio disminuye. Así en el caso del átomo de sodio, cuyo radio es de 1,86 A, al convertirse en catión reduce su radio a 0,95 A.
Por el contrario, si un átomo gana electrones, completando su última órbita con ocho electrones, se transforma en anión y su radio aumenta. Esto se explica por la repulsión eléctrica entre los electrones, de modo similar a lo antes señalado para los gases inertes. En el flúor, por ejemplo, el radio atómico es de 0,64, mientras que el radio iónico de su anión aumenta a 1,36 A.
Potencial de ionización
Cuando a un átomo neutro se le quita un electrón se ioniza, transformándose en un catión. Así, si a un átomo de litio se le arrebata un electrón se convierte en un catión de litio con una carga positiva, lo cual puede expresarse de este modo:
![]()
El proceso para arrancar un electrón requiere cierta cantidad de energía que se denomina potencial de ionización y que se puede definir así:
Potencial de ionización es la energía necesaria para arrancar un electrón de la capa externa de un átomo aislado.
Para expresar el potencial de ionización se suele utilizar una unidad muy pequeña, denominada electrón-volt, que es equivalente a 1,6.10-9 joule.
Así, en el caso del litio, se necesita una energía de 5,4 electrón-volt para quitarle un electrón.
El potencial de ionización también resulta ser una función periódica del número atómico, observándose lo siguiente:
a) En general, dentro de cada período de la Tabla Periódica, el potencial de ionización aumenta de izquierda a derecha.
En el caso del 2° período se observa:
| Z | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Elemento | Li | Be | B | C | N | O | F | Ne |
| Pot. De ionización (eV) | 5,4 | 9,3 | 8,3 | 11,3 | 14,5 | 13,6 | 17,4 | 21,6 |

Los metales tienen un potencial de oxidación inferior a los no metales.
El incremento que se observa en el potencial de ionización se relaciona con el aumento del número atómico, o sea, de la carga nuclear positiva que atrae más a los electrones negativos.
b) En un mismo grupo de la Tabla Periódica, el potencial de ionización disminuye de arriba hacia abajo.
Así, en el Grupo 1, se observa:
| Z | 3 | 11 | 19 | 37 | 55 |
| Elemento | Li | Na | K | Rb | Cs |
| Período | 2 | 3 | 4 | 5 | 6 |
| Pot. De ionización (eV) | 5,4 | 5,1 | 4,3 | 4,2 | 3,9 |

Al aumentar el número atómico se incrementa el número de órbitas y, por lo tanto, se reduce la atracción entre el núcleo y los electrones externos.
Como se observa, el potencial de ionización varía de modo inverso a como lo hace el radio atómico.
En forma esquemática se puede expresar la variación del potencial de ionización en la Tabla Periódica de la siguiente forma:

Afinidad electrónica
En las propiedades químicas de los elementos, ejerce una considerable influencia la tendencia de un átomo neutro a capturar electrones para transformarse en anión. Esta cualidad se mide por la denominada afinidad electrónica, que puede definirse así:
Energía que se libera cuando un átomo neutro gana un electrón.
Esta afinidad se mide en electrón-volt (eV).
Los no metales, en particular los del grupo 17, tienen una gran afinidad electrónica. A modo de ejemplo se pueden señalar los siguientes valores en eV: Flúor 3,6, Cloro 3,75, Bromo 3,53, Yodo 3,2, Oxígeno 2,2.
En general, la afinidad electrónica varia en la Tabla Periódica de modo análogo al potencial de ionización.

Más adelante, al tratar el tema de la unión covalente, se explicará otra propiedad periódica: la electronegatividad.
-
Bibliografía:
-
Química 4 - José María Mautino- Ed. Stella - 1992.
-
Enciclopedia Encarta 2000 - Microsoft - 1999.
-
WebElements - The periodic table on the world-wide web: www.webelements.com
Un sistema de numeración anterior utilizaba números romanos y letras “a” para los elementos representativos, “b” para los de transición y el número 0 para los gases inertes. Así, la numeración nueva del 1 al 18 corresponde a la siguiente numeración antigua: Ia - IIa - IIIb - IVb - Vb - VIb - VIIb - VIII (3 grupos) - IIa - IIIa - IVa - Va - VIb - VIIa - 0.
Halógenos: del griego halós = sal; gennan = engendrar, o sea, engendradores de sales.
Todos los períodos empiezan con un metal, salvo el 1, y terminan con un gas inerte, incluido el 7, que ahora finaliza con el elemento Ununoctium (Z=118; Uuo).
E. E. M. Nº 2 - Ranelagh 3º 2ª Adultos
Química
1
Descargar
| Enviado por: | Rata7 |
| Idioma: | castellano |
| País: | Argentina |
