Química
Solvólisis del cloruro de terbutilo
Cinética de la Reacción de la Solvólisis
de Cloruro de terbutilo.
Introducción:
La solvólisis del cloruro de terbutilo es un ejemplo clásico de una reacción de sustitución nucleofílica unimolecular.
CH3 CH3
% %
H3C%C%Cl + H2O ð H3C%C%OH + HCl
% %
CH3 CH3
Esta reacción de sustitución se denomina SN1 debido a que el paso determinante es unimolecular.
Las reacciones unimoleculares suelen darse en carbonos secundarios y terciarios (carbocationes estabilizados por hiperconjugación), su velocidad viene determinada únicamente por la concentración de sustrato ya que la etapa determinante de la velocidad de reacción es la salida del grupo saliente. Da lugar a la química de los carbocationes y normalmente va acompañada de sustitución nucleófila unimolecular (SN1).
Las reacciones bimoleculares se dan en carbonos primarios y secundarios. Su velocidad viene dada por la concentración de sustrato y por la concentración de base, es una reacción concertada, grupo saliente y protón salen conjuntamente. Los carbocationes primarios son demasiado inestables para existir, por ello la reacción es concertada. No obstante, hay alguna excepción, con una estabilización extra del carbocatión primario.
Por mediciones, ya sea de la concentración de los reactantes como de los productos en función del tiempo se puede tener la velocidad de reacción.
De la ley de velocidad se puede obtener la constante de velocidad:
velocidad = k [(CH3)3 CCl]
d [(CH3)3 CCl] /dt = k [(CH3)3 CCl]
d [(CH3)3 CCl] / [(CH3)3 CCl] = k dt / integrando
Ln [(CH3)3CCl ] = k t
Para poder seguir la cinética de la reacción se desarrolla un método analítico para la medida cuantitativa de los reactivos o productos de reacción en función del tiempo. En esta experiencia se determinará el momento en el cual la cantidad de HCl producido neutraliza la base original por el cambio de color de un indicador ácido-base: azul de bromo fenol.
Las características fisicoquímicas del indicador azul de bromofenol son las siguientes:
| Azul de Bromofenol | Características fisicoquímicas |
| Fórmula molecular | C19H10Br4O5S |
| Peso molecular | 670 g/mol |
| Solubilidad | Alcohol, hidróxidos alcalinos |
| En medio ácido | Amarillo |
| En medio básico | Azul púrpura |
| Intervalo de pH | 3,0 - 4,6 |
Este indicador sirve para determinar el punto final de la reacción estudiada ya que esta reacción ocurre en medio ácido y el rango de viraje del indicador es en pH ácido.
Tratamiento de datos.
La hidrólisis del cloruro de terbutilo se puede tratar usando una ecuación de velocidad de primer orden.
Se deberá representar gráficamente ln [(CH3)3CCl ] en función del tiempo transcurrido para la reacción y la pendiente de este gráfico dará el valor de k.
Si se tienen valores de k a diferentes temperaturas es posible obtener la energía de activación de la reacción, de acuerdo a la ecuación de Arrhenius:
k = A e-Ea/ RT
Es posible graficar -ln t en función del tiempo (1/T ) y la pendiente de este dará el valor de la energía de activación.
PROCEDIMIENTO EXPERIMENTAL
Soluciones: 0.1M NaOH, titulada
0.1M Cl-terbutilo en acetona
1% en indicador Azul de bromofenol.
El hidróxido de sodio es corrosivo, produce irritación y fuertes quemaduras. La ingestión produce vómitos y colapso fisiológico. El NaOH reacciona violentamente con agua, ácidos fuertes y materia orgánica. Debe ser usado con gafas de seguridad, guantes y en un lugar con ventilación adecuada. En caso de contacto con los ojos o la piel se debe lavar con abundante agua.
El terbutilo es tóxico e irritante puede quemar la piel y los ojos. Es inflamable y sus vapores pueden formar compuestos explosivos con el aire. En caso de incendio se debe usar rocío de agua, niebla o espuma resistente al alcohol. Si se pone en contacto con la piel se debe enjuagar inmediatamente con abundante agua.
Procedimiento:
a) orden de reacción
Se mide el tiempo transcurrido para un determinado % de hidrólisis manteniendo constante el volumen de reacción.
Se puede determinar la cantidad de moles ya que se conoce la concentración inicial del cloruro de terbutilo (0,1 M) y el volumen ocupado ( 3 mL), además se conocen los moles de hidróxido de sodio que reaccionan con el ácido clorhídrico formado. Al llegar al punto de equivalencia de la reacción se tendrá la cantidad de moles de ácido clorhídrico producidos, la cual será equivalente a la cantidad de moles de hidróxido de sodio iniciales, a partir de esto se obtendrán los moles de cloruro de terbutilo que reaccionaron. Con lo cual se puede calcular el % de hidrólisis.
Moles iniciales 100 %
Moles reacción X%
En un matraz erlenmeyer de 25 ml preparar las siguientes soluciones:
Tabla 1: Solución A: 7 mL volumen final
| Solución | Vol. NaOH / mL | Vol H2O / mL | Indicador (3 gotas) | Tiempo / seg |
| A1 | 0,1 | 6,9 | 3 | 30 |
| A2 | 0,2 | 6,8 | 3 | 55 |
| A3 | 0,3 | 6,7 | 3 | 131 |
| A4 | 0,4 | 6,6 | 3 | 366 |
| A5 | 0,5 | 6,5 | 3 | 458 |
| A6 | 0,6 | 6,4 | 3 | 831 |
Introducir en un baño de agua a temperatura constante durante 5 minutos.
A la solución A añadir 3 ml de solución de terbutilo en acetona, cronometrar desde este instante y agitar en forma continua. El cambio de color del indicador indica el tiempo final transcurrido para un determinado % de hidrólisis.
Los volúmenes de solución deben ser medidos en buretas muy limpias.
b) Energía de activación
Realizar el procedimiento de "a" para la muestra 2 variando la temperatura entre 2 y 25 ºC. (al menos 5 medidas).
Tabla 2: Efecto de la temperatura de reacción
| Muestra A2 | Temperatura /ºC | Tiempo / seg |
| B1 | 18 | 609 |
| B2 | 25 | 103 |
| B3 | 29,5 | 125 |
| B4 | 36 | 45 |
| B5 | 20 | 458 |
c) Efecto del solvente
Realizar el procedimiento de "a" para la muestra 2 variando la cantidad de agua añadida para obtener el volumen total de 7 mL
Tabla 3: Efecto de la cantidad de agua
| solución | Vol. NaOH / mL | Vol acetona / mL | Vol H2O / mL | Indicador (3 gotas) | Tiempo / seg |
| C1 | 0,2 | 0,1 | 6,7 | 3 | 88 |
| C2 | 0,2 | 0,3 | 6,5 | 3 | 252 |
| C3 | 0,2 | 0,5 | 6,3 | 3 | 302 |
| C4 | 0,2 | 0,8 | 6,0 | 3 | 509 |
| C5 | 0,2 | 1 | 5,8 | 3 | 547 |
RESULTADOS
Tabla 4: Orden de reacción.
| Solución | % de hidrólisis | Ln % hidrólisis | Tiempo / seg |
| A1 | 96,66 | 4,57 | 30 |
| A2 | 93,33 | 4,54 | 55 |
| A3 | 90,00 | 4,49 | 131 |
| A4 | 86,86 | 4,46 | 366 |
| A5 | 38,33 | 4,42 | 458 |
| A6 | 80,00 | 4,38 | 831 |
Linear Regression for DATA1_B:
Y = A + B * X
Parameter Value Error
A 4,52916 0,01504
B -1,93271E-4 3,27549E-5
R SD N P
-0,95951 0,0201 5 0,00972
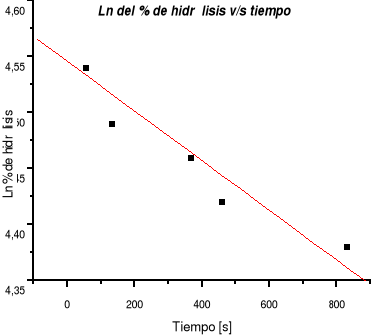
Gráfico 1: ln % hidrólisis v/s tiempo.
El valor de la pendiente representa k, por lo tanto, k = 1,93 x 10-4 s-1
Tabla 5: Energía de activación.
| Muestra A2 | Tiempo /seg | ln (t) | Temperatura / K | (1/T) *103 / K-1 |
| B1 | 609 | 6,4 | 291 | 3,44 |
| B2 | 103 | 4,63 | 298 | 3,36 |
| B3 | 125 | 4,83 | 302,5 | 3,31 |
| B4 | 45 | 3,81 | 309 | 3,24 |
| B5 | 458 | 6,13 | 293 | 3,41 |
Linear Regression for DATA1_B:
Y = A + B * X
Parameter Value Error
A -38,42896 1,70868
B 13,05118 0,50991
R SD N P
0,99848 0,08127 4 0,00152
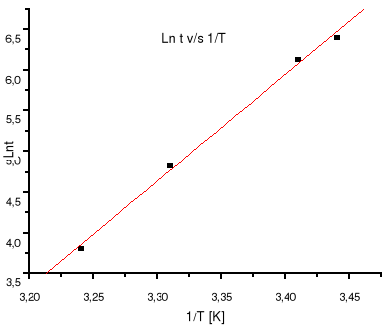
Gráfico 2. Ln t v/s 1/T.
Donde la pendiente es igual a Ea/R , que es igual a 13,05118 , despejando y usando R = 1,987 cal / mol K se obtiene:
Ea=19529,2 x 1,987 cal/mol K = 25,9 cal/mol
Tabla 6: Efecto del solvente.
| Solución | [H2O] x 10 (M) | 1/ t x103 / seg-1 |
| C1 | 3,7 | 11,36 |
| C2 | 3,6 | 3,96 |
| C3 | 3,5 | 3,31 |
| C4 | 3,3 | 1,96 |
| C5 | 3,2 | 1,83 |
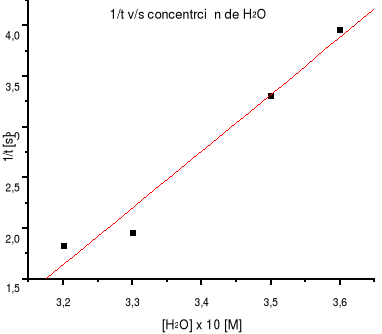
Gráfico 3. 1/t v/s concentración de H2O.
DISCUSIÓN
Para que la reacción de solvólisis del cloruro de terbutilo siga una cinética de orden uno, es necesario que la concentración del halogenuro de alquilo decrezca de manera exponencial con respecto al tiempo.
Analizando los resultados que se indican en la Tabla 5 y observando claramente el gráfico 1 queda demostrado que la reacción es de primer orden ya que a medida que el tiempo transcurre, la concentración de cloruro de terbutilo disminuye. Además si la reacción es de orden uno al graficar el % de hidrólisis en función del tiempo da una línea recta con pendiente igual a la constante de velocidad (k), lo que se visualiza claramente en el gráfico 1.
Con respecto a la energía de activación, que corresponde a la barrera energética a superar por los reactivos para pasar a los productos, representada por la ecuación de Arrhenius:
k = A e-Ea/ RT
es un parámetro que determina como afecta la temperatura a la velocidad de reacción.
En las reacciones SN1 la solvatación del carbocatión intermediario, es decir la interacción del ión con las moléculas del solvente debe aumentar la velocidad de reacción. Los solventes polares como el agua son buenos para solvatar iones ya que las moléculas del mismo se orientan rodeando al ión, de manera que los extremos de los dipolos del solvente, ricos en electrones, miren hacia la carga positiva, lo que implica la estabilización del carbocatión. En cambio, los solventes no polares como la cetona, provocan el efecto contrario en el carbocatión disminuyendo su velocidad de reacción.
Este efecto del solvente se ve claramente en los datos obtenidos experimentalmente ya que a medida que se tiene una mayor cantidad de agua el tiempo de reacción es menor en comparación a cuando hay una mayor cantidad de acetona donde la reacción se vuelve más lenta, lo cual implica que disminuye su velocidad.
Por lo tanto, al aumentar la polaridad del solvente, el carbocatión estará más estabilizado por efecto de solvatación, lo cual implica que la reacción es más rápida, es decir aumenta su velocidad.
Debido a posibles errores en el manejo de las soluciones es que se debió eliminar un dato en cada tabla, para así lograr obtener un margen de error menor en el cálculo de las pendientes de los gráficos correpondientes.
CONCLUSIONES
La solvólisis del cloruro de terbutilo es una reacción de sustitución nucleofílica unimolecular, que sigue una cinética de primer orden ya que la velocidad de reacción sólo depende de la concentración del halogenuro de alquilo donde este participa en una reacción espontánea limitadora de la velocidad. Todo esto quedó demostrado en la evidencia experimental y el tratamiento teórico que se les dio.
Los factores que hacen disminuir el "G, ya sea bajando el nivel de energía del estado de transición o aumentando la energía del estado fundamental, favorecen las reacciones SN1 haciéndolas más rápidas. Por el contrario, los factores que aumentan "G al incrementar la energía del estado de transición o disminuir la del reactivo, desaceleran la reacción SN1.esto está OK pero no es el resultado de su trabajo
Las reacciones SN1 se favorecen en solventes próticos, ya que la energía del estado de transición que forma el carbocatión intermediario baja por solvatación. Por lo tanto, los solventes polares estabilizan al carbocatión intermediario por solvatación, con lo cual aumentan la velocidad de reacción. Esto si lo vio en su trabajo
BIBLIOGRAFIA
-
P. W. Atkins, “Fisicoquímica”, 3ª edición, 1991, editorial Addison-Wesley Iberoamericana.
-
Castellan, Gilbert W., “Fisicoquímica”, 2ª edición, editorial Addison-Wesley Iberoamericana.
-
Levine, Ira N., “Fisicoquímica”, 3ª edición, editorial Mc Graw-Hill.
-
McMurry John, “Química Organica”, 3ª edición, 1992, editorial Iberoamericana.
Descargar
| Enviado por: | Natalia Herrera |
| Idioma: | castellano |
| País: | Chile |
