Química
Soluciones químicas
Experimento N° 1
Preparar una solución de 150 gr de azúcar en agua a una concentración del 17 % P/P.
Materiales:
-
Balanza
-
2 vasos de precipitado
-
Pipeta
-
Baqueta
-
Matraz
-
Paño para secar
-
Cuchara
-
Azúcar (reactante)
-
Agua (reactante)
Procedimiento:
Primero se hicieron los cálculos correspondientes para determinar la cantidad de soluto y de solvente necesarios para formar una solución a la concentración deseada (17 % P/P).
100 gr solución 17 gr azúcar
150 gr solución X gr azúcar
100X = 2250
X = 25,5 gr
Se necesitan 25,5 gr de azúcar y 124,5 gr de agua.
Luego se usó la balanza para sacar las cantidades exactas de azúcar y de agua, y así después mezclamos en un vaso de precipitado estas 2 sustancias y las revolvimos con una baqueta.
Resultados y Conclusión:
Después de revolver un largo rato con la baqueta, logramos que se formara una mezcla homogénea, con azúcar como soluto y agua como solvente, mezcla que, a simple vista, se veía como si estuviera muy concentrada. Después de hacer esto, pudimos concluir que aunque se vio difícil que el agua pudiera disolver esa gran cantidad de azúcar, después de un largo rato revolviendo, se pudo lograr una mezcla homogénea, lo que quiere decir que es el agua un solvente que tiene una gran capacidad para disolver solutos.
Experimento N° 2
Preparar una solución de alcohol en agua al 25 % V/V (distinta a 100 CC)
Materiales:
-
Matraz
-
Pipeta
-
Probeta
-
Baqueta
-
Paño para secar
-
Alcohol (reactante)
-
Agua (reactante)
Procedimiento:
Primero se determinó la cantidad de solución a preparar: Nosotros preparamos 200 CC. de solución.
Luego, hicimos los cálculos correspondientes para determinar la cantidad de soluto y de solvente necesarios para preparar la solución.
X CC. alcohol 200 CC. de solución
25 CC. alcohol 100 CC. de solución
50 CC. alcohol
150 CC. agua
Se necesitan 50 CC. de alcohol y 150 CC. de agua.
Después, usamos 2 probetas para medir la cantidad que necesitábamos de cada sustancia, y así después finalmente vertimos las sustancias en un matraz, donde se mezclaron y se produjo la solución tras revolverlas con una baqueta.
Resultados y conclusión:
Al mezclar el alcohol con el agua (soluto y solvente), se produjo una mezcla homogénea que adoptó un color amarillo transparente. Esto nos indica que el agua puede actuar como un gran solvente para disolver el alcohol y así formar una solución, es decir, el agua puede formar una mezcla homogénea con el alcohol.
Experimento N° 3
Medir la temperatura de ebullición de una solución de agua y sal según el sgte. cuadro:
Materiales:
-
Balanza
-
Pipeta
-
Probeta
-
Vaso de precipitado
-
Mechero
-
Rejilla de asbesto
-
Trípode
-
Matraz
-
Soporte universal
-
Nuez
-
Termómetro
-
Reloj
-
Paño para secar
-
Cuchara
-
Sal (reactante)
-
Agua (reactante)
Procedimiento:
Primero se puso 50 CC. de agua en un vaso de precipitado (Pyrex). Luego el vaso de precipitado se puso sobre la rejilla de asbesto, al fuego del mechero. Después, usamos el soporte universal y la nuez para poner el termómetro dentro del agua contenida en el vaso de precipitado. Así, fuimos midiendo la temperatura de ebullición, primero del agua sola, y después cada vez que le echamos 10 gr de sal. Con esto, obtuvimos el sgte. cuadro:
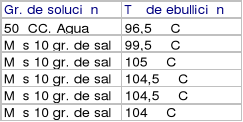
Resultados y conclusión:
Después de medir 6 veces la temperatura de ebullición, obtuvimos el sgte. resultado: el agua sola tiene menos temperatura de ebullición que una solución de agua con sal, como se pudo ver en el cuadro anterior. Concluimos entonces esto y otra cosa: que el agua al evaporarse, afectó enormemente la T° de ebullición, y esta misma, al agregársele sustancias, varía su temperatura de ebullición. Los resultados obtenidos se presentarán en el sgte. gráfico:
Descargar
| Enviado por: | Lalonzio |
| Idioma: | castellano |
| País: | Chile |
