Química
Sistema periodic # Sistema periódico
SISTEMA PERIODIC
Índex:
1-Introducció
2-Desenvolupament historic:
2.1-Dmitri Ivanovich Mendeléiev
2.2- Julius Lothar Meyer
2.3-Dmitri Ivanovich Mendeléiev y Julius Lothar Meyer
3- Teoria de la capa electronica
4-Teoria Quàntica
5-Definicions:
5.1-Element químic
5.2-Elements de l'escorça terrestre
5.3-Elements al cos humà
5.4-Elements químics (taula).
5.5-Electró
5.6-Protó
5.7-Àtom
5.8-Neutró
5.9-Molècula
5.10-Molècules comuns
5.11-Valencies d'alguns elements químics
5.12-Valencia química
5.13-Metals
5.14-Composts binaris
5.15-Substancies simples
1-INTRODUCCIÓ:
Esquema de tots els elements químics disposats per orde de nombre atòmic creixent i en una forma que reflexa l'estructura dels elements. Els elements estan ordenats en set fileres horitzontals, anomenades períodes, i en 18 columnes verticals, anomentas grups. El primer període, que conté dos elements, l'hidrogen i l'heli, i els dos períodes següents, cada un amb huit elements, es anomenen períodes curts. Els períodes restants, anomenats períodes llargs, contenen 18 elements en el cas dels períodes 4 i 5, o 32 elements en el del període 6. El període llarg 7 inclou el grup dels actínids, que ha sigut completat sintetitzant nuclis radioactius més enllà de l'element 92, l'urani (veja Elements transurànics).
Els grups o columnes verticals de la taula periòdica van ser classificats tradicionalment d'esquerra a dreta utilitzant nombres romans seguits de les lletres “A” o “B”, on la “B” es referix als elements de transició. En l'actualitat ha guanyat popularitat un altre sistema de classificació, que ha sigut adoptat per la Unió Internacional de Química Pura i Aplicada (IUPAC, sigles en anglés). Este nou sistema enumera els grups consecutivament de l'1 al 18 a través de la taula periòdica.
2-DESENVOLUPAMENT HISTÓRIC:
2.1- Dmitri Ivanovich Mendeléiev:

Dmitri Ivanovich Mendeléiev
Dimitri Ivanovich Mendeléiev va publicar en 1869 el seu Sistema Periòdic, en el qual es basa el que continuem utilitzant hui en dia. La seua taula consta d'una sèrie de columnes (8 en la primera versió, 18 després de la correcció de Werner i Paneth) i d'una sèrie de files (12 en el sistema curt de 8 columnes i 6 en el sistema llarg). Les columnes es denominen grups i les files períodes.
Esta taula es basa en un doble criteri d'ordenació.

La massa atòmica: els elements es col·loquen d'acord amb les seues masses atòmiques, de menor a major massa.
Les propietats: els elements es col·loquen de tal forma que coincidisquen en una mateixa columna els elements de propietats semblants.
La gran aportació de Mendeleev fue suposar, observant les propietats dels elements coneguts, que en la taula havien de deixar-se alguns buits buits, que correspondrien a elements que en aquell moment no es coneixien, però que haurien de ser descoberts amb el temps. Així, Mendeleev va predir l'existència de tres elements que va denominar eka-bor, eka-alumini i eka-silici ("eka" és la paraula sànscrita que significa "un"), els quals van ser en efecte descoberts més avant i van rebre el nom d'escandi, gal·li i germani, respectivament.
2.2- Julius Lothar Meyer:

Va publicar, un any després que Mendeleev i independentment d'este, una ordenació dels elements semblant, però en la que faltava el gran bot que va donar Mendeleev al predir l'existència d'elements que eren desconeguts en aquell moment.
Meyer va representar gràficament els volums atòmics dels elements en funció dels seus pesos atòmics, amb la qual cosa va observar que s'aconseguien valors màxims per als metalls alcalins: sodi, potassi, rubidi i cesi. Cada descens i nova licitada a un màxim correspondria a un període en la taula d'elements.Altres propietats físiques descendien i pujaven de forma semblant.
Per la seua banda, Mendeleev s'havia basat en el canvi progressiu de les valencies. Va classificar la informació corresponent no en un gràfic, com Meyer, sinó en una taula, la qual cosa aportava major claredat.
2.3- Dmitri Ivanovich Mendeléiev i Julius Lothar Meyer:
El sistema periòdic ha experimentat dos avanços principals des de la seua formulació original per part de Mendeléiev i Meyer. La primera revisió va estendre el sistema per a incloure tota una nova família d'elements. Este grup comprenia els tres primers elements dels gasos nobles o inerts, argó, heli i neó, descoberts en l'atmosfera entre 1894 i 1898 pel matemàtic i físic britànic John William Strutt Rayleigh i el químic britànic William Ramsay. El segon avanç va ser la interpretació de la causa de la periodicitat dels elements en termes de la teoria de Bohr (1913) sobre l'estructura electrònica de l'àtom.
3-TEORÍA DE LA CAPA ELECTRÓNICA:
En la classificació periòdica, els gasos nobles, que no són reactius en la majoria dels casos (valència = 0), estan interposats entre un grup de metalls altament reactius que formen compostos amb valència +1 i un grup de no metalls també molt reactius que formen compostos amb valència -1. Este fenomen va conduir a la teoria que la periodicitat de les propietats resulta de la disposició dels electrons en capes al voltant del nucli atòmic. Segons la mateixa teoria, els gasos nobles són generalment inerts perquè les seues capes electròniques estan completes; per tant, altres elements han de tindre algunes capes que estan només parcialment ocupades, i les seues reactivitats químiques estan relacionades amb els electrons d'eixes capes incompletes. Per exemple, tots els elements que ocupen una posició en el sistema immediatament anterior a un gas inert, tenen un electró menys del nombre necessari per a completar les capes i presenten una valència -1 i tendixen a guanyar un electró en les reaccions. Els elements que seguixen als gasos inerts en la taula tenen un electró en l'última capa, i poden perdre-ho en les reaccions, presentant per tant una valència +1.
Un anàlisi del sistema periòdic, basat en esta teoria, indica que la primera capa electrònica pot contindre un màxim de 2 electrons, la segona un màxim de 8, la tercera de 18, i així successivament. El nombre total d'elements de qualsevol període correspon al nombre d'electrons necessaris per a aconseguir una configuració estable. La diferència entre els subgrups a i B d'un grup Donat també es pot explicar basant-se en la teoria de la capa d'electrons. Ambdós subgrups són igualment incomplets en la capa exterior, però diferixen entre ells en les estructures de les capes subjacents. Este model de l'àtom proporciona una bona explicació dels enllaços químics.
4-TEORÍA CUÁNTICA:
El desenvolupament de la teoria quàntica i la seua aplicació a l'estructura atòmica, enunciada pel físic danés Niels Bohr i altres científics, ha aportat una explicació fàcil a la majoria de les característiques detallades del sistema periòdic. Cada electró es caracteritza per quatre nombres quàntics que designen el seu moviment orbital en l'espai. Per mitjà de les regles de selecció que governeu eixos nombres quàntics, i del principi d'exclusió de Wolfgang Pauli, que establix que dos electrons del mateix àtom no poden tindre els mateixos nombres quàntics, els físics poden determinar teòricament el nombre màxim d'electrons necessari per a completar cada capa, confirmand les conclusions que s'inferixen del sistema periòdic.
Desenvolupaments posteriors de la teoria quàntica van revelar per què alguns elements només tenen una capa incompleta (en concret la capa exterior, o de valència), mentres que altres també tenen incompletes les capes subjacents. En esta última categoria es troba el grup d'elements conegut com a lantànids, que són tan semblants en les seues propietats que Mendeléiev va arribar a assignar-li als 14 elements un únic lloc en la seua taula.
5-DEFINICIONS:
5.1-Element químic:
Substància que no pot ser descomposta o dividida en substàncies més simples per mitjans químics ordinaris. Antigament, els elements es consideraven substàncies fonamentals, però hui se sap que consistixen en una varietat de partícules elementals: electrons, protons i neutrons.
Es coneixen més de 100 elements químics en l'univers. Encara que diversos d'ells, els anomenats elements transurànics, no es troben en la naturalesa, han sigut produïts artificialment bombardejant nuclis atòmics d'altres elements amb nuclis carregats o amb partícules nuclears. Tal bombardeig pot tindre lloc en un accelerador de partícules (com el ciclotró), en un reactor nuclear o en una explosió nuclear.
Els elements químics es classifiquen en metalls i no metalls. Els àtoms dels metalls són electropositius i combinen fàcilment amb els àtoms electronegatius dels no metalls. Hi ha un grup d'elements anomenats metal·loides, que té propietats intermèdies entre els metalls i els no metalls, i que es considera a vegades com una classe separada. Quan els elements estan ordenats per orde de nombre atòmic (nombre de càrregues positives existents en el nucli d'un àtom d'un element), es repetixen a intervals específics elements amb propietats físiques i químiques semblants (veure Sistema periòdic). Eixos grups d'elements amb propietats físiques i químiques semblants s'anomenen famílies, per exemple: els metalls alcalinoterris, els lantànids, els halògens i els gasos nobles.
La unitat de massa atòmica dels elements és un dotzé de la massa de l'àtom de carboni 12 (establida arbitràriament en 12). El nombre atòmic, la massa atòmica i el símbol químic de cada un dels elements coneguts vénen donats en el sistema periòdic o taula periòdica. Veure articles sobre cada element per separat.
Quan dos àtoms tenen el mateix nombre atòmic, però diferents nombres màssics, es anomenen isòtops. Alguns elements tenen diversos isòtops naturals, mentres que altres només existixen en una forma isotòpica. S'han produït centenars d'isòtops sintètics. Diversos isòtops naturals i alguns sintètics són inestables.
Els elements transurànics pesats produïts en el laboratori són radioactius i tenen vides molt curtes. Alguns físics especulen sobre l'existència d'un nombre d'elements superpesats estables, elements amb nombres atòmics de 114 o superiors; les dades obtingudes arran de la creació dels últims elements químics del sistema periòdic pareixen confirmar esta “illa d'estabilitat”.
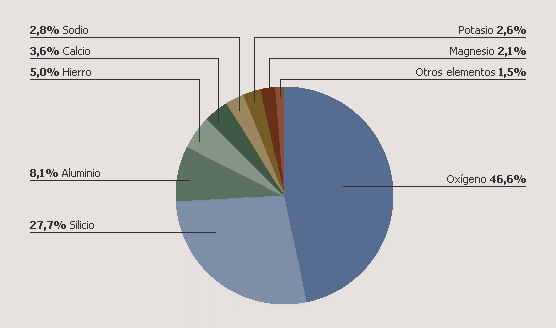
5.2-Elements en l'escorça terrestre
L'escorça terrestre està composta en la seua major part per oxigen i silici. Estos elements químics, junt amb l'alumini, el ferro, el calci, el sodi, el potassi i el magnesi, constituïxen el 98,5% de la corfa terrestre.
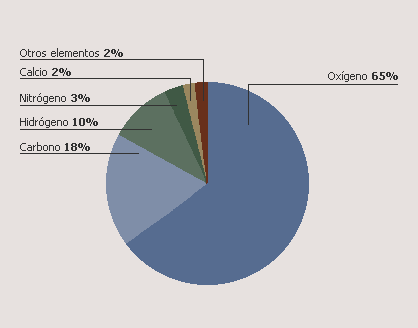
5.3-Elements al cos humà
Els quatre elements químics més abundants en el cos humà són l'oxigen, el carboni, l'hidrogen i el nitrogen, que constituïxen el 96% de la massa corporal. A més del calci (2%), elements com el fòsfor, el potassi, el sofre i el sodi, entre altres, formen també part del cos humà, encara que en un percentatge molt de menor.
5.4-Elements químics
Símbol, nombre atòmic i massa atòmica dels elements químics.
| NÚMERO ATÓMICO | NOMBRE | SÍMBOLO | MASA ATÓMICA* |
| 1 | Hidrógeno | H | 1,0079 |
| 2 | Helio | He | 4,0026 |
| 3 | Litio | Li | 6,941 |
| 4 | Berilio | Be | 9,012 |
| 5 | Boro | B | 10,81 |
| 6 | Carbono | C | 12,011 |
| 7 | Nitrógeno | N | 14,007 |
| 8 | Oxígeno | O | 15,999 |
| 9 | Flúor | F | 18,998 |
| 10 | Neón | Ne | 20,1798 |
| 11 | Sodio | Na | 22,99 |
| 12 | Magnesio | Mg | 24,305 |
| 13 | Aluminio | Al | 26,98 |
| 14 | Silicio | Si | 28,086 |
| 15 | Fósforo | P | 30,97 |
| 16 | Azufre | S | 32,066 |
| 17 | Cloro | Cl | 35,453 |
| 18 | Argón | Ar | 39,948 |
| 19 | Potasio | K | 39,098 |
| 20 | Calcio | Ca | 40,08 |
| 21 | Escandio | Sc | 44,956 |
| 22 | Titanio | Ti | 47,867 |
| 23 | Vanadio | V | 50,94 |
| 24 | Cromo | Cr | 51,996 |
| 25 | Manganeso | Mn | 54,94 |
| 26 | Hierro | Fe | 55,845 |
| 27 | Cobalto | Co | 58,93 |
| 28 | Níquel | Ni | 58,69 |
| 29 | Cobre | Cu | 63,546 |
| 30 | Cinc | Zn | 65,409 |
| 31 | Galio | Ga | 69,72 |
| 32 | Germanio | Ge | 72,64 |
| 33 | Arsénico | As | 74,92 |
| 34 | Selenio | Se | 78,96 |
| 35 | Bromo | Br | 79,904 |
| 36 | Criptón | Kr | 83,8 |
| 37 | Rubidio | Rb | 85,47 |
| 38 | Estroncio | Sr | 87,62 |
| 39 | Itrio | Y | 88,906 |
| 40 | Circonio | Zr | 91,22 |
| 41 | Niobio | Nb | 92,906 |
| 42 | Molibdeno | Mo | 95,94 |
| 43 | Tecnecio | Tc | (98) |
| 44 | Rutenio | Ru | 101,07 |
| 45 | Rodio | Rh | 102,905 |
| 46 | Paladio | Pd | 106,42 |
| 47 | Plata | Ag | 107,87 |
| 48 | Cadmio | Cd | 112,41 |
| 49 | Indio | In | 114,82 |
| 50 | Estaño | Sn | 118,711 |
| 51 | Antimonio | Sb | 121,76 |
| 52 | Teluro | Te | 127,6 |
| 53 | Yodo | I | 126,9 |
| 54 | Xenón | Xe | 131,29 |
| 55 | Cesio | Cs | 132,91 |
| 56 | Bario | Ba | 137,33 |
| 57 | Lantano | La | 138,91 |
| 58 | Cerio | Ce | 140,12 |
| 59 | Praseodimio | Pr | 140,91 |
| 60 | Neodimio | Nd | 144,24 |
| 61 | Promecio | Pm | (145) |
| 62 | Samario | Sm | 150,36 |
| 63 | Europio | Eu | 151,96 |
| 64 | Gadolinio | Gd | 157,25 |
| 65 | Terbio | Tb | 158,93 |
| 66 | Disprosio | Dy | 162,5 |
| 67 | Holmio | Ho | 164,93 |
| 68 | Erbio | Er | 167,26 |
| 69 | Tulio | Tm | 168,93 |
| 70 | Iterbio | Yb | 173,04 |
| 71 | Lutecio | Lu | 174,97 |
| 72 | Hafnio | Hf | 178,49 |
| 73 | Tántalo | Ta | 180,95 |
| 74 | Volframio | W | 183,84 |
| 75 | Renio | Re | 186,21 |
| 76 | Osmio | Os | 190,2 |
| 77 | Iridio | Ir | 192,2 |
| 78 | Platino | Pt | 195,08 |
| 79 | Oro | Au | 196,97 |
| 80 | Mercurio | Hg | 200,59 |
| 81 | Talio | Tl | 204,38 |
| 82 | Plomo | Pb | 207,2 |
| 83 | Bismuto | Bi | 208,98 |
| 84 | Polonio | Po | (209) |
| 85 | Astato | At | (210) |
| 86 | Radón | Rn | (222) |
| 87 | Francio | Fr | (223) |
| 88 | Radio | Ra | (226) |
| 89 | Actinio | Ac | (227) |
| 90 | Torio | Th | 232,04 |
| 91 | Protactinio | Pa | 231,036 |
| 92 | Uranio | U | 238,03 |
| 93 | Neptunio | Np | (237) |
| 94 | Plutonio | Pu | (244) |
| 95 | Americio | Am | (243) |
| 96 | Curio | Cm | (247) |
| 97 | Berquelio | Bk | (247) |
| 98 | Californio | Cf | (251) |
| 99 | Einstenio | Es | (252) |
| 100 | Fermio | Fm | (257) |
| 101 | Mendelevio | Md | (258) |
| 102 | Nobelio | No | (259) |
| 103 | Laurencio | Lr | (260) |
| 104 | Rutherfordio | Rf | (261) |
| 105 | Dubnio | Db | (262) |
| 106 | Seaborgio | Sg | (266) |
| 107 | Bohrio | Bh | (264) |
| 108 | Hassio | Hs | (263) |
| 109 | Meitnerio | Mt | (268) |
| 110 | Ununnilio | Uun | (271) |
| 111 | Unununio | Uuu | (272) |
| 112 | Ununbio | Uub | (277) |
| 114 | Ununquadio | Uuq | (289) |
| 116 | Ununhexio | Uuh | (292) |
|
| |||
5.5-Electró:
Tipus de partícula elemental de càrrega negativa que forma part de la família dels leptons i que, junt amb els protons i els neutrons, forma els àtoms i les molècules. Els electrons estan presents en tots els àtoms i quan són arrancats de l'àtom s'anomenen electrons lliures.
Els electrons intervenen en una gran varietat de fenòmens físics i químics. Es diu que un objecte està carregat elèctricament si els seus àtoms tenen un excés d'electrons (posseïx càrrega negativa) o un dèficit dels mateixos (posseïx càrrega positiva). El flux d'un corrent elèctric en un conductor és causat pel moviment dels electrons lliures del conductor. La conducció de la calor també es deu fonamentalment a l'activitat electrònica. L'estudi de les descàrregues elèctriques a través de gasos enrarits en els tubs de buit va ser l'origen del descobriment de l'electró. En els tubs de buit, un càtode calfat emet un corrent d'electrons que pot emprar-se per a amplificar o rectificar un corrent elèctric (veja Rectificació). Si eixe corrent s'enfoca per a formar un feix ben definit, este es denomina feix de rajos catòdics. Si es dirigix el feix de rajos catòdics cap a un objectiu adequat es produïxen rajos X; si es dirigixen cap a la pantalla fluorescent d'un tub de televisió, s'obtenen imatges visibles. Les partícules beta que emeten algunes substàncies radioactives són electrons.
Els electrons també intervenen en els processos químics. Una reacció química d'oxidació és un procés en el qual una substància perd electrons, i una reacció de reducció és un procés en el qual una substància guanya electrons.
En 1906, el físic nord-americà Robert Andrews Millikan, per mitjà del seu experiment de “la gota d'oli”, va determinar la càrrega de l'electró: 1,602 × 10-19 coulombs; la seua massa en repòs és 9,109 × 10-31 kg. La càrrega de l'electró és la unitat bàsica d'electricitat i es considera la càrrega elemental en el sentit que tots els cossos carregats ho estan amb un múltiple sencer de la dita càrrega. L'electró i el protó posseïxen la mateixa càrrega, però, convencionalment, la càrrega del protó es considera positiva i la de l'electró negativa.
5.6-Protó:
Partícula nuclear amb càrrega positiva igual en magnitud a la càrrega negativa de l'electró; junt amb el neutró, està present en tots els nuclis atòmics. Al protó i al neutró se'ls denomina també nucleons. El nucli de l'àtom d'hidrogen està format per un únic protó. La massa d'un protó és d'1,6726 × 10-27 kg, aproximadament 1.836 vegades la de l'electró. Per tant, la massa d'un àtom està concentrada quasi exclusivament en el seu nucli. El protó té un moment angular intrínsec, o porc Espí, i per tant un moment magnètic. D'altra banda, el protó complix el principi d'exclusió. El nombre atòmic d'un element indica el nombre de protons del seu nucli, i determina de quin element es tracta. En física nuclear, el protó s'empra com a projectil en grans acceleradors per a bombardejar nuclis a fi de produir partícules fonamentals (veure Acceleradors de partícules). Com a ió de l'hidrogen, el protó exercix un paper important en la química (veure Àcids i bases; Ionització).
L'antiprotó, l'antipartícula del protó, es coneix també com a protó negatiu. Es diferencia del protó en què la seua càrrega és negativa i que no forma part dels nuclis atòmics. L'antiprotó és estable en el buit i no es desintegra espontàniament. No obstant, quan un antiprotó col·lidix amb un protó, ambdós partícules es transformen en hostals, la vida mitja del qual és extremadament breu (veure Radioactivitat). Si bé l'existència d'esta partícula elemental es va postular per primera vegada en la dècada de 1930, l'antiprotó no es va identificar fins a 1955, en el Laboratori de Radiació de la Universitat de Califòrnia.
Els protons són part essencial de la matèria ordinària, i són estables al llarg de períodes de milers de milions, inclús bilions, d'anys. No obstant, interessa saber si els protons acaben desintegrant-se, en una escala temporal de 1033 anys o més. Este interés es deriva dels actuals intents d'aconseguir teories d'unificació que combinen les quatre interaccions fonamentals de la matèria en un únic esquema (veure Teoria del camp unificat). Moltes de les teories proposades impliquen que el protó és, en últim terme, inestable, per la qual cosa els grups d'investigació de nombrosos acceleradors de partícules estan duent a terme experiments per a detectar la desintegració d'un protó. Fins ara no s'han trobat proves clares; els indicis observats poden interpretar-se d'altres formes.
5.7-Àtom:
La unitat més xicoteta possible d'un element químic. En la filosofia de l'antiga Grècia, la paraula “àtom” s'emprava per a referir-se a la part de matèria més xicoteta que podia concebre's. Eixa “partícula fonamental”, per emprar el terme modern per a eixe concepte, es considerava indestructible. De fet, àtom significa en grec “no divisible”. Al llarg dels segles, la grandària i la naturalesa de l'àtom només van ser objecte d'especulacions, per la qual cosa el seu coneixement va avançar molt lentament.
5.8-Neutró:
Partícula sense càrrega que constituïx una de les partícules fonamentals que componen la matèria. La massa d'un neutró és d'1,675 × 10-27 kg, aproximadament un 0,125% major que la del protó. L'existència del neutró va ser profetitzada en 1920 pel físic britànic Ernest Rutherford i per científics australians i nord-americans, però la verificació experimental de la seua existència va resultar difícil pel fet que la càrrega elèctrica del neutró és nul·la i la majoria dels detectors de partícules només registren les partícules carregades.

James Chadwick
El físic britànic James Chadwick va ser guardonat amb el Premi Nobel de Física en 1935 pel descobriment del neutró. Este descobriment va conduir al desenvolupament de la fissió nuclear i de la bomba atòmica.
5.9-Molécula:
La partícula més xicoteta d'una substància, que manté les propietats químiques específiques d'eixa substància. Si una molècula es dividix en parts encara més xicotetes, estes tindran una naturalesa diferent de la substància original. Per exemple, una mostra d'aigua pot dividir-se en dos parts, i cada una dividir-se al seu torn en mostres d'aigua més xicotetes. El procés de divisió i subdivisió finalitza a l'arribar a la molècula simple d'aigua, que si es dividix donarà lloc a quelcom que ja no és aigua: hidrogen i oxigen. Cada molècula es presenta independentment de les altres. Si es troben dos molècules, se sol produir un rebot sense que ocórreguen canvis fonamentals. En cas de encontres més violents es produïxen alteracions en la composició de les molècules, i poden tindre lloc transformacions químiques.
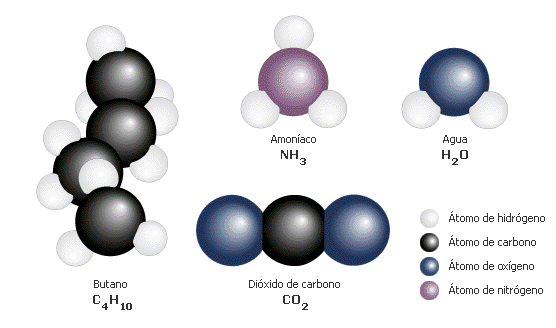
5.10-Molécules comuns
Les molècules estan formades per combinacions específiques d'àtoms. Les substàncies comunes poden dividir-se teòricament en molècules simples, com ací es representa, però no es poden dividir més sense alterar la seua naturalesa. Com en una recepta en què els àtoms són els ingredients, cada molècula té una fórmula química. Si es lleva o canvia un ingredient, la molècula resultant serà completament diferent.
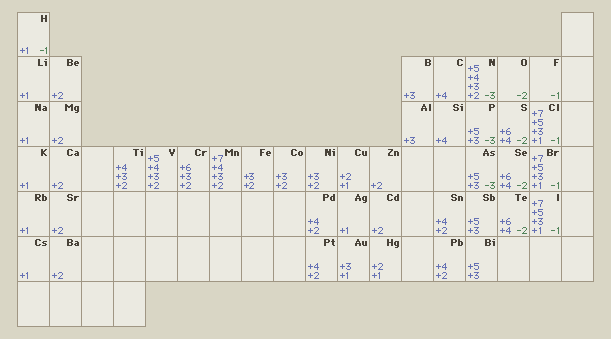
5.11-Valencies d'alguns elements químics
5.12-Valencia (química):
Nombre que representa la capacitat d'un àtom o radical individual per a combinar-se amb altres àtoms o radicals. El valor expressa el nombre d'electrons que un àtom pot donar a —O acceptar de— un altre àtom (o radical) durant una reacció química.
5.13-Metals:
Grup d'elements químics que presenten totes o gran part de les següents propietats físiques: estat sòlid a temperatura normal, excepte el mercuri que és líquid; opacitat, excepte en capes molt fines; bons conductors elèctrics i tèrmics; brillants, una vegada polits, i estructura cristal·lina en estat sòlid. Metalls i no metalls es troben separats en el sistema periòdic per una línia diagonal d'elements. Els elements a l'esquerra d'esta diagonal són els metalls, i els elements a la dreta són els no metalls. Els elements que integren esta diagonal —Bor, silici, germani, arsènic, antimoni, tel·lur, poloni i àstat— Tenen propietats tant metàl·liques com no metàl·liques. Els elements metàl·lics més comuns són els següents: alumini, bari, beril·li, bismut, cadmi, calci, ceri, crom, cobalt, coure, or, iridi, ferro, plom, liti, magnesi, manganés, mercuri, molibdé, níquel, osmi, pal·ladi, platí, potassi, radi, rodi, plata, sodi, tàntal, tal·li, tori, estany, titani, volfram, urani, vanadi i zinc. Els elements metàl·lics es poden combinar uns amb altres i també amb altres elements formant compostos, dissolucions i mescles. Una mescla de dos o més metalls o d'un metall i certs no metalls com el carboni es denomina aliatge. Els aliatges de mercuri amb altres elements metàl·lics són conegudes com a amalgames.
5.14-Compostos binaris:
1. Si un element és l'Oxigen:
La seua fórmula : X2O La valència de l'oxigen s'indica davall de X i la de X davall de l'oxigen.
El seu nom : Oxide de X (qualsevol element del Sistema Periòdic).
2. Si un element és hidrogen:
La seua fórmula: XH La valència de l'oxigen s'indica davall de X i la de X davall de l'oxigen.
El seu nom: Hidrur de X (qualsevol element del Sistema Periòdic).
5.15-Sustancies simples:
Són les que estan constituïdes per àtoms d'un només element . Ej : H2, Cl2 , P4 , He y O3.
Descargar
| Enviado por: | Tanner Johan |
| Idioma: | catalán |
| País: | España |
