Ingeniero Químico
Síntesis orgánica y bioquímica
Practica · 2 síntesis orgánica y bioquímica
Alquenos: reacciones de eliminación obtención de ciclohexano.
Introducción
Eliminación
Hidrocarburos no saturados
En nuestro estudio de los alcanos mencionados brevemente otra familia de hidrocarburos, los alquenos, que contienen menos hidrógeno que los alcanos de igual número de carbonos y que pueden convertirse en éstos por adición de hidrógeno. Además, se explicó cómo se obtienen los alquenos a partir de los alcanos por pérdida de hidrógeno en el proceso del cracking.
Puesto que los alquenos tienen, evidentemente, menos hidrógeno que el máximo posible, se denominan hidrocarburos no saturados. Esta insaturación puede satisfacer mediante otros reactivos diferentes del hidrógeno, lo que da origen a sus propiedades químicas características.
Estructura del etileno. El doble enlace carbono-carbono
El miembro más sencillo de la familia de los alquenos es el etileno, C2H4. En vista de la fácil conversión del etileno en etano, es razonable suponer que ambos tienen cierta similitud estructural.
En consecuencia, comenzamos conectando los átomos de carbono con un enlace covalente y luego unimos a cada uno de ellos dos átomos de hidrógeno. En esta etapa, cada carbono tiene solamente seis electrones de valencia, en vez de los ocho requeridos, y a la molécula entera aún le falta un par para ser neutra. Podemos resolver ambos problemas si damos por sentado que los carbonos pueden compartir dos pares de electrones y, para describir esta situación, decimos que están unidos por un doble enlace. El doble enlace carbono-carbono es el rasgo característico de la estructura de los alquenos.
La mecánica cuántica da una descripción más detallada del etileno y del doble enlace carbono-carbono. Para formar enlaces con tres átomos adicionales, el carbono utiliza tres orbítales híbridos equivalentes sp2, que resultan de mezclar un orbital s y dos p. Hemos visto que los orbítales sp2 se encuentran en l plano del núcleo del carbono y que se dirigen hacia los vértices de un triángulo equilátero; el ángulo entre cualquier par de orbítales resulta de 120º. Esta disposición trigonal permite la separación máxima de los orbítales híbridos. Al igual que la repulsión mutua entre orbítales da cuatro enlaces tetraédricos, también da tres enlaces trigonales.
(7.2) Orbítales atómicos: orbítales híbridos sp2. Los ejes
Se dirigen a los vértices de un
Triangulo equilátero.
Si ordenamos los dos carbonos y cuatro hidrógenos del etileno para permitir el solapamiento máximo de orbítales, obtenemos la estructura de la figura 7.2. Cada átomo de carbono se encuentra en el centro de un triángulo, en cuyos vértices se ubican dos hidrógenos y el otro carbono. Todos los ángulos de enlace son de 120º. Aunque la distribución en torno al núcleo de carbono es distinta, individualmente estos enlaces son muy semejantes a los del etano, siendo cilíndricamente simétricos en torno a una recta que conecta los núcleos, por lo que se les designa igual: enlace o (enlace sigma).
Fig. 7.2 Molécula de etileno: sólo se indican
Los enlaces o.
Sin embargo, la molécula aún no está completa. Para formar los tres orbítales sp2, cada carbono sólo ha utilizado dos de los tres orbítales p; el restante consta de dos lóbulos iguales, uno por encima y el otro por debajo del plano de los tres orbítales sp2 (Fig. 7.3), y está ocupado por un solo electrón. Si el orbital p de uno de los carbonos solapa al del otro, se aparean los electrones y se forman un enlace adicional.
Fig. 7.3 Molécula de etileno: doble enlace carbono-carbono. El solapa-
Miento de los orbítales p genera un enlace n; hay una nube n por encima del plano, y otra, por debajo.
Propiedades físicas de los alquenos.
Como clase, los alquenos poseen propiedades físicas esencialmente iguales que las de los alcanos. Son insolubles en agua, pero bastante solubles en líquidos no polares, como benceno, éter, cloroformo o ligroína, y son menos densos que el agua. De la tabla 7.2 se desprende que el punto de ebullición aumenta con el número creciente de carbonos; como en el caso de los alcanos, el aumento del punto de ebullición es de 20 a 30 grados por cada carbono adicional, excepto para los homólogos muy pequeños. Las ramificaciones bajan el punto de ebullición. Una comparación de la tabla 7.2 con la 3.3 (Sec. 3.12) demuestra que el punto de ebullición de un alqueno es muy parecido al del alcano con un esqueleto carbonado correspondiente.
Al igual que los alcanos, los alquenos son, a lo sumo, sólo débilmente polares. Puesto que los electrones n muy sueltos del doble enlace se desplazan con facilidad, sus momentos dipolares son mayores que los de los alcanos; sin embargo, son pequeños: por ejemplo, compararemos los momentos dipolares del propileno y del 1-buteno, señalados más adelante, con el del cloruro de metilo, 1.83 D. La unión del grupo alquilo al carbono del doble enlace tiene una polaridad pequeña, cuya dirección se supone que es la indicada, es decir, con el.
Prelaboratorio
TOXICIDAD DE LOS REACTIVOS
Ácido sulfúrico:
El Ácido Sulfúrico, de fórmula H2SO4 ( óleum: H2SO4 con SO3 en solución), a temperatura ambiente es un líquido corrosivo, es más pesado que el agua e incoloro (a temperatura y presión ambiente). El óleum tiene un olor picante y penetrante. Esta es la sustancia más importante de la industria química mundial. Sus nombres químicos son ácido sulfúrico y ácido sulfúrico fumante. También es llamado aceite de vitriolo, ácido de baterías y ácido de fertilizantes.
El ácido sulfúrico es un ácido diprótico, ya que cada unidad de ácido produce dos iones H en dos etapas independientes:
H2SO4 (ac) H (ac) + HSO4 (ac)
HSO4 (ac) H (ac) + SO4 (ac)
Datos Físicos:
1. Concentración mayor: 98,5%
A una temperatura de 15,5 ºC:
2. Punto de ebullición: 338 ºC ó 640 ºF
3. Densidad a 20 ºC: 1,84 g/cm.
4. Punto de fusión: -40 ºC para una concentración de 65,13%.
5. Solubilidad: Soluble en agua, pero reacciona violentamente al mezclarse con ella, generando calor. Con otros solventes no hay mezcla: no hay reacción.
6. Temperatura de descomposición: 340 ºC.
7. Presión de vapor a 20 ºC: < 0,001 bar.
Peligros para la salud de las personas.
Efectos de una sobre exposición aguda: El ácido sulfúrico es corrosivo para todos los tejidos del cuerpo. La cantidad fatal para un adulto varía entre una cucharadita de té y seis gramos del ácido concentrado. Aun pocas gotas pueden ser fatales si el ácido alcanza la tráquea. Puede haber perforación gástrica y peritonitis. Las que pueden ser seguidas por colapso circulatorio. Es común que la causa inmediata de la muerte sea el shock circulatorio.
Inhalación: La inhalación de los vapores puede causar daño pulmonar grave.
Se debe llevar a la víctima en forma urgente al aire libre. Si existen los medios administrarle oxígeno. Conseguir atención médica inmediata.
Contacto con la piel: El contacto con la piel puede causar necrosis (gangrena) grave de los tejidos.
Las personas que hayan tenido contacto con el ácido sulfúrico deberán lavar las partes afectadas con abundante agua corriente y retirar las ropas lo más rápido posible. Como complemento puede usarse jabón para lavar las partes afectadas. Conseguir atención médica inmediata.
Contacto con los ojos: El contacto del ácido sulfúrico con los ojos puede resultar en la pérdida total de la visión.
Se deben irrigar los ojos con abundante agua corriente, por lo menos durante quince minutos. Los párpados deben mantenerse abiertos durante la irrigación, para asegurar el contacto del agua con los tejidos de la región. Si después de la irrigación continúan las molestias, se necesitará una segunda irrigación por otros quince minutos. También se podrá aplicar dos a tres gotas de un anestésico líquido protegiendo los ojos después con un parche. No se debe aplicar aceites ni ungüentos oleosos. Conseguir atención médica inmediata.
Ingestión: El contacto del ácido sulfúrico con los órganos internos del cuerpo corroe las membranas mucosas de la boca, garganta y esófago, con dolor agudo y dificultad para tragar. Puede haber también hemorragia gástrica y vómitos. El vómito puede contener sangre fresca.
Si accidentalmente la persona llega a ingerir ácido sulfúrico debe administrársele abundante agua o leche, con el objeto de reducir la concentración, y una vez hecho ésto puede dársele a tomar leche de magnesia o agua de cal para neutralizar el ácido. No debe provocársele el vómito. Conseguir atención médica inmediata.
Efectos de una sobre exposición crónica: Puede causar tráqueobronquitis, estomatitis, conjuntivitis y gastritis.
Peligro para el medio ambiente: El ácido sulfúrico es dañino para la vida acuática en concentraciones muy bajas.
Peligros especiales del producto: El ácido sulfúrico no es inflamable pero en su concentración más alta puede causar combustión al contacto con líquidos y sólidos. En contacto con metales genera hidrógeno, gas altamente inflamable.
KMnO4:
PELIGROS QUIMICOS:
La sustancia se descompone al calentarla intensamente, produciendo gases tóxicos y humos irritantes . La sustancia es un oxidante fuerte y reacciona con materiales combustibles y reductores, causando peligro de incendio o explosión. Reacciona violentamente con metales en forma de polvo , originando peligro de incendio.
VIAS DE EXPOSICION:
La sustancia se puede absorber por inhalación del polvo y por ingestión .
RIESGO DE INHALACION:
La evaporación a 20°C es despreciable; sin embargo, se puede alcanzar rápidamente una concentración nociva de partículas en el aire cuando se dispersa.
EFECTOS DE EXPOSICION DE CORTA DURACION:
La sustancia es corrosiva para los ojos, la piel y el tracto respiratorio. Corrosiva por ingestión. La inhalación del polvo de esta sustancia puede originar edema pulmonar (véanse Notas). Los efectos pueden aparecer de forma no inmediata. Se recomienda vigilancia médica.
EFECTOS DE EXPOSICION PROLONGADA O REPETIDA:
La sustancia puede afectar al pulmón, dando lugar a bronquitis y neumonía .
Br 2.
PELIGROS FISICOS
El vapor es más denso que el aire.
PELIGROS QUIMICOS
Por calentamiento intenso se producen humos tóxicos. La sustancia es un oxidante fuerte y reacciona violentamente con sustancias combustibles y reductoras. Reacciona violentamente con amoníaco, oxidantes, metales, compuesto orgánicos y fósforo, originando peligro de incendio y explosión. Ataca a algunas formas de plástico, caucho y recubrimientos.
VIAS DE EXPOSICION
La sustancia se puede absorber por inhalación del vapor, a través de la piel y por ingestión.
RIESGO DE INHALACION
Por evaporación de esta sustancia a 20°C se puede alcanzar muy rápidamente una concentración nociva en el aire.
EFECTOS DE EXPOSICION DE CORTA DURACION
Corrosivo. El vapor es corrosivo para los ojos, la piel y el tracto respiratorio. La inhalación del vapor puede originar edema pulmonar (véanse Notas). La sustancia puede causar efectos en el sistema nervioso central, dando lugar a alteraciones funcionales. La exposición a altas concentraciones puede producir la muerte. Se recomienda vigilancia médica.
EFECTOS DE EXPOSICION PROLONGADA O REPETIDA
El contacto prolongado o repetido con la piel puede producir dermatitis.
CLORURO DE CALCIO:
ESTADO FISICO; ASPECTO
Cristales higroscópicos, incoloros e inodoros.
PELIGROS FISICOS
PELIGROS QUIMICOS
La sustancia se descompone al calentarla intensamente a altas temperaturas y al arder, produciendo humos tóxicos y corrosivos. La disolución en agua es una base débil. Ataca al cinc en presencia de agua, produciendo gas inflamable de hidrógeno. Se disuelve violentamente en el agua con liberación de gran cantidad de calor.
LIMITES DE EXPOSICION
TLV no establecido.
VIAS DE EXPOSICION
La sustancia se puede absorber por inhalación del aerosol.
RIESGO DE INHALACION
La evaporación a 20°C es despreciable; sin embargo, se puede alcanzar rápidamente una concentración nociva de partículas en el aire cuando se dispersa.
EFECTOS DE EXPOSICION DE CORTA DURACION
La sustancia irrita la piel y el tracto respiratorio.
EFECTOS DE EXPOSICION PROLONGADA O REPETIDA
El contacto prolongado o repetido con la piel puede producir dermatitis. La sustancia puede afectar a la mucosa nasal, dando lugar a ulceraciones.
CICLOHEXANOL
ESTADO FISICO; ASPECTO
Líquido hidroscópico incoloro.
Cristales blancos, de olor característico.
Punto de ebullición: 161°C
Punto de fusión: 23°C
Densidad relativa (agua = 1): 0.96
Solubilidad en agua, g/100 ml a 20°C: 4
Presión de vapor, kPa a 20°C: 0.13
Densidad relativa de vapor (aire = 1): 3.5
Punto de inflamación: 68°C c.c.
Temperatura de autoignición: 300°C
Límites de explosividad, % en volumen en el aire: 2.4-12
Coeficiente de reparto octanol/agua como log Pow: 1.2
PELIGROS QUIMICOS
Reacciona violentamente con oxidantes fuertes.
Ataca el plástico.
LIMITES DE EXPOSICION
TLV: 50 ppm (como TWA); (piel) A3 (ACGIH 2003).
MAK: 50 ppm; 210 mg/m3; I(1); H (DFG 2003)
grupo de embarazo de riesgo: IIc
VIAS DE EXPOSICION
La sustancia se puede absorber por inhalación y por ingestión.
RIESGO DE INHALACION
Por evaporación de esta sustancia a 20°C no se alcanza, o se alcanza sólo muy lentamente, una concentración nociva en el aire.
EFECTOS DE EXPOSICION DE CORTA DURACION
La sustancia irrita los ojos , la piel y el tracto respiratorio.
EFECTOS DE EXPOSICION PROLONGADA O REPETIDA
El líquido desengrasa la piel.
CICLOHEXANO
ESTADO FISICO; ASPECTO
Líquido incoloro.
PELIGROS FISICOS
El vapor es más denso que el aire y puede extenderse a ras del suelo; posible ignición en punto distante. Como resultado del flujo, agitación, etc., se pueden generar cargas electrostáticas.
PELIGROS QUIMICOS
LIMITES DE EXPOSICION
TLV (como TWA): 300 ppm; 1030 mg/m3 (ACGIH 1993-1994).
MAK: 300 ppm; 1050 mg/m3 (1993).
VIAS DE EXPOSICION
La sustancia se puede absorber por inhalación del vapor y por ingestión.
RIESGO DE INHALACION
Por evaporación de esta sustancia a 20°C se puede alcanzar bastante rápidamente una concentración nociva en el aire.
EFECTOS DE EXPOSICION DE CORTA DURACION
La sustancia irrita los ojos y el tracto respiratorio. La ingestión del líquido puede dar lugar a la aspiración del mismo por los pulmones y la consiguiente neumonitis química. La exposición por encima del OEL puede producir pérdida del conocimiento.
EFECTOS DE EXPOSICION PROLONGADA O REPETIDA
El contacto prolongado o repetido con la piel puede producir dermatitis.
CICLOHEXENO
ESTADO FISICO; ASPECTO
Líquido incoloro, de olor característico.
PELIGROS FISICOS
El vapor es más denso que el aire y puede extenderse a ras del suelo; posible ignición en punto distante. Como resultado del flujo, agitación, etc., se pueden generar cargas electrostáticas.
PELIGROS QUIMICOS
La sustancia puede formar peróxidos explosivos. La sustancia puede polimerizar bajo ciertas condiciones. Reacciona con oxidantes fuertes, originando peligro de incendio y explosión.
LIMITES DE EXPOSICION
TLV (como TWA): 300 ppm; 1010 mg/m3 (ACGIH 1995-1996).
MAK: 300 ppm; 1015 mg/m3 (1996).
VIAS DE EXPOSICION
La sustancia se puede absorber por inhalación y por ingestión.
RIESGO DE INHALACION
Por evaporación de esta sustancia a 20°C se puede alcanzar bastante lentamente una concentración nociva en el aire.
EFECTOS DE EXPOSICION DE CORTA DURACION
La sustancia irrita los ojos, la piel y el tracto respiratorio. La ingestión del líquido puede dar lugar a la aspiración del mismo por los pulmones y la consiguiente neumonitis química.
EFECTOS DE EXPOSICION PROLONGADA O REPETIDA
Reacciones de eliminación E1 Y E2.
Estas reacciones pueden ser de dos tipos:
-
Eliminación monomolecular (E1).En este caso la reacción transcurre en dos etapas,para dar lugar a un carbocatión en una primera etapa y a un doble enlace en una segunda etapa; es una reacción competitiva con la SN1.
-
Eliminación bimolecular (E2).En este caso la reacción transcurre en una sola etapa a través de un agente nucleofílico.Si el sustrato es un haloalcano, para que se produzca esta reacción el halógeno y el H adyacente tienen que estar en disposición anti.
Criterios de reactividad.
| Orden del sustrato | Nucleófilo débil | Nucleófilo | Nucleófilo NO IMPEDIDO | Nucleófilo IMPEDIDO |
| Metilo | NO HAY REACCIÓN | SN2 | SN2 | SN2 |
| Primario | NO HAY REACCIÓN | SN2 | SN2 (mayoritaria) | E2 |
| Secundario | SN1 + E1 (muy lenta) | SN2 | E2 | E2 |
| Terciario | SN1 (mayoritaria) + E1 | SN1 + E1 | E2 | E2 |
La reacción SN2 está muy influenciada por efectos estéricos.
Al aumentar la temperatura se favorece la eliminación.
Los sustratos más usuales son haloalcanos.
Bases fuertes impedidas estéricamente: LDA, tBuO-Na+.
Bases fuertes no impedidas estéricamente: EtO-Na+, MeO-Na+, NH2-Na+.
Nucleófilos débiles: H2O, ROH (alcoholes).
Características de las reacciones E1 Y E2
COMPARACIÓN ENTRE LAS REACCIONES E1 y E2.
| Características | E1 | E2 |
| Mecanismo | Dos pasos, Intermedio tipo carbocatión | Un paso, eliminación concertada, con estado de transición |
| Cinética | Primer orden | Segundo orden |
| Transposiciones | En ocasiones | Nunca |
| Sustratos | Haluros, Tosilatos, alcoholes en medio ácido | Haluros, tosilatos, hidróxidos de tetraalquilamonio |
| Características estructurales favorables | Halogenuros 3º, y empleando disolventes polares | Elevada concentración de base. |
| Competencia | Reacción SN1 | Reacción SN2 |
Correlación entre estructura y reactividad para reacciones de sustitución y de eliminación.
| Tipo de halogenuro | SN1 | SN2 | E1 | E2 |
|
R-CH2-X (primario) |
No ocurre |
Altamente favorecida |
No ocurre |
Ocurre cuando se emplean bases fuertes |
|
R2-CH-X (secundario) |
Puede ocurrir con halogenuros bencílicos y alílicos |
Ocurre en competencia con la reacción E2 |
Puede ocurrir con halogenuros bencílicos y alílicos |
Es favorecida cuando se usan bases fuertes |
|
R3-C-X (terciario) |
Es favorecida en solventes hidroxílicos |
No ocurre |
Ocurre en competencia con la reacción SN1 |
Es favorecida cuando se emplean bases |
Procedimiento:
Por destilación fraccionada.
Monte un equipo de destilación fraccionada (Nota 1). En el matraz pera de una boca coloque 10 ml de ciclohexanol, agregue gota a gota y agitando 1.5 ml de ácido sulfúrico, agregue cuerpos de ebullición y adapte el resto del equipo..
Emplee un baño de aire y caliente moderadamente el vaso de pp con el mechero, a través de la tela de asbesto. Reciba el destilado en el matraz de bola y enfrié todo lo que destile entre 80-85oC en un baño de hielo.
Suspenda el calentamiento cuando solo quede un pequeño residuo en el matraz o bien empiecen a aparecer vapores blancos de SO2.( Nota 2)
Sature el destilado con cloruro de sodio y decántelo en el embudo de separación, lavelo 3 veces con una solución de bicarbonato de sodio al 5% empleando porciones de 5 ml cada vez.
Reciba luego, la fase orgánica en un vaso de precipitados y séquela con sulfato de sodio anhídro. Esta fase orgánica debe ser ciclohexeno, el cual deberá purificar por destilación simple, empleando un baño de aire (Nota 3). Colecte la fracción que destila a la temperatura de ebullición del ciclohexeno (Nota 4).
La cabeza y la cola de la destilación pueden utilizarse para hacer las pruebas de insaturación, que se indican al final de este procedimiento.
Mida el volumen obtenido y entréguelo al profesor. Calcule el rendimiento de la reacción.
Observaciones:
En un matraz de destilación se añaden los 10 ml del ciclohexanol y los 1.5 ml de ácido sulfúrico (gota a gota).
La solución de torno de amarrillo claro y después de unos minutos de coloro verde oscuro.
Enseguida se monto el equipo de destilación por arrastre de vapor.
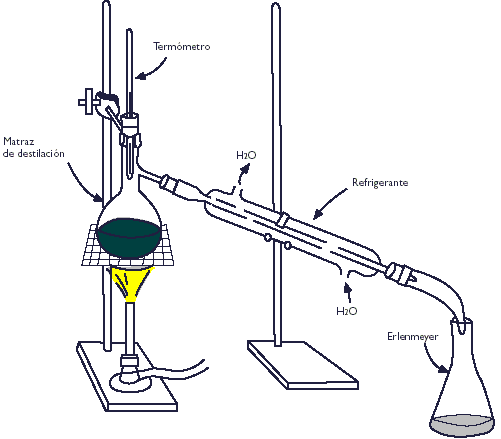
El matraz erlenmeyer donde se esta recogiendo el destilado, tiene que estar en una cuba con mucho hielo.
Nota: la temperatura no debe superar los 90 grados.
El destilado obtenido fue depositado en un embudo de separación.
En el cual se obtuvo el 3.4 % de rendimiento.
Prueba de bayer: 3 gotas de ciclohexeno y 3 gotas de solución de KMnO4
Esta solución es de apariencia incolora de ciclohexeno , con el KMnO4
Que es de color violeta y esta mezcla se torno café oscuro.

Prueba de adición de bromo:
Se añaden 3 gotas de coclohexeno y 1 ml de solución de Br2
En esta prueba no se observa ningún cambio de color.
Prueba de combustión: se agregan 10 ml de ciclohexeno y haciendo la prueba de ignición y se observa un flama de coloración roja. 
Ahora se hace lo mismo pero en vez de manejar ciclohexeno se manejara ciclohexano.
Prueba de bayer:
El ciclohexano no se mezcla con el KMnO4.

Prueba de adicion del bromo:
Se muestra incolora.
![]()
Prueba de combustión: la flama es amarilla.

Manejo de residuos:
Las soluciones acuosas obtenidas del lavado del ciclohexeno y de los residuos de la destilación:
Desechar en el fregadero.
El residuo del CaCl2:
Desechar en el fregadero
Las soluciones de las pruebas de identificación:
Desechar en el fregadero
Desechos del ciclohexeno:
Conservar y entregarlo
Peligrosidad de los reactivos:
REACCION

CONCLUSION:
En conclusión la practica de obtención del ciclohexano se llevo acabo en un mecanismo de eliminación, llevándose la destilación sin ningún incidente y todo en el completo orden que esta practica exigía, también se tomo en cuanta el manejo de residuos y tomando en cuenta los primeros auxilios en caso de algún accidente.
Bibliografía:
http://www.monografias.com/trabajos10/quimi/quimi.shtml
http://www.segulab.com/fis.php?q=ciclohexeno

Universidad veracruzana
15
Laboratorio de síntesis orgánica y bioquímica
Descargar
| Enviado por: | Nikky |
| Idioma: | castellano |
| País: | México |
