Química
Separación de mezclas
COLEGIO NACIONAL NICOLAS ESGUERRA
SEPARACIÓN DE MEZCLAS
Trabajo presentado por:
COLEGIO NACIONAL NICOLÁS ESGUERRA
Laboratorio de Química
Química
Bogotá Distrito Capital 2001
COLEGIO NACIONAL NICOLAS ESGUERRA
SEPARACION DE MEZCLAS
SANTA FE DE BOGOTÁ 20001
OBJETIVOS
-
Familiarizarnos con el uso de los diferentes instrumentos de laboratorio.
-
Diferenciar las diferentes clases de mezclas.
-
Identificar los métodos para separar los componentes de una mezcla y adquirir habilidad en la aplicación de diferentes métodos a través de la experiencia en el laboratorio.
MARCO TEÓRICO
LAS MEZ CLAS
Son dos o más sustancias que forman un sistema en el cual no hay enlaces químicos entre las sustancia que lo integran. Las mezclas se clasifican en homogéneas y heterogéneas, las mezclas homogéneas están formadas por una sola fase, es decir, no se pueden distinguir las partes, ni aún con la ayuda de un microscopio eléctrico.
Por ejemplo el aire es una mezcla gaseosa compuesta principalmente por Nitrógeno, Oxígeno, Argón, Vapor de Agua, y Dióxido de Carbono, en ésta mezcla no se distinguen límites de separación entre una sustancia y otra.
Las mezclas heterogéneas están formadas por más de una fase, por ejemplo el aceite y el agua forman una mezcla en la que el aceite se localiza en la parte superior y el agua, en la parte inferior,, debido a que la densidad de ésta última es mayor que la del aceite, se pueden distinguir claramente las fases.
LA SEPARACIÓN DE MEZCLAS
En un estado natural de las sustancias generalmente forman mezclas. Existen métodos para separar los componente que las forman por lo cual se debe tomar en cuenta el estado natural de la mezcla y de sus componentes.
Existe gran cantidad de sustancias químicas que, para identificarlas, se separan en sistemas homogéneos sencillos para conocer su utilización y composición, utilizan procesos que reciben el nombre de Análisis Químicos.
Hay varios métodos para separar los componentes de una mezcla. En el laboratorio son comunes los siguientes:
-
Decantación.
-
Filtración.
-
Destilación.
-
Cristalización.
-
Magnetismo.
-
Cromatografía.
LA DECANTACIÓN:
Se usa para separar mezclas formadas por sólidos y líquidos o por más de dos o más líquidos no miscibles (no solubles). Consiste en dejar reposar el líquido que contiene partículas sólidas en suspensión.
Luego se transvasa con cuidado el líquido (menos denso) a otro recipiente, puede utilizarse una varilla de vidrio a fin de retenerse alguna partícula sólida que trate de pasar.
Esta técnica se utiliza también con líquidos no miscibles, como el agua y el aceite. Se emplea con frecuencia el embudo de separación o de decantación.
Se coloca en el embudo la mezcla y cuando se hallan diferenciado las dos partes, abre la llave y se separan los líquidos. La capa superior pertenece al líquido menos denso y queda dentro del embudo. (Figura 1)
LA FILTRACIÓN
Se usa para separas sólidos no solubles en líquidos. La separación se hace por medios porosos que retienen las partículas sólidas y dejan pasar el líquido; algunos son:
-
Papel de filtro.
-
Fieltro.
-
Porcelana Porosa.
-
Algodón.
-
Lana de vidrio.
-
Arena.
-
Carbón.
Según la mezcla que se valla a filtrar (figura 2)
DESTILACION
Las soluciones (sistemas homogéneos) o mezclas de líquidos miscibles pueden separarse por cambios de estado “Congelación , Evaporación y Condensación” para separar los componentes de una solución se emplea con frecuencia la destilación; también se usa para purificar las sustancias líquidas.
El agua se destila con el fin de eliminar las sales contenidas en ésta. La destilación se basa en la diferencia de los puntos de ebullición de sus componentes. Se calienta la solución y se concentran los vapores, la sustancia que tiene menor punto de ebullición (más volátil9 se convierta en vapor antes que la otra, ésta primera sustancia se hace pasar al condensador para llevarla a estado líquido. (Figura 3).
CRISTALIZACIÓN
En éste proceso se utilizan los puntos de solidificación, la solución se enfría hasta que uno de sus componentes alcance el punto de solidificación, y se cristalice. Se emplea además para purificar sólidos, disolviendo un sólido impuro en el disolvente adecuado en caliente. Al bajar la temperatura, el primer sólido se cristaliza, con lo cual quedará libre de impurezas.
MAGNETISMO
Se vale de las propiedades magnéticas de algunos materiales. Se emplea para separar mezclas en donde uno de sus componentes es magnético, por ejemplo, para separar el hierro del mineral llamado magnetita (Fe3O4). (Figura4).
CROMATOGRAFÍA
Se basa en la diferente absorción y adsorción de algunos materiales que ejercen sobre los componentes de la solución. Hay varias clases de Cromatografía, de columna, de capa delgada y de papel etc.
TAMIZADO:
Procedimiento mecánico empleado para separar mezclas de sólidos, cuyas partículas tienen distinto tamaño. Se utiliza un tamiz, aparato que consta de tres partes: el cedazo, el recipiente y la tapa; los tamices se clasifican por el numero de mayas que lleve el cedazo por centímetro cuadrado. Al agitar el tamiz las partículas van atravesando, según su tamaño, los orificios del cedazo.
Este método se utiliza para análisis de la textura del suelo para separar arena fina de la gruesa, arena del afreso etc.
CRISTALIZACION
Es el método no solo de separación de sólidos, sino de purificación de sustancias; se basa en la diferencia de los puntos de solidificación de los componentes de la mezcla. El soluble impuro se disuelve en un solvente adecuado hasta saturación, en cliente; se deja enfriar la solución lentamente para que se produzca la cristalización. Se separa los cristales por filtración, se lavan con solvente puro y se dejan secar si algunas impurezas cristalizan con la sustancia problema, se recurre a una recristalización
PROCEDIMIENTO
Procedimiento del Tamizado:
En el proceso de separación del tamizado utilizamos arena con piedras; tomamos la arena y la colocamos en el colador comenzamos a batir hasta que por debajo del tamizado comenzó a salir la misma arena pero más pura o fina y dentro del Tamizado quedaron las piedras. Y este procedimiento se repitió hasta cuando la arena salió perfectamente fina.
Procedimiento de Destilación:
Armamos el montaje respectivo del método de DISTALICIÓN que consta de las siguientes partes: Balón con Desprendimiento, Corchos, Mangueras (2), un condensador, Mecheros (3), Beaker (600ml), una Pinza, Una Pinza con anillo y permanganato de sodio.
Colocamos 100ml de agua en el balón con el permanganato de sodio(paso 1) prendimos los mecheros, en una de las mangueras la conectamos al suministro de agua (Paso 2) y la dejamos abierta hasta cuando sé el procedimiento de destilación; y por la otra manguera salía el agua (Paso 3).
Cuando llego a su punto de ebullición “92°c” (Paso 4) el vapor comenzó a entrar al condensador, empezaba de claro a oscuro hasta llegar al otro extremo totalmente claro (Paso 5); y es cuando se termina la Destilación (Resultado).
MATERIAL
-
Carbonato de potasio
-
Arena
-
Balón de destilación
-
Mechero de alcohol
-
Destilador
-
Vaso de precipitado
-
Agua
-
Pinzas
-
Soporte Universal
GRAFICAS:
Decantación Figura N° 1
Filtración Figura N° 2
Destilación Figura N° 3
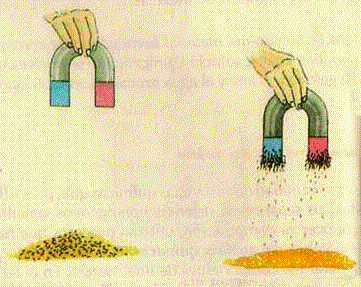
Magnetismo Figura N° 4
CUESTIONARIO
¿Cuales de las siguientes sustancias son sustancias puras?
-
10g de Azúcar
-
1litro de Limonada
-
500 ml de alcohol (R-OH)
-
1 lb de sal (NaCl)
Respuesta:
-
500 ml de alcohol (R-OH)
-
1 lb de sal (NaCl)
¿Cómo podría separa cada una de éstas mezclas?
-
El Azúcar se podría separar aprovechando la fácil cristalización de éstos compuestos.
-
La limonada se podría separa utilizando la cromatografia, la destilación, o la cristalización fraccionada.
-
La sal podría ser separada mediante electrólisis.
¿Explica de las siguientes sustancias cuáles son Homogéneas y cuáles heterogéneas?
-
Agua y tinta Mezcla Homogénea
-
Agua y arena Mezcla Heterogénea
-
Agua y sal Mezcla Heterogénea
-
Agua y Azúcar Mezcla Heterogénea
-
Agua y alcohol Mezcla Homogénea
Explique:
¿Qué se hace la tinta, la sal, el azúcar y el alcohol?
¿Se desaparecen?
No. La tinta, la sal, al azúcar y el alcohol se disuelven en el agua, ya que el agua hace el papel de disolvente, y el agua, la sal y el alcohol, haría el pape de disolvente, y el agua, la sal y el alcohol, haría el papel de soluto, por ende, generaría una mezcla Homogénea.
DISOLUCIONES
En química, mezcla homogéneas de dos o mas sustancias. La sustancia presente en mayor cantidad suele recibir el nombre de disolvente, y a la de menor cantidad se le llama soluto y es la sustancia disuelta.
El soluto puede ser gas, liquido o un sólido, y el disolvente puede ser también un gas, un liquido o un sólido. El agua con gas es un ejemplo de un gas (dióxido de carbono) disuelto en un liquido (agua). Las mezclas de gases, como ocurre en la atmósfera, son disoluciones. Las disoluciones verdaderas se diferencian de las disoluciones coloidales y de las suspenciones en que las partículas del soluto son de tamaño molecular, y se encuentran dispersas entre las moléculas del disolvente. Observadas a través del microscopio, las disoluciones aparecen homogéneas y el soluto no puede separarse por filtración. Las sales, ácidos y bases se ionizan al disolvente en el agua
BIBLIOGRAFÍA
POVEDA JULIO CESAR, Química 10, Editorial Educar Editores.
CASTRO SÁNCHEZ NIDIA, Consultor Estudiantil tomo 2, Editorial Prolibros.
Paso 2
Paso 1
Paso 3
Paso 4
Paso 5
Resultado
De Claro a Oscuro
Descargar
| Enviado por: | Mane |
| Idioma: | castellano |
| País: | Colombia |
