Química
Recuperación del Diacetato de Etilenglicol
RECUPERACIÓN DEL REACTIVO: DIACETATO DE ETILENGLICOL

OBJETIVO.
Elaborar un método para la recuperación del diacetato de etilenglicol (C6H10O4) para su reuso en el desarrollo de nuevas prácticas de la asignatura Ingeniería de Reactores impartida en el laboratorio de “Ingeniería Química”. Dicha metodología estará basada en una cultura de recuperación limpia que pretenderá fomentar dicha conciencia ecológica en la formación de los futuros Ingenieros; además de generar ahorros en los recursos económicos asignados a la Facultad de Química para la adquisición de reactivos.
GENERALIDADES
Concepto de Éster.
Los ésteres son las sales alcohólicas, tanto de los ácidos inorgánicos como de los ácidos orgánicos. Los ésteres líquidos se han empleado como sustitutos de esencias de algunas frutas debido a su olor agradable.
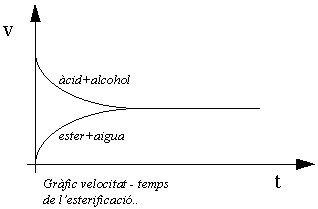
Si se pone en contacto una base inorgánica con un ácido inorgánico, se forman agua y la sal correspondiente, de modo cuantitativo. En cambio, si se mezcla un alcohol con un ácido orgánico, la reacción no se verifica de manera sencilla y completa como lo indica la ecuación de abajo. La velocidad de formación de la sal alcohólica disminuye continuamente hasta llegar a un estado en el que, aparentemente, ya no hay formación del éster; el sistema se encuentra en estado de equilibrio. Frecuentemente el equilibrio es desfavorable para la formación de la sal.
La Reacción de Esterificación.
Definiendo sintéticamente la esterificación podríamos decir que se trata de la formación de un éster por la unión de un alcohol y un ácido, mediante una reacción que es lenta a temperatura ambiente, reversible y que libera agua. Esta reacción es una deshidratación en la cual el ácido actúa como catalizador y deshidratante.
ácido + alcohol -> ÉSTER+ agua
La reacción general de este proceso es:
R-CO-OH + R'-OH ! R-CO-OR' + H2O
Se ha formulado la reacción del ácido con el alcohol con el signo de reversibilidad, porque efectivamente el agua formada actúa sobre el éster hidrolizándolo y recuperando el ácido y el alcohol.
Se puede favorecer la esterificación empleando un exceso de alguno de los reactivos o eliminando alguno de los productos; a veces, es suficiente emplear un gran exceso de alcohol para asegurarse un buen rendimiento en éster; otras veces, hay que añadir un líquido como el benceno o el tetracloruro de carbono a la mezcla para eliminar el agua destilándola en forma de un azeótropo de bajo punto de ebullición. Para acelerar la reacción hay que utilizar pequeñas cantidades de un catalizador que puede ser ácido sulfúrico, ácido clorhídrico o bencensulfónico, y elevar la temperatura en la reacción.
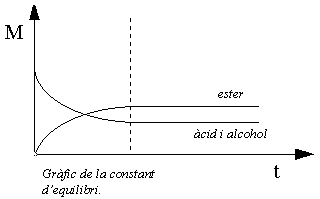
En el año 1862, M. P. E. Berthelot, mediante su estudio del sistema alcohol etílico-ácido acético, demostró que la esterificación es un equilibrio. Si reaccionan 1 mol de alcohol etílico y 1 mol de ácido acético, al lograr el equilibrio, estan presentes, a temperatura ambiente, 2/3 de mol de acetato de etilo y 2/3 de mol de agua, junto con 1/3 de mol de alcohol y 1/3 de mol de ácido. Estos valores pueden sustituirse en la ecuación de equilibrio:
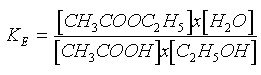
donde KE es la constante de equilibrio y los corchetes indican las concentraciones del reactivo (sea el reactivo que sea) en moles por litro. De esta forma se obtiene, para KE, el valor 4. Siempre que la temperatura no se altere voluntariamente, este valor es constante para el alcohol etílico y el ácido acético; independientemente de las concentraciones iniciales de ácido y de alcohol, el valor 4 se mantiene siempre constante.
Cinética
La velocidad de esterificación depende de la catálisis (aplicación de un ácido fuerte); el método habitual de conseguir más rápidamente el equilibrio consiste en la adición de un 3% (en masa) de cloruro de hidrógeno anhidro, ácido sulfúrico concentrado o trifluoruro de boro. Si se calientan los reactivos en presencia de un catalizador, generalmente se puede alcanzar el equilibrio en 2 o 3 horas, a no ser que intervenga un ácido aromático con sustituyentes en las dos posiciones orto respecto al grupo carboxilo. V.Meyer (1894) demostró que estos ácidos tienen un impedimento tan acusado para la reacción con los alcoholes que la esterificación directa es impracticable. Actualmente disponemos de un método general apropiado para esterificar aquellos ácidos impedidos (M.S.Newman, 1941) que consiste en disolver primeramente el ácido aromático sustituido por ácido sulfúrico al 100% y, después, verter la solución en el alcohol de que se trate. De esta manera, obtenemos el éster, con un buen rendimiento, en pocos minutos.
Mecanismo
Mediante la utilización de oxígeno isotópico (18O) se ha demostrado que en la reacción de un ácido con un alcohol primario o secundario, el oxígeno del éster procede del alcohol y el oxígeno del ácido se separa formando agua, ya que el éster formado es radiactivo (contiene 18O). Además, en una esterificación ordinaria, catalizada por ácidos, la velocidad de reacción depende de las concentraciones del ácido carboxílico y del alcohol. Estas observaciones obedecen al siguiente esquema por el mecanismo:

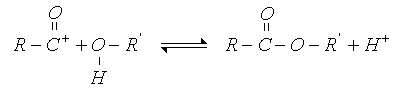
INTRODUCCIÓN.
De manera particular, la reacción que fue de nuestro interés:
![]()
Ac. Acético Etilenglicol Diacetato etilenglicol Monoacetato etilenglicol
Conforme a las generalidades anteriormente establecidas, el reactivo utilizado en exceso para incrementar el rendimiento de la formación del DAEG (diacetato de etilenglicol), fue el ácido acético, que a su vez elimina el subproducto no deseado: monoacetato de etilenglicol.. También por otra parte , el agua formada durante la reacción será eliminada por destilación, lo cuál se corrobora más adelante.
El diacetato de etilenglicol se ocupa como reactivo en el 50% de las prácticas de el laboratorio de Ingeniería de reactores. Las prácticas en las cuáles se lleva a cabo una reacción que involucre al diacetato de etilenglicol, son las siguientes:
DEFINICIÓN DE UN SISTEMA REACCIONANTE.
Objetivo. Establecer el esquema de reacción de hidrólisis del DAEG (diacetato de etilenglicol).
Procedimiento. Llevar a cabo la reacción a 80°C y a la temperatura de ebullición de la muestra.
EFECTO DEL CATALIZADOR SOBRE LA RAPIDEZ DE LA REACCIÓN.
Objetivo: Hallar la concentración del catalizador necesaria para obtener un mejor rendimiento de la reacción de hidrólisis del diacetato de etilenglicol.
Debido a su amplio uso en este laboratorio para fines educativos, un método de recuperación del DAEG es una muy buena opción ya que el costo de este reactivo es alrededor de $130.00 por Litro; la cantidad de DAEG utilizado en cada reacción es aproximadamente ½ L, por lo que este método de recuperación del DAEG representa un excelente ahorro si consideramos que existen 8 grupos de Laboratorio correspondiente a esta asignatura (I.R. clave 1813), y en cada grupo se forman 5 equipos de 3 alumnos cada uno lo cual nos daría un total de 20 L de DAEG utilizados cada semana y a su vez representaría un gasto de $2,600.00 semanales.
TÉCNICAS ANÁLISIS UTILIZADAS.
-
CROMATOGRAFÍA DE GASES.
-
ESPECTROMETRÍA DE INFRARROJO.
-
REFRACTOMETRÍA.
MÉTODO UTILIZADO.
Debido a que el reactivo que se iba a recuperar se encontraba en fase líquida y que es volátil, se determinó que la mejor forma de separarlo para analizar dicho reactivo durante el proceso de recuperación, por ser la más rápida y confiable era por medio de cromatografía de gases.
El proceso de separación se refleja en una gráfica llamada cromatograma, que es representada como una serie de picos. Las áreas descritas por dichos picos del cromatograma es posible convertirlas en medidas cuantitativas, comparándolas sencillamente con gráficas estándar del compuesto apropiado.
Caracterización del Residuo de Ésteres hidrolizados.
De los resultados arrojados por este análisis preeliminar realizado a los residuos y apoyados en el orden en que aparecen los reactivos en la ecuación representativa de la reacción de esterificación de nuestro interés, se obtuvo que la composición promedio porcentual de la mezcla de residuos era:
| REACTIVO | % (V) | PRODUCTO | % (V) |
| Ácido Acético | 20.6321 | DAEG | 40.2848 |
| Etilenglicol | 10.7242 | Monoacetato etilenglicol | 25.3588 |
Como se puede apreciar no se contempla ni el agua ni el ácido sulfúrico (catalizador) en esta caracterización y es debido a que no son detectables en este cromatógrafo.
Regeneración de Residuos por Esterificación
Una vez establecido lo anterior, se procedió a establecer la forma en que debería recuperarse el reactivo de interés y los equipos a utilizar que mejor se adaptaran a las condiciones que se requerían controlar para poder realizar la recuperación.
Se decidió que la recuperación se realizaría en el reactor PIGNAT instalado en el laboratorio debido a que este reactor al tener un control de tipo automatizado nos permitía controlar la temperatura a la que se realizaría la reacción de purificación, también el control de la presión se podía realizar, para poder generar un vacío y así abatir las presiones de vapor de los reactivos que intervenían en la reacción y por lo tanto por disminuir el punto de ebullición de los mismos y mantener una temperatura de reacción menor, este reactor nos permitía además ir separando el agua que se producía durante la reacción en el momento en que lo hacía, mediante destilación con reflujo.
Entonces , al hacer las aclaraciones anteriores, describiremos a continuación el procedimiento utilizado para esta recuperación:
Primero se introduce la mezcla de reacción en el reactor PIGNAT, posteriormente se le añade Ácido Acético en exceso para desplazar la reacción hacia la formación del diéster (DAEG) y evitar la formación del éster no deseado(monoacetato); de esta forma se controló la dirección de la reacción.
Con los controles automáticos del reactor se manipuló la presión de vacío, de tal forma que la temperatura a la que se realizó fuera de 108 °C, tanto para promover la formación de DAEG, destilar el agua formada, como para facilitar la reacción ayudando en su labor al catalizador (H2SO4) al acelerar la misma; de igual manera se controló la destilación con un reflujo de 2 a 1 para optimizar la separación de agua y la recuperación del DAEG. Durante el transcurso de la reacción, al ir analizando el grado de avance de la formación del diéster mediante la cromatografía de gases se fue añadiendo ácido acético a la reacción para los fines antes establecidos; y se procedió así hasta la total formación del DAEG y la desaparición de los otros reactivos involucrados.
Caracterización y Purificación del Producto.
Debido a que, del análisis realizado a la mezcla de reacción, una vez terminado el proceso de recuperación, se observo que la composición promedio era de: 98.49 % de DAEG y 1.51 % de Ácido Acético.
Como es sabido, el Índice de refracción es sumamente valioso en los análisis cualitativos, además cuando se obtienen en una reacción 2 productos (como en este caso DAEG y Monoacetato de Etilenglicol), vale la pena seguir un método sistemático de medición de una constante física como lo es el nD (índice refracción) en conjunción con una técnica analítica como IR ( Espectrometría de Infrarrojo ) utilizada para detectar grupos funcionales de una sustancia practicamente pura.
Se procedió entonces a la purificación del diéster, esta se realizó en un reactor Kimax que nos permitió realizar esta operación mediante una destilación simple, debido a la diferencia en los puntos de ebullición de estos compuestos siendo para DAEG entre 186-187 °C , y para el Ac. Acético en el rango 116-118 °C.
Posteriormente se corrió el espectro de Infrarrojo de la substancia obtenida para identificar el grupo funcional y corroborar que efectivamente el producto obtenido era DAEG; además se determinó su índice de refracción (nD) que sirvió como parámetro del grado de pureza del compuesto recuperado.
Condiciones muestreo
Muestra líquida 1 ml
Espesor celda 20 material CsBr (Cesio y Bromo)
Longitud onda radiación láser 5145 A°
Flux radiación 1500 mW
Amplificador corriente directa CD
Tipo cátodo S20
Vel. Registro Vel. Papel Tiempo cte
Condiciones multiplicador 50 cm/min 1 cm/min 0.5 s
| nD20 teórico | nD20 experimental * | |
| DAEG | 1.4152 | 1.411 |
* Medición realizada en un refractómetro de Abbé.
Resultados
Los resultados obtenidos que aquí se presentan, se hacen en forma porcentual debido a que el proceso que se realizó fue de recuperación, por lo cual al hacerlo en esa forma se puede visualizar mejor el grado de recuperación del diéster logrado.
Discusión de los resultados
Como podemos observar, en los datos presentados de los resultados obtenidos después del proceso de recuperación del reactivo DAEG, se puede concluir que se recuperó un 58.2052 % del diéster (98.49final-40.2848 inicial) presente en la mezcla de reacción, lo cual se puede considerar como un muy buen grado de recuperación tomando en cuenta que se trataba de una reacción que en condiciones estándares de Temperatura y Presión, es una reacción lenta y que tiende a desplazarse más hacia la regeneración del ácido acético y el etilenglicol, además de la formación del subproducto no deseado: monoacetato de etilenglicol. De acuerdo al valor del índice de refracción experimental obtenido y comparado con el teórico se puede corroborar que el compuesto obtenido efectivamente es DAEG que aunado al espectro de infrarrojo nos da la certeza esperada.
Se puede también decir que la metodología y las estrategias comtempladas durante este proceso fueron las adecuadas ya que al generar una Pvacío y abatir la presión de valor de los reactivos se disminuyó la temperatura de operación y con la incorporación de un catalizador (H2SO4) se pudo también disminuir el tiempo de reacción por lo cual, se logró obtener de manera aproximada y en promedio 3 L de DAEG por cada hora de operación del sistema. Las únicas consideraciones adicionales son que: al manejar líquidos expandibles y Pvacío hay que observar las debidas precauciones en el uso y operación del reactor PIGNAT y los reactivos en general, para evitar provocar alguna falla en el sistema y por lo tanto algún accidente, se requiere por lo tanto exclusivamente de conocer y aplicar las medidas básicas de seguridad industrial y manejo de reactivos peligrosos.
CONCLUSIONES
Desde el punto de vista del beneficio social que representa este proyecto podemos iniciar diciendo que al recuperar este tipo de reactivo se genera un beneficio de tipo ambiental (protección) ya que al eliminar residuos peligrosos evitamos que los mismos contaminen el medio ambiente ya que no son desechados en el sistema de drenaje o almacenados en bidones para su posterior eliminación por otro medio.
Cabe mencionar que este método de recuperación estaría conforme a la normatividad correspondiente para este tipo de desechos (NOM-010-STPS, acerca de manejo de residuos peligrosos); que establece los límites permisibles siguientes:
Tabla I.1
| No | Substancia | No CAS | Connotación | LMPE-PPT | L |
| ppm-mg/m3 | |||||
| 22 | Ac Acético | 64-19-7 | - | 10 - 25 | - |
| 279 | Etilenglicol | 107-21-1 | P,A4 | - | - |
| 31 | H2SO4 | 7446-09-5 | A2 | -1 | |
| - | DAEG | - | - | - | - |
| - | Monoacetato | - | - | - | - |
CAS. Iniciales del nombre en inglés del servicio de información de sustancias químicas de los E.U.A (Chemical Abstract Service).
LMPE. Límite máximo permisible de exposición( ppm).
A2. Carcinógeno humano sospechoso.
A4. No clasificado como carcinógeno en humano.
P. Límite máximo permisible de exposición pico.
Por otra parte al ser reciclados dichos reactivos para su posterior reutilización en nuevas prácticas de la asignatura correspondiente se genera un ahorro en costos, ya que no es necesario solicitar más reactivo a las compañías que lo surten como se analizó anteriormente. Desde el punto de vista profesional es proyecto ayudará para la formación de futuros ingenieros químicos con una conciencia de recuperación de residuos y una cultura de reciclaje limpio, a la vez que les será útil para poder ellos mismos establecer la metodología más conveniente para determinada problemática que se les presente en el transcurso de su desarrollo ya como profesionistas del área de Ingeniería Química.UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO
FACULTAD DE QUÍMICA
ANALÍTICA II
PROYECTO
RECUPERACIÓN DEL REACTIVO: DIACETATO DE ETILENGLICOL.
-
Reactor de acero inoxidable de acero encamisado, a circulación de aceite.
-
Abastecimiento.
-
Sonda termométrica de acero inoxidable.
-
Columna de rectificación.
-
Condensador a reflujo.
-
Válvula de reflujo.
-
Decantadora azeotrópica.
9, 10, 11, 12, 13 Válvulas.
-
Móvil de agitación.
-
Vacíado.
-
Tubería de abastecimiento
-
Ajuste de altura de la interfase en la decantadora.
-
Recibidores.
6
15
1
10
9
8
11
12
16
18
5
4
2
13
7
21
19
4
5
6
7
8
9
10
11
12
13
15
16
17
18
19
21
Descargar
| Enviado por: | Chumacero |
| Idioma: | catalán |
| País: | México |
