Química
Química
1) ¿Qué son los iones? ¿Cómo se forman?
El átomo que tiene cargas eléctricas es un Ion. Puede haber obtenido esta carga por perder o ganar electrones, o por capturar algunos electrones extra, haciendo la carga negativa. El proceso de convertir un átomo en un ión se llama ionización (de aquí el término “energía de ionización”).
Los iones se forman en muchas reacciones químicas. La ionización también puede ser causada por radiaciones, tal como fotones de alta energía o partículas cargadas. La clave es impactar los átomos con suficiente energía para sacudir los electrones a su alrededor. 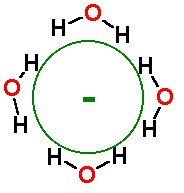
2) Averigua como funciona un conductímetro y el mecanismo por el cual las sustancias transmiten la corriente eléctrica.
Un aparato que permite ver si una sustancia conduce o no conduce la electricidad.
3)¿Por qué algunas sustancias que se disuelven en agua como por ejemplo, el azúcar o el alcohol, no son capaces de transmitir la corriente eléctrica?
Porque el agua no ioniza estas sustancias (azúcar y alcohol), puesto que los iones son átomos cargados eléctricamente, al ser una sustancia ionizada, estos (los iones) transmiten su electricidad a la sustancia, pero como estas no están ionizadas, no están cargadas, por lo tanto, no pueden transmitir electricidad.
4) ¿Qué son los electrolitos?
Es una solución o sustancia disuelta que consta de varios químicos que pueden llevar cargas eléctricas. Los electrolitos están presentes en la sangre como ácidos, bases y sales (como sodio, calcio, potasio, cloro, magnesio y bicarbonato) y se pueden medir mediante estudios de laboratorio en suero.
5) ¿ De qué depende que una sustancia conduzca más o menos la corriente eléctrica?
De qué tan ionizada esté. De que tenga polaridad.
6) ¿Cómo se define operacionalmente el PH?
Definido en 1909, por el químico danés Sorensen como el potencial hidrógeno (pH) como el logarítmo negativo de la concentración molar (más exactamente de la actividad molar) de los iones hidrógeno. Esto es:
![]()
El término pH ha sido universalmente utilizado por la facilidad de su uso, evitando asi el manejo de cifras largas y complejas. El pH típicamente va de 0 a 14, siendo los pH menores que 7 ácidos, y los mayores, básicos. El pH = 7 indica la neutralidad de la disolución. El valor del pH se puede medir de forma precisa mediante un pHmetro, un instrumento que mide la diferencia de potencial entre dos electrodos: un electrodo de referencia (generalmente de plata/cloruro de plata) y un electrodo de vidrio que es sensible al ión hidrógeno.
También se puede medir de forma aproximada el pH de una disolución empleando indicadores, ácidos o bases débiles que presentan diferente color según el pH. Generalmente se emplea papel indicador, que se trata de papel impregnado de una mezcla de indicadores.
7) ¿Qué importancia tiene conocer el pH de algunas sustancias?
La importancia, es que sirve para conocer su nivel de acidez o básidez, porque en algunos casos las sustancias son muy ácidas y pueden ser dañinos para algún tipo de piel o compuesto.
8)¿ Qué es una sustancia ácida y una básica o alcalina?
La sustancia ácida es una sustancia que tiene el pH menor a 7. En la sustancia básica o alcalina la sustancia tiene un pH mayor a 7.
9) ¿Por qué el agua pura es considerada solvente unirvesal?
Gracias a la composición pura del agua, ésta no discrimina al disolver distintos tipos de sustancias.
10) ¿Qué es la solubilidad de una sustancia?
Es la capacidad que tiene una sustancia de disolverse en el solvente (como por ejemplo, el agua).
11) ¿De qué factores depende el grado de solubilidad de las sustancias químicas?
De la concentración, la densidad y polaridad.
12) ¿Cómo se define el punto de fusión y ebullición de una sustancia?
El punto de ebullición es cuando la presión de vapor iguala a la presión atmosférica ( cuando pasa del estado liquido a gas), mientras el punto de fusión corresponde a el equilibrio entre la fase sólida y liquida.
13) ¿ De qué depende que una sustancia tenga mayor o menor tº de fusión y ebullición?
Depende de distintos factores:
-
si la sustancia está compuesta de un soluto y un solvente.
-
del ambiente.
-
de la temperatura y presión.
14) ¿Qué son las propiedades coligativas?
Son las propiedades que adquiere el soluto al ser aplicado a distintos tipos de procesos, como:
-
Punto de ebullición.
-
Punto de evaporación.
-
Presión de vapor.
-
Osmosis.
15) ¿ Por qué se agrega sal al agua para despejar las calles congeladas?
Porque la sal, mezclada con el agua, provocan que el hielo, se derrita más rápidamente, debido a que se produce un “Descenso Crioscópico”
16) ¿Por qué algunas sustancias hacen bajar la tº del agua mientras que otras hacen aumentar su tº?
Porque la distinta composición química hace variar la tº del agua. Si una sustancia tiene más cantidad de NaCl (sales) el agua se va a enfriar y si no tiene muchas sales el agua se va a calentar. (influye en la tº de solidificación, fusión, etc).
17) ¿ Cómo se explica la capacidad del agua para dilatarse?
El agua es la única sustancia conocida que al pasar del estado sólido a líquido disminuye su volumen. Este fenómeno de contracción del agua se produce en el rango que va desde los 0ºC a los 4ºC, una vez que la tº supera los 4ºC el agua vuelve a dilatarse normalmente, esto hace que el agua en estado sólido sea menos densa que el agua líquida a menos de 4 ºC .
18) ¿Qué importancia tiene el fenómeno anómalo del agua que al congelarse se dilata?
Tiene mucha importancia, ya que gracias a esto, el hielo flota sobre el agua. Si no ocurriese así, el hielo estaría bajo el agua, y mataría a la fauna y flora por el frío.
19) ¿Por qué el agua es considerada un termorregulador de la temperatura? ¿Con qué propiedad física se asocia?
Porque el agua es capaz de transferir y absorber el calor, ejemplo:
Si uno tiene 2 vasos, uno con agua cálida y otro con agua fría, el vaso con agua fría absorbería el calor del otro vaso hasta alcanzar la igualdad de tº.
Se asocia a la propiedad de
20) ¿ Qué es la dureza del agua?
La dureza de las aguas naturales es producida sobre todo por las sales de calcio y magnesio, y en menor proporción por el hierro, el aluminio y otros metales. La que es ocasionada por los bicarbonatos y carbonatos de calcio y magnesio se denomina dureza temporal. La dureza residual se conoce como dureza no carbónica o permanente.
21) ¿Por qué el jabón se corta y forma grumos con las aguas duras?
Por que el jabón es un ácido graso y se saponifica con las sales que contiene el agua y eso hace que se formen grumos y no burbujas.
22) ¿Qué efectos produce la dureza del agua en el organismo, los procesos industriales y domésticos?
Causa problemas renales, porque el sarro se acumula en el riñón, y también pueden dar origen a los “cálculos”
23)¿ Qué mecanismos existen para ablandar las aguas duras?
La destilación (Un aparato, que quita todas las sales minerales. Puede ser grande o pequeño).
24) Compara la cantidad de carbonato de calcio presente en cada tipo de agua.
25) averigua los parámetros normales permitidos por el ministerio de salud para calidad del agua potable para región.
Descargar
| Enviado por: | Altariel |
| Idioma: | castellano |
| País: | Chile |
