Ciencias del Mar
Química
Prácticas fundamentales de química
Índice
Práctica 1
Técnicas de separación: filtración y cristalización
Práctica 2
Técnicas de separación: extracción
Práctica 3
Técnicas de separación: destilación
Práctica 4
Preparación de disoluciones: medidas de pH
Práctica 5
Práctica 6
Práctica 7
Práctica 8
Práctica 9
Práctica 10
Practica nº 1
Filtración y cristalización
Esta practica consiste en eliminar las impurezas de una sal mediante una extracción.
Los materiales necesarios son:
-

Probeta de 25 ml -
Embudo
-
Vasos de precipitados
-
Cristalizador
-
Embudo
-
Mortero
-
Crisol de porcelana
-
Placa calefactora
-
Varilla de vidrio cristalizador utilizado para la formación de cristales de sulfato de cobre
Para ello pesamos 5 gr de sulfato de cobre pentahidratado y los disolvemos en 20 cm³ de agua destilada, después filtramos la disolución y la introducimos en un cristalizador.
Pudimos observar a la semana que ya se podían apreciar pequeños cristalitos azules, a las varias semanas vimos un cristal de unos 8 cm de largo.
Cu2SO4 + 5H2O Cu2SO4
CU
S 313
O
m
n =
PM
5
n = = 0,0012
313
m = n · PM mCu2SO4 = 0,0012 · 223 = gr
AL2 (SO4)3 · 18H2O + K2SO4 + 6H2O 2AL K (SO4)2 · 12H2O
Cuestiones
1.- Si reducimos a polvo 5 gramos de sulfato de cobre pentahidratado, y lo dejamos en la estufa durante tres horas a 110 grados hasta la deshidratación total, ¿cuánto pesará el residuo que sacamos de la estufa?
Cu2SO4 + 5H2O Cu2SO4
PM = 63,5 + 32 + (4 · 16) + (5· 18) = 249,5
m 5gr
n = n = = 0,02 moles
PM 249,5
mf = n · PMf mf = 0,02 · 159,5 = 3,19 gr de Cu2SO4
Practica nº 2
Extracción
La extracción es el proceso por el cual somos capaces de separar dos elementos juntos para obtener esos elementos separados en estado puro. Hay dos formas de extracción; la simple y la triple, comprobamos según la experiencia en laboratorio que la extracción triple es más eficaz.
Los materiales necesarios para la realización de la técnica son:
-
Aro, pinzas y soporte
-
Embudo de decantación de 50 ó 100 ml
-
Probeta de 25 ó 50 ml
-
Pipeta de 10 ml
-
3 vasos de precipitado
Extracción simple:
Vertimos 25 ml de una disolución acuosa de yodo en un embudo de decantación y añadimos 6 ml de tetracloruro de carbono, produciéndose una mezcla rosácea. Agitamos, dejando salir los gases con frecuencia y comprobamos que las disoluciones se separan por diferencia de densidades.
Abriendo la llave del embudo podemos separar sin dificultad ambas disoluciones. Obteniendo un vaso de precipitado con una disolución rosácea y en otro vaso una disolución transparente aunque con motas rosáceas claramente visibles.
Extracción triple:
Vertimos nuevamente 25 ml de la disolución acuosa de yodo en el embudo de decantación, y esta vez añadimos el tetracloruro de carbono en etapas tres etapas de 2 ml cada una.
Al separar ambas disoluciones comprobamos a simple vista que tenemos una disolución rosácea y otra disolución transparente y sin motas rosáceas
Para comprobar cual de las dos extracciones es más eficaz ponemos 20 ml de la disolución acuosa de yodo en un vaso de precipitado, y comprobamos con las otras dos disoluciones acuosas resultantes del laboratorio. A simple vista podemos apreciar cual de las extracciones a sido la mas eficaz pero aún así lo comprobamos. Para ello añadimos unas gotas de almidón a cada una de ellas.
La primera se queda azul por el almidón, ello nos indica que tiene una pequeña cantidad de yodo, en la segunda el almidón no reacciona y la disolución permanece del mismo color.
Cuestiones:
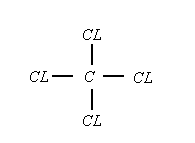
¿Qué disolvente es mas denso: el agua o el tetracloruro de carbono? Razonar en base a la experiencia.
El tetracloruro
¿Por qué se disuelve mejor el yodo en tetracloruro de carbono que en el agua?.
El agua es una molécula con un enlace covalente polar, mientras que el tetracloruro de carbono y el yodo son moléculas con enlace covalente apolar. Se ha comprobado que moléculas polares entre sí disuelven muy bien, y moléculas apolares entre si también disuelven muy bien, en cambio si combinas una molécula polar con una apolar no se disuelven. Por tanto el tetracloruro de carbono y el yodo se disuelven.
¿Qué extracción ha sido más eficaz? ¿Por qué?.
La extracción ha sido más eficaz en la triple extracción. Mediante la practica hemos podido ver que el agua de la extracción triple es mucho mas transparente y pura que en la extracción simple, donde aun se aprecian restos de la disolución violácea. Teóricamente podemos comprobar también que la extracción va a ser mas pura en la extracción triple gracias al coeficiente de reparto:
C1/C2 = S1/S2 = K
Este proceso de extracción es muy usual en la industria debido a que es muy eficaz. Mediante extracciones múltiples se consigue separar diferentes sustancias y obtener el disolvente prácticamente puro otra vez.
Observamos que en los 20ml puros se queda de color negro al añadir almidón, el agua sobrante de la extracción simple es de color azul, y en el sobrante de la triple extracción no ay ningún cambio puesto que no hay yodo.
Esta prueba del almidón nos corrobora aún mas que la extracción triple es mucho mas eficaz utilizando la misma cantidad de productos.
Practica nº 3
Destilación
La técnica de la destilación se usa para separar dos liquidos, para ello utilizamos un aparato de destilación simple y aumentamos la temperatura haciendo que se separen los dos elementos.
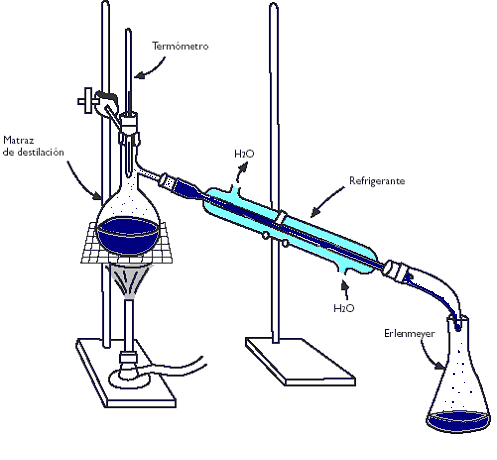
Los materiales necesarios son:
-
Aparato para destilación simple
-
Probeta de 250 ml
-
Erlenmeyer de 250 ml
-
Tubos de ensayo y gradilla
-
Manta calefactora
Los reactivos que usamos son:
-
Agua de mar, es el reactivo que vamos a destilar
-
Disolución de nitrato de plata, para ver si hay cloruro en el agua
-
Disolución de cloruro de bario, para ver si hay sulfato en el agua.
-
Reactivo de Kolfthoff
Esta practica como ya hemos dicho consiste en obtener agua destilada apartir de agua de mar, para ello usamos el aparato de destilación simple, dibujado sobre esta página. Introducimos 150ml de agua de mar en el matraz y le añadimos un trocito de porcelana para favorecer la ebullición. Con la manta calefactora le damos calor al agua para que empiece a hervir. Observamos que el punto de ebullición permanece durante todo el tiempo constante a 100,5ºC.
El vapor de agua sube por el matraz y se condensa en las paredes del tubo hasta llegar al erlenmeyer. Hemos despreciado los 5 primeros mililitros puesto que pueden contener restos pertenecientes al aparato de destilación.
Eficacia:
Para comprobar la eficacia de esta practica analizamos el agua obtenida, el agua de mar, agua de grifo, y agua destilada de laboratorio. Vamos a analizar la presencia de cloro, sodio y sulfato. No vamos a poder comprobar la existencia de sodio por la falta de las disoluciones necesarias.
Cloro: ponemos en cuatro tubos de ensayo un mililitro de cada una de las “aguas”. Después añadimos tres gotas de nitrato de plata en cada uno de ellas. La turbidez blanca nos indica cloruro.
Sulfato: ponemos otra vez en cuatro tubos de ensayo un mililitro de cada una de las “aguas” y le añadimos cinco gotas de reactivo de kolthoff. Si aparece un precipitado amarillo indica la presencia de sodio.
Presento los diferentes resultados en la tabla adjunta:
| | AGUA DE MAR | AGUA DE GRIFO | NUESTRO DESTILADO | AGUA DESTILADA LABORATORIO | PRIMEROS 5ml DESPRECIADOS |
| CLORURO | Mucho | Muchísimo | Negativo | Negativo | Muy alta concentración de cloruro |
| SODIO | - | - | - | - | |
| SULFATO | Mucha concentración | Pueden verse algunas rayas muy finas | Negativo | Negativo | No hemos comparado |
Cuestiones:
1.- ¿Por qué se eliminan los cinco primeros mililitros destilados?
Porque pueden arrastrar ciertas impurezas de cloruro, o de restos de impurezas en el aparato de destilación.
2.- Escribir las ecuaciones químicas correspondientes a las reacciones que se han producido en los ensayos de cloruro y sulfato.
Cl + Ag* Ag Cl
SO4 + Ba ** Ba SO4
Si hay cloro hay sodio por el NaCl, si hemos eliminado el Cl hemos eliminado el Na.
Agua grifo: H20 + pocas impurezas + Cl H20 turbia
H20 + pocas impurezas + Ba ** H20 turbia
Agua de mar: H20 impura + Cl H20 muy turbia
H20 impura + Ba ** H20 muy turbia
Agua destilada lab.: H20 pura + Cl H20
H20 pura + Ba ** H20
Agua destilada nuestra: H20 pura + Cl H20
H20 pura + Ba ** H20
Practica nº 4
Medidas de pH
Grupo 1, acetato sódico.
1.- HCl 0,1 Molar
gr/l
M = gr = M · l · PM
PM
gr = 0,1 · 36,45 · 0,250 = 0,91125gr de HCl
Como necesito saber el volumen que tengo que coger aplico la fórmula de la densidad para hallar el volumen como incógnita:
gr = V · d 0,9125 = V · 1,185
V = 0,768 cm³
2.- Hacer 25ml de acetato sódico 0,5 M
gr = M · l · PM
PM acetato sodico = 82,04
gr = 0,5 · 82,04 · 0,025
gr = 1,0255
El papel indicador nos da un verde entre claro y oscuro, es decir entre 8 y 9 de pH.

3.- Hacer 25ml de ácido acético 0,5 M
gr = M · l · PM
PM ácido acético = 60,05 d = 1,05 gr/ cm³
gr = 0,5 · 60,05 · 0,025
gr = 0,7506
gr = V · d 0,7506 = V · 1,05
V = 0,714 cm³
El papel indicador nos da un anaranjado amarillento entre 2 y 3 de pH.
Al mezclarlos da 4,6 pH.
Comprobando la capacidad reguladora:
Adicionamos 20 ml de agua destilada y medimos un pH de
Añadimos 2ml de HCl 0,5 N y medimos un pH de
Añadimos 7ml de HCl 0,5 N y medimos un pH de
Practica nº 5
Análisis cualitativo de cationes
Lo primero que hicimos fue introducir 6cc de una disolución que nos proporcionó el profesor en un tubo de ensayo limpio y seco.
A continuación tomamos otro tubo de ensayo y le añadimos 3cc de la disolución en cuestión, junto con dos gotas de clorhídrico 2M. Agitamos y observamos que se producía un precipitado blanco en el fondo el cual no se sabía muy bien si era cuajoso o pulvurento. Apreciamos también aguas turbias.
seguimos añadiendo mas gotas de clorhídrico y agitamos asegurándonos de que la precipitación había sido total. Filtramos la muestra dejando el papel de filtro en el embudo.
Después lavamos el precipitado dos veces con 0,5 cc de agua destilada a la que le añadimos una gota de clorhídrico diluido. Unimos esas aguas de lavado con la disolución.
En nuestro proyecto al añadirle el hidróxido de amonio nos apareció un precipitado amarillo en el fondo con lo cual indica presencia de PbCl2.
En el primer tubo aparece un precipitado al añadir K2CrO4 con lo que averiguamos que también tenía plomo.
Al segundo tubo le añadimos ácido sulfúrico, produciéndose una reacción de cierta turbidez y un elevado aumento de la temperatura de la disolución.
Conclusión:
Tenemos mercurio porque el precipitado aparece negro. Tenemos plata porque a aparecido un precipitado amarillo claro de AgI prueba por lo tanto de la presencia de plata. Y al añadir cinco gotas de clorhídrico aparece una disolución turbia de color blanquecino que es otra prueba de la presencia de plata.
Tenemos la presencia de los tres cationes en la disolución inicial.
Pb** Ag* Hg**
Practica nº 7
Valoración del ácido clorhídrico con carbonato sódico
| Nº equivalentes | V proc | Normalidad practica | Volumen teórico | Normalidad teórica | |
| 1 | 1,88 · 10-3 | 35 · 10-3 | 0,05371 | 0,1 | |
| 2 | 1,877 · 10-3 | 37,2 · 10-3 | 0,05041 | 0,1 | |
| 3 | 1,883· 10-3 | 34 · 10-3 | 0,05538 | 0,1 |
Practica nº 8
Neutralización ácido-base
| Nº equivalentes | V proc | Normalidad practica | Volumen teórico | Normalidad teórica | |
| 1 | · 10-3 | · 10-3 | 0 | ||
| 2 | · 10-3 | · 10-3 | |||
| 3 | · 10-3 | · 10-3 |
Practica 9?
*Disolución 1ª:
Peso: 0,0830
Volumen gastado de permanganato: 10ml = 0,1l
0,0830
E = x2 = 1,23805 x 10 -3
134
1,238805 x 10 -3
N = =0,1238805
0,01l
*Disolución 2ª:
Peso: 0,0863
Volumen gastado de permanganato: 10,6ml = 0,0106l
0,0863
E = x2 = 1,28805 x 10 -3
134
1,28805 x 10 -3
N = =0,121
0,0106l
*Disolución 3ª:
Peso: 0,0917
Volumen gastado de permanganato: 10,2ml = 0,0102l
0,0917
E = x2 = 1,36865 x 10 -3
134
1,238805x 10 -3
N = =0,1238805
0,01l
7
Descargar
| Enviado por: | Sas87 |
| Idioma: | castellano |
| País: | España |
