Química
Química general
Introducción
En este trabajo de la asignatura de Química General II, nos hemos enfocado en distintos temas pero que tienen una base en común, “los metales”. En el principio del trabajo hablamos ampliamente sobre estos y mencionamos sus propiedades físicas y químicas, su clasificación en la tabla periódica para ir entrando en el tema, y luego irnos sumergiendo dentro de los subtemas relacionados a las teorías de las bandas, propiedades redox, composición y características de las aleaciones, entre otros.
El tema desarrollado por el grupo fue realizado en partes asignadas a cada estudiante y cada parte fue desarrollada mediante el pensamiento explicito a partir de una investigación individual de cada uno de estos, para mas tarde haber hecho una puesta en común y socializar todo lo que habíamos y no habíamos aprendido, tratando de aclarar nuestras dudas mediante el material que se había investigado o mediante otras fuentes.LOS METALES.
PROPIEDADES.
Los metales son elementos que a la temperatura y presión ambiente se caracterizan por:
-
Ser buenos conductores de calor y electricidad(conductores de primera clase)
-
Posee un gran poder reflector y escasa absorción de la luz intensa llamado”metálico”
-
Con el oxigeno forman óxidos y si son unidos con agua funcionan como base, y hidróxido.
-
Cuando se combinan con el hidrogeno dan hidruro gaseosos
-
Las soluciones de sus hidróxidos o de sus sales, cuando se electrolizan, separan el metal en polo negativo. Este es típico de los metales y se manifiesta por su tendencia (electro afinidad positiva) variando según el metal.
Para los metales alcalino-térreos que poseen gran facilidad para combinarse con el oxigeno y descomponer el agua, además cuando están en estado sólido los metales pueden sufrir ciertas deformaciones permanentes sin quebrarse.
-
Los metales son sólidos a temperatura ordinaria, a excepción del mercurio que es líquido, son insolubles en los disolventes neutros habituales.
-
Densidad; son mas denso que el agua, aquellos cuyo peso especifico es menor que 3 se denomina “liviano” (li =0,59), (Na = 0,97),(Al = 2,6) ect.
-
Fusión: todos los metales son fusibles, algunos a temperatura relativamente alta (estaño =232`), (plomo = 327¨)
-
Maleabilidad: cuando pueden reducirse a hojas delgadas bajo la acción de un laminador o un martillo.
-
Dureza: ofrecen una resistencia al ser rayados por otros metales, la cual se mide en una “escala de möh”
Propiedades químicas de los metales.
-
La corrosión: el aire húmedo especialmente debido a la acción combinada del oxigeno, del agua y el anhídrido reacciona con los metales, por eso los metales pierden su brillo a excepción del (oro, plata entre otros).
-
La acción de los ácidos diluye la mayor parte de los metales, a veces en frió (alcalino-térreos) y otros en caliente.
-
La acción de los ácidos oxidantes concentrados: tanto el ácido sulfúrico como ácido nítrico en soluciones concentradas y en caliente actúan como oxidante atacando la mayoría de los metales. En los metales, la plata puede ser disuelta por el ácido nítrico mientras que el oro y el platino solo se disuelven por las aguas regias.
-
Metales livianos( densidad inferior a 3) y metales pesados ( densidad superior a 7 )
-
Los metales livianos comprenden tres grupos los metales alcalinos monovalentes, cuyos hidróxidos son bases muy fuertes (sodio, potasio)
-
Los metales del grupo del hierro: este grupo comprende a elementos de carácter metálico dominante del 4 periodo de la tabla integrado por 18 elementos (desde k hasta Kr). Todos funcionan como (bi y trivalente) dando sales con cationes de valencia mínima (+2) y máxima (+3). Y tienen la propiedad de ser atraídos por los campos magnéticos su importante aplicación en las arte e industrias)
-
Metales del cuarto grupo: encabezados por elementos como el silicio y el carbono (no metales) se comportan como tetravalente (+4) y como divalente (+2). Sus óxidos e hidróxidos son anfóteros actuando como base frente a los ácidos y como ácidos frente a las bases.
-
Los metales del tercer grupo (tierras raras): estos elementos tienen carácter metálico excepto el (boro) el mas importante de este grupo es aluminio por su abundancia en la naturaleza después del oxigeno. Las tierras raras son muy difíciles de separar por poseer propiedades muy parecidas, forman dos series (numero atomico57”lantano” hasta el 71(lutecio).
-
Metales (alcalino): este tipo de grupo se caracteriza por poseer un único electrones en la orbita externa de sus átomos. Aparecen en la naturaleza combinados con los halógenos y los elementos del grupo de oxigeno y formando compuestos iónicos solubles en el agua, en estado puro los metales (Li, Na, K, Rb, Cs y Fr). Son muy brillantes y mas ligeros que el resto de los metales, la existencia de un electrón hace que su ligadura sean relativamente (blando, y bajo punto de fusión). Y valencia (+1) y reaccionan con (no metales, para formar compuestos binarios) y con el agua (exotérmico).
-
Metales del primer grupo (alcalinos-térreos): estos se caracterizan por poseer dos electrón en la orbita externa de su átomo. Se llaman alcalino térreos por diferencia de los metales alcalino por la insolubilidad, por lo general son del agua de mar y de pozos muy profundos. Todos los metales alcalinos se obtienen por electrolisis de halogenuros o hidróxidos profundos. presentan carácter “metálico”, tienen brillo intenso y una buena conductividad. Son mas duros que los (alcalinos pero pueden ser cortados por un cuchillo). Aparecen como silicatos, sulfatos y fosfatos. Los óxidos se encuentran como revestimiento para hornos, los alcoholes del bloque (s) son fuerte. Y son blancos, solubles en agua.
-
Metales nobles: estos están caracterizados porque la capa electrónica que sigue posee 18 electrones (son menos electropositivos) también no ceden ni reciben y no se oxidan fácilmente.)
-
Cristales simples o de componentes puros, cristalizados separadamente donde cada cristal contiene un solo componente. En este caso la aleación llamada eutéctica es una mezcla íntima de cristales formada cada uno de ellos de un solo componente puro. Estas aleaciones son de poca aplicación práctica debido a sus bajas propiedades mecánicas.
Por su baja temperatura de fusión, se emplean casi exclusivamente para la soldadura dulce. El ejemplo típico lo constituye la aleación plomo estaño empleada en la soldadura de láminas de cinc, cobre y latón. -
Cristales de elementos compuestos. Estos cristales están formados por compuestos químicos de los componentes donde no es posible distinguir separadamente los componentes originales como en el carburo de hierro que le aporta dureza a los aceros que lo contienen.
-
Cristales de solución sólida. Llamada así por semejanza con las soluciones líquidas. Están formados por una solución sólida de los componentes puros o por uno de ellos y un compuesto químico de ambos. Se forman debido a la solubilidad de los componentes en el estado sólido.
-
Aleaciones férreas: que contienen hierros.
-
aleaciones no férreas: resto de los metales que no contienen hierro (aleaciones a base de aluminio), magnesio, titanio, cobre, níquel, estaño y cinc.
-
Cobre y sus aleaciones
-
El bronce es una aleación de cobre y varios otros elementos dentro de los que se incluyen estaño (Sn), Aluminio (Al), Silicio (Si) y Níquel (Ni). Estas aleaciones son más fuertes que los latones y mantienen una alta resistencia a la corrosión. Generalmente se utilizan cuando además de una alta resistencia a la corrosión se requieren buenas propiedades a la tensión.
-
Aluminio y sus aleaciones.
-
Magnesio y sus aleaciones.
-
Titanio y sus aleaciones.
-
Su maleabilidad en algunos casos.
-
Su dureza.
-
Resistencia.
-
Constituyen una característica de los elementos metálicos, resultante de la fusión de dos o más elementos, de los que uno al menos es un metal donde el producto es un material con propiedades metálicas.
-
Se preparan ordinariamente fundiendo los elementos juntos, agitando la mezcla hasta que sea homogénea y dejándola enfriar.
-
Con frecuencia, las aleaciones tienen propiedades muy diferentes de las de los metales que lo forman. Así, disminuye el punto de fusión, aumenta la dureza, disminuye la conductividad eléctrica y térmica.
-
Un electrón es portador de carga eléctrica negativa.
-
Un hueco es un portador de carga eléctrica positiva. (representa la ausencia de un electrón en un punto que normalmente debería encontrarse.
-
Cuando un átomo le falten o sobre electrones en su capa exterior es un átomo ionizado estará: “ionizado positivamente. (carga positiva).
-
“Ionizado negativamente”, si sobran electrones (cargas negativa).
-
Para temperaturas muy bajas, tienen una resistencia comparable con la de los cuerpos aislantes.
-
Para temperaturas relativamente altas tienen una resistencia comparable a la de los cuerpos semiconductores.
-
También el estado de pureza de un cuerpo semiconductor influye en su resistencia.
-
En estado puro tienen una resistencia comparable a las de los materiales aislantes.
-
Cuando contienen algunas impurezas (distintas para cada cuerpo semiconductor) su resistencia puede llegar a ser como la de un conductor.
-
Su comportamiento eléctrico depende esencialmente de su estructura atómica.
-
Una característica fundamental de los semiconductores es de poseer 4 electrones en su orbita.
-
Los elementos como el silicio (Si) y el germanio (Ge) agrupan sus átomos formando una estructura reticular.
CLASIFICACION TECNICA DE LOS METALES
Los metales libres se clasifican en:
COMPOSICION Y CARACTERISTICA DE LAS ALEACIONES
Se llaman aleaciones a la mezcla de dos o mas metales, efectuada por medio de la fusión si uno de los metales es el mercurio la aleación se llama” amalgama”. El mercurio se combina con todos los metales comunes, excepto hierro y platino, formando dichas aleaciones llamadas amalgamas.
La amalgamación es un proceso metalúrgico que utiliza mercurio para disolver plata u oro formando una amalgama. Este sistema a sido sustituido en gran medida por el proceso con cianuro, en el que se disuelve oro o plata en disoluciones de cianuro de sodio o potasio. En los diversos procesos de lixiviación o precolación se emplean diferentes disoluciones acuosas para disolver metales contenidos en los minerales.
Los carbonatos y sulfuros metálicos se tratan mediante calcinación, calentándolos hasta una temperatura por debajo del punto de fusión del metal.
En el caso de los carbonatos el proceso depende del dióxido de carbono, y queda un oxido metálico. Cuando se calcinan sulfuros, el azufre se combina con el oxigeno del aire para formar dióxido de azufre gaseoso, y también resulta un oxido metálico. Los óxidos se reducen después por fundición.
El fósforo es favorable para el forjado en caliente, pero hace quebradizo al hierro en frió cuando se encuentran en gran cantidad. También disminuye el punto de fusión del hierro.
Las aleaciones metálicas están formadas por un agregado cristalino de dos o más metales con los metaloides. Las aleaciones se obtienen fundiendo los diversos metales en un mismo crisol y dejando luego solidificar liquida formando una estructura granulada cristalina apreciable.
La estructura queda conformada por diferentes micro- constituyentes:
Composición de las aleaciones.
La composición de las aleaciones depende del tipo de aleaciones con los diferentes elementos.
Aleaciones no férreas
El cobre y sus aleaciones poseen una combinación de propiedades físicas que han sido utilizados en múltiples aplicaciones desde la antigüedad. El cobre puro es dúctil y suave, tanto que es difícil de maquinar, también tienen una capacidad casi ilimitada para ser trabajado en frío. Además es altamente resistente a la corrosión en diversos ambientes incluyendo el ambiente atmosférico, agua de mar, y algunos químicos industriales. Las propiedades de resistencia mecánica y a la corrosión del cobre se pueden mejorar por aleaciones. La mayoría de las aleaciones de cobre no pueden ser endurecidas o pensionadas por procedimientos de tratamientos térmicos por lo que trabajos en frío y/o aleaciones de soluciones sólidas deben utilizarse para mejorar esas propiedades mecánicas.
La aleación de cobre más común es el LATON en la cual el cinc como impureza sustitucional es el elemento aleante más importante.
Se caracterizan por una baja densidad (2.7 g/cc comparada con 7.9 g/cc del acero), altas conductividades eléctricas y térmicas y resistencia a la corrosión en algunos ambientes incluyendo el atmosférico. Son muy dúctiles y ello es aprovechado para conformarlos fácilmente tales como las técnicas de enrollado. Su estructura interna FCC permite que su ductilidad se mantenga aun a temperaturas baja. La principal limitación del aluminio es su baja temperatura de fusión (660ºC) lo cual restringe su uso por debajo de esta temperatura.
Se usan en partes de aviones, recipientes para gaseosas enlatadas, cuerpos de buses y partes de automóviles (pistones)
Debido a que la característica más importante del magnesio es la densidad (1.7 g/cc), la cual es la mas baja de los metales estructurales, sus aleaciones se usan donde el bajo peso es una consideración importante, por ejemplo en componentes de aviones. El Mg tiene una estructura hexagonal compacta, es relativamente suave y tiene un modulo elástico bajo. A temperatura ambiente el Mg y sus aleaciones son difíciles de deformar, de hecho solo pequeños grados de trabajo en frío pueden lograrse sin tratamientos de temple. Consecuentemente, la mayoría de su fabricación se produce por colado o trabajo en caliente entre 200 y 350ºC. El magnesio así como el aluminio tiene bajo punto de fusión (651ºC).
Químicamente el magnesio es relativamente inestable y especialmente susceptible a la corrosión en ambientes marinos. Pero a atmósfera normal presenta buena resistencia a la corrosión o a la oxidación.
Son aleaciones relativamente nuevas que poseen una extraordinaria combinación de propiedades. El metal puro tiene una relativamente baja densidad (4.5 g/cc) y alto punto de fusión (1668ºC) y alto modulo elástico. Las aleaciones de titanio son extremadamente fuertes y altamente dúctiles y fácilmente forjadas y maquinadas. La principal limitación del titanio es su reactividad química con otros materiales a elevadas temperaturas. Esto hace necesario el desarrollo de técnicas no convencionales de refinado, fusión y colado. Consecuentemente las aleaciones de titanio son muy costosas. A temperatura ambiente la resistencia a la corrosión del titanio es inusualmente alta. Ellas son virtualmente inmunes al ambiente marino, y una amplia variedad de ambientes industriales. Son comúnmente usadas en estructuras de aeroplanos, vehículos espaciales y las industrias químicas y del petróleo.
Aleaciones férreas
Constituyen la mayoría de los metales empleados en ingeniería. Son muy usados para soportar cargas estructurales o transmitir potencia.
Se dividen en dos categorías, de acuerdo a la cantidad de carbono que contengan:
-Aceros: Tienen entre 0.05 y 2.0 % en peso de carbono
-Fundiciones: Tienen entre 2 y 4.5 % en peso de carbono.
Aceros al carbono y de baja aleación.
La mayoría de las aleaciones férreas son de este tipo. Estas aleaciones son de precios moderados y poca cantidad de elementos aleantes y son suficientemente dúctiles como para conformarse con facilidad. El producto final es fuerte y duradero y se usan en muchas aplicaciones. Una clase interesante de estos aceros son los aceros de baja aleación y alta resistencia (HSLA) cuya característica principal es su bajo peso por lo que se usan principalmente en la industria automotriz.
Aceros de alta aleación.
Son aquellos en los que la cantidad de aleantes supera el 5% en peso, por lo que son más costosos. Se cuentan entre estos aceros los siguientes:
1. Aceros inoxidables que requieren la adición de aleantes que aumenten su resistencia a la corrosión, entre los que se cuenta el Cr cuya cantidad puede variar entre 4 y
30% en peso.
2. Aceros usados en las herramientas que también requieren gran cantidad de aleantes que aumenten su dureza.
3. Superaleaciones, que requieren la adición de elementos aleantes que les proporciona estabilidad en aplicaciones a alta temperatura.
Características de las aleaciones.
A partir de la explicación de los distintos usos de las aleaciones es fácil definir por sí mismo algunas de sus características, a continuación mencionaremos todas ellas.
RELACION DE LAS PROPIEDADES FISICAS DE LOS METALES (CONDUCTIVIDAD TERMICA Y ELETRICA) MEDIANTE EL RECURSO DE LA TEORIA DE LAS BANDAS.
Para comprender la relación de las propiedades físicas de los metales mediante la teoría de las bandas, primero debemos entender esta teoría.
La teoría de las bandas hace referencia al aglutinamiento de los átomos en los metales, esta establece que los electrones deslocalizados se mueven libremente a través de las "bandas" que se forman por el solapamiento de los orbítales moleculares. Al estar tan amontonados los átomos de un metal, los orbítales moleculares quedan muy cerca uno de otro, tanto así que los orbítales tienen energías tan parecidas que quedan mejor descritos como una banda.
Entonces los niveles energéticos llenos de cada átomo, tan parecidos uno del otro, constituyen una banda de valencia. Sobre esta banda de valencia se forma otra banda por encima de ésta, correspondiente a los orbítales deslocalizados y vacíos que se forman por el solapamiento de los orbítales mas externos, dicha banda recibe el nombre de "banda de conducción".
Entonces la relación de las propiedades físicas de los metales es debido a que la banda de valencia y la banda de conducción son adyacentes entre sí, y la cantidad de energía que se requiere para promover un electrón de la banda de valencia a la banda de conducción es prácticamente despreciable.
Una vez en la banda de conducción, el electrón puede desplazarse a través de todo el metal, ya que la banda de conducción carece de electrones.
Podemos concluir con todo lo anteriormente dicho, que en todos los metales el espacio energético entre las bandas de conducción y de valencia es prácticamente nulo, y esto permite el fácil flujo de electrones mediante la promoción de un electrón desde la banda de valencia hasta la banda de conducción y de allí, el flujo del electrón por todo el metal.
COMPARACION DE LOS NO METALES, METALES Y SEMI METALES EN CUANTO A SU CONDUCTIVIDAD A TRAVES DE LA TEORIA DE LAS BANDAS.
Como ya hemos explicado antes, los metales son conductores de electricidad por excelencia debido a su propiedad adyacente en las bandas de conducción.
Una gran cantidad de elementos son semi-conductores, o sea, que no son conductores pero conducen la electricidad a elevadas temperaturas o cuando se combinan con una pequeña cantidad de algunos elementos.
En los semi-conductores el espacio energético entre las bandas llenas y vacías, o sea, las de conducción y de valencia es mucho menor que la de los metales. Debido al pequeño espacio energético entre las bandas si se le suministra la energía suficiente, el electrón se excita y pasa de una banda a otra.
Este comportamiento es opuesto al de los metales ya que al aumentar la temperatura en un metal la conducción de electricidad disminuye porque los átomos en el metal empiezan a vibrar y esto tiende a impedir o romper con el flujo de los electrones.
El caso de los no metales, la conductividad eléctrica (de un sodio) depende del distanciamiento energético de las bandas y si el no metal considerado como aislante entonces ese espacio energético es muy grande, por lo que se dificulta la promoción de un electrón desde la banda de valencia hasta la banda de conducción. Es decir que se requiere de demasiada energía para excitar un electrón hacia la banda de conducción.
CLASIFICACION DE LOS METALES SEGÚN SU UBICACIÓN EN LA TABLA PERIODICA.
Los metales tienen apariencia lustrosa, son sólidos a temperatura ambiente con excepción del mercurio y son buenos conductores del calor y la electricidad, son maleables y dúctiles.
En los metales la electronegatividad aumenta de izquierda a derecha a lo largo de un periodo, y de abajo hacia arriba en un grupo. El carácter metálico se manifiesta en direcciones totalmente opuestas, o sea, que aumenta de derecha a izquierda a lo largo de un periodo y de arriba hacia abajo en un grupo. Los metales en general tienen electronegatividades bajas, tienden a formar cationes, y casi siempre adquieren números de oxidación positivos en sus compuestos.
Los elementos del grupo IA. Al grupo IA (litio, sodio, potasio, rubidio, cesio y francio) se les conoce como grupo de los metales alcalinos, haciendo referencia al hecho de que estos elementos son constituyentes comunes de las cenizas vegetales. El término alcalino también hace referencia al carácter básico de sus óxidos.
Estos elementos presentan un electrón solitario en el orbital mas externo. Estos electrones poseen un bajo potencial de oxidación y los átomos los pierden con facilidad, produciendo iones (m+) con la estructura del gas noble que le antecede, estos son poco polarizadles y muy estables por lo que no ocurre otro estado de oxidación. Así cuando el sodio cede su electrón de valencia se transforma en el ión sodio, que tiene la misma configuración electrónica del átomo de neón.
Na: 1s2 2s2 2p6 3s1 - e- Na+: 1s2 2s2 2p6
Los elementos del grupo IIA.
El grupo IIA (berilio, magnesio, calcio, estroncio, bario y radio) se suele identificar comúnmente como de los metales alcalino-térreos; son alcalinos porque sus óxidos (Cal=CaO y magnesio = MgO) presentan carácter básico, y térreos porque tienen características de las tierras de los alquimistas, presentan carácter metálico, insolubles en agua e inalterables al fuego.
Los metales alcalino-térreos solo alcanzan la estructura de gas noble cediendo dos electrones. Así que cuando el magnesio cede los electrones del orbital mas externo se convierte en el ión magnesio, cuya estructura electrónica es igual a la del neón.
Mg: 1s2 2s2 2p6 3s2 -2e- Mg +2: 1s2 2s2 2p6
Los elementos del bloque d de la tabla periódica se corresponde con los elementos del grupo IB, IIB, IIIB, IVB, VB, VIB, VIIB y VIIIB. En sentido general son elementos metálicos y de transición, así como también generan sales metálicas al ser atacados por ácidos, aunque algunos de ellos no son afectados por estas sustancias y se les llama metales nobles.
Actúan con varias valencias o estados de oxidación y por esto, en algunos casos, forman compuestos coloreados. Por poseer capas incompletas, muchos de ellos forman elementos paramagnéticos.
Series de transición.
Para analizar los elementos del bloque D se les ha dividido en tres series de transición que se encuentran entre los metales alcalinos y alcalino-térreos y los no metales pertenecientes al bloque P. Estas series son las siguientes:
1era serie: esta agrupa los elementos con el orbital 3d para ser completado. En su forma ionizada todos estos elementos presentan capas D incompletas con excepción del escandio. Además el cobre es el único que ha completado su capa D.
2da serie de transición: Agrupa los elementos con el orbital 4d para ser completado. Todos estos elementos en su forma ionizada presentan capas d incompletas, menos el litio. Por otro lado, la plata es el único que ha completado su capa d.
3era serie de transición: consta de los elementos que deben completar el orbital 5d. En su forma ionizada, todos estos elementos presentan capas d incompletas, y el oro es el único que ha completado su capa d.

SEMI CONDUCTORES
¿QUÉ ES UN SEMICONDUCTOR?
Primero un semiconductor es un elemento que no es directamente un conductor de corriente, pero tampoco es un aislante. EN los semiconductores se producen corrientes tanto por el movimiento de los electrones como las cargas positivas (huecos). Y esta formado por materiales tipo p y tipo n.
Los semiconductores son materiales cuya conductividad varia con la temperatura, pudiendo comportarse como conductores o como aislante.
Para conseguir esto, se introducen los átomos de otros elementos en el semiconductor. Esto átomos se llaman impurezas y tras su introducción, el material semiconductor presenta una conductividad controlable eléctricamente.
Los materiales semiconductores mas empleados para estos son el “silicio”y el “germanio”. Para incrementar el nivel de la conductividad se provocan cambios de temperatura, de la luz o se integran impurezas en su estructura molecular.
Un átomo con 8 electrones de valencia es un eléctricamente muy estable no tiene ni perder ni ganar electrones. Ahora un átomo con tres electrones de valencia es eléctricamente inestable, y tiende a perder uno o más de estos electrones, un átomo con 7 electrones de valencia es también inestable pero tiende a atraer. En muchos casos, existen electrones libres, cuando un átomo ha perdido un electrón de su capa valencia, se que queda con una carga eléctrica positiva: en consecuencia intenta atraer un electrón móvil que se encuentre en las proximidades, de esta forma se puede definir la carga positiva del átomo como un hueco o”laguna electrónica”
También esta en fenómeno de “conducción “es la tendencia de los átomos a neutralizar sus cargas. Es decir que los positivos atraen los electrones sobrantes de los negativos:
Se puede considerar la conducción: el desplazamiento de electrones libres desde átomos ionizados negativo a átomos ionizados positivamente (conducción electrónica). El desplazamiento de huecos libres desde átomos ionizados positivo a átomos ionizados negativo (conducción lagunar).
Características generales de los semi- conductores
Clasificación de los semi- conductores.
Mientras que los cuerpos buenos conductores ofrecen escasas resistencia al paso de los electrones y los electrones ofrecen elevadísima resistencia los semiconductores presentan una resistencia intermedia.
Semiconductores intrínsecos
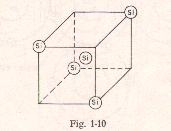
Un elemento semiconductor mas utilizados son (germanio, silicio). Estos elementos agrupan sus átomos de modo muy particular, formando una estructura reticular. Cada átomo de silicio ocupa siempre el centro de un cubo que posee otros 4 átomos, el átomo al estar rodeado por otros 4 “enlace covalentes” este caso el átomo se hace estable, pues se comporta como si tuviese 8 electrones.
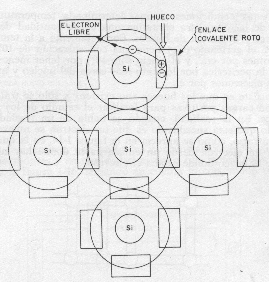
Pero al aplicarle aumenta la agitación desordenada de electrones, con lo que algunos de su periferia se salen de su orbita rompiendo sus enlace covalente, cuanta es mas alta la temperatura, mayor es la agitación y el numero de enlaces covalentes rotos junto con la de electrones libres, (hueco, carga positiva) dentro de estas condiciones, a una determinada temperatura habrá dentro de la estructura cristalina una cierta cantidad de electrones libres y la misma de huecos.
En este caso un electrón de los que forman enlaces covalentes no puede saltar fuera del enlace bajo el único efecto de la tensión, sino las fuerzas combinadas con la temperatura.
Semiconductor extrínsecos tipo n.
Debido a la estructura reticular del germanio y el silicio, cuyos átomos forman el centro de un cubo y este tiende a hacerse estable por lo tanto aislante, puesto que tienen bien sujetos a sus electrones ahora hasta que no se le aplique los factores de la temperatura. Pero al aplicarle una diferencia de potencial se consigue una débil corriente proporcional a la temperatura ya que no es muy útil en aplicaciones
Tipo”N”
Para aumentar el numero de portadores de electrones libres a este tipo de semiconductor (intrínseco) se le añaden impurezas estas impurezas tiende a aumentar el numero de electrones libre.
El átomo de antimonio (Sb) se dice que es pentavalente porque dispone de 5 electrones en su orbita mas externa. Ahora si ala estructura de ya conocida del semiconductor (intrínsecos, germanio o silicio puro) estas impureza ocupa un lugar donde debería ir otro átomo de (germanio o silicio) de este modo tratara de formar con el 4 enlaces covalentes necesario para estabilizarse. U como en su orbita le sobra un electrón este tiende a soltarle y así este pasa a ser un electrón libre. Por eso habrá más electrones libres que hueco (cargas positiva).
En este caso los portadores mayoritarios serán los electrones libres (cargas negativas).
Semiconductores intrínsecos tipo p.
El boro en un elemento trivalente, al igual que el aluminio por disponer de 3 electrones en la orbita de valencia.
Al añadir impurezas trivalentes al semiconductor intrínseco y entrar estas a formar parte de la estructura cristalina. Quedan dichas impurezas rodeadas por 4 átomos de silicio o germanio con los a de formar 4 enlaces covalentes cosa que le sobrara un electrón pero en este caso no queda libre sino que falta un electrón en su enlace covalente.
.
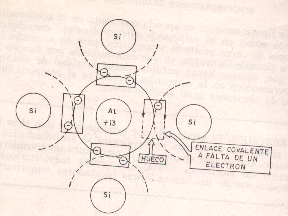
Por cada átomo de impureza trivalente que se añade al semiconductor intrínseco habrá un mayor número de huecos (cargas positivas) que de electrones libres.
En este caso los huecos serán los portadores mayoritarios y los electrones libres minoritarios. Sometiendo a una circulación de corriente al semiconductor tipo veremos una mayor circulación de portadores mayoritarios tipo n.
Ahora si hacemos lo mismo con un semiconductor tipo p observamos que será diferente
.
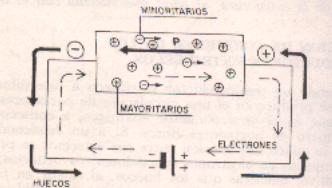
En este caso como la impureza tiende a hacer que falten mas enlaces con los electrones, estos serán atraídos por el polo negativo, se producen dos corrientes una importante que es la de huecos y otra débil de electrones libres.
Uniones “P” Y “N”
Antes de ver este tipo de semiconductor hay que tener presente el “fenómeno de la difusión”, y es cuando entra en contacto dos elementos de diferentes concentraciones se produce un fenómeno de agitación térmica llamado “difusión”, que tiende a igualar las concentraciones en ambos.
Uniones del semiconductor tipo”p” con “n”
Como hemos vistos un semiconductor tipo (p) dispone mas “huecos” libres (mayoritarios) que de electrones libres o portadores minoritarios, pero la carga total de ellos dos es neutra.
Al colocar parte del semiconductor de tipo “p” junto a otra parte del semiconductor tipo “n” debido a la ley de la difusión los electrones de la zona”n”,con alta concentración de los mismo, tienden a dirigirse a la zona “ que tiene en pocos del tipo “n” y a si lo contrario. Con los huecos en la zona “n” que tratan de dirigirse de la zona “p” a la zona “n”
La ley de difusión impulsa a los electrones de la zona “n” a fundirse hacia la zona “p” y a los huecos de “p” a dirigirse hacia la zona “n” así produciéndose un encuentro que tiende a neutralizar ambas cargas (huecos y electrones libres) formándose dicha unión estable y neutra. De todas formas que la zona “n” era en principio neutra y colocarla junto con la zona “p” pierde electrones. A esta zona se le llama “barrera de potencial” lo que impide la continuación de la difusión.
Diodos semiconductores.
Al unir un trozo de semiconductor de tipo “n” con otro tipo “p” se forma entre ambos una zona neutra y aislante, entre cuyos extremos existe una barrera de potencial. Una vez detenido el fenómeno de la difusión por la barrera de potencial se puede polarizar externamente dicha unión n-p, de forma que la tensión se oponga en la barrera de potencial.
La unión n-p se dice que esta polarizada directamente cuando se le aplica un potencial negativo a la zona n y el potencial positivo de la zona p puesto que al anular la barrera de potencial continua el fenómeno de la difusión pasando electrones mayoritarios de la zona n hacia los minoritarios de la zona p y siendo absorbidos por el polo positivo de la batería y al mismo tiempo el polo negativo repone los electrones absorbidos por el polo positivo y asimismo el fenómeno de difusión se describe de forma indefinida.
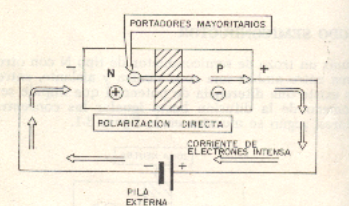
En este caso este tipo de unión entrara en conducción cuando se le polariza directamente.
Conclusión
En este trabajo hemos desarrollado el tema de los metales a profundidad. En toda su amplitud inicia hablando de sus propiedades y características tanto químicas como físicas y mas tarde nos vamos adentrando en el porque de su conductividad mediante el recurso de la teoría de las bandas relacionando sus propiedades físicas haciendo referencia a dicha teoría. Además con relación a esta teoría hicimos una comparación de los metales, semi-conductores y no metales, por lo que debimos de leer y analizar el comportamiento de la teoría de las bandas para comprender correctamente y luego realizar la comparación. Entre los subtemas desarrollados se encuentran los de las amalgamas y haceros seguido del tema de los semiconductores el cual contiene los siguientes subtemas: características generales, clasificación, uniones pn y np y sus aplicaciones. Para finalizar tenemos la opinión de que hemos realizado un trabajo muy completo debido a la basta diversidad de temas ampliamente explicados y desarrollados, de buena consulta para personas con inquietudes en el tema.
El carácter metálico aumenta de arriba hacia abajo en un grupo
El carácter no metálico aumenta de izquierda a derecha en un periodo
El carácter metálico aumenta de derecha a izquierda
Descargar
| Enviado por: | Ingeni |
| Idioma: | castellano |
| País: | República Dominicana |
