Química
Preparación de soluciones químicas
UNIVERSIDAD ANTONIO NARIÑO
FACULTAD DE MEDICINA
ASIGNATURA: QUIMICA
PRIMER SEMESTRE
LABORATORIO 7: SOLUCIONES
PRESENTADO POR
BOGOTA D.C.
ABRIL DE 2007
OBJETIVOS
OBJETIVO GENERAL
Preparar soluciones de diferente concentración
OBEJTIVOS ESPECIFICOS
-
Conocer el concepto de soluciones
-
Conocer los conceptos de peso a peso, densidad, Molaridad, Molalidad.
MARCO TEORICO
Densidad
En física el término densidad (![]()
) es una magnitud referida a la cantidad de masa contenida en un determinado volumen, y puede utilizarse en términos absolutos o relativos.
Molaridad
La molaridad (M) es el número de moles de soluto por litro de disolución. Por ejemplo, si se disuelven 0,5 moles de soluto en 100 mL de disolución, se tiene una concentración de ese soluto de 5,0 M (5,0 molar). Para preparar una disolución de esta concentración normalmente se disuelve primero el soluto en un volumen menor, por ejemplo 30 mL, y se traslada esa disolución a un matraz aforado, para después rellenarlo con más disolvente hasta los 100 mL.
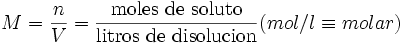
Es el método más común de expresar la concentración en química sobre todo cuando se trabaja con reacciones químicas y relaciones estequiométricas. Sin embargo, tiene el inconveniente de que el volumen cambia con la temperatura.
Molalidad
La molalidad (m) es el número de moles de soluto por kilogramo de solvente. Para preparar soluciones de una determinada molalidad en un disolvente, no se emplea un matraz aforado como en el caso de la molaridad, sino que se puede hacer en un vaso de precipitados y pesando con una balanza analítica, previo peso del vaso vacío para poderle restar el correspondiente valor.
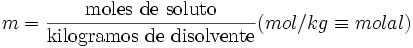
La principal ventaja de este método de medida respecto a la molaridad es que como el volumen de una disolución depende de la temperatura y de la presión, cuando éstas cambian, el volumen cambia con ellas. Gracias a que la molalidad no está en función del volumen, es independiente de la temperatura y la presión, y puede medirse con mayor precisión. Es menos empleada que la molaridad.
Porcentaje por masa
Masa de soluto por cada cien partes de solución.
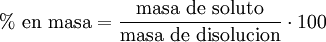
MATERIALES Y METODOS
1. MATERIALES
| Balanza de triple brazo |
|
| Papel filtro |
|
| Mechero |
|
| Erlenmeyer | |
| Capsula de porcelana |
|
| Espátula |
|
| Soporte universal |
|
| Rejilla |
|
| Gradilla |
|
| Vidrio de reloj | |
| NACL | CLORURO DE SODIO |
| SACAROSA | AZUCAR |
2. METODOLOGIA
1.
Se preparan 100 ml de sln de NACL al 10% p/p de Nacl en H20
Se preparan 200 ml de sln al 5% de sacarosa en H20.
2.
A. Se determina la densidad de la solución A y la solución B.
3. Se efectúa el calculo de molaridad M= n (soluto)/ v (solvente) lt
Posteriormente se preparan 100 ml de NACL en 0,2 M y 100 de sacarosa en 0,1 M.
4. Molalidad = m= n (soluto)/kg solvente
5. Por ultimo se preparan 100 ml de NACL 0,1 m y 100 de sacarosa 0,1 m
TABLA DE DATOS
| Peso picnómetro vació 9,3 g | Peso picnómetro lleno con sal 14 g |
| Peso de la sal : 4,7 g | |
| Peso del picnómetro con azúcar : 14,5 g | Peso del azúcar: 5.2 g |
CALCULOS
Porcentaje peso a peso: % peso a peso= g soluto/ g solución *100
NACL: 10% = 58 g / 100 g* 100 = 58%
SACAROSA: 5% = 342 g / 200 g*100= 171%
Densidad: Se determino con el picnómetro el peso de cada compuesto, luego aplicando la formula de la densidad se tiene: d= m/v.
NACL:
Volumen del picnómetro: 5 ml - Peso del NACL: 4,7.
D= 4,7 g/ 5 ml = 0,94 g/ml
SACAROSA: Volumen del picnómetro: 5 ml - Peso de Sacarosa: 5,2 g
D= 5,2 g/ 5 ml = 1.04 g/ml
Molaridad: M= n(soluto) / v sln lt
a. Nacl: n= M.V
n= 0,2 M * 0.1 lt = 0.02 moles NACL
b. Sacarosa: n= M.V
n= 0.1 M * 0,1 lt = 0,01 moles Sacarosa
Luego se pasan los moles a gramos:
0.02 moles Nacl * ( 58 g Nacl / 1 mol Nacl) = 1.16 gramos Nacl
0.01 moles de Sacarosa * ( 342 g sacarosa/ 1 mol sacarosa) = 3.42 g sacarosa
Molalidad: m= n (soluto)/ kg solvente
Nacl : n= molalidad * kg , luego de la formula de la densidad hallamos la masa contenida en 100 ml, de esta forma d= m/v
m= v. d, luego m= 100 ml * 0,94 g/ ml = 94 g = 0.094 kg
* Así aplicando la formula= n= molalidad * kg= 0,1 m * 0.094 kg = 0.0094 mol nacl
Sacarosa : n= molalidad * kg , luego de la formula de la densidad hallamos la masa contenida en 100 ml, de esta forma d= m/v
m= v. d, luego m= 100 ml * 1,04 g/ ml = 104 g = 0.104 kg
-
Así aplicando la formula= n= molalidad * kg= 0,1 m * 0.104 kg = 0.0104 mol Sacarosa
Luego hallamos los gramos en cada uno de los moles así:
-
Nacl : 0,0094 mol nacl * ( 58 g/ 1 mol) = 0,5452 g Nacl
-
Sacarosa: 0.0104 mol sacarosa * ( 342 g sacarosa/ 1 mol) = 3,5568 g sacarosa
ANALISIS DE RESULTADOS
En 100 ml de H20, debo agregar 1,16 gramos de NACL, a partir de la preparación de una solución 0,2 M con 100 ml de NACL .
En 100 ml de H20, debo agregar 3,42 gramos de SACAROSA, a partir de la preparación de una solución 0,1 M con 100 ml de NACL.
CONCLUSIONES
-
En química, para expresar cuantitativamente la proporción entre un soluto y el disolvente en una disolución se emplean distintas unidades: molaridad, normalidad, molalidad
-
Para preparar una disolución de esta concentración normalmente se disuelve primero el soluto en un volumen menor, y se traslada esa disolución a un matraz aforado, para después rellenarlo con más disolvente hasta los 100 mL.
-
Para preparar soluciones de una determinada molalidad en un disolvente, no se emplea un matraz aforado como en el caso de la molaridad, sino que se puede hacer en un vaso de precipitados y pesando con una balanza analítica, previo peso del vaso vacío para poderle restar el correspondiente valor.
BIBLIOGRAFIA
* Brown, T.L. Lemay. H.E. & Bursten, B.E. 1999. Quimica: La ciencia central. Pearson-Prentice may, septima edición, México.
* Chang, R. 2002. Quimica, editorial McGraw-Hill, Septima Edición, Colombia.
Descargar
| Enviado por: | FXSTAR2007 |
| Idioma: | castellano |
| País: | Colombia |