Física
Modelos atómicos
INTRODUCCIÓN
El átomo es la unidad más pequeña posible de un elemento químico, que no se ha podido observar aún por separado, pero gracias a muchas investigaciones a lo largo de la historia se sabe de él. Toda materia esta formada por átomos distintos, si son de distintos elementos. A esta conclusión o teoría se ha llegado tras muchos años de investigación, leyes y modelos de muchos científicos importantes que se han basado en otros modelos, experiencias, etc. Que les han servido de guía y ayuda.
Los avances de la teoría atómica se hicieron cada vez más rápidos a partir de los siglos XVI y XVII tras la llegada de la ciencia experimental, pero todo empezó en la antigua Grecia, ya que fue el primer pueblo que se interesó por la física y la química. De hecho átomo significa en griego “no divisible”; Tras este primer interés por los átomos surgieron otras teorías que finalmente han dado lugar a una única, la que conocemos hoy en día.
2
MODELOS ATÓMICOS
A lo largo de la historia ha habido muchos científicos que han investigado los átomos, desde los griegos hasta los más recientes.
1-FILÓSOFOS
- El griego Thales de Mileto en el año 585 a.C. sugirió que todo elemento natural era agua ya que podía estar en 3 estados distintos (líquido, gas y sólido) dependiendo de la temperatura ambiente.
- Los sucesores de Thales, Epicurio de Samos y el romano Lucrecio Caro, sugirieron que toda sustancia estaba formada por los 4 elementos (el agua, el fuego, la tierra y el aire).
- A finales del siglo V a.C. los filósofos griegos Leupino y Demócrito sugirieron que la materia esta formada por pequeñas partículas indivisibles que denominaron átomos y señalaron que si bien eran inmutables las relaciones entre ellos cambian.
2-CIENTÍFICOS EUROPEOS DEL SIGLO XVII Y XVIII
Tras casi 2000 años desde la teoría de Leupino y Demócrito, el inglés Boyle en el siglo XVII usó el concepto del átomo en sus trabajos de química y Newton lo tuvo en mente al desarrollar sus descubrimientos en física. También el francés Antoine Lavoisier, tras sus investigaciones de combustión, identificó muchas sustancias puras que no podían separarse en otras mas sencillas, elementos.
3
3- JOHN DALTON
El profesor y químico británico John Dalton en al siglo XIX creó una importante teoría atómica de la materia basándose en las leyes cuantitativas de la química:
-
Ley de conservación de la masa del científico Lavoisier.
-
Ley de las proporciones definidas realizada por el científico Proust
-
Ley de combinación de los gases de Avogadro.
-
Ley de las proporciones múltiples realizada por él mismo.
TEORÍA ATÓMICA DE JOHN DALTON
La teoría de Dalton que se dio a conocer en 1803, decía que:
- Los elementos estaban formados por átomos (partículas muy pequeñas e indivisibles).
- Los átomos de un mismo elemento son idénticos en su masa y demás propiedades.
- Los átomos de distintos elementos químicos son distintos entre sí, en particular su masa.
- Los compuestos se forman por la unión de átomos de los distintos elementos que forman la relación de números enteros.
- En las reacciones químicas, los átomos ni se crean ni se destruyen solo se distribuyen.
4
4- AMADEO AVOGADRO
El italiano Amadeo Avogadro, gracias al estudio de los gases, formuló en 1811 una importante ley que lleva su nombre:
LEY DE AVOGADRO
Esta ley afirma que:
-
Dos volúmenes iguales de gases diferentes, contienen el mismo número de moléculas si sus condiciones de temperatura y presión

son iguales.
5- DMITRI MENDELÉIEV
Dmitri Ivánovich Mendeléiev era un químico ruso que en el año 1869 publicó una versión de la tabla periódica en la que se incluían los elementos conocidos en la época en un orden numérico respecto a su número atómico de los elementos, pero en 1971 publicó una nueva versión en la que dejaba espacios vacíos o en blanco para próximos elementos que se pudiesen encontrar.

6- JOSEPH JOHN THOMSON
Joseph John Thomson físico británico del siglo XIX y XX creó un modelo que lleva su propio nombre, basándose en:
5
- El comportamiento eléctrico, las fuerzas electromagnéticas de la materia realizado por Faraday con las experiencias con el electrólito.
- Las experiencias de él mismo con los tubos de descarga:
1- Los rayos catódicos son partículas de carga negativa.
2- Son idénticos en todo tipo de materiales.
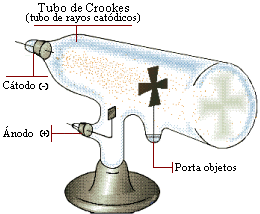
MODELO DE THOMSON
Gracias a las investigaciones de Thomson creó un modelo sobre el átomo, que consistía en:
-
La materia es eléctricamente neutra, lo que quiere decir que además de electrones esta formada por algunas partículas de carga positiva, que no se pueden extraer de los átomos.
-
Los átomos están constituidos mayoritariamente de carga positiva, así que propuso un ejemplo que los átomos fueran como una sandia y los electrones, las pepitas; o que fuera un pastel y los electrones las pasas, frutas…


Joseph John Thomson 6 Modelo de Thomson
7- ERNEST RUTHERFORD
El neocelandés Ernest Rutherford, del siglo XIX y XX que obtuvo un premio Nobel de Química en 1919, demostró una teoría que lleva
Su propio nombre, la teoría de Rutherford, basándose en:
- Su descubrimiento de la radioactividad de los átomos, los rayos “alfa” y “beta”, basándose en el modelo de Becquerel (descubridor de la radioactividad del uranio).
-
Su experiencia con los rayos alfa sobre una fina lámina de oro, que dio como resultado que casi todas las partículas atravesaban la lámina, pocas se desviaban y 1 ó 2 rebotaban, esto le hizo pensar que rebotaban porque chocaban contra partes de los átomos de la lámina a los que llamó núcleo del átomo.
-
También se basó en otros modelos como el de Thomson que daba a conocer la carga, el de Dalton que daba a conocer la masa del

átomo…
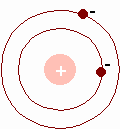
MODELO DE RUTHERFORD
En el año 1911 creó el modelo atómico de Rutherford que consistía en:
-
Los átomos constan de una parte central, llamada núcleo, donde se encuentra toda la carga positiva y casi toda la masa del núcleo.
-
La parte externa del átomo esta constituida por toda la carga negativa, por el número de electrones que tenga el átomo
-
Los electrones están girando constantemente a gran velocidad en torno del átomo.
7
-
El núcleo respecto a todo el átomo es insignificante (es unas
100.000 veces menor).
8-MAX PLANCK
El físico alemán Max Kart Ernest Ludwig Planck del siglo XIX y XX premiado con un premio Nobel de Física en 1918, formuló que la energía se radia en unidades pequeñas separadas, denominadas cuantos.
LEY DE PLANCK
Establece que la energía de cada cuanto es igual a la frecuencia de la radiación multiplicada por la constante universal.
Esta teoría fue un nacimiento de la mecánica cuántica que posteriormente comenzó a construirse y a modificarse.
9- NIELS BOHR
El físico danés Niels Bohr, de finales del siglo XIX y principios del siglo XX, obtuvo un premio Nobel de Física en 1922 por su primer modelo basado en la cuantización de la energía, para realizarlo se Basó en lo siguientes:
-
La teoría cuántica y la teoría de Planck.
-
La teoría de Rutherford.
-
Los espectros atómicos o de luz en los elementos gaseosos.
8
Pero oponiéndose al planteamiento de Maxwell, que decía que un electrón que giraba en torno al núcleo radiaba continuamente energía electromagnética hasta perder toda su fuerza y acabaría cayendo en el núcleo.
MODELO DE BOHR
Este modelo explica perfectamente el comportamiento de los electrones de hidrógeno, ya que tiene solo 1 electrón y 1 protón. El modelo consistía en:
-
El electrón tiene ciertos estados definidos según el movimiento y ocupan determinadas órbitas.
-
El electrón si esta en la misma órbita no varia, pero si cambia a otra, absorbe o desprende energía.
-
Cuando el átomo tiene muy poca o ninguna energía, el electrón se encuentra en la capa u órbita más cercana al núcleo.
-
Los electrones pasan de una órbita a otra de manera consecutiva sin pasar de 2 en 2.
-
Cuando los electrones pasan de una órbita externa a otra inferior o más cercana al núcleo la energía vuelve en forma de radiaciones.

Niels Boro
10- LOUIS VICTOR BROGLIE
Louis Victor príncipe de Broglie era un físico francés que recibió el premio Nobel de física en 1929, que en 1924,contribuyó de manera fundamental al
9
desarrollo de la teoría cuántica , porque trató de racionalizar la doble naturaleza de la materia y la energía, comprobando que las dos están compuestas de corpúsculos y tienen propiedades ondulatorias.
11- W. KARL HEISENBERG
Werner Karl Heisenberg fue un físico alemán del siglo XX que desarrolló un sistema de mecánica cuántica y cuyo principio de incertidumbre ha ejercido una gran influencia en la física y en la filosofía. Heisenberg desarrolló un importante avance en la teoría de la estructura atómica. En 1925 comenzó a desarrollar un sistema de mecánica cuántica llamada mecánica matricial en el que la formulación matemática se basa n las frecuencias y amplitudes de las radiaciones absorbidas y emitidas por el átomo.
12- ERWIN SCHRÖDINGER
Edwin Schrödinger era un físico austriaco, que ganó un premio Nobel en física el año 1933 por sus estudios de la mecánica ondulatoria y sus aportaciones a la estructura atómica. Schrödinger publicó en 1926 una rigurosa descripción matemática de las ondas estacionarias discretas que describen la distribución de los electrones dentro del átomo.
13- MODELO DE LAS CAPAS ELECTRÓNICAS
Este modelo fue desarrollado por muchos científicos de todo el mundo, esta basado en el modelo de Bohr ya que solo explica el comportamiento de los átomos de hidrógeno que tienen 1 electrón y 1 protón. Explica:
-
Los átomos están formados por un núcleo y los electrones, el núcleo esta formado por protones y neutrones.
10
-
Los electrones están en las capas electrónicas.
-
Los átomos con la mínima energía tienen los electrones en las capas más cercanas al núcleo.
-
Según el tipo de capas electrónicas, las más cercanas o las más lejanas al núcleo, los átomos se distribuyen de una forma determinada. Esta distribución se llama configuración electrónica.
Configuración electrónica
1ª capa más cercana: puede tener hasta 2 electrones
2ª capa más cercana: puede tener hasta 8 electrones
3ª capa más cercana: puede tener hasta 18 electrones
4ª capa más cercana: puede tener hasta 18 electrones
5ª capa más cercana: puede tener hasta 18 electrones
- Las capas electrónicas se superponen de forma regular hasta un máximo de 7 capas pero ningún átomo existente tiene la 7ª capa llena
14- JAMES CHADWICK
James Chadwick era un físico y químico británico que descubrió en el 1932 el neutrón y que en 1935 recibió un premio Nobel por su descubrimiento.
11
EL ÁTOMO ACTUAL
El átomo en la actualidad tras muchas investigaciones se ha llegado a la conclusión que:
-
Esta compuesto por un núcleo y una corteza
-
En el núcleo se encuentran los neutrones (son partículas nucleares sin carga) y por protones (son partículas nucleares con carga positiva). Tienen la misma masa.
-
La corteza esta constituida por electrones, estos giran en órbitas
-
El tamaño del átomo está determinado por el movimiento de los electrones alrededor del núcleo por las órbitas
-
En todos los átomos el número de protones es igual al número de electrones. En la tabla periódica el número de electrones y protones está determinado por el número atómico.
-
A la suma de los neutrones y los protones se le denomina número másico.
Hay átomos de un mismo elemento que tiene algunas variables en el número másico por lo que quiere decir que no se diferencia en el número de electrones y protones, sino que se diferencian en el número de neutrones.
12
ÍNDICE
Introducción……………………………………………….Pág. 2
Modelos atómicos:
-
Filósofos………………………………………………….Pag. 3
-
Científicos europeos……………………………………...Pag. 3
-
John Dalton……………………………………………….Pág. 4
-
Amadeo Avogadro………………………………………..Pág. 5
-
Dmitri Mendeléiev………………………………………..Pág.5
-
Joseph John Thomson…………………………………….Pág.5-6
-
Ernest Rutherford…………………………………………Pág.7
-
Max planck……………………………………………….Pág. 8
-
Niels Bohr………………………………………………...Pág. 8-9
-
Louis Victor Broglie……………………………………...Pág. 9
-
W. Kart Heisenberg……………………………………....Pág. 10
-
Erwin Schrödinger………………………………………..Pág. 10
-
Capas electrónicas………………………………………..Pág. 10-11
-
James Chadwick………………………………………….Pág. 11
El átomo actual…………………………………………….Pág. 12
Conclusiones………………………………………………Pág. 13
Bibliografía………………………………………………..Pág. 14
1
CONCLUSIONES
-
No se sabe a ciencia cierta como son los átomos porque, quizás, con el tiempo, se obtengan nuevas teorías que demuestren cambios…
-
Los científicos empezaron a interesarse por el átomo tras la llegada de la ciencia experimental donde empezaron a estudiar la posibilidad de llegar a saber la estructura, carga eléctrica…
-
Todos los científicos han tenido que aguantar largos años estudiando los átomos para poder formular leyes y teorías y haber realizado muchos experimentos.
-
Muchos científicos han empleado toda su vida a la ciencia y no han sido dados a conocer. Muchos de ellos se han dado a conocer varios años después de su muerte porque se han dado cuenta que crearon modelos que después han resultado ser ciertos.
13
BIBLIOGRAFÍA
He extraído la información de los siguientes lugares de consulta:
-
De la Encarta 2000
-
Y de las páginas web siguientes:
· www.monografias.com/trabajos/atomo/atomo.shtml
· www.soko.com.ar/Fisica/cuantica/Atomo.htm
· www.rincondelvago.com/modelos-atomicos_3.html
· www.rincondelvago.com/atomo_historia-e-investigadores.html
·www.es.encarta.msn/Encyclopedia_761567432/Atomo.html
14
Átomos y Modelos Atómicos
ASIGNATURA: FÍSICA Y QUÍMICA
Descargar
| Enviado por: | Oscar Granel |
| Idioma: | castellano |
| País: | España |
