Biología, Botánica, Genética y Zoología
Metabolismo de las lipoproteínas
Metabolismo de las lipoproteínas
Introducción
El principal almacén de energía del organismo es un compuesto hidrofílico, el triacilglicerol. Otras moléculas hidrofóbicas desempeñan papeles importantes en la función celular, particularmente el colesterol y sus ésteres (ésteres de colesterol). Por ello se han desarrollado mecanismos que permitan transportar por sangre estos compuestos no solubles en agua.
Los ácidos grasos no esterificados son transportados por el citoplasma unidos a albúmina. Algunos micronutrientes y reguladores metabólicos solubles en lípidos —como las vitaminas liposolubles y las hormonas esteroideas— son transportados por plasma mediante proteínas transportadoras específicas. como la globulina que une cortisol, que transporta cortisol. Tanto los triacilgliceroles como el colesterol son transportados en estructuras especializadas, conocidas con el nombre de lipoproteínas. Los triacilgliceroles y el colesterol son transportados por el mismo sistema, por lo que sus metabolismos están íntimamente interrelacionados.
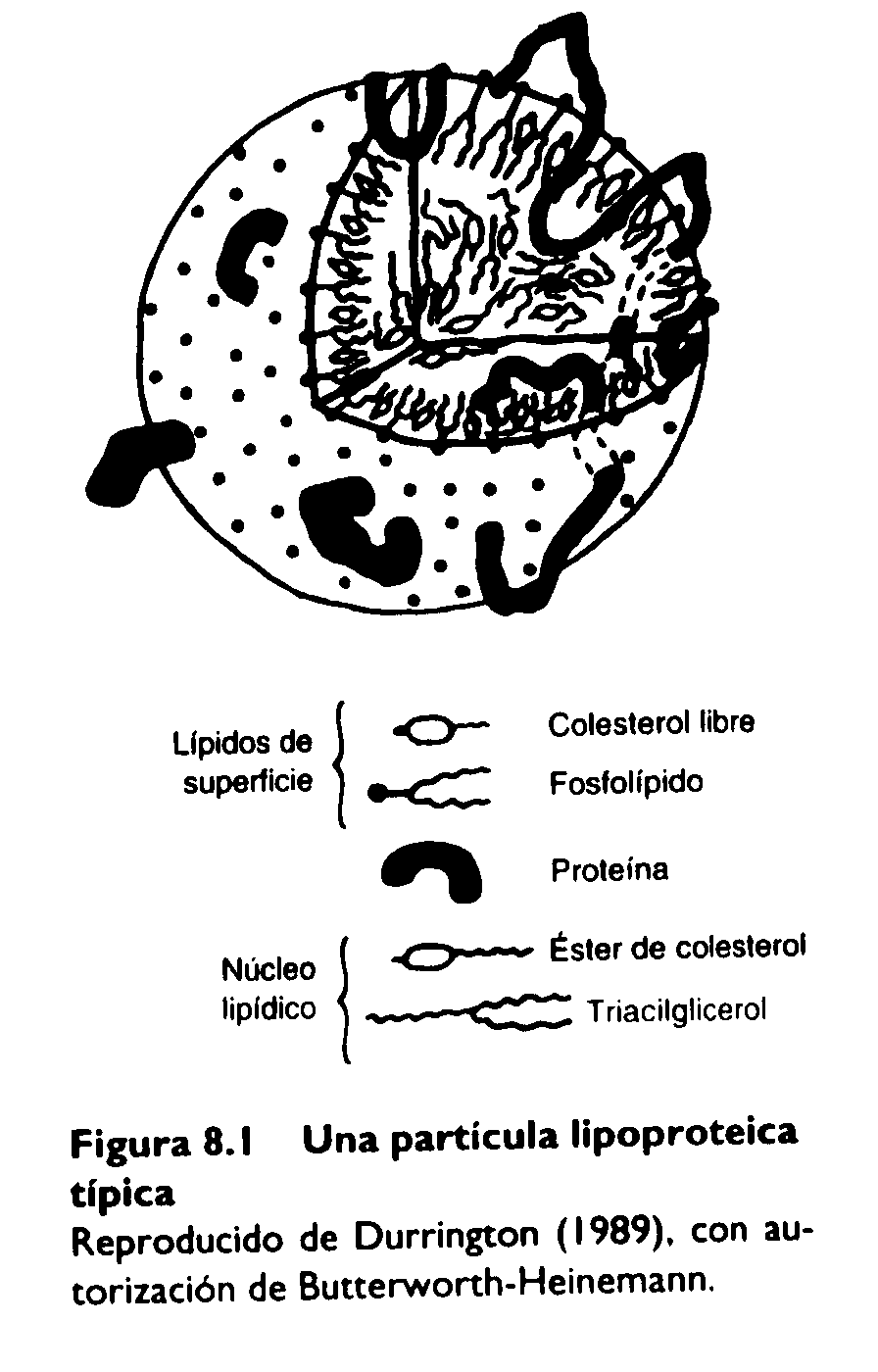
Las lipoproteínas son partículas que tienen una zona central (“corazón”) altamente hidrofóbica y una superficie externa relativamente hidrofílica. Una partícula lipoproteica típica (Figura 8.1) consta de un corazón de triacilglicéridos y de ésteres de colesterol, y de una lámina superficial externa formada por fosfolípidos y colesterol libre. Los ésteres de colesterol son muy hidrofóbicos. A efectos comparativos, el colesterol libre (no esterificado) tiene propiedades anfipáticas debido a su grupo hidroxilo. Cada partícula está asociada con una o más moléculas de proteína, las apolipoproteínas, las cuales tienen dominios hidrofóbicos que se “sumergen” en el corazón de la lipoproteína y anclan la proteína a la partícula, y dominios hidrofílicos que están expuestos en la superficie de la lipoproteína.
Las lipoproteínas forman un heterogéneo grupo de partículas de diferente composición lipídica y proteica, y de diferente tamaño. Tradicionalmente se han separado en grupos, o fracciones, sobre la base de su movilidad electroforética o de su coeficiente de flotación en una ultracentrífuga. Esta segunda técnica ha dado lugar a un sistema de clasificación, más habitual, que nosotros usaremos aquí. Las fracciones aisladas en una ultracentrífuga también tienen algunas diferencias funcionales. Sin embargo, las diferencias no son absolutas, y cada fracción de ultracentrífuga puede estar formada por un abanico de partículas de funciones algo diferentes entre sí.
En la Tabla 8.1 se presentan las características de las principales fracciones de lipoproteínas. Los quilomicrones y las lipoproteínas de muy baja densidad (VLDL, de very-low-density lipoprotein) son relativamente ricas en triacilgliceroles, por lo que a menudo se denominan lipoproteínas ricas en triacilgliceroles; principalmente participan en el transporte de triacilgliceroles a los tejidos. Las lipoproteínas más pequeñas (LDL, de low-density lipoprotein y HDL, de high-density lipoprotein) participan más en el transporte de colesterol entre las células..
![]()
Principales apolipoproteínas que participan en el metabolismo de las lipoproteínas
Apolipoproteínas Al y A2
Estas apolipoproteínas no están relacionadas entre sí, excepto en que a menudo se presentan juntas en las fracciones lipoproteicas. La mejor caracterizada es la Al. Tiene una masa molecular relativa (Mr) de 28000 (243 restos de aminoácido) y tiene dos funciones principales. Es un activador de la enzima lecitin-colesterol acil-transferasa. Además, su secuencia de aminoácidos contiene seis secuencias repetidas de 22 aminoácidos cada una, que se empaquetan formando hélices * con caras fuertemente polares y caras fuertemente no polares. Por lo tanto, tiene propiedades anfipáticas, que le permiten unirse muy fuertemente a varia clases de lípidos, incluyendo los fosfolípidos y el colesterol. Esta propiedad puede proporcionarle un papel especial en la interacción con membranas celulares, “recogiendo” colesterol de las células. Se sintetiza en las células del intestino delgado y de hígado.
Apolipoproteína B
Es una lipoproteína muy grande que se encuentra en los quilomicrones, las VLDL y las LDL Existen dos isoformas: la apolipoproteína B100 y la apolipoproteína B48. La primera está formada por 4536 restos de aminoácido (Mr 513000). La apolipoproteína B48 es como la B100, pero su aminoácido N-terminal es el aminoácido 2152 de la B100 (Mr 241000), es decir, representa alrededor del 48% de la molécula de apolipoproteína B100 (de ahí el nombre de ambas lipoproteínas). La apolipoproteína B48 está sintetizada a partir del mismo gen que la apolipoproteína B100, pero editada del RNA mensajero con un codón de stop . Es sintetizada en las células intestinales e incorporada en los quilomicrones, mientras que la B100 es producida en el hígado e incorporada en las VLDL. Como las partículas LDL son producidas a partir de las LDL, también contienen B100. Únicamente hay una sola molécula de apolipoproteína B (sea B100 o B48) por partícula lipoproteica: rodea toda la partícula, y su región hidrofóbica “se sumerge” en el corazón hidrofóbico, anclándola. Actúa como un ligando de receptor.
Apolipoproteínas Cl, C2 y C3
Como las apolipoproteínas A, las apolipoproteínas C no están relacionadas estructuralmente entre sí, pero a menudo se encuentran juntas. La apolipoproteína C2 es la mejor conocida. Es una proteína de Mr 8900, con 78 residuos de aminoácido. Es un activador esencial de la lipoproteína lipasa. Así, la lipoproteína lipasa únicamente puede actuar sobre los triacilgliceroles de las partículas que contengan apolipoproteína C2. Es sintetizada en el hígado.
Apolipoproteína E
Es una proteína de Mr 34000 (229 residuos de aminoácido), que se presenta en tres isoformas principales (E2, E3 y E4). Cada persona tiene dos alelos: un individuo puede ser E2/E3, o E3/E3, etc. Las apolipoproteínas E actúan como ligandos de receptor. Las diferentes isoformas tienen diferentes afinidades para el receptor, lo cual contribuye a la variabilidad en las concentraciones de lipoproteínas de una población. La apolipoproteína E se encuentra asociada a las partículas ricas en triacilgliceroles, los quilomicrones y las VLDL y también a las HDL. Es sintetizada en muchos tejidos, pero probablemente la fuente principal de apolipoproteína E en plasma es el hígado.
Algunas enzimas importantes que participan en el metabolismo de las lipoproteínas
Lipoproteína lipasa
Esta enzima se halla en varios tejidos extrahepaticos, especialmente en el tejido adiposo, el músculo esquelético y el músculo cardíaco. Es sintetizada en el interior de las células de los tejidos (por ejemplo, en los adipocitos) y es exportada a los capilares, donde se une a las células endoteliales. Allí se une (por enlaces no covalentes) a cadenas de glucosaminoglucanos cargadas muy negativamente, como el heparán sulfato. La lipoproteína lipasa actúa sobre las partículas lipoproteicas que atraviesan los capilares, hidrolizando las moléculas de triacilgliceridos y liberando ácidos grasos no esterificados, los cuales pueden ser captados por los tejidos subyacentes y reesterificados (y así, almacenados, principalmente en el tejido adiposo) u oxidados (en el músculo). Únicamente puede actuar si las partículas contienen apolipoproteína C2. La actividad lipoproteína lipasa del tejido adiposo es activada por la insulina, en un tiempo relativamente corto (unas horas). En el músculo es ligeramente inhibida por la insulina, pero su actividad aumenta con el ejercicio (tanto agudo como de entrenamiento).
Lipasa hepática
Esta enzima está relacionada estructuralmente con la lipoproteína lipasa, pero tiene varias características diferentes. No requiere apolipoproteína C2 para expresar su actividad, y se halla presente en el hígado. Es más activa sobre las partículas ricas en triacilgliceroles pequeños, mientras que la lipoproteína lipasa es mas activa sobre las grandes; más adelante discutiremos el significado de esta diferencia. Además, puede hidrolizar tanto triacilgliceroles como ésteres de colesterol.
Lecitín-colesterol aciltransferasa
Esta enzima procede del hígado, pero se halla en plasma. Está asociada a las partículas que contienen apolipoproteína Al (que la activa). Transfiere un ácido graso de la posición 2 del fosfolípido lecitina a una molécula de colesterol no esterificado, formando de este modo un éster de colesterol.
Metabolismo de los quilomicrones: la vía exógena
A menudo, al metabolismo de los quilomicrones se le denomina la vía exógena del metabolismo de las lipoproteínas. Exógeno significa “desde el exterior del organismo”, y esta vía transporta la grasa de la dieta. La vía se resume en la Figura 8.2.
Los triacilgliceroles y el colesterol son absorbidos y reesterificados en las células de la pared intestinal, y secretados como partículas de quilomicrón, a través de los vasos linfáticos, a la circulación. Las partículas de quilomicrón acabadas de secretar están formadas por un corazón de ésteres de colesterol y de triacilgliceroles, y de una superficie formada por colesterol no esterificado, fosfolípidos y las apolipoproteínas B48 y Al.
En la circulación, los quilomicrones interactúan con otras partículas, de forma que algunas de las apolipoproteínas más pequeñas pasan de unas partículas a otras, probablemente por difusión pasiva a favor de gradiente de concentración. Concretamente, los quilomicrones adquieren rápidamente apolipoproteína C2, lo cual los hace sustrato de la lipoproteína lipasa cuando atraviesen los capilares de los tejidos que expresan esta enzima, como el tejido adiposo y el músculo.
Entonces, los triacilgliceroles son hidrolizados y las partículas van disminuyendo de tamaño. Pueden seguir pasando por varios capilares y van perdiendo triacilgliceroles. Al mismo tiempo, también van perdiendo parte de la cubierta superficial, disociando algunas moléculas de colesterol no esterificado, de fosfolípidos y de apoproteínas, que son captados por otras partículas, como las HDL.
Las partículas de quilomicrón “reducidas” se conocen como remanentes de quilomicrón. Están relativamente enriquecidas en ésteres de colesterol, ya que han perdido sus triacilgliceroles, y son potencialmente peligrosas. Cuando llegan a tener un cierto tamaño, se vuelven ligandos de receptores del hígado. No se conoce con certeza la naturaleza de este receptor, pero parece que puede ser el receptor de *-2 macroglobulina —actualmente ésta constituye un área de intensa investigación. Así pues, los triacilgliceroles de la dieta son transportados hasta los tejidos, algunas moléculas de colesterol no esterificado entran en la fracción de HDL, y algunas de ésteres de colesterol son transportadas, en las partículas remanentes, hasta el hígado.
Metabolismo de las VLDL y de las LDL
Metabolismo de las VLDL: la vía endógena
En contraste con el metabolismo de los quilomicrones, la vía endógena del metabolismo de las lipoproteínas distribuye los triacilgliceroles desde el hígado hasta otros tejidos. Las partículas VLDL, que son secretadas por el hígado, contienen triacilgliceroles, ésteres de colesterol, apolipoproteína B100 y también pequeñas cantidades de las apolipoproteínas E y C.
Como todas las partículas lipoproteicas, tienen una superficie formada por fosfolípidos y colesterol no esterificado. El contenido de apolipoproteínas E y C de las VLDL aumenta rápidamente cuando las partículas lipoproteicas llegan al plasma, debido a su transferencia desde otras lipoproteínas, principalmente las HDL.
Las partículas VLDL, sustrato de la lipoproteína lipasa en la luz de los capilares, transportan triacilgliceroles desde el hígado hasta otros tejidos. Se trata de un sistema de distribución de energía lipídica entre los tejidos. La hidrólisis de los triacilgliceroles del corazón de las VLDL por la lipoproteína lipasa genera material de superficie redundante que es transferido a otras partículas, de nuevo principalmente las de la fracción HDL. Las partículas resultantes, enriquecidas en ésteres de colesterol, pueden seguir dos vías. Pueden ser captadas directamente por el hígado o por otros tejidos, a través de un receptor que se une a una región homóloga de la apolipoproteína B100 y de la apolipoproteína E. Se denomina receptor B/E, o receptor de LDL. De esta forma, aportan ésteres de colesterol a los tejidos. Alternativamente, pueden permanecer en circulación, van disminuyendo de tamaño por acción de la lipoproteína lipasa y de la lipasa hepática (la cual presenta mayor actividad cuanto menores sean las partículas hasta que pierden todos los componentes de superficie, excepto la apolipoproteína B1OO y una capa de fosfolípidos y de colesterol libre; la zona interior, el corazón de la lipoproteína, está enriquecida en ésteres de colesterol. De hecho, se transforman en partículas de LDL. Por lo tanto, las partículas de LDL son “remanentes de VLDL”.
Metabolismo de las LDL y regulación del contenido celular de colesterol
Las partículas de LDL tienen una vida media relativamente larga en circulación: unos 3 días. Durante este tiempo son relativamente estables metabólicamente. Abandonan la circulación principalmente debido a su captación por varios tejidos a través del receptor de LDL, y así aportan colesterol a los tejidos.
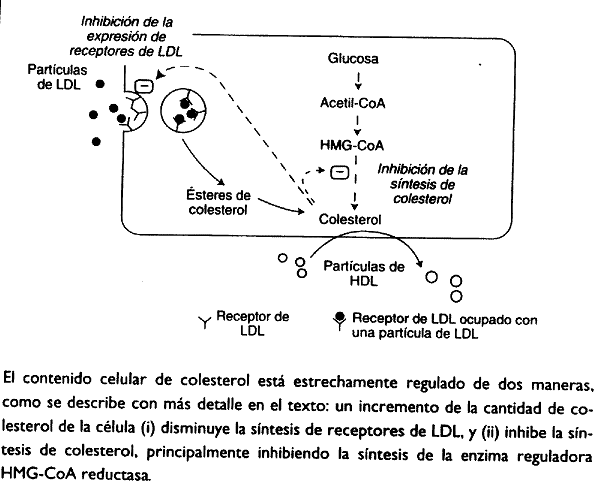
Por lo tanto, el contenido celular de colesterol aumenta en los tejidos que captan partículas de LDL. Esto tiene dos repercusiones. En primer lugar, la biosíntesis de colesterol —que puede producirse en todas las células nucleadas— disminuye principalmente por inhibición de la enzima hidroximetilglutarilCoA reductasa (HMG-CoA reductasa; EC 1.1.1.88).
En segundo lugar, también disminuye la síntesis de nuevos receptores de LDL, de forma que el dímero de receptores que expresa cada célula en su superficie, baja. Por lo tanto, el incremento del contenido celular de colesterol generado por la captación de colesterol-LDL a través de los receptores LDL, se autolimita.
Existe una variación importante de este esquema. Algunas células, especialmente los macrófagos, expresan diferentes receptores que pueden captar LDL. Uno de estos receptores es conocido como receptor basurero (scavenger receptor). Estos receptores no están sujetos a la regulación hacia abajo como la que sufren los receptores de LDL y, por lo tanto, especialmente en individuos que presentan niveles elevados de colesterol de LDL en plasma, los macrófagos pueden resultar excesivamente cargados de colesterol. éste puede ser el inicio dcl proceso de aterosclerosis: deposición de material lipídico en la pared de las arterias, que lleva a una disminución de la luz de las arterias y a un potencial bloqueo del flujo a través de ellas.
El receptor de LDL y la regulación del contenido celular de colesterol
El receptor de LDL es una proteína de Mr 120000 que atraviesa la membrana de la célula; tiene un corto dominio intracelular y un gran dominio extracelular, que tiene el lugar de unión en el extremo N-terminal. Se expresa en la mayoría de las células nucleadas, pero a captación de LDL es especialmente activa en el hígado y en algunos tejidos que necesitan colesterol para determinados procesos biosintéticos como las glándulas adrenales y los ovarios, en los que el colesterol se utiliza como precursor de la síntesis de hormonas esteroideas.
Las partículas de LDL se unen al receptor, el cual entonces es internalizado por endocitosis. El colesterol esterificado contenido en la partícula de LDL es hidrolizado en los lisosomas. generando colesterol libre que pasa a formar parte del acervo de colesterol de la célula. Este colesterol es utilizado para incorporarlo a la membrana, para síntesis de hormonas esteroideas y, en el hígado, para síntesis de ácidos biliares y para la formación de VLDL Además, algo de colesterol es reesterificado, dando lugar a ésteres de colesterol, que pueden ser eliminados de la célula al incorporarse a HDL.
Metabolismo de las HDL
Mientras que las partículas LDL regulan el contenido de colesterol de las células debido a que aportan colesterol, las partículas HDL llevan a cabo el proceso inverso: la eliminación de colesterol, el cual es transportado al hígado para su excreción final.
HDL y transporte reverso de colesterol
Las partículas HDL inician su vida en forma de HDL discoidales, secretadas por el hígado. Las partículas discoidales están formadas principalmente por fosfolípidos y apolipoproteína Al. Reciben colesterol no esterificado que es liberado por la acción de la lipoproteína lipasa sobre las lipoproteínas ricas en triacilgliceroles, como “material de superficie en exceso”. También toman colesterol no esterificado al interaccionar con las células, posiblemente vía un receptor especifico, a pesar de que esta cuestión no está aclarada todavía. De esta forma, las HDL recogen colesterol de las células. El colesterol no esterificado es esterificado por acción de la enzima plasmática lecitin-colesterol aciltransferasa (LCAT; EC 2.3.1.43), que es activada por la apolipoproteína A1. Así las HDL discoidales van adquiriendo un corazón hidrofóbico de ésteres de colesterol, y se transforman en particulas esféricas.
La fracci6n de HDL no es homogénea. Las partículas esféricas, relativamente grandes y ricas en ésteres de colesterol, son conocidas como HDL2. Sus ésteres de colesterol pueden ser captados por el hígado a través de diferentes mecanismos. Puede haber captación mediada por receptor de grandes partículas HDL que contienen apolipoproteína E. Además, parece que se produce una captación hepática de ésteres de colesterol procedentes de las HDL más grandes, quizá a través de la hidrólisis de los ésteres de colesterol por la lipasa hepática. Algo de los ésteres de colesterol de las partículas HDL más grandes es transferido a las lipoproteínas ricas en triacilgliceroles. Esta cesión de ésteres de colesterol da lugar a partículas HDL más pequeñas, denominadas HDL3, las cuales están preparadas para aceptar más colesterol procedente de los tejidos.
Así pues, el colesterol es transferido desde los tejidos periféricos hasta el hígado, desde donde puede ser excretado a través de la bilis, en forma de colesterol o de sales biliares. Este proceso de captación del colesterol de los tejidos, transporte hasta el hígado y excreción final del cuerpo, es el camino opuesto al de aporte de colesterol por la LDL: se conoce como transporte reverso de colesterol (Figura 8.4).
Homeostasis del colesterol en el organismo
El acervo corporal de colesterol es de unos 140 g. De ellos, unos 8 g se encuentran en el plasma, principalmente en las LDL. Cada día entra en el acervo de colesterol alrededor de 1 g de colesterol (400 mg a partir de la absorción intestinal y 600 mg procedentes de biosíntesis), es decir, el recambio de colesterol diario es de menos del 1% del acervo total de colesterol del organismo. Cada día ingerimos en la dieta alrededor de 1 g de colesterol, ya que la absorción de colesterol es incompleta. Existe un recambio de unos 5 g de colesterol plasmático cada día. El colesterol entra al plasma en los quilomicrones y en las partículas VLDL, y desde los tejidos en las HDL, mientras que abandona el plasma en los remanentes de quilomicrón, en las partículas VLDL, en las partículas LDL y eliminándose de las HDL.
También se produce recambio de colesterol en la circulación enterohepática. Las sales biliares formadas en el hígado a partir del colesterol, son secretadas en la bilis y en gran parte reabsorbidas en el íleo. El acervo total de 2,5-4 g de ácidos biliares es reciclado unas dos veces en cada ingesta, es decir, que su recambio es rápido: cada día pasan a la bilis unos 18 g de ácidos biliares, pero alrededor del 90% de ellos son reabsorbidos. En la bilis también se excreta colesterol, a una velocidad aproximada de 1 g/dia; de él, alrededor de la mitad es reabsorbido mientras que el resto es eliminado en las heces.
La circulación enterohepática puede ser interrumpida por resinas, como la colestiramina o el colestipol, que se unen a los ácidos biliares, impiden su reabsorción y provocan su excreción en las heces. Entonces, se transforma una mayor cantidad de colesterol en ácidos biliares, para mantener la cantidad de ácidos biliares aproximadamente constante. Si este tratamiento fuera completamente eficiente, podría suponer la pérdida de 18 g de colesterol cada día —muchas veces superior a la velocidad de recambio del acervo corporal de colesterol. Así, podemos favorecer la disminuci6n de la concentración plasmática de colesterol. Sin embargo, el potente control del contenido celular de colesterol sobre la actividad de Ia HMG-CoA reductasa minimiza este efecto.
Proteína transferidora de ésteres de colesterol
Una proteína circulante, conocida como proteína transferidora de esteres de colesterol (CETP, de cholesteryl ester-transfer protein) cataliza el intercambio de lípidos hidrofóbicos, como los ésteres de colesterol y los triacilgliceroles, entre partículas lipoproteicas (Figura 8.5). Parece que el intercambio se produce por colesterol libre; la zona interior, el corazón de la lipoproteína, está enriquecida en ésteres de colesterol. De hecho, se transforman en partículas de LDL. Por lo tanto, las partículas de LDL son “remanentes de VLDL”.
Regulación del metabolismo de las lipoproteínas
Los procesos del metabolismo de las lipoproteínas están regulados en muchas etapas. La insulina desempeña un papel muy importante en esta regulación.
Insulina y metabolismo de triacilgliceroles
La lipoproteína lipasa del tejido adiposo se activa por insulina. Así, en el periodo post-prandial la eliminación de las lipoproteínas ricas en triacilgliceroles aumenta, y ello ocurre cuando se produce el pico de la concentración de triacilgliceroles en plasma, pocas horas después de una ingesta de lípidos. La eliminación de triacilgliceroles de quilomicrones es un proceso saturable, y tras una ingesta rica en lípidos se satura. Los quilomicrones y las VLDL compiten entre sí- por ser hidrolizados por la lipoproteína lipasa, un proceso que normalmente se denomina mecanismo de eliminación fácilmente saturable. Por razones que no están completamente aclaradas, la lipoproteína lipasa actúa preferentemente sobre las partículas de mayor tamaño, de forma que los quilomicrones tienden a “ganar” en esta competencia. Un corolario de esta competencia es que la velocidad de desaparición del exceso de triacilgliceroles del plasma en el periodo post-prandial es dependiente de la concentración de triacilgliceroles de VLDL de cada individuo: en las personas que tienen concentraciones balas de triacilgliceroles de VLDL, la velocidad de eliminación de triacilgliceroles tras una ingesta tiende a ser más rápida. Además, debido a la competencia entre los triacilgliceroles de quilomicrón y los triacilgliceroles de VLDL por 5cr hidrolizados por la lipoproteína lipasa, normalmente la concentración de triacilgliceroles de VLDL aumenta tras una ingesta de lípidos.
Probablemente resulta beneficioso para el individuo ser capaz de eliminar rápidamente de la circulación el exceso de triacilgliceroles que se produce tras cada ingesta. Por ello, parece sensato que el cuerpo no añada más triacilgliceroles de VLDL al plasma en este periodo. Varios estudios sobre hepatocitos in vitro han demostrado que la insulina inhibe la salida de VLDL a corto plazo. Estos estudios son muy difíciles de llevar a cabo in vivo, pero parece razonable suponer que la secreción hepática de triacilgliceroles de VLDL dependa claramente del aporte de ácidos grasos no esterificados del plasma como sustrato para la síntesis de triacilgliceroles. Estos ácidos grasos son captados por los hepatocitos y esterificados, para ser secretados como triacilgliceroles de VLDL. La concentración de ácidos grasos no esterificados en plasma disminuye tras una ingesta, debido a la inhibición de la lipólisis del tejido adiposo por la insulina. Así pues, la secreción de triacilgliceroles de VLDL es inhibida en este período.
Relación entre las concentraciones plasmáticas de triacilgliceroles y de colesterol de HDL
En estudios realizados sobre un gran número de individuos, habitualmente se observa una relación inversa entre las concentraciones plasmáticas de triacilgliceroles y de colesterol de HDL: cuanto mayores son las concentraciones plasmáticas de triacilgliceroles del individuo, menor tiende a ser la concentración de colesterol de HDL. Vamos a ver cómo se produce esta relación inversa.
Debido a que la hidrólisis de lipoproteínas ricas en triacilgliceroles por la lipoproteína lipasa viene acompasada de la transferencia de colesterol y de otros componentes de superficie, la concentración de HLDL puede aumentar debido a la acción rápida de la lipoproteína lipasa en el período post-prandial. Por otra parte, si la eliminación de triacilgliceroles es lenta, la oportunidad de intercambio de lípidos por acción de la CETP aumenta. Así, las HDL quedan vacías de ésteres de colesterol y los remanentes de lipoproteínas ricas en triacilgliceroles acabarán enriquecidos en ésteres de colesterol. De nuevo, se produce una relación inversa entre las concentraciones de triacilgliceroles plasmáticos y de colesterol de HDL.
Homeostasis de colesterol
Existe un recambio continuo del acervo de colesterol del cuerpo, que es de unos 140 g de colesterol (entre libre y esterificado).
La insulina puede regular el recambio de colesterol en diferentes puntos. La insulina activa la HMG-CoA reductasa por fosforilación reversible, incrementando así la síntesis de colesterol; sin embargo, probablemente este efecto está compensado por el control debido al contenido celular de colesterol. Parece que la insulina también estimula la expresión del receptor de LDL; durante una infusión de insulina, en una situación experimental, aumenta la eliminación de colesterol de LDL, un efecto que también se ha demostrado en hepatocitos cultivados in vitro. No sabemos si esto ocurre en todos los tejidos o solamente en el hígado. Sin embargo, parece que los efectos que ejercen las hormonas sobre la homeostasis del colesterol no deben tener demasiada importancia.
Alteraciones del metabolismo de las lipoproteínas
Colesterol y aterosclerosis
El metabolismo de las lipoproteínas ha ganado importancia debido a su interacción con las enfermedades coronarias. Alteración coronaria significa bloqueo —parcial o completo— de una o varias de las arterias coronarias que aportan la sangre a las paredes musculares dcl corazón (el miocardio). Se inicia debido al desarrollo de cúmulos de grasa en las paredes arteriales (aterosclerosis), los cuales pueden afectar a las arterias de todo el organismo y pueden producir una disminución del aporte de sangre a las extremidades, por ejemplo —Un problema concreto de los grandes fumadores. Cuando afecta al aporte de sangre dcl miocardio, el resultado puede ser fatal. El principio, la restricción de aporte de sangre al miocardio puede provocar dolores torácicos (angina) durante el ejercicio, cuando la demanda dcl miocardio aumenta. Al final, puede producirse el bloqueo completo como resultado de un coágulo de sangre en el lugar de la lesión aterosclenótica —se denomina una trombosis coronaria, un ataque de corazón o un infarto de miocardio. La región dcl miocardio alimentada por la arteria bloqueada, puede necrosarse (morir). A corto plazo, lo más importante son las alteraciones de la contracción del corazón, ya que éste puede empezar a palpitar de forma descoordinada (fibrilación ventricular) o puede pararse completamente (asístole o parada cardiaca). Se trata de una situación muy seria con un elevado riesgo de mortalidad.
El acúmulo de grasa se conoce como placa aterosclerótica. Es una compleja estructura que comprende proliferación de las células musculares lisas de la pared arterial y de tejido conectivo (fibrillas de colágeno) y acúmulo de lípidos ricos en colesterol. Parece que empiezan debido a pequeñas lesiones denominadas estrías lipídicas; se trata de pequeños acúmulos de grasa, que son uno de los primeros síntomas visibles dcl desarrollo de la ateroscicrosis. Las estrías lipídicas se forman por el acúmulo de las llamadas células espumosas, macrófagos que al microscopio parecen estar repletas de espuma debido al acumulo de lípidos, principalmente colesterol. Por tanto, el acúmulo de colesterol es uno de los primeros eventos que se producen en el desarrollo de la aterosclerosis.
La relación entre el colesterol en sangre y las alteraciones coronarias fue descubierta en parte debido a que la incidencia de enfermedades coronarias varía ampliamente entre los diferentes países; en Finlandia, por ejemplo, la incidencia es casi diez veces mayor que en Japón. La concentración media de colesterol en sangre también varía ampliamente de un país a otro, y lo hace exactamente en paralelo con la incidencia de alteraciones coronarias (Figura 8.6).
En cada uno de los países, la incidencia de alteraciones coronarias también vana con la concentración plasmática de colesterol. Estos datos son epidemiológicos, y hemos de ser muy cuidadosos a la hora de interpretarlos —quizá unos niveles elevados de colesterol en plasma conduzcan al desarrollo de enfermedades coronarias, pero puede ser igualmente válido que la gente que tenga alteraciones coronarias, por alguna razón, desarrolle concentraciones elevadas de colesterol en plasma. Sin embargo, varios estudios a largo plazo en los que disminuían las concentraciones plasmáticas de colesterol en personas de alto riesgo de padecer alteraciones coronarias, mostraron que la disminución de la concentración de colesterol reduce ci riesgo de enfermedades coronarias.
Condiciones que conducen a un incremento de la concentración de lípidos en sangre
La concentración media de colesterol en sangre en el Reino Unido es de unos 6 mmol/l, del cual, la mayor parte, alrededor de 4 mmol/l, está en la fracción de LDL. La concentración media de triacilgliceroles en sangre tras el ayuno de una noche es aproximadamente de 1-2 mmol/l. Un aumento de la concentración de lípidos en sangre se denomina hiperlipemia. Habitualmente ello supone una elevación de la concentración de colesterol, ya que en sangre hay mis cantidad de colesterol que de triacilgliceroles. Cuando es necesario distinguir la contribución de los diferentes lípidos, un incremento de la concentración de colesterol se denomina hipercolesterolemia y Un incremento de la concentración de triacilgliceroles se denomina hipertrigliceridemia. (La palabra “triacilglicerol” se reemplaza pon el antiguo término “triglicérido”, ya que los médicos no están dispuestos a quedarse con la palabra “hipertriacilglicerolemia”.)
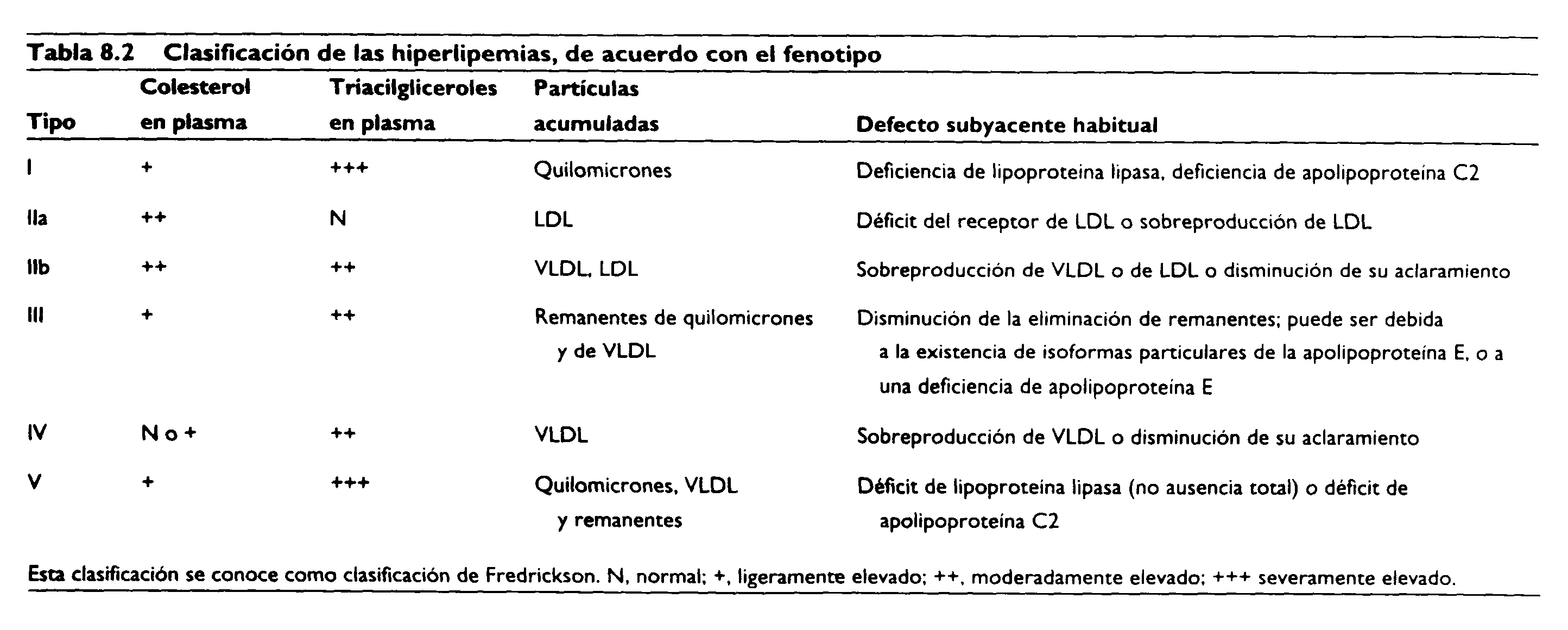
La concentración de lípidos en sangre puede ser elevada debido a una predisposición genética (hiperlipemia primaria) o a factores ambientales (hiperlipemia secundaria). Una clasificación alternativa se basa en el fenotipo, sin considerar la causa subyacente, aunque a veces la causa puede inferirse del fenotipo (Tabla 8.2).
Hiperlipoproteinemias primarias
Las hiperlipoproteinemias más dramáticas son las conocidas como la hipercolesterolemia familiar, un incremento hereditario de la concentración sanguínea de colesterol, y la hiperlipoproteinemia de Tipo I (Tabla 8.2) o síndrome de quilomicronemia.
La hipercolesterolemia familiar se manifiesta como un aumento consistente de la concentración de colesterol en sangre, típicamente entre 8 y 10 mmol/l en individuos heterocigotos para esta enfermedad, pero cercanos a 15-20 mmol/l en individuos homocigotos (es decir, que tienen dos copias del gen que genera la enfermedad). La incidencia de enfermedades coronarias en estos individuos es muy elevada, si no son tratados de forma adecuada para hacerles bajar la concentración de colesterol. Ésta es otra razón que nos induce a creer que existe una relación causa-efecto directa entre el aumento de la concentración de colesterol en sangre y el desarrollo de aterosclerosis. El defecto que da lugar a la enfermedad de la hipercolesterolemia familiar se encuentra en la secuencia de aminoácidos del receptor de LDL: el receptor no se une de forma normal a las partículas LDL, por lo que éstas permanecen en circulación. Recientemente han sido descubiertos varios casos que presentan un defecto en la secuencia de apolipoproteína B, lo cual da lugar a un síndrome muy similar al de la hipercolesterolemia familiar.
Debido a que el colesterol de las lipoproteínas no es captado por las células, el proceso de biosíntesis de colesterol no está inhibido, lo cual agrava todavía más el problema. La forma preferente de tratamiento de estos enfermos es la utilización de fármacos (Las estatinas) que inhiben el proceso de síntesis de colesterol en la enzima HMG-CoA reductasa. Una ingesta pobre en colesterol también ayuda, así como la ingesta de sustancias (resinas) que unen colesterol y sales biliares en el intestino, impidiendo su reabsorción.
La hiperlipoproteinemia de Tipo I también es una enfermedad genética, en la cual se acumulan quilomicrones en el plasma, lo cual le confiere un aspecto lechoso. Las alteraciones más importantes, aparte del caso de la hipercolesterolemia familiar, no se producen por el acúmulo de colesterol, sino por el de triacilgliceroles. La concentración plasmática de triacilgliceroles puede alcanzar los 50, o incluso los 100 mmol/l. Es interesante constatar que la gente que padece esta alteración no tienen mayor riesgo de padecer enfermedades coronarias. La gente con hipertrigliceridemias tienen riesgo de padecer inflamaciones del páncreas (pancreatitis). Esto puede ser muy serio: si los jugos pancreáticos, con sus potentes enzimas digestivas, entran en la cavidad abdominal, los efectos pueden ser peligrosos para la vida. Por esta razón, la enfermedad ha de ser tratada, y ello puede hacerse de una manera muy efectiva mediante una dieta baja en lípidos: sin grasas en la dieta, los quilomicrones no se acumulan. La hiperlipoproteinemia de Tipo I está causada, habitualmente, por una deficiencia de lipoproteína lipasa. Normalmente esta condición se detecta en individuos que son homocigotos para el defecto; los heterocigotos tienen suficiente actividad lipoproteína lipasa para eliminar, de forma relativamente normal, los quilomicrones de la sangre. En algunos casos, la actividad lipoproteína lipasa es normal; los pacientes carecen de apolipoproteína C2, ci cofactor esencial para la actividad lipoproteína lipasa.
Hiperlipoproteinemias secundarias
Las hiperlipoproteinemias secundarias se producen a causa de la dieta, de factores corporales (como la obesidad) o debido a otras enfermedades (como la diabetes mellitus).
La concentración media de colesterol en sangre varia ampliamente de un país a otro. Ello puede reflejar diferencias genéticas raciales, pero parece que no es el caso. Los japoneses que se han trasladado a Estados Unidos tienen concentraciones de colesterol y frecuencias de enfermedades coronarias más elevadas, o al menos iguales, que los otros residentes en Estados Unidos. Algo del estilo de vida del Japón hace que la concentración de colesterol se mantenga baja, y la evidencia sugiere que este factor es la dieta.
Los ácidos grasos de la dieta condicionan, de forma mucho más importante que el propio colesterol de la dieta, la concentración de colesterol en suero. El mecanismo a través del cual los ácidos grasos afectan a la concentración plasmática de colesterol no está completamente aclarado, a pesar de que se sabe que probablemente participan dos mecanismos. Parece que los ácidos grasos saturados del hígado afectan a la distribución del colesterol hepático entre las formas esterificada y no esterificada. En presencia de ácidos grasos saturados, se produce una menor transformación de colesterol no esterificado a colesterol esterificado. Debido a que el contenido de colesterol no esterificado de los tejidos es lo que regula la expresión del receptor de LDL, este cambio conduce a una disminución de la expresión de los receptores hepáticos de LDL y, por lo tanto, a un aumento de la concentración plasmática de LDL. La lipoproteína lipasa tiene preferencias por determinados ácidos grasos de ciertas posiciones de las moléculas de triacilglicerol. Actúa más lentamente sobre moléculas de triacilglicerol que tengan un ácido graso saturado en el carbono central del glicerol (C2). Por lo tanto, el aclaramiento de las partículas lipoproteicas que contengan ácidos grasos saturados disminuye, lo cual puede dirigir los remanentes de las partículas lipoproteicas hacia diferentes procesos o tejidos que en caso contrario podrían haberlas aclarado no tan rápidamente. Sin embargo, esto todavía no está completamente entendido.
Colesterol de HDL, triacligliceroles plasmáticos y enfermedades coronarias
En estudios realizados sobre grandes cantidades de individuos, se ha observado una relación inversa entre las concentraciones plasmáticas de triacilgliceroles y de colesterol de HDL. A partir de estudios de este tipo también es evidente que, a diferencia de lo que ocurre con el colesterol de LDL, un aumento de la concentración del colesterol de HDL está asociado a una disminución del riesgo de enfermedades coronarias. Así, debido a la relación inversa entre las concentraciones plasmáticas de triacilgliceroles y colesterol de HDL, un aumento de la concentración plasmática de triacilgliceroles está asociado a un aumento dcl riesgo de enfermedades coronarias. Esta correlación entre triacilgliceroles plasmáticos y riesgo de enfermedades coronarias no está tan bien definida como la de colesterol de LDL: por ejemplo, la gente que tiene niveles plasmáticos de triacilgliceroles extremadamente elevados debido a una deficiencia de actividad lipoproteína lipasa no tienen un riesgo elevado de enfermedades coronarias.
Existen dos hipótesis sobre la relación entre estas concentraciones y el riesgo de enfermedades coronarias. En primer lugar, el colesterol de HDL puede, por si mismo, estar asociado con una protección contra las enfermedades coronarias, debido a que las HDL son un buen índice de la eficiencia del transporte reverso de colesterol, la eliminación de colesterol de los tejidos.
Alternativamente, concentraciones bajas de colesterol de HDL (y, por tanto, aumentos de riesgo) pueden ser un índice de algún defecto del metabolismo de las lipoproteínas ricas en triacilgliceroles. Una implicación de este hecho consiste en que las partículas remanentes permanecen durante más tiempo en la circulación, mientras su tamaño se va reduciendo hasta ser suficientemente pequeñas como para ser captadas por mecanismos mediados por receptor. Estos remanentes pueden ser captados iniciando la formación de lesiones ateroscleróticas. En el caso de las VLDL, está claro ya que los remanentes de VLDL son las LDL. Pero en el caso de los quilomicrones, sus partículas remanentes han generado más sospechas, no sólo debido a que una partícula de quilomicrón puede contener 30 veces más moléculas de colesterol (libre y esterificado) que una molécula típica de LDL (quilomicrón, 60000; partícula de LDL, 2000).
La idea que un remanente de quilomicrón tiene un elevado potencial aterogénico explica claramente por que la gente que tiene deficiencia de actividad lipoproteína lipasa, con unas concentraciones plasmáticas de triacilgliceroles enormemente elevadas, tiene un riesgo de padecer enfermedades coronarias muy bajo; si sus partículas lipoproteicas no son metabolizadas en absoluto, no se producirán remanentes pequeños. Desde este punto de vista, es mejor que el metabolismo de las lipoproteínas ricas en triacilgliceroles sea “perezoso” que no que este inhibido completamente. Una situación como ésta puede producirse por un cambio genético de la secuencia de la lipoproteína lipasa, de forma que la enzima es menos eficiente de lo normal. Alternativamente, puede reflejar un aumento de la concentración de triacilgliceroles de VLDL, que disminuirá la eficiencia de aclaramiento de los triacilgliceroles de quilomicrones, debido a la competencia entre ambos tipos de lipoproteínas por la Iipoproteína lipasa. A su vez, ello puede ser debido a un aumento de la síntesis de VLDL o a una disminución de su utilización. Estas dreas son temas actuales de estudio.
Influencia de la dieta sobre la concentración sérica de colesterol
La cantidad de colesterol en la dieta no es un factor que afecte demasiado a la concentración de colesterol en sangre. Comemos aproximadamente 1 g de colesterol al día, mientras que la cantidad de colesterol en todo el cuerpo es de unos 140 g, de los cuales alrededor de 8 g están en el plasma. Por el contrario, en cada comida ingerimos una cantidad de glucosa varias veces superior a la cantidad de glucosa que tenemos en sangre. El colesterol no es absorbido rápidamente, a diferencia de lo que ocurre con la glucosa: entra en el plasma lentamente, como los triacilgliceroles. Además, la ingesta de colesterol hace que el colesterol entre a las células, y éste suprime de forma eficiente la síntesis de más colesterol. A los individuos con hipercolesterolemia familiar, una dieta pobre en colesterol puede ayudarles, pero en la mayoría de nosotros la concentración de colesterol en sangre está relacionada más estrechamente con la ingesta de ácidos grasos saturados.
Ácidos grasos en la dieta
La evidencia inicial de que los ácidos grasos aumentan las concentraciones de colesterol fue epidemiológica: se observó que las amplias diferencias en la concentración de colesterol en plasma entre diferentes países se correlacionaba con el consumo de ácidos grasos saturados. Posteriormente, estudios más detallados han demostrado que se trata de una sobre-simplificación. Determinados ácidos grasos saturados son más responsables que otros: el ácido esteárico (C18:0) parece ser relativamente inerte, mientras que el ácido palmítico (C16:0) y el ácido mirístico (C14:0) aumentan la concentración de colesterol. Los ácidos grasos monoinsaturados —de los que el ácido oleico (C18:1 ), que se encuentra en el aceite de oliva, es el ejemplo más común de la dieta— son relativamente neutros, mientras que los ácidos grasos poliinsaturados, como el ácido linoleico (C18:2) y el ácido linolénico (C18.3) disminuyen la concentración de colesterol.
Un cambio en el contenido de ácidos grasos de la dieta produce un cambio claramente predecible en la concentración de colesterol en suero; se ha diseñado una fórmula que permite este cálculo:
* colesterol en suero = 0,026 x (2,16*S — 1 ,65*P + 6,66*C — 0,53)
donde * colesterol en suero representa la variación de la concentración de colesterol en suero (mmol/I), *S la variación de ácidos grasos saturados en la dieta (expresada como porcentaje de energía derivada de ellos). *P la variación de ácidos grasos poliinsaturados en la dieta, y *C la variación de colesterol en la dieta (en 100 mg/dia). El factor 0,026 convierte de mg/dl a mmol/I. (A partir de Hegsted et al., 1965.)
El punto más importante es que los efectos negativos de los ácidos grasos saturados de la dieta son más potentes que los efectos beneficiosos de los ácidos grasos poliinsaturados (en la ecuación, el factor de *S es mayor que el de *P); así, resulta más conveniente eliminar de la dieta productos lácteos como la mantequilla, que contienen una elevada proporción de ácidos grasos saturados, que aumentar el consumo de aceites vegetales que contienen más ácidos grasos insaturados.
Hay que destacar algunos puntos. Un solo cambio puede producir una diferencia insignificante en el riesgo de padecer enfermedades coronarias en cualquier individuo, mientras que para cambiar este riesgo quizá hay que modificar también otros factores del estilo de vida (como dejar de fumar, hacer ejercicio físico, controlar el peso corporal). Mucha gente cree que el consumo de ácidos grasos insaturados engorda menos que el de productos lácteos: esto no es así. Recientemente está apareciendo otro problema. Las margarinas se fabrican endureciendo aceites vegetales insaturados por el proceso de hidrogenación —reducción de algunos de sus dobles enlaces. En este proceso, algunos de los dobles enlaces se transforman en la configuración trans en lugar de la configuración habitual cis. Ahora existen evidencias de que los ácidos grasos trans-saturados pueden predisponer a las enfermedades cardiacas.
ANEXO I
| Influencia de la práctica y cese del ejercicio físico moderado en las lipoproteínas plasmáticas J.A. Carbayoa, C. González-Moncayob, J. Gómez Lópezc, J. Carbayob y J. Fernández Pardod aSección de Sanidad. Base Aérea de Albacete. bAnálisis Clínicos. cComplejo Hospitalario de Albacete. dUnidad de Hipertensión y Lípidos. Hospital General Universitario de Murcia. Uno de los efectos saludables del ejercicio físico es el cambio favorable que ejerce en el metabolismo lipoproteico. Sin embargo, no hay acuerdo unánime acerca del papel del ejercicio moderado ni tampoco de la duración de sus efectos una vez ha cesado la práctica de la actividad física. Hemos medido el efecto de la realización de ejercicio físico aeróbico, de 45 min por sesión, cuatro veces por semana y con un consumo energético medio de 8,44 kcal/min (1.519 kcal por semana) en 27 varones jóvenes, con una media de edad de 24,8 ± 3,3 (media ± DE) años, no dislipémicos, sometidos a un régimen de vida y dieta muy similares que seguían el Curso de Formación Básica para Policías Locales de Castilla-La Mancha. Los individuos fueron evaluados (cuestionario, exploración física y extracción de sangre venosa en ayunas) en cinco ocasiones: a) a la semana de su ingreso (primera fase); b) tras 8 semanas de entrenamiento (segunda fase); c) tras un período de descanso de 3 semanas (tercera fase); d) después de un nuevo período de entrenamiento de 5 semanas de duración (cuarta fase), y e) tras 4 días del cese del programa de ejercicio físico (quinta fase). Hemos observado cambios porcentuales favorables en las fases de realización del ejercicio: el 2,4% de colesterol total (CT) (p < 0,01), el 3,4% de triglicéridos (p < 0,05), el 5,0% de colesterol transportado por las lipoproteínas de baja densidad (cLDL) (p < 0,001) y el +4,0% de colesterol transportado por las lipoproteínas de alta densidad (cHDL) (p < 0,001) en la segunda fase, y el 2,7% de CT (p < 0,01), el 4,0% de triglicéridos, el 6,1% de cLDL (p < 0,001) y el +7,1% de cHDL (p < 0,001) en la cuarta fase. Incluso en la segunda fase se incrementó el peso (+2,32% [p < 0,001]) y el índice de masa corporal (IMC) (+2,32% [p < 0,001]), situación que permaneció sin cambios en el resto de las fases. Los valores medios regresaron a la situación previa en las fases de inactividad física: el +3,2% de CT, el +19,4% de triglicéridos (p < 0,001), el +6,5% de cLDL, el 6,4% de cHDL (p < 0,001) en la tercera fase, y el +2,4% de CT, el +6,7% de triglicéridos, el +6,6% de cLDL y el 6,6% de cHDL (p < 0,01) en la quinta fase. Nuestros resultados demuestran que la práctica de ejercicio físico moderado, independientemente de los cambios en el peso y la masa grasa, induce a medio plazo cambios favorables en el perfil lipídico, que revierten precozmente (4 días) tras el cese de la actividad física. |
Descargar
| Enviado por: | Antonio |
| Idioma: | castellano |
| País: | España |
