Química
Mediciones de laboratorio
UNIVERSIDAD NACIONAL DE
SAN CRISTÓBAL DE HUAMANGA
FACULTAD DE INGENIERÍA QUÍMICA Y METALURGIA
Departamento Académico de Ingeniería Química
Escuela de Formación Profesional Ingeniería Civil
Práctica de Laboratorio N° 01
“Mediciones en el Laboratorio Químico”
CURSO : QUÍMICA GENERAL
SIGLA : QU - 121
CUCLO ACADÉMICO : 2002 - I
FECHA DE EJECUCIÓN : 24 - 06 - 2002
HORA : 11:00 a.m. - 1:00 p.m.
FECHA DE ENTREGA : 01 - 07 - 2002
Ayacucho - Perú
2002Mediciones en el Laboratorio Químico
FINALIDAD:
Desarrollar experimentos conducentes; a las mediciones de: masas, pesos, volúmenes y densidad de sólidos y de líquidos.
Conocer el modo de operar balanzas; adquirir destreza en el manejo de la Pipeta y Probeta.
Obtener el punto de ebullición del agua líquido en el Laboratorio Químico de la UNSCH (Huamanga).
Medir la presión atmosférica absoluta local (Huamanga).
FUNDAMENTACIÓN TEÓRICA:
Para comprender la presente práctica, se debe tener en cuenta conceptos muy básicos y fundamentales como:
-
MEDICIÓN:
Es comparar una magnitud cualquiera con otra tomada como unidad, pero de la misma especie. Es desde este punto de vista simple que se realiza tanto en química y física y ciencias afines el Proceso de la Medición.
PROCESO DE LA MEDICIÓN:
Llamamos magnitud a cualquier propiedad física susceptible de ser cuantificada objetivamente en el proceso de medición. El proceso de medición de cierta porción de dicha magnitud consistirá en compararla con una porción de la misma, que se adopta convencionalmente como referencia y que denominamos unidad, y expresar cuántas veces mayor que esta es la porción sometida a medición. Muchas magnitudes físicas son expresables como combinación de otras. Así por ejemplo, la magnitud velocidad se puede expresar como combinación de una longitud y un tiempo. Por ello, en la XIV CONFERENCIA GENERAL DE PESAS Y MEDIDAS (1971) se decidió adoptar un conjunto de magnitudes fundamentales de tal manera que todas las demás (magnitudes derivadas) pudieran expresarse en función de las primeras. Además se adoptaron también las unidades correspondientes a cada una de las magnitudes fundamentales. Estas y otras disposiciones de la misma Conferencia constituyen lo que se llama Sistema Internacional, abreviadamente S.I.:
| Magnitud | Unidad | Símbolo unidad | Símbolo dimensión |
| Longitud | metro | m | l |
| Masa | kilogramo | kg | M |
| Tiempo | segundo | s | T |
| Intensidad eléctrica | amperio | a | A |
| Temperatura | kelvin | k | K |
| Cantidad de sustancia | mol | mol | S |
| Intensidad luminosa | candela | cd | C |
PREFIJOS MODIFICATIVOS
| Aumentativos | Diminutivos | ||||
| x 10 | deca | da | x 10-1 | deci | D |
| x 102 | hecto | h | x 10-2 | centi | c |
| x 103 | kilo | k | x 10-3 | mili | m |
| x 106 | mega | M | x 10-6 | micro | ð |
| x 109 | giga | G | x 10-9 | nano | n |
| x 1012 | tera | T | x 10-12 | pico | p |
| x 1015 | peta | P | x 10-15 | femto | f |
| x 1018 | exa | E | x 10-18 | atto | a |
-
MASA Y PESO
La masa de un cuerpo es una propiedad característica del mismo, que está relacionada con el número y clase de las partículas que lo forman. Se mide en kilogramos (kg) y también en gramos, toneladas, libras, onzas, etc. Es decir es la medida de la cantidad de la materia de un cuerpo, y su valor no varía de una posición a otra en el universo, o sea es constante aún cuando varía la aceleración de la gravedad., podemos decir entonces que la masa de un cuerpo viene a ser la medida de su inercia.
El peso de un cuerpo es la fuerza con que lo atrae la Tierra y depende de la masa del mismo. Un cuerpo de masa el doble que otro, pesa también el doble. Se mide en Newtons (N) y también en kg-fuerza, dinas, libras-fuerza, onzas-fuerza, etc. Es decir. Es la fuerza de la gravedad que actúa sobre la masa de un objeto, y su valor depende de la posición que ocupa el cuerpo con respecto al cuerpo que genera la fuerza de gravedad, que en nuestro caso es el planeta Tierra, que tiene una aceleración de la gravedad de 9,79 m/s2.
El kg es por tanto una unidad de masa, no de peso. Sin embargo, muchos aparatos utilizados para medir pesos (básculas, por ejemplo), tienen sus escalas graduadas en kg en lugar de kg-fuerza. Esto no suele representar, normalmente, ningún problema ya que 1 kg-fuerza es el peso en la superficie de la Tierra de un objeto de 1 kg de masa. Por lo tanto, una persona de 60 kg de masa pesa en la superficie de la Tierra 60 kg-Fuerza. Sin embargo, la misma persona en la Luna pesaría solo 10 kg-fuerza, aunque su masa seguiría siendo de 60 kg. (El peso de un objeto en la Luna, representa la fuerza con que ésta lo atrae)
-
VOLUMEN

Además de masa, los cuerpos tienen una extensión en el espacio, ocupan un volumen. El volumen de un cuerpo representa la cantidad de espacio que ocupa su materia y que no puede ser ocupado por otro cuerpo, ya los cuerpos son impenetrables.
El volumen también es una propiedad general de la materia y, por tanto, no permite distinguir un tipo de materia, una sustancia, de otra, ya que todas tienen un volumen.
Cuando un cuerpo está hueco o posee una concavidad, ésta puede rellenarse con otra sustancia. Así una botella o un vaso se pueden llenar de un líquido o de aire. El volumen de líquido que puede contener se llama capacidad.
El volumen, como la masa, puede medirse en muchas unidades, sobre todo dependiendo de la nación o la comarca en la que se vive. En el Sistema Internacional (SI), que es usado por los científicos y técnicos de todo el mundo y en la mayoría de los países, el volumen se mide en metros cúbicos (m3), aunque también es muy empleado el litro, sobre todo para medir capacidades
-
DENSIDAD:
Aunque toda la materia posee masa y volumen, la misma masa de sustancias diferentes tienen ocupan distintos volúmenes, así notamos que el hierro o el hormigón son pesados, mientras que la misma cantidad de goma de borrar o plástico son ligeras. La propiedad que nos permite medir la ligereza o pesadez de una sustancia recibe el nombre de densidad. Cuanto mayor sea la densidad de un cuerpo, más pesado nos parecerá.
![]()
La densidad se define como el cociente entre la masa de un cuerpo y el volumen que ocupa. Así, como en el S.I. la masa se mide en kilogramos (kg) y el volumen en metros cúbicos (m3) la densidad se medirá en kilogramos por metro cúbico (kg/m3).
Esta unidad de medida, sin embargo, es muy poco usada, ya que es demasiado pequeña. Para el agua, por ejemplo, como un kilogramo ocupa un volumen de un litro, es decir, de 0,001 m3, la densidad será de:
La mayoría de las sustancias tienen densidades similares a las del agua por lo que, de usar esta unidad, se estarían usando siempre números muy grandes. Para evitarlo, se suele emplear otra unidad de medida el gramo por centímetro cúbico (gr./c.c.), de esta forma la densidad del agua será: Las medidas de la densidad quedan, en su mayor parte, ahora mucho más pequeñas y fáciles de usar. Además, para pasar de una unidad a otra basta con multiplicar o dividir por mil.
Tabla: Densidad de algunas sustancias
| Sustancia | Densidad en kg/m3 | Densidad en g/c.c. |
| Agua | 1000 | 1 |
| Aceite | 920 | 0,92 |
| Gasolina | 680 | 0,68 |
| Plomo | 11300 | 11,3 |
| Acero | 7800 | 7,8 |
| Mercurio | 13600 | 13,6 |
| Madera | 900 | 0,9 |
| Aire | 1,3 | 0,0013 |
| Butano | 2,6 | 0,026 |
| Dióxido de carbono | 1,8 | 0,018 |
La densidad de un cuerpo está relacionada con su flotabilidad, una sustancia flotará sobre otra si su densidad es menor. Por eso la madera flota sobre el agua y el plomo se hunde en ella, porque el plomo posee mayor densidad que el agua mientras que la densidad de la madera es menor, pero ambas sustancias se hundirán en la gasolina, de densidad más baja.
-
PUNTO DE EBULLICIÓN Y PUNTO DE FUSIÓN:
Punto de ebullición:
Si ponemos al fuego un recipiente con agua, como el fuego está a mayor temperatura que el agua, le cede calor y la temperatura del agua va aumentando, lo que podemos comprobar si ponemos un termómetro en el agua. Cuando el agua llega a 100 ºC, empieza a hervir, convirtiéndose en vapor de agua, y deja de aumentar su temperatura, pese a que el fuego sigue suministrándole calor: al pasar de agua a vapor de agua todo el calor se usa en cambiar de líquido a gas, sin variar la temperatura.
La temperatura a la que una sustancia cambia de líquido a gas se llama punto de ebullición y es una propiedad característica de cada sustancia, así, el punto de ebullición del agua es de 100 ºC, el del alcohol de 78 ºC y el hierro hierve a 2750 ºC.
Punto de fusión:
Si sacas unos cubitos de hielo del congelador y los colocas en un vaso con un termómetro verás que toman calor del aire de la cocina y aumentan su temperatura. En un principio su temperatura estará cercana a -20 ºC (depende del tipo de congelador) y ascenderá rápidamente hasta 0 ºC, se empezará a formar agua líquida y la temperatura que permanecerá constante hasta que todo el hielo desaparezca.
Igual que en el punto de ebullición, se produce un cambio de estado, el agua pasa del estado sólido (hielo) al estado líquido (agua) y todo el calor se invierte en ese cambio de estado, no variando la temperatura, que recibe el nombre de punto de fusión. SE trata de una temperatura característica de cada sustancia: el punto de fusión del agua es de 0 ºC, el alcohol funde a -117 ºC y el hierro a 1539 ºC.
Tabla:
Punto de Fusión y Punto de Ebullición de algunas sustamcias
| Sustancia | Punto de fusión (ºC) | Punto de ebullición(ºC) |
| Agua | 0 | 100 |
| Alcohol | -117 | 78 |
| Hierro | 1539 | 2750 |
| Cobre | 1083 | 2600 |
| Aluminio | 660 | 2400 |
| Plomo | 328 | 1750 |
| Mercurio | -39 | 357 |
-
PRESIÓN ATMOSFÉRICA:
Aunque el aire es muy ligero, tiene sin embargo un peso; y por tanto ejerce una fuerza sobre todas las cosas que se encuentran sobre la tierra. Hemos de tener en cuenta que hay sobre cada uno de nosotros una columna de aire de poca densidad; pero de unos 400 Kilómetros. Si calculamos la fuerza ejercida por el aire por unidad de superficie; obtendremos el valor de una presión. A esta presión la denominaremos presión atmosférica.
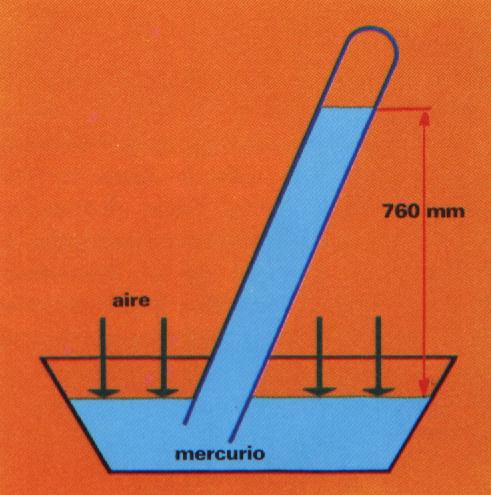
El matemático físico e inventor Italiano TORRICELLI; nacido en 1608, encontró el medio para hallar el valor de la presión atmosférica: Llenó completamente de mercurio un tubo de cristal de un metro de longitud; cerrado por uno de sus extremos; tapó con el dedo el extremo superior del tubo y lo invirtió, introduciéndolo en una cubeta con mercurio; el mercurio del tubo fue descendiendo; pero no hasta el nivel de la cubeta sino se quedó estabilizado a una altura de 76 centím etros y en la parte superior del tubo quedó el vació. La explicación de esta experiencia es la siguiente: La presión que la atmósfera ejercía sobre el mercurio de la cubeta se equilibraba con la presión ejercida por el peso dela columna de mercurio.
Su unidad es la atmósfera(atm). Los aparatos destinados a medir se llaman Barómetros.

MATERIALES Y REACTIVOS:
MATERILES:
-
Vaso de Precipitado de 400 ml.
-
Probeta Graduada de 25ml.
-
Probeta Graduada de 100ml.
-
Probeta Graduada de 250ml.
-

Balanza Mecánica Simple “HEMA”. -
Balanza de Triple Barra.
-
Agua Destilada.
-
REACTIVOS QUÍMICOS:
-
Zinc Metálico
-
PROCEDIMIENTO EXPERIMENTAL:
-
ENSAYO N° 1: MEDICIONES DE PESOS DE SÓLIDOS Y LÍQUIDOS:
-
Uso de la Balanza Mecánica(De Torsión) “Hema”
-
Escalas:
-
Vasos precipitados
-
Probetas graduadas
-
Lunas de reloj, etc.
-
Uso de la Balanza de Triple Barra:
-
Escalas:
-
Vasos precipitados
-
Probetas graduadas
-
Lunas de reloj, etc.
-
ENSAYO N° 2: MEDICIONES DE VOLÚMENES:
-
Volúmenes de Sólidos:
-
Volúmenes de Líquidos:
-
Con Pipeta Gravimétricas:
-
Con Pipetas Graduadas:
-
Con Probetas Graduadas:
-
Matraz Aforado o Fiolo:
-
ENSAYO N° 02: MEDICIÓN DE DENSIDADES
-
DENSIDAD DE SÓLIDOS:
-
Pesar una luna de reloj limpia y seca P1(g), en la Balanza Triple Barra que tiene una presición:
-
Pesar en la luna de reloj cuanto menos unos 10 g de zinc metálico(zinc sólido) P2(g).
-
DENSIDAD DE LÍQUIDOS:
-
Pesar una Probeta Graduada de 100 ml limpia y seca; P1 (g) en balanza de triple barra.
-
Añadir H2O(d) a la probeta de 100 ml en volúmenes comprendido entre 90 - 100 ml.
-
Medir exactamente el volumen del H2O(l) tomadoV(ml).
-
Pesar Probeta + H2O(l) = P2(g)
-
Peso H2O(l) = P2(g) - P1(g)
-
CÁLCULOS:
-
CONCLUSIONES:
-
Densidad del Zinc Sólido: 16,3235 g/ml
-
Densidad del Zinc(exacta): 7,14 g/ml
-
Peso Específico obtenido con el densímetro y oreómetro: 0,721 atm.
-
Punto de Ebullición del H2O (l) en la ciudad de Huamanga: 92 °C.
-
Presión Atmosférica Absoluta Local: 540 mm Hg.Atm.
-
Presión Atmosférica Local (Exacta): 540 mm Hg.Atm.
-
RECOMENDACIONES:
-
La recomendación al Sr. Profesor; a fin de que, tanto el reconocimiento, cálculos y manipulación de materiales y reactivos que utilizamos, deben ser repetidas y profundizadas en las veces posibles; para facilitarnos y familiarizarnos para la elaboración de nuestros informes.
-
De igual modo a mis compañeros, para prestar más orden y seriedad en el desarrollo del experimento, para asimilar con facilidad, y no tener dificultades en el desarrollo de nuestros informes.
-
BIBLIOGRAFÍA:
-
TEXTOS:
-
VARIOS AUTORES “QUÍMICA EXPERIMENTAL”. Edit.Mercantil Ayacucho. 1995.
-
HANS RUDOLF, Christen “QUÍMICA GENERAL”. Edit.Reverté S.A. Barcelona.España.
-
BABOR E IBARZ “QUÍMICA GENERAL MODERNA”.
-
INTERNET:
Pesar objetos o materiales del Laboratorio como:
Para pesar objetos materiales de Laboratorio, como:
El volumen de un sólido geométrico puede calcularse gracias a la geometría. Midiendo sus dimensiones y aplicando la correspondiente fórmula, podemos determinar el volumen. Así, el volumen de un objeto cúbico puede determinarse midiendo la longitud de su arista y elevándola al cubo, el volumen de una caja recta se determina midiendo las tres ar istas distintas que tiene y multiplicando las tres medidas, etc.
Cuando un sólido no tiene una forma geométrica que permita determinar por cálculo su volumen, se mide directamente. El procedimiento lo descubrió Arquímedes, un sabio griego del siglo III antes de Cristo. En un recipiente graduado vertemos un líquido y, a continuación, introducimos en él el sólido cuyo volumen deseamos conocer. El aumento de nivel del líquido nos permitirá, por sustracción, determinar el volumen del sólido. Normalmente el líquido empleado será agua, pero si el sólido se disuelve en ella (por ejemplo la sal o el azúcar) usaremos otro líquido que no disuelva al sólido.
El volumen de los líquidos se mide con pipetas gravimétricas
Sirve para preparar soluciones de concentraciones de solutos en unidades físicas o químicas(molares o normales)
Escala: desde 50 ml. Hasta 1000 ml.
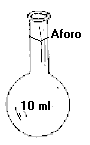
La densidad se mide con areómetro o densímetro.
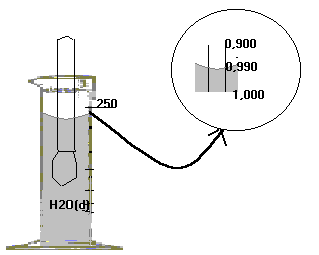
Escalas del Densímetro o Areómetro:
| SÓLIDOS | LIQUIDOS | |||||
| SUSTANCIA | PESO (g) | VOLUMEN (ml) | DENSIDAD | SUSTANCIA | VOLUMEN ml | DENSIDAD g/ml |
| Zn | 10 | 3,4 | 16,32529 | Agua | 25 | 1,000 |
***la densidad DEL Zn, en realidad es 7,14 g/ml; el dato obtenido en laboratorio, es diferente a la misma., posiblemente a errores sistemáticos(toma de datos).
Esta primera práctica, ha servido para familiarizarnos con los elementos y materiales del Laboratorio, propios para el curso de Química; de donde en síntesis se obtuvieron los resultados generales, siguientes:
9
Vasos Precipitados
Probeta
Balanza




Descargar
| Enviado por: | Nanaqsunqu |
| Idioma: | castellano |
| País: | Perú |
