Física
Mecánica cuántica
EXPERIMENTO DE RUTHERFORD
Ernest Rutherford, sucesor de la cátedra de Thompson, Hans Geiger y Gregor Marsden, discípulos de Thomson continuan con los trabajos de Tompson pero enfocados a identificar la radiación de la urania a las que Rutherford, en 1898, llamó alfa ( ![]()
) y beta ( ![]()
). Posteriormente se identificó otro tipo de radiación a la que llamarían radiación gamma ( ![]()
), esta última identificada por Paul Villard.
Los trabajos de los tres discípulos de Thomson, antes mencionados, construyeron un experimento en el que la experiencia consistía en bombardear láminas delgadas de distintas sustancias, donde los proyectiles consistían de partículas alfa ( 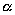
). Este trabajo rindió frutos, ya que en 1919 le otorgaron precisamente el premio Novel de Química.
Para 1911 Ernest Rutherford realizo un experimento el cual consistía en bombardear con partículas alfa una finísima lámina de oro, las cuales eran recogidas en un pantalla de sulfuro de cinc. Un suceso importante que llamó la atención de Rutherford fue el hecho de que la mayoría de partículas atravesaban la lámina sin desviarse o desviadas en ángulos pequeños, mientras que unas cuantas partículas eran dispersadas a ángulos grandes hasta 180º. Esto llevo a Rutherfor a supones que las cargas positivas que las desviaban estaban concentradas dentro de los átomos ocupando un espacio muy pequeño, es comparación con el resto del átomo. A esta parte Rutherford le llamó núcleo.
Contradicciones del modelo
Aunque el modelo rugiría la existencia de electrones moviéndose alrededor del núcleo como planetas alrededor del sol, los cuales no caían al núcleo, posteriormente se encontraría inapropiada. La razón por la cual los electrones no caían al núcleo era debido a que la fuerza de atracción electrostática contrarrestaba con la tendencia de moverse en línea recta al núcleo, con lo que su trayectoria era circular. La contradicción a la que condujo dicho modelo fue la siguiente: todo objeto eléctricamente cargado es acelerado o cuya dirección lineal es modificada emite o absorbe radiación electromagnética, razón por lo cual la emisión de radiación disminuiría la energía y en consecuencia su movimiento debería de estar en espiral hasta caer al núcleo.
Puntos del modelo
Podemos mencionar que el modelo de Rutherford ofrecía las siguientes afirmaciones:
El átomo esta constituido por una parte central a la que se le llama núcleo y la que se encuentra concentrada casi toda la masa del núcleo y toda la carga positiva.
En la parte externa del átomo se encuentra toda la carga negativa y cuya masa es muy pequeña en comparación con el resto del átomo, esta está formada por los electrones que contenga el átomo.
Los electrones giran a gran velocidad en torno al núcleo, en orbitas circulares.
El tamaño del núcleo es muy pequeño en comparación con el del átomo, aproximadamente 100000 veces menor, en comparación con el átomo es muy pequeño.
EXPERIMENTO DE CHADWICK
Rutherford se basó en la evidencia experimental, para concluir que las partes positivas de todos los átomos estaban hechas de núcleos de hidrógeno, a los que dió el nombre de protones. Sin embargo todavía había algunas cosas que no se podían explicar...
Bien, tomemos el helio, por ejemplo. Un núcleo promedio de helio es cuatro veces más pesado que un protón, lo que parecería implicar que está hecho de cuatro protones. Pero entonces debería tener cuatro veces la carga eléctrica de un protón, mientras que en realidad tiene solo dos veces esa carga. Todos los núcleos más pesados mostraban la misma disparidad entre masa y carga. Aún peor, se han descubierto en diferentes isótopos de algunos elementos--átomos del mismo elemento con diferentes masas.
En 1920, Rutherford sospechó que debería existir una clase nueva de partícula en el núcleo, casi tan pesada como el protón, pero sin carga eléctrica, que llamó neutrón.
Y entonces Rutherford encontró realmente algunos neutrones, ¿verdad?
| No, pero su asistente James Chadwick lo hizo en 1932. | |
| Los neutrones aparecieron también en otro experimento relacionado con partículas alfa. Esta vez, se había disparado a átomos de berilio; el berilio emitió una extraña clase de radiación neutral. |
Algunas personas sugirieron que se trataba de fotones con alta energía, como los rayos gamma, pero Chadwick demostró que eso no podría ser así. La radiación desconocida podía sacar protones de otros átomos; eso significaba que debía ser una partícula relativamente pesada, no un fotón sin masa.
Usando la velocidad de los protones expulsados y las leyes de la conservación de energía y momento, Chadwick calculó la masa de la partícula desconocida. Era solamente un poco más pesada que el protón. El no tuvo duda de que se trataba de los neutrones de Rutherford.
EXPERIMENTO DE THOMPSON
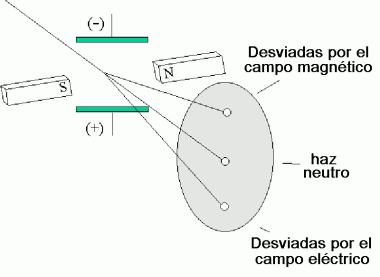
J. J. Thompson (en 1897) por medio de un experimento midió la proporción que existe entre la carga y la masa de una corriente de electrones, usando un tubo de rayos catódicos obteniendo un valor de 1.76 x 108 C/g.
La corriente de partículas cargadas puede desviarse por medio de una carga eléctrica o un campo magnético.
Se puede emplear un campo eléctrico para compensar por la desviación producida por el campo magnético. Dando como resultado que el haz de electrones se comporte como si no tuviera carga.
La corriente requerida para neutralizar al campo magnético aplicado indica la carga del haz.
La pérdida de masa del cátodo indica la masa de la corriente de electrones.
.
![]()
Diagrama del experimento de Thompson.
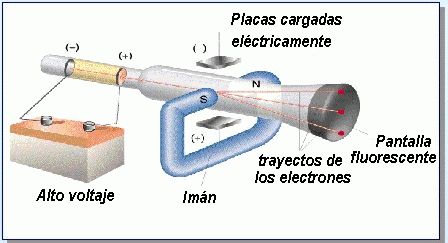
Tubo de rayos catódicos y el arreglo usado en el experimento de Thompson.
Thompson determinó el cociente entre la carga y la masa para el electrón, pero no pudo determinar la masa del electrón.
Sin embargo, de sus datos se puede obtener la carga de un electrón, siempre y cuando se conozca la masa de un solo electrón.
Robert Millikan (en 1909) pudo medir la carga de un electrón en el experimento de la gota de aceite, obteniendo un valor de 1.60 x 10-19 C. Así, la masa de un electrón puede calcularse:
(1g / 1.76 x 108 C) (1.60 x 10-19 C) = 9.10 x 10-28 g
EXPERIMENTO DE MILLIKAN.
Thomson determinó en el siglo XIX la relación carga/masa de los electrones y se dio cuenta que sus medidas mostraban que la cuantización de la carga era posible y que podía existir una porción mínima de carga eléctrica; aún así, había bastantes físicos que opinaban que los rayos catódicos o anódicos tenían naturaleza ondulatoria. Por tanto, la experiencia de Thomson fue un importante argumento, pero no decisivo, de la existencia del electrón. La medida de su carga fue realizada por el físico americano Millikan en 1909.
|
| El objetivo de la experiencia era la determinación de la cantidad de carga que lleva una gotita de aceite. La experiencia constaba de dos partes realizadas con la misma gotita. La determinación de la su masa o radio midiendo la velocidad de caída en ausencia de campo eléctrico. La determinación de su carga midiendo la velocidad en presencia de campo eléctrico. |
Millikan comprobó que el valor de la carga de cada gota era múltiplo entero de la cantidad 1.6·10-19 C. La carga eléctrica está, por tanto, cuantizada. Dicha cantidad se denomina cantidad fundamental de carga o carga del electrón.
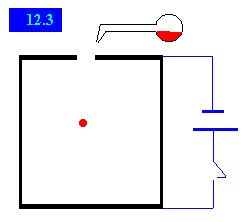
Así como una varilla de vidrio frotada adquiere propiedades eléctricas, otras sustancias se comportan de manera similar. Las gotitas producidas en el atomizador, adquieren electricidad por fricción, a continuación, pasan a través de un orificio, al interior de una cámara formada por dos placas horizontales de un condensador. Un microscopio permite observar el movimiento de cada gota en el interior de la cámara.
Determinación del radio de la gota en ausencia de campo
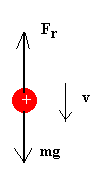
Cada gota cae bajo la acción de su propio peso, pero la fuerza de la gravedad es anulada inmediatamente por la resistencia del aire, por lo fisica/dinamica/stokes/stokes.html">que cae con velocidad límite constante. Midiendo esta velocidad se determina el radio de la gota. Despreciamos la fuerza de empuje del aire, ya que la densidad del aceite es del orden de 800 kg/m3 y la densidad del aire tan sólo de 1.29 kg/m3.
|
| Suponemos que la gota es una esfera de radio R.
Despejando la velocidad límite constante
siendo ρ la densidad del aceite y ð la viscosidad del aire. |
Determinación de la carga de la gota con el campo eléctrico conectado
Cuando se aplica una diferencia de potencial a las placas del condensador se establece un campo eléctrico. Millikan estableció un campo de modo que la gota se elevaba con velocidad uniforme, midiendo ésta se determinaba la carga de la gota. Si la gota ha adquirido una carga q y está en un campo E dirigido hacia arriba, las fuerzas sobre una gota que asciende se muestran en la figura.
|
| Suponiendo que ha alcanzado la velocidad límite constante escribiremos
Despejando la velocidad v' obtenemos
|
Los datos necesarios para realizar la experiencia son:
-
densidad del aceite ρ de 800 kg/m3,
-
viscosidad del aire ð es de 1.8 10-5 kg/(ms).
Para facilitar el cálculo estableceremos un sistema de unidades en el que:
-
La carga q se mide en unidades de la carga elemental 1.6 10-19 C
-
La velocidad v o v' en mm/s
-
El radio de la gotita en ðm (micras)
-
El campo eléctrico en 100000 N/C
Las fórmulas anteriores, se convierten respectivamente en las siguientes:
Radio de la gota en micras, medido con el campo eléctrico desconectado
![]()
Carga de la gota en unidades de la carga elemental, medida con el campo eléctrico conectado.

El valor que se obtiene de q debe ser un número entero, o muy próximo a un entero.
BIBLIOGRAFÍA Y REFERENCIAS
Choppin, Gregory, et. al. Química. Publicaciones Cultural. México, 1973.
Sears y Zemansky. Física General. Aguilar. España. Diciembre, 1967.
http://www.sc.ehu.es/sbweb/fisica/elecmagnet/millikan/millikan.htm. Consultada en noviembre 12 de 2002 a las 14:12 horas.
http://depa/pquim.unam.mx/QI. Consultada en noviembre 12 de 2002 a las 14:30 horas.
www.fotunecity.com/campus/dawswon/196/rutherford. Consultada en noviembre 12 de 2002 a las 17:09 horas.
Descargar
| Enviado por: | Mon |
| Idioma: | castellano |
| País: | México |