Maestro, Especialidad de Educación Primaria
Materia
La materia
Materia es todo lo que nos rodea, ocupa un lugar en el espacio y tiene peso y masa. La materia la podemos encontrar en el Universo en diferentes estados: sólido, líquido o gaseoso. Si miramos a nuestro alrededor podemos ver edificios, nubes, aire, agua; todo eso es materia.
Propiedades
Las propiedades físicas de la materia son el conjunto de características que permiten su estudio usando los sentidos o algún instrumento específico. Los científicos se han puesto de acuerdo en determinar que la materia posee ciertas propiedades que son: masa, peso, volumen y densidad.
Masa
En física, masa es la cantidad de materia que constituye un cuerpo determinado. Esta propiedad física no varía jamás, independiente del lugar donde se encuentre el cuerpo o de su volumen. Para medir la masa se utiliza un instrumento llamado balanza. Su valor debe ser expresado siempre en una de estas unidades: tonelada, kilogramo o gramo.
Peso
Esta propiedad física es la fuerza de atracción que ejerce la gravedad sobre la masa de un cuerpo. A diferencia de la masa, esta propiedad varía dependiendo en el lugar donde se encuentre el cuerpo. Por ejemplo, cualquier objeto pesará más si está situado a nivel del mar que si se encuentra en lo alto de una montaña, pero su masa seguirá siendo la misma. Más sorprendente aún es la variación del peso en la Tierra v/s la Luna, ya que en el satélite el peso disminuye considerablemente.
El peso se mide con un instrumento llamado dinamómetro y su unidad se expresa en Newton (N). El dinamómetro está formado por un resorte con un extremo libre y posee una escala graduada en unidades de peso. Para saber el peso de un objeto solo se debe colgar del extremo libre del resorte, el que se estirará; mientras más se estire, más pesado es el objeto.
Volumen
El volumen es el espacio que ocupa un cuerpo. Se mide en una probeta, que es un tubo transparente cerrado por uno de los dos extremos y graduado por el exterior.
La unidad de medida del volumen es el metro cúbico (m ).
Densidad
Es la cuarta propiedad física de la materia y se relaciona directamente con la masa y el volumen de un cuerpo. Incluso, dos cuerpos pueden tener el mismo volumen pero distinta masa. Por ejemplo, si se toma 1 ml. de agua y se mide su masa, esta es de 1 Kg. Basándonos en la relación de masa y volumen, podríamos decir que la densidad es la masa de un cuerpo contenida en una unidad de volumen.
ACTIVIDADES:
Indica las propiedades generales de la materia e indica en qué se miden.
2. Completa las frases siguientes:
-
La materia es -------------------------- y la podemos encontrar en la Tierra de forma ---------, ----------------- y ---------------.
-
El volumen es una --------------- de la materia, que se mide en una--------------. Su unidad de medida es el -------------.
-
La densidad es --------------- de un -------------- contenida en una unidad de --------.
-
La masa es la ------------------- de materia que constituye un ----------------------------.
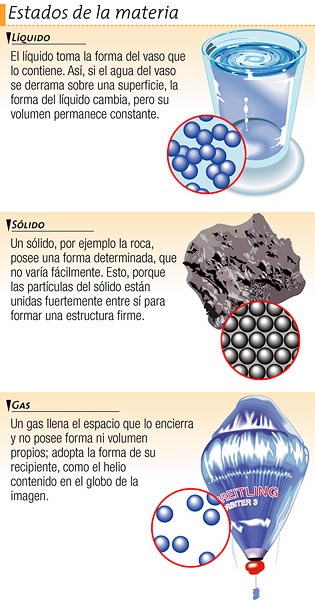
LOS ESTADOS DE LA MATERIA
En nuestro planeta, la materia se encuentra en tres estados: sólido, líquido y gaseoso.
Los gases
Para entender el ordenamiento de las partículas en cada estado de la materia, procederemos a construir un modelo. Supondremos que las partículas en un material se comportan como niños jugando durante el recreo en su colegio.
Imaginemos que estamos en el patio y que podemos observar el juego de nuestros compañeros en cada lugar de este. Ahora, veamos si este modelo responde a las propiedades que observamos en los estados de la materia.
Supongamos que un grupo de nuestros compañeros se encuentra jugando al “pillarse”. ¿Cuál es el comportamiento de este grupo de niños? Lo que observamos es que cada niño corre azarosamente por el patio; es más, rara vez se tocan. Si pusiéramos a los niños en una habitación, veríamos que estos tienden a correr por todo el espacio disponible, razón por la cual la forma del grupo está definida tan solo por las paredes del lugar que los contiene (la habitación). Si los devolvemos al espacio abierto, constataríamos que la forma del grupo cambia constantemente, producto del deambular errático de cada uno de los niños. En efecto, son estas las características que observamos en un gas.
Si observas cuando alguien fuma, verás que el humo no adopta una forma particular. Sin embargo, si pides que echen el humo dentro de una botella, este ocupará todo el volumen disponible en el recipiente. En un gas, las interacciones entre partículas son muy limitadas, y en algunos casos estas se pueden considerar como cuerpos libres; es decir, sin ser sometidas a ningún tipo de interacción.
Los líquidos
Supongamos ahora que tomamos al grupo de niños y los hacemos jugar a la ronda. ¿Qué observamos? Cuando los niños juegan a la ronda sus movimientos individuales ya no son tan erráticos, pues las interacciones entre niños vecinos son más fuertes (de hecho, están tomados de la mano). Sin embargo, no se encuentran del todo ligados unos a otros, pues si existe un obstáculo la ronda se deforma de acuerdo con la forma de este.
Ahora, si ponemos al grupo en una habitación, observaremos que no tiende a utilizar todo el espacio disponible; es decir, la ronda tiene un “volumen” definido, aun cuando su forma está determinada por el recipiente que la contiene: si la habitación es cuadrada, la forma será circular, mientras que si la habitación es rectangular, la forma será más bien ovalada.
De acuerdo con esto, podemos decir que la ronda de niños posee un comportamiento parecido al de los líquidos, pues un líquido posee un volumen definido, pero no así una forma definida. Esto se debe a que en el líquido, al igual que en la ronda, las interacciones entre partículas cobran importancia, pero no son lo suficientemente fuertes como para mantener al conglomerado completamente unido. Las interacciones se dan a primeros vecinos, lo que significa que existen interacciones mayoritariamente entre una partícula y sus vecinas más cercanas, pero no así con todo el resto de las partículas. En el modelo de la ronda, cada niño interactúa con su vecino tomándole la mano, mas no le toma la mano al que sigue a su vecino.
Si el líquido se encuentra en un recipiente, supongamos un vaso de vidrio, entonces las interacciones a los primeros vecinos se dan a lo largo de todo el líquido; sin embargo, en la frontera líquido-pared del vaso ocurre algo un tanto distinto, pues las últimas partículas deben interactuar con sus partículas vecinas y con la pared del vaso, generando así una interacción conocida como tensión superficial. Cuando el material en la frontera es un gas, las partículas del líquido no alcanzan a interactuar con este y solo interactúan entre sí. Es por esto que las gotas de agua adquieren su forma característica en los bordes de un recipiente o en la superficie de una mesa. Si el material en la frontera forma parte de un recipiente, las partículas del líquido interactúan con este y tienden a adherírsele. Es por esto que los líquidos suben por las paredes de un capilar o tubo muy delgado, o bien, tienen la forma curvada típica que se presenta en los bordes de un vaso. También este mismo efecto es el responsable de que algunos insectos livianos puedan pararse sobre el agua sin hundirse. En este caso, la tensión superficial hace las veces de cama elástica y sostiene el peso del insecto.
Los sólidos
¿Qué sucede si ahora los niños se aprietan y comienzan a jugar abrazados? Dada esta situación (que el grupo se encuentra apretado), las interacciones entre los niños son mucho más fuertes. El grupo ya no se deforma frente a un obstáculo y ocupa un espacio definido. Este es el caso de los sólidos, los cuales se caracterizan porque las interacciones entre partículas son tan fuertes que prácticamente la distancia entre ellas se mantiene constante. Esto trae como consecuencia que los sólidos conservan su volumen y forma.
En este tipo de materiales, las partículas interactúan y se ordenan esencialmente de dos formas:
Cuando el material tiene una estructura ordenada y periódica, es decir, cuando cada partícula se encuentra en un lugar específico y la misma estructura se repite a lo largo de todo el material, hablamos de un sólido cristalino. Este es el caso de la sal de mesa común (cuya nomenclatura química es NaCl, cloruro de sodio), en la cual las partículas de cloro y sodio se encuentran alternadas a lo largo de las esquinas de las caras de un cubo.
Si, por el contrario, el ordenamiento es azaroso y desordenado, hablamos de un sólido amorfo. Tal es el caso del vidrio.
Veamos unas imágenes que facilitarán la comprensión de lo explicado anteriormente:
ACTIVIDADES:
1. Di en qué estado físico encontramos los siguientes cuerpos en la naturaleza e indica el color que poseen: oxígeno, hueso, sangre, vapor de agua, aceite, mármol y petróleo.
2. ¿Cuáles son los estados de la materia? Indica sus características.
3. ¿Qué estado físico de la materia tiene un cuerpo cuyo volumen varía con el recipiente que lo contiene, al igual que su forma?
LOS CAMBIOS FÍSICOS DE LA MATERIA
Es el cambio transitorio de las sustancias que no afecta a la naturaleza de la materia aunque sí cambia su forma. Un cambio físico se produce por la acción de un agente externo a la naturaleza. En el caso del agua, el agente es el calor.
Los cambios físicos más conocidos son los llamados cambios de estado. Estos son los siguientes:
|
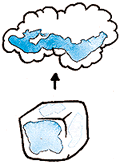
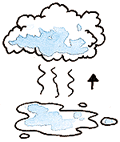
Es la transformación directa, sin pasar por otro estado intermedio, de una materia en estado sólido a estado gaseoso al aplicarle calor. Ej. Hielo (agua en estado sólido) + temperatura = vapor (agua en estado gaseoso)
Ej. Cobre sólido + temperatura = cobre líquido, cubo de hielo (sólido) + temperatura = agua (líquida). El calor acelera el movimiento de las partículas del hielo, se derrite y se convierte en agua líquida.
| |||||||
| - Sublimación regresiva. Es el cambio de una sustancia de estado gaseoso a estado sólido, sin pasar por el estado líquido.
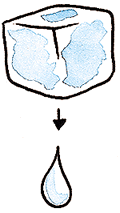
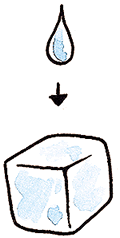
| - Solidificación. Es el paso de una sustancia en estado líquido a sólido. Este cambio lo podemos verificar al poner en el congelador un vaso con agua, o los típicos cubitos de hielo.
| - Condensación. Es el cambio de estado de una sustancia en estado gaseoso a estado líquido.
| |||||
ACTIVIDADES:
1. Indica en cuáles de los siguientes casos se produce un cambio físico:
-Un ascensor que se detiene.
-Una tenista que devuelve la pelota.
-Un cubito de hielo que se derrite.
-Un trozo de madera que se quema.
2. Completa las siguientes frases indicando el cambio físico que se produce en cada caso:
- La lava de los volcanes al -------------- pasa a estado sólido.
- El hielo al ----------------- pasa a estado líquido.
- El agua al ------------------ pasa a estado gaseoso.
3. Anota debajo de cada dibujo el cambio de estado realizado. Razona tu respuesta.
4. ¿Qué otros cambios de estado existen además de los citados en el ejercicio anterior?
EXPERIMENTOS QUE SE PUEDEN REALIZAR PARA FACILITAR LA COMPRENSIÓN DE LOS CAMBIOS DE ESTADO:
Evaporación
Materiales:
Recipiente con agua, tus manos
Procedimiento:
Moja una de tus manos con agua y mantén la otra seca. Nota que la mano húmeda se sentirá más fría. Ahora sopla aire sobre la mano húmeda y notarás que se enfriará aún más.
La transpiración es un mecanismo del cuerpo humano para enfriarse. Durante periodos muy húmedos, la transpiración se evapora tan lentamente que deja de ser eficaz como método de refrigeración corporal, uno siente mucho calor e incomodidad
El calor del sol evapora el agua
Materiales:
Dos platos, agua, un libro
Procedimiento:
Coloca dos platos iguales en una ventana soleada. Cúbrelos apenas con agua fría. Con un libro hazle sombra a uno de los platos.
Protegida de los rayos solares el agua en el segundo plato se evaporará más lentamente.
Verificar que la evaporación es función de la superficie
Coloca la misma cantidad de agua en tres recipientes cuyas bocas tengan diferentes superficies (pueden ser una botella de gaseosa, una jarra de agua y un plato hondo. ¿De qué recipiente se evapora más agua?
Probablemente te lleve varios días encontrar la respuesta al interrogante ya que el agua se evapora de a poco.
Verás que se evaporará más el agua desde el recipiente de boca más ancha (de mayor superficie).
Evaporación y viento
Haz un charco con agua y marca una línea alrededor. Luego de una hora, vuelve a trazar la línea que rodea el charco. Puedes medir cuánto tarda el charco en secarse. Haz la misma observación un día de mucho viento. Notarás que a mayor velocidad de viento la evaporación es mayor.
Condensación - Recolector de humedad
Materiales:
Vaso de plástico, algunas piedras grandes y pequeñas, hoja de plástico.
Procedimiento:
Haz un pozo de forma cónica en el suelo y coloca un vaso de plástico dentro de él. Cubre el pozo con una hoja de plástico, fijándola al suelo con las piedras grandes (para que no se vuele con el viento). Coloca las piedras más pequeñas en el centro.
A medida que baja la temperatura, el vapor de agua del aire y del suelo se condensa sobre la hoja de plástico y gotea hacia el vaso.
Congelación - ¿Cómo levantar un bloque de hielo con una cuerda?
Materiales:
Cuerda, cubito de hielo, agua, sal
Procedimiento:
Moja una punta de la cuerda, luego coloca ese extremo sobre el cubito de hielo, échale un poco de sal por encima y espera unos minutos. Verás que cuando intentes levantar el cordel, éste se habrá pegado al hielo.
La sal rebaja el punto de congelación del agua y así el hielo se derrite alrededor del extremo del cordel, el hielo al derretirse ha diluido la sal y por lo tanto aumenta el punto de congelación nuevamente, se ha vuelto a congelar el agua que rodeaba al cordel y éste ha quedado sujeto al cubito.
La temperatura de congelación es función de la presión
Materiales:
Dos cubos de hielo, una toalla
Procedimiento:
Presiona los dos cubos de hielo uno contra el otro cubriéndolos con una toalla. Cuando dejes de presionarlos se congelarán unidos.
El punto de fusión decrece con la presión. Cuando presionas el hielo se funde y cuando dejas de presionar el agua vuelve a congelarse uniendo ambos cubos de hielo.
Sublimación - El vapor pasa al estado sólido directamente
Materiales:
Lata de gaseosa o cerveza, termómetros, hielo, sal, palillo.
Procedimiento:
Llena la lata con capas alternadas de hielo y sal. Empuja la mezcla con un palillo mientras llenas la lata. Luego de unos minutos, el exterior de la lata estará a una temperatura por debajo del punto de congelación. Cuando la humedad atmosférica es suficientemente baja, la saturación ocurrirá a temperaturas por debajo de los 0ºC. A la temperatura de congelamiento se formará una capa delicada de hielo (escarcha), por la directa transformación del vapor en hielo. Cuando la humedad es alta, el vapor se condensará primero y luego se congelará (rocío congelado)
Núcleos de condensación:
¿Sabías qué…?
| En 1875 Paul Jean Coulier, estudiando la respuesta de la niebla a los cambios de presión en un sistema cerrado, se sorprendió al encontrar que la niebla no se formaba sino hasta que dejaba entrar aire del exterior a su sistema. Llegó a la conclusión que para que se forme la niebla se necesitaba la presencia de polvo o partículas en el aire. Estas partículas se llaman núcleos de condensación. Los núcleos de condensación más pequeños (10-7 - 10-5cm) se llaman núcleos de Aitken, en honor a John Aitken, un físico escocés que identificó los tipos más importantes de núcleos de condensación. Los que superan los 10-4 cm se llaman núcleos gigantes. |
Nota de seguridad Haz este experimento bajo la supervisión de un adulto.
Materiales:
Botella de vidrio claro transparente, tubo de plástico, tapón, fósforo, agua.
Procedimiento:
Agrega una delgada capa de agua en el interior de la botella y tápala con el tapón (al que previamente hay que atravesarlo con un largo tubo de plástico). Sacude la botella con energía. Coloca el extremo libre del tubo en tu boca y haz ingresar aire a la botella. Luego deja que el aire salga rápidamente. La presión en el interior de la botella disminuirá y permitirá el enfriamiento adiabático del aire. Para una mejor visualización de este proceso, debemos ingresar a la botella núcleos de condensación. Toma una bocanada de aire del interior de la botella y presiona (pellizca) el tubo para que no entre aire. Sostén un fósforo encendido cerca del extremo del tubo, deja de pellizcar el tubo para que entre el humo a la botella. Fuerza al aire de nuevo a ingresar a la botella con tu boca. Verás que ahora la nube formada es más densa debido a las partículas del humo actuando como núcleos de condensación.
Para que una nube o niebla se forme se necesita
Vapor de agua en el aire
Enfriamiento del aire hasta la saturación
Presencia de núcleos de condensación
En ausencia de núcleos de condensación las nubes para formarse necesitarían humedad relativa por encima del 400%
Sigamos con otros cambios físicos...
Los cambios de volumen también se encuentran dentro de los cambios físicos: se refieren a los cambios que sufre la materia en relación al espacio que ocupan.
Por ejemplo, un cuerpo aumenta su volumen si aumenta el espacio que ocupa y, por el contrario, si reduce su volumen significa que disminuye el espacio que ocupa.
Los cambios de volumen son dos: contracción y dilatación.
Contracción.
Es la disminución de volumen que sufre un cuerpo al enfriarse.
Por ejemplo, los zapatos te quedan más "sueltos " en invierno; al poner un globo inflado en un tiesto con agua fría disminuye su tamaño.
La contracción se entiende porque al enfriarse los cuerpos, las partículas están más cercanas unas de otras, disminuye su movimiento y como consecuencia disminuye su volumen.
¿Qué ocurre cuando pones un termómetro en agua con hielo?
Dilatación.
Es el aumento de volumen que experimentan los cuerpos al contacto con la temperatura.
Por ejemplo, el Mercurio del termómetro se dilata con facilidad y por eso es capaz subir por un capilar pequeño e indicar el alza de temperatura.
Este fenómeno no afecta sólo a los líquidos o sólidos también a los gases. Al recibir un aumento de calor, las partículas se separan entre sí, permitiendo que el gas se torne más liviano y se eleve. Ejemplo de esto es lo que hace posible que los "globos aerostáticos" se puedan elevar y desplazar.
Pero toda regla tiene su excepción y es el agua en este caso quién confirma la regla, porque al calentarse entre los 0ºC y los 4ºC, se contrae y al enfriarse se dilata. Se conoce este fenómeno como la dilatación anómala del agua.
ACTIVIDAD:
- ¿Cuál crees que es la razón por la que en verano a muchas personas se les hinchan los pies y las manos?
MEZCLAS
Las mezclas son sustancias que se forman cuando se unen elementos y compuestos. Sin embargo, esta unión no es en una proporción determinada sino variable.
En la mezcla, la unión que se produce entre los componentes es física y no química. Por lo tanto, cada componente de la mezcla mantiene sus propiedades específicas.
Son ejemplos de mezclas:
-
Agua con tierra.
-
Leche con café.
-
Vinagre con aceite.
La tierra y la mayor parte de las rocas, los animales, las plantas, el carbón, el petróleo, el aire el gas, los ríos, los lagos y los mares son ejemplos visibles de lo que se entiende por mezcla.
Las mezclas pueden clasificarse en dos grupos: mezclas homogéneas y mezclas heterogéneas. Veamos.
-
Homogéneas
Son aquellas en las cuales sus componentes no se pueden visualizar a simple vista.
Por ejemplo, el aire atmosférico. En él encontramos elementos y compuestos en una relación variable, ya que las condiciones pueden modificarse, pero esta mezcla sigue siendo aire.
El aire está formado por la unión de varios gases como son: Oxígeno, Nitrógeno, Anhídrido carbónico, vapor de agua y Ozono. Además, tiene otros componentes como el polvo, humo, cenizas, partículas contaminantes y gases inertes (Argón, Neón, Helio, etcétera. )
También son mezclas homogéneas el gas licuado y la leche.
-
Heterogéneas
Son aquellas en las cuales sus componentes pueden ser observados a simple vista.
Por ejemplo, al unir harina con limadura de hierro, se forma una mezcla heterogénea, ya que a pesar de la unión o mezcla de los componentes, la harina y la limadura son completamente identificables.
Otro ejemplo clásico es unir agua con aceite, donde el agua y el aceite se separan formando dos fases. El aceite queda arriba y el agua abajo.
La disolución o solución
Este es un tipo de mezcla homogénea, en la cual participan dos componentes, y se combinan entre ellos en cantidades variables.
En toda solución se reconoce un solvente, el cual es el componente de la mezcla que se encuentra en mayor cantidad y el soluto es el componente que participa en menor cantidad.
Un ejemplo de solución es mezclar agua con azúcar, el agua es el solvente y el azúcar es el soluto. En este caso el agua disuelve al azúcar.
Tipos de disoluciones:
-
Disolución de un gas en un líquido: El agua lleva oxígeno disuelto. Para observarlo no tienes más que dejar reposar un tiempo suficiente un vaso lleno de agua. Al hacerlo observarás unas burbujas producidas por el oxígeno disuelto. Este hecho es importante, ya que permite a los animales acuáticos respirar dentro del agua.
-
Disolución de un líquido en un líquido: Un ejemplo de este tipo de disolución sería el café con leche o el alcohol y el agua.
-
Disolución de un sólido en un líquido: EL azúcar o la sal se disuelven en agua.
-
Disolución de un gas en un gas: el aire lleva oxígeno disuelto.
SEPARACIÓN DE MEZCLAS
Las mezclas pueden separarse, ya que la unión entre sus componentes es sólo de tipo física. Por lo tanto, se pueden recuperar sus componentes sin que se altere la composición de ellos.
Las mezclas pueden realizarse entre dos sólidos, dos líquidos o entre un líquido y un sólido.
-
Filtración: consiste en hacer pasar la mezcla a través de un filtro, quedando retenido el sólido en el filtro y la parte líquida pasa a través de él.
-
Destilación: es un poco más compleja, pero permite separar la parte líquida de la mezcla. Se logra aplicando calor sobre la mezcla, el líquido se evapora, y este vapor al pasar por un tubo de destilación, se condensa y el líquido se recupera en otro tiesto.
-
Evaporación: en este caso se le aplica calor a la mezcla, el líquido se evapora y la parte sólida queda.
-
Magnetismo: esta mezcla se puede separar utilizando un imán. La mezcla debe contener un elemento metálico, que es atraído por el imán, quedando la otra sustancia.
-
Decantación: en este caso se prepara la mezcla de los dos sólidos y luego se coloca en un líquido, los dos sólidos se separan ya que uno se hunde (decanta) y el otro flota.
Dos líquidos: se separan mediante la destilación. Este método se basa en el antecedente de que cada líquido tiene una temperatura específica de ebullición. Por ejemplo: si se tienen dos líquidos uno hierve a
70º C y el otro a 98º C. Al aplicar calor se evaporará primero el líquido que tiene una menor temperatura de ebullición, por lo tanto, éste se recuperará antes.
ACTIVIDADES EN GRUPO:
Objetivo
Determinar métodos para separar mezclas
Materiales (por grupo)
| Leche | 400 cc |
| Cereales | 1 caja de 24 gramos |
| Arena | 2 cucharadas |
| Agua |
|
| Cuchara plástica | 6 unidades |
| Plato plástico | 3 unidad |
| Vasos plásticos | 2 unidad |
| Harina | 2 cucharadas |
| Imán | 1 unidad |
| Colador | 1 unidad |
| Papel filtro | 1 unidad |
| Embudo | 1 unidad |
| Vaso transparente | 2 unidad |
Procedimiento
| Medidas de seguridad:
|
Lee cuidadosamente la Guía de Trabajo.
El encargado de materiales recoge los materiales y los distribuye a cada miembro. El investigador principal asigna a cada par de integrantes las siguientes mezclas:.
Alumno 1 y 2: Pon leche y cereales a un plato. Revuelve suavemente con la cuchara.
Alumno 3 y 4: Pon leche con harina en un vaso plástico. Revuelve suavemente con la cuchara.
Alumno 5 y 6: Pon los alfileres y la harina en el plato entregado.
Alumno 5 y 6: Vierte en un vaso plástico agua y arena. Revuelve suavemente con la cuchara.
Conversen para decidir que materiales usarán para separar cada mezcla, teniendo presente que los implementos para separar mezclas se pueden ocupar sólo para una mezcla. Los materiales que pueden usar son: Colador, embudo y papel filtro, imán, dos platos y dos vasos transparente.
Usando los materiales para la separación, haz la prueba de separación de tu mezcla. Anota en tu guía el procedimiento y los resultados obtenidos.
Comparte tus observaciones con los otros integrantes del grupo. En el cuadro resumen, escribe los procedimientos y resultados obtenidos por tus compañeros en la separación de cada una de las mezclas. Tu profesor te entregará más adelante el nombre del método.
Observa la demostración experimental de la separación de agua salada que realiza el Profesor.
Registra en tu guía el procedimiento y resultados de la experiencia realizada por el profesor para la separación de agua y sal. Dibuja la demostración del profesor.
Registro de Observaciones de Separación de mezclas
Mezcla:______________________________________________
Tipo de Mezcla: _______________________________________
Descripción del proceso de separación de mezcla:
Resultado de la aplicación de este proceso:
Ilustración de la actividad de separación que realizó el profesor:
|
|
Cuadro Resumen de registro de observaciones
| Mezclas experimentales | Tipo de mezclas | Material utilizado | Descripción del método | NombreMétodo |
| Harina más agua
|
|
|
|
|
| Cereal con leche
|
|
|
|
|
| Arena más agua
|
|
|
|
|
| Harina más alfileres
|
|
|
|
|
| Agua más sal
|
|
|
|
|
Experimento: Decantación
En este experimento podrás apreciar cómo se pueden separar los líquidos de distinta densidad.
|
|
|
|
|
| Paso 1 | Paso 2 |
|
|
|
| Paso 3 | Paso 4 |
Experimento: Filtración
En esta experiencia se muestra cómo funciona la filtración al separar lo sólido de lo líquido.
|
|
|
|
| Materiales | Paso 1 | Paso 2 |
|
|
|
| Paso 3 | Paso 4 |
Experimento: Destilación
En este experimento podrás saber cómo se pueden separar los componentes de una mezcla gracias al manejo de los puntos de ebullición.
|
|
|
| Materiales | Paso 1 |
|
|
|
| Paso 2 | Paso 3 |
CAMBIOS QUÍMICOS
Un cambio químico es el cambio que se produce cuando combinamos dos o más sustancias y se forman otras nuevas, de propiedades distintas a las sustancias iniciales.
Los cambios químicos se conocen con el nombre de reacciones químicas. Cada minuto, millones de reacciones químicas están ocurriendo a nuestro alrededor sin que nos demos cuenta. Algunas de ellas son producto de procesos naturales; otras son el resultado de la acción del hombre.
Ya vimos que el proceso de digestión de nuestro cuerpo involucra una serie de reacciones químicas, que buscan fraccionar el alimento en pequeñas partes para obtener la energía que requerimos para vivir. También sabemos que las plantas realizan una importante reacción química en la fotosíntesis (ver recuadro). Otra reacción química fundamental para la vida que se produce en el ambiente es la que ocurre cuando la atmósfera de la Tierra remueve los dañinos rayos ultravioleta del Sol.
En cuanto a las reacciones químicas producidas por el hombre, muchas de ellas se llevan a cabo en los laboratorios, donde los científicos las provocan con diversos fines: para crear nuevas medicinas, producir nuevos materiales o evitar la descomposición de alimentos, por ejemplo.
¿Pero qué es una reacción química? Si bien ya hemos dado una idea de ella, una reacción química consiste simplemente en romper o separar los componentes de una sustancia, para ocuparlos en la formación de una nueva sustancia. A esta se le llama producto y tiene características completamente diferentes a las de las sustancias originales, que estaban presentes antes de que se produjera la reacción química, y que son denominadas reactantes, porque son las que “reaccionan” para formar algo nuevo.
Para que una reacción química ocurra se requiere de energía. Las fuentes de esta energía pueden ser, entre otras, la luz, calor o electricidad.
Las combustiones:
Son reacciones químicas que se producen cuando hacemos arder sustancias; es decir, cuando se combinan con oxígeno.
Como en todas las reacciones químicas, en las combustiones hay reactivos y productos:
-
Los reactivos son las sustancias que arden, y el oxígeno y el aire.
-
Los productos son las sustancias que se forman tras la reacción, como el dióxido de carbono y el vapor de agua, y la energía en forma de luz y calor. También pueden aparecer otras sustancias; por ejemplo, si quemamos madera aparecen cenizas.
Una combustión se representa del siguiente modo:
Combustible + Oxígeno Dióxido de carbono + Vapor de agua + Energía
Reactivos Productos
Las reacciones químicas en la vida diaria
Muchas de las sustancias que utilizamos normalmente, como las bolsas de plástico, los medicamentos, las pinturas o los detergentes no están presentes en la naturaleza, sino que proceden de otras sustancias que se transforman mediante diversas reacciones químicas. Por ejemplo, del petróleo obtenemos, además de combustibles, medicamentos, plásticos y muchas cosas más.
Estas sustancias se fabrican en instalaciones especiales, las industrias. La mayoría de las reacciones químicas que tienen lugar en ellas son muy peligrosas y tienen que llevarse a cabo de manera controlada, ya que en ellas se liberan productos tóxicos y una elevada cantidad de energía que puede poner en peligro la vida de los seres vivos.
En nuestra casa también se producen reacciones químicas. Cuando encendemos la cocina de gas se produce una combustión que, como sabes, es una reacción química. Muchas de nuestras casas poseen ventanas y balcones de hierro que reaccionan con el oxígeno del aire. Este hecho transforma el hierro en otra sustancia diferente, llamada óxido de hierro. Esta reacción química se conoce como oxidación.
ACTIVIDADES:
1. ¿Qué diferencia hay entre un cambio físico y un cambio químico? Cita ejemplos de estos tipos de cambios.
2. Completa la siguiente reacción química:
Gas + Oxígeno = Dióxido de Carbono + Vapor de Agua+……
¿Cómo se llama esta reacción química?
3. Cuando se enciende una chimenea es necesario darle aire con un fuelle o con un abanico, ¿Por qué damos aire?
4. Nombra tres sustancias que se formen mediante reacciones químicas y averigua de qué sustancias provienen.
5. Indica al menos tres reacciones químicas que tengan lugar en los seres vivos.
Reacción química: gas
Con esta experiencia se demuestra cómo con algunos reactantes se forma un nuevo producto, distinto de los que se usaron inicialmente.
|
|
|
|
| Materiales | Paso 1 | Paso 2 |
|
|
|
| Paso 3 | Paso 4 |
21
Descargar
| Enviado por: | Anuka |
| Idioma: | castellano |
| País: | España |