Química
Masa equivalente del Magnesio
Índice
Pág.
Introducción………………………………………………………………… 2
Capitulo I
-
Objetivos……………………………………………………… 3
-
Marco teórico………………………………………………. 3
Capitulo II
-
Experimento………………………………………………… 6
-
Procedimientos y resultados ………………………….. 6
Conclusión…………………………………………………………………… 12
Bibliografía……………………………………………………………………. 13
Introducción
En el presente informe se tratara de determinar por diferentes métodos la masa equivalente de una cinta de magnesio.
La masa equivalente de un elemento es el peso en gramo del mismo que se combina con 8 g de O2 o 1.008 g H2, siendo el equivalente-gramo una cantidad en gramos del compuesto igual al peso equivalente del mismo
La masa equivalente se puede determinar de forma experimental y puede ser por:
1 - Determinación directa.
2 - Métodos analíticos.
3 - Por desplazamiento del agua.
Para determinar la masa equivalente del magnesio se utilizo la técnica de desplazamiento del agua y también se utilizo para determinar la masa equivalente del magnesio las leyes de los gases. Obteniéndose con ambas técnicas el mismo resultado.
En el presente experimento se ara reaccionar una cinta de magnesio metálico con un cation de hidrogeno para determinar la masa equivalente del magnesio (Mg)
La ecuación resultante al combinar el Magnesio y HCL es:
Mg + 2 HCl MgCl2 + H2
Produciéndose cloruro de magnesio más una molécula gaseosa de hidrogeno la cual es recogida para medirse el volumen y buscarle la presión, al saber la presión se hallan los moles con la ecuación de estado y luego aplicándose una regla de tres para hallas los Nº de equivalente de hidrogeno.
Para poder hallar la masa equivalente del magnesio se emplea la ley de equivalencia El enunciado dice que “Un Equivalente Gramo de una sustancia reacciona reemplazando a un equivalente gramo de otra” hallándose de esta manera la masa equivalente del elemento (Hidrogeno) sabiendo que
Nº de Equivalente Hidrogeno = Nº de Equivalente Magnesio.
Determinación de la masa equivalente del magnesio
Objetivos.
Determinar la masa equivalente del magnesio (Mg)
Estimar los errores durante la experiencia de laboratorio.
Interpretar la Reacción química que ocurre.
Masa Equivalente
Masa equivalente de un agente reductor como la masa del mismo capaz de suministrar N electrones (“N” numero de avogadro), del mismo modo se define el equivalente-gramo de un agente oxidante como la masa del mismo que puede captar N electrones. En todas la reacciones de oxido - reducción son igual los números de equivalentes - gramos de la sustancias reductoras y oxidante ya que el numero de electrones liberado ha de ser el mismo que el de los capturados.
AGENTE OXIDANTE
Es aquél que gana electrones. El que se reduce
AGENTE REDUCTOR
Es aquél que cede electrones. El que se oxida.
La masa equivalente de un elemento se puede determinar en forma experimental de varias formas, entre ellas tenemos:
Determinación directa:
En este caso se encuentra la cantidad del elemento que se han combinado con 1.008 g de hidrogeno o con 8.0 g de oxigeno.
Método analítico:
Se determina la masa equivalente por la cantidad del elemento que se combina con otro del cual se conoce su masa equivalente.
Por desplazamiento del agua:
Este método consiste en hacer reaccionar una determinada masa de un metal con un ácido para que desprenda hidrogeno. Para el calculo se encuentra la masa del metal que ha desplazado 1.008g de hidrogeno o 11200 ml del gas. (a condiciones normales de temperatura y presión)
La Masa Equivalente De Un Elemento.
Es el peso en gramo del mismo que se combina con 8 g de O2 o 1.008 g H2 y se puede determinar de forma experimental.
La masa equivalente de un ácido.
Es la masa del ácido (expresado en gramos) que proporcionara 6,022.1023 iones de hidrogeno (1 mol) o que reacciona con 6,022.1023 de iones de hidróxido.
Para un ácido, es el peso que contiene 1 Eq-g de un ión de hidrogeno sustituible
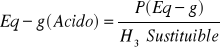
La Masa equivalente de una base.
Se define como la masa de la base (Expresado en gramo) que suministra 6,022.1023 iones de hidróxido a la masa de la base que reacciona con 6,022.1023 iones de hidrógeno.
Para una base es el peso de la base que contiene 1 Eq-g del grupo oxidrilo.
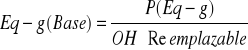
La masa equivalente para una sal
![]()
Ley de equivalencia.
El enunciado de la ley de equivalencia dice que “Un Equivalente Gramo de una sustancia reacciona reemplazando a un equivalente gramo de otra”.
Experimento
En el presente experimento are reaccionar una cinta de magnesio metálico con un cation de hidrogeno para determinar la masa equivalente del magnesio (Mg)
La ecuación resultante al combinar el Magnesio (Mg) y HCl es:
Mg + 2 HCl MgCl2 + H2
Produciéndose cloruro de magnesio más una molécula gaseosa de hidrogeno la cual es recogida para medirse el volumen.
Procedimiento Práctico y resultados
Coloco 35 ml de HCl a 3M en un cilindro graduado de 100 ml y se completa hasta enrase con agua destilada, (Enrasarse es llenar el cilindro graduado hasta el borde). Luego el cilindro graduado es invertido tratando de que no entren burbuja de aire al cilindro, lo sumerjo en una cubeta de agua corriente llena hasta ¾ de misma.
Luego le introduzco una cinta de magnesio al cilindro graduado que esta invertido en la cubeta, la cinta de magnesio empieza a reaccionar con el HCl liberando hidrogeno.
Después de completarse la reacción, le introduzco a la cubeta un termómetro para medir la temperatura.
Los resultados obtenidos son:
Inicialmente se tiene:
-
35 ml de HCl enrasado con agua destilada.
-
La cinta de Magnesio introducida tiene un peso Inicial de 0.0676 gr
Al reaccionar la cinta de Magnesio y el HCl se obtiene una molécula de hidrogeno gaseoso lo recogí y lo medí. Teniendo un resultados de 59 ml de hidrogeno.
La altura del agua después de la reacción es de 9 cm. haciéndose una conversión para llevar de cm. de H2O a mm de Hg.:
755,396 mm Hg 1028.09 cm H2O
X 9 cm H2O
X = 6.613 mm Hg.(Altura del Agua o Presión de la columna de agua)
Nota:
755,396 mm Hg es la Presión atmosférica de Maturín y es igual a 1028.09 cm H2O.
Luego con el termómetro tomo la temperatura del barde, resultando de 27 ºC que es igual a 300 ºK.
Sabiendo la temperatura se puede halla a través de una tabla la presión de vapor de agua, Siendo 26.7 mm Hg la presión del vapor del agua a 27 ºC.
La presión de hidrogeno lo calculo a través de la ley de Dalton.
P. Atmosférica = P. Vapor de Agua + P. Hidrogeno + Altura columna de Agua
Despejo la Presión de Hidrogeno, resultando:
P. Hidrogeno = P. Atmosférica - P. Vapor de Agua - Altura Columna de Agua
P. Hidrogeno = 755.396 mm Hg - 26,7 mm Hg - 6.6133 mmHg
P. Hidrogeno = 722.082 mm Hg = 0.9501 Atm.
Luego hallo los moles de hidrogeno con la ecuación de estado:
P V = n R T
Siendo P : Presión del hidrogeno
V : Volumen de Hidrogeno (L)
n : Numero de Moles
R : Es una constante y su valor es de 0.082 atm . L /mol . ºK
T : Temperatura expresado en ºK
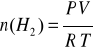
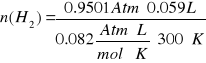
!![]()
![]()
Mediante una regla de tres hallo los Equivalentes - Gramos.
1 mol de H2 2 Eq . H+
2.2787x10-3 mol H2 X
X = 4.5573x10 -3 Equivalente gramo.
Sabiendo que el numero de equivalente de hidrogeno es igual al numero de equivalentes de magnesio y conociendo la masa inicial de la cinta (0.0672g), puedo calcular la masa equivalente.
![]()
Ahora calculo el error experimental, el cual es la diferencia existente entre un valor experimental (Ve) y un valor real (Vr), el cual es 12.16g. masa equivalente del magnesio.
Error Absoluto = / Ve - Vr /
Error Absoluto = /14.745- 12.16/
Error Absoluto = 2.585
Porcentaje de error:

Tabla de datos
| Parámetros | Datos |
| Temperatura del agua | 27 ºC |
| Diferencia entre los niveles de agua (h H2O) | 9 cm. |
| Volumen de H2 (ml) | 59 ml |
| Presión atmosférica (P. Atmosf.) | 755.396 mm Hg |
| Masa de magnesio | 0.0676 gr |
| Presión del vapor de Agua | 26.7 mm Hg |
Tabla de Resultados.
| Parámetros | Datos |
| Presión De La Columna De Agua (Mm Hg) | 6.613 mm Hg |
| Presión Del Hidrogeno (Mm Hg) | 722.082 mm Hg |
| Moles De Hidrogeno (N H2) | 2.2787x10-3 mol |
| Masa Equivalente Del Magnesio | 14.745 g |
Otro método para determinar la masa equivalente del magnesio es a través de las leyes de los gases.
La ley de boyle relaciona presiones y volúmenes de una muestra de gas a temperatura constante.
P1 . V1 = P2 . V2
La ley de Charles Relaciona volúmenes y temperaturas a presión constante.
![]()
La combinación de la ley de Boyle y la ley de chasle en una sola expresión de la ecuación de la leyes combinando solo los gases.
![]()
Planteamiento:
Peso del magnesio: 0.0676 g
V1 = 59 ml
P1 = 722.082 mm Hg = 0.9502 Atm
T1 = 300 º K
V2 = ?
P2 = 755.396 mm Hg = 0.9941 Atm
T2 = 273 º K (Normal)
Aplicando la ecuación combinada y sustituyendo tenemos:
![]()

Por medio de una regla de tres conseguimos el peso equivalente del magnesio
0.0676 g 51.3 ml
X 11200 ml H2
X = 14.7586 g
Conclusión
El experimento realizado se determino la masa equivalente del magnesio resultando un valor experimental de 14.7586 g (Con ambas técnicas utilizada para determinar la masa equivalente del Mg, el resultado fue el mismo), siendo el valor real de 12.16 g, resultando un error porcentual de 21.25%. Este error es debido a pequeños fallos de cálculo que nunca son exactos, como por ejemplo el volumen del gas de hidrogeno, la temperatura, la presión atmosférica a la cual fue sometido el experimento en ese instante, entre otros factores.
Como posibles errores se puede decir que:
Si se produce una fuga del gas obtenido en el cilindro graduado.
Hay menos Presión de Hidrogeno, menos volumen, menos masa de Magnesio resultando un Exceso en el resultado.
Si el Magnesio utilizado contiene impurezas no atacables por el HCl.
Va a quedar Magnesio sin reaccionar, va a haber menor reacción de hidrogeno, menos Presión de Hidrogeno, menos volumen, menos masa de Magnesio, resultando un Exceso.
Siendo estos algunos de los posibles errores cometidos en el momento de haberse realizado el experimento.
BIBLIOGRAFÍA
-
Química general Brown - le May.
-
Raymond Chang, Química. Cuarta Edición.
Descargar
| Enviado por: | Aly Jose |
| Idioma: | castellano |
| País: | Venezuela |
