Ecología y Medio Ambiente
Lluvia ácida y efecto invernadero
LLUVIA ÀCIDA:
-Introducción................................................................................................. pág 2 y 3
-¿Qué es la lluvia ácida?.............................................................................. pág 3 y 4
-Contaminante que origina la lluvia ácida.............................................. pág 4,5 y 6
-Características de la lluvia ácida............................................................. pág 7 y 8
-Los ecosistemas acuáticos y terrestres....................................................... pág 8
-Efectos sobre la salud humana........................................................................ pág 9
-Zonas afectadas.................................................................................................. pág 9
-¿Cómo afecta la lluvia ácida?....................................................... pág 10,11,12 y 13
EFECTO INVERNADERO:
-Introducción.............................................................................................. pág 14 y 15
-Factor que produce el efecto invernadero................................... pág 15,16 y 17
-¿Que es el efecto invernadero?.................................................................... pág 17
-¿Cómo atrapa la atmósfera la energía que irradia la tierra hacia el espacio?........................................................................................................ pág 17 y 18
-El dióxido de carbono: el principal culpable................................................ pág 18
-Otros culpables.................................................................................................. pág 18
-La tierra se recalentiza................................................................................... pág 19
-La subida del nivel del mar.............................................................................. pág 19
-¿Cómo sabemos que están aumentando los gases invernadero y que está subiendo la temperatura media mundial?.............................................. pág 19 y 20
-¿Qué se puede hacer?...................................................................................... pág 20
-Grafico.................................................................................................................. pág 21
BIBLIOGRAFÍA................................................................................................... pág 22
* Introducción:
Lluvia ácida, forma de contaminación atmosférica, actualmente objeto de gran controversia debido a los extensos daños medioambientales que se le han atribuido. Se forma cuando los óxidos de azufre y nitrógeno se combinan con la humedad atmosférica para formar ácidos sulfúrico y nítrico, que pueden ser arrastrados a grandes distancias de su lugar de origen antes de depositarse en forma de lluvia. Adopta también a veces la forma de nieve o niebla, o precipitarse en forma sólida. De hecho, aunque el término lluvia ácida viene usándose desde hace más de un siglo —procede de unos estudios atmosféricos realizados en la región de Manchester, Inglaterra—, un término científico más apropiado sería deposición ácida. La forma seca de la deposición es tan dañina para el medio ambiente como la líquida.
El problema de la lluvia ácida tuvo su origen en la Revolución Industrial, y no ha dejado de agravarse desde entonces. Hace mucho que se reconoce la gravedad de sus efectos a nivel local, como ejemplifican los periodos de smog ácido en áreas muy industrializadas. No obstante, la gran capacidad destructiva de la lluvia ácida sólo se ha hecho evidente en las últimas décadas. Una extensa área que ha sido objeto de múltiples estudios es el norte de Europa, donde la lluvia ácida ha erosionado estructuras, ha dañado los bosques y las cosechas, y ha puesto en peligro o diezmado la vida en los lagos de agua dulce.
Se atribuye a las emisiones industriales ser la principal causa de la lluvia ácida. Debido a que las reacciones químicas implicadas en la producción de lluvia ácida en la atmósfera son complejas y aún poco conocidas, las industrias tienden a rechazar la imputación y a hacer hincapié en la necesidad de realizar ulteriores estudios y, debido al coste de reducir la contaminación, los gobiernos han tendido a respaldar su actitud. Los estudios publicados a comienzos de la década de 1980, no obstante, inculpaban inequívocamente a las industrias como principal fuente de la lluvia ácida. En 1988, como parte del Acuerdo sobre la contaminación transfronteriza de la Convención de las Naciones Unidas (1979), veinticinco naciones ratificaron un protocolo en el que se congelaban las emisiones de óxidos de nitrógeno en los niveles de 1987. Las enmiendas de 1990 a la US Clean Air Act de 1967 introdujeron normas para reducir la liberación de dióxido de azufre por parte de las centrales energéticas en 10 millones de toneladas al año antes del 1 de enero del año 2000. Esta cantidad representa más o menos la mitad de las emisiones del año 1990.
* ¿Qué es la lluvia ácida?
Cuando la atmósfera recibe fuertes dosis de óxidos de azufre y nitrógeno, estos compuestos por reacciones químicas complejas se convierten parcialmente en ácido sulfúrico y nítrico. Algunas de esas partículas ácidas desaparecen por gravedad o por impacto contra el suelo, edificios, plantas, etcétera: es la llamada precipitación seca. Otras, permanecen en la atmósfera, se combinan con la humedad de las nubes y caen con la lluvia, la nieve y el rocío: es la lluvia ácida.
El carbón, así como otros combustibles minerales, son los responsables de verter a la atmósfera el óxido de azufre. Las altas temperaturas de las combustiones combinan químicamente el nitrógeno y el oxígeno presentes en el aire y forman el óxido de nitrógeno.
Las centrales eléctricas, las industrias grandes y pequeñas y las casas donde se combustiona carbón son los responsables, junto a los usuarios de petróleo, de este tipo de contaminación.
El pH es el símbolo que utiliza la química para medir la ácidez o alcalinidad de las soluciones (equivale al logaritmo decimal negativo de la concentración de iones hidrógeno). Una solución neutra tiene un pH de 5,6 a 7 (la escala va de 0,0 a 14,0), por debajo de 5,6 se considera medio ácido y por encima de 7,0, medio alcalino.
La llamada lluvia ácida tiene un pH inferior a 5,6 y puede ir hasta 2,5 y excepcionalmente 1,5.
Una solución con un pH 6 es diez veces más ácida que una de pH 7, una de pH 5, cien veces más ácida, la proporción se va multiplicando por diez a medida que disminuyen los valores del pH.
Los efectos de la lluvia y la precipitación ácida en lagos y corrientes de aguas implica la muerte de crustáceos, insectos acuáticos y moluscos y la desaparición del fitoplancton, lo que provoca con el tiempo la imposibilidad de sobrevivencia del resto de la fauna por falta de alimento y vuelve los lagos transparentes.
En el suelo, la ácidez penetra en la tierra y afecta las raíces de los árboles, al tiempo que sus hojas se ven afectadas también directamente por las gotas de lluvia que reciben. El proceso de envenenamiento de la flora termina con la muerte de las plantas y árboles.
Los edificios y las construcciones de hormigón también se ven seriamente afectados, deben ser continuamente restaurados, y en los animales se ha observado pérdida de pelo y desgaste prematuro de mandíbulas entre otras afecciones.
La consecuencia de la lluvia ácida en el ser humano determina un incremento muy importante de las afecciones respiratorias (asma, bronquitis crónica, síndrome de Krupp, etcétera) y un aumento de los casos de cáncer.
La contaminación debilita todo el organismo, sea humano, vegetal o animal, y eso provoca una disminución de las defensas y una mayor disposición a contraer enfermedades. Los más afectados son los niños, las personas mayores, las mujeres embarazadas y los aquejados de dolencias crónicas como corazón, circulación y asma.
* Contaminante que origina la lluvia ácida.
El principal contaminante que origina la lluvia ácida es el dióxido de azufre (SO2). El SO2 se produce por oxidación del azufre contenido en el combustible, convirtiéndose en SO2 y SO3. El contenido medio de azufre en los fuel-oiles es del 3,6%. Las centrales térmicas españolas son las principales emisoras del SO2 en España. Pero, no todos los contaminantes proceden de la quema de combustibles, los hidrocarbonos se generan en gran parte por los vegetales, así las algas marinas expulsan grandes cantidades de terpenos.
El SO2 en sí no es perjudicial para la salud en niveles normales de hasta 2 p.p.m., si bien, a las personas asmáticas las afecta gravemente causándolas trastornos respiratorios, desde concentraciones de 0,25 p.p.m. El principal problema del SO2 se produce al reaccionar con el agua presente en la atmósfera, generando la denominada lluvia ácida. Hay tres clases de deposición ácida:
a) Cuando el SO3 formado se disuelve en el agua de lluvia tenemos la lluvia ácida propiamente dicha.
b) Si no hay lluvia, la deposición será sobre las bajos de los árboles o en el suelo: deposición ácida.
c) Si se mezcla con las gotas de niebla: deposición oculta, cuya acidez puede ser superior, 10 veces, a la de la lluvia ácida.
Se considera lluvia ácida cuando su pH es 4,5; consecuencia de esto los distintos tipos de deposición producen una serie de fenómenos distintos: acidificación de los lagos y agua dulce; acidificación de los suelos, lo cual conlleva a un cambio en sus actividades biológicas del suelo; y destrucción de los bosques como consecuencia de la acidez del agua de lluvia, primero se observa un clareo de los hojas en su copa, luego una decoloración y posteriormente la asfixia de la planta.
La lluvia ácida afecta no sólo a la salud de los seres humanos, sino a la totalidad de la biosfera, y también a los materiales de construcción empleados para edificios, así como al patrimonio histórico, ya que causa graves perjuicios a edificios y obras de arte, que sufren un deterioro acelerado.
En virtud de los desplazamientos de las masas de aire, los efectos perniciosos de los contaminantes se dejan sentir en zonas alejadas a cientos de kilómetros del lugar donde han sido emitidos. Esta es la razón por la cual se crea la necesidad de saber hacia dónde se dirigen las nubes contaminantes originadas por un país; y se elabora con este fin un programa modelo, el MM4, que se aplica entre 25 y 2.500 Km e incluye: ciclos convectivos, lluvias, nubes y el efecto del suelo. Pronostica variables de vientos, temperatura del aire, humedad relativa, superficie del mar, diferencias de presiones, etc. Los métodos normalizados más empleados en el análisis de SO2 son: método del peróxido de hidrógeno, método del yodo, método gravimétrico, método yodo-tiosulfato, métodos espectrofotométricos, métodos colorimétricos, etc.
En esta situación se comprueba que Gran Bretaña y Alemania son los grandes exportadores de SO2, al provocar lluvias ácidas en otros países de la Comunidad europea. De igual forma se sabe que la acidez de las lluvias, en general, es mayor en los meses de primavera y verano, y no coinciden estas épocas con los meses en los cuales las cantidades emitidas de contaminantes son mayores (meses de invierno). Luego, podemos decir que el transporte de contaminantes por las corrientes de aire es muy importante, ya que los efectos de lluvia ácida que sufre un determinado país se deben en su mayor parte a las emisiones de otro.
En vista de los daños que provoca la contaminación es necesaria la adopción de medidas internacionales y nacionales para su prevención, entre las cuales destaca el Convenio de Ginebra sobre Contaminación Transfronteriza, vigente desde 1983. De esta manera, se establecen los niveles de emisiones generados en cada país. Reducciones que se deberán hacer, bien en los combustibles, o bien con la preparación adecuada de las instalaciones.
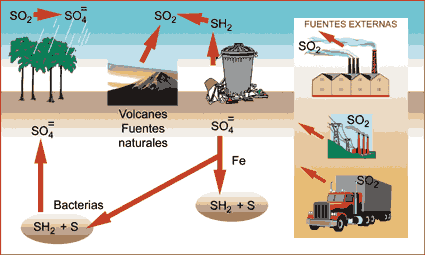
Ciclo del Azufre
Ciclo del Nitrógeno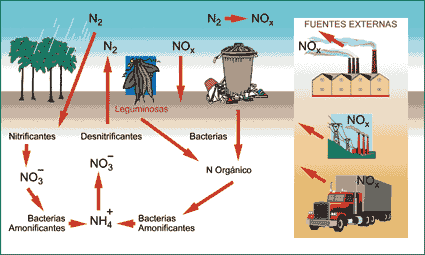
* Características de la lluvia ácida
La lluvia ácida presenta un pH menor (más ácido) que la lluvia normal o limpia. Constituye un serio problema ambiental ocasionado principalmente por la contaminación de hidrocarburos fósiles. Estos contaminantes son liberados al quemar carbón y aceite cuando se usan como combustible para producir calor, calefacción o movimiento (gasolina y diesel).
El humo del cigarro es una fuente secundaria de esta contaminación, formada principalmente por dióxido de azufre (SO2) y óxidos de nitrógeno (NOx). Las erupciones volcánicas y los géiseres contribuyen con una pequeña cantidad de estos contaminantes a la atmósfera.
La lluvia ácida se forma generalmente en las nubes altas donde el SO2 y los NOx reaccionan con el agua y el oxígeno, formando una solución diluida de ácido sulfúrico y ácido nítrico. La radiación solar aumenta la velocidad de esta reacción.
SO3+H2O --> H2SO4
2NO2+H20 --> HNO3 + HNO2
La lluvia, la nieve, la niebla y otras formas de precipitación arrastran estos contaminantes hacia las partes bajas de la atmósfera, depositándolos sobre las hojas de las plantas, los edificios, los monumentos y el suelo.
A través del ciclo hidrológico, el agua se mueve en plantas y animales, ríos, lagos y océanos, evaporándose a la atmósfera y formando nubes que viajan empujadas por el viento, de tal suerte que si transportan contaminantes, éstos pueden alcanzar casi cualquier lugar sobre la superficie terrestre.
Una lluvia ¨limpia¨ es imposible de despojar de partículas de polvo y polen y de un pH cercano al 5.6 (ligeramente ácido). Al adicionarse SO2 y NOx el pH se torna dramáticamente ácido (por los ácidos sulfúrico y nitrico formados en la atmósfera).
Los contaminantes pueden depositarse también en forma seca, como gas o en forma de pequeñas partículas. De hecho, casi la mitad de la acidez de la atmósfera se debe a este tipo de deposición.
El viento se encarga de empujar estos contaminantes sobre los edificios, el suelo, el campo y aún, hacia nuestro interior con el aire que respiramos. Cierta parte de estos contaminantes la podemos ingerir con los alimentos a los que ha llegado polvo y gas.
* Los ecosistemas acuáticos y terrestres
La mayor preocupación por el impacto de la lluvia ácida sobre los ecosistemas acuáticos se centra en los efectos sobre la población piscícola. La creciente acidificación de los lagos ha causado la muerte de peces y el agotamiento de las reservas. Los efectos negativos se han atribuido a disminuciones repentinas del pH; sus descensos graduales con el tiempo, provocan una acidez prolongada que obstaculiza la reproducción científica y el desove, con lo cual su fauna disminuye y se reproducen las especies más tolerantes. Otro problema es que la deposición ácida conduce a la movilización de metales tóxicos, especialmente el aluminio, y este puede ser otro factor que contribuye a la mortandad de los peces.
La deposición ácida puede causar daños a los ecosistemas terrestres aumentando la acidez del suelo, disminuyendo la cantidad de nutrientes, movilizando los metales tóxicos, eliminando importantes sustancias del suelo y cambiando su composición. La precipitación ácida causa una reducción de la productividad forestal afectando a las distintas 
clases de árboles. En un estudio de un período de 15 años, se demostró que la lluvia ácida esta lixiviando importantes nutrientes de las plantas como el ácido, el magnesio y el potasio de los suelos haciéndolos inutilizables para los árboles. Además moviliza el aluminio en los suelos forestales, que disminuyen la proporción entre el calcio y dicho elemento hasta el punto en que se deteriora el crecimiento de las raíces. Además de los árboles, se ha centrado la atención en los efectos sobre un amplio espectro de cultivos.
* Efectos sobre la salud humana
Excesivas cantidades de cationes de hidrógeno introducidos en el suelo por precipitación ácida pueden cambiarse por cationes de metal pesado introduciéndose en el suelo y las corrientes de agua. Los componentes metálicos pueden contaminar a los peces comestibles y el agua potable y así, pasar a las personas.
Otra cuestión preocupante es que la deposición ácida puede acelerar la lixiviación, la movilización y acumulación de metales pesados tóxicos y otras sustancias químicas y nocivas en vertederos de residuos peligrosos. Su acción directa sobre los seres humanos se refleja en el aumento de las enfermedades cardiovasculares y de las vías respiratorias, de la conjuntivitis y de las alergias.
La precipitación ácida puede acelerar la corrosión de metales y la erosión de las piedras. La frecuencia cada vez mayor de neblinas contaminantes en áreas rurales y desiertas puede afectar al clima de la tierra.
* Zonas afectadas
Las zonas que tienen más fuentes de acidez están entre las que sufren mayor cantidad de precipitación ácida, pero sólo el transporte a largas distancias de óxido de azufre y nitrógeno desde estas fuentes puede explicar la lluvia ácida en lugares distantes de las fuentes de contaminación. Aunque una parte sustancial de las emisiones de SO2 se deposita cerca de sus fuentes, una proporción significativa se dispersa por lugares lejanos. Esta proporción que no se deposita "in situ" se difundirá por la atmósfera y se transformará por oxidación en sulfatos; una situación similar acontece a las emisiones de óxido de nitrógeno, donde ciertas cantidades se convierten en aerosoles de nitrato.
El efecto de la lluvia ácida varía según el pH del suelo sobre el que caiga: mientras que los terrenos graníticos dan lugar a suelos ácidos, lo que acentúa el problema, las rocas calcáreas dan lugar a suelos básicos, que convierten los ácidos sulfúricos y nítricos en sulfatos y nitratos.
* ¿Cómo afecta la lluvia ácida?
La lluvia ácida huele, se ve y se siente igual que la lluvia normal, y se podría decir que podemos bañarnos con ella sin sentir un efecto inmediato especial. El daño que produce a las personas no es directo, es más inmediato el efecto de los contaminantes que producen esta lluvia y que llegan al organismo cuando éste los respira, afectando su salud.
Los productos del hombre, monumentos y edificios, son más susceptibles a la acción de la lluvia ácida. Muchas ruinas han desaparecido o están en vías de hacerlo, a causa de este factor.
En los bosques la situación es un tanto distinta. Aunque los científicos no se han puesto de acuerdo con respecto a los efectos inmediatos concretos, todos estiman que la lluvia ácida no mata directamente a plantas y árboles, sino que actúa a través de ciertos mecanismos que los debilitan, haciéndolos más vulnerables a la acción del viento, el frío, la sequía, las enfermedades y los parásitos. La lluvia ácida afecta directamente las hojas de los vegetales, despojándolas de su cubierta cerosa y provocando pequeñas lesiones que alteran la acción fotosintética. Con ello, las plantas pierden hojas y así, la posibilidad de alimentarse adecuadamente. En ocasiones la lluvia ácida hace que penetren al vegetal ciertos elementos como el aluminio (éste bloquea la absorción de nutrientes en las raíces), que afectan directamente su desarrollo.
Los efectos de la lluvia ácida en el suelo pueden verse incrementados en bosques de zonas de alta montaña, donde la niebla aporta cantidades importantes de los contaminantes en cuestión.
Las áreas de cultivo no son tan vulnerables a los efectos de la lluvia ácida, toda vez que generalmente son abonadas con fertilizantes que restituyen nutrientes y amortiguan la acidez.
La naturaleza posee ciertos mecanismos para regular la acidez producida por causas naturales. El suelo, sobre todo el calizo, ejerce una acción amortiguadora (buffer) que impide que el pH se torne demasiado ácido. No obstante, la mayor cantidad de contaminantes llegan al medio como producto de la actividad humana, que los produce en cantidades colosales, que no pueden ser amortiguadas.
En sitios donde los suelos no son tan buenos amortiguadores, o donde el aporte de contaminantes es muy superior a lo que puede reciclarse, se acentúan los efectos nocivos de la lluvia ácida.
Sólo como ilustración, presentamos la estimación que los investigadores Inés García y Carlos Dorronsoro, presentan para el caso de el efecto de la acidez en Europa. Conviene analizar cada caso para establecer alguna relación con respecto a factores como: tipo de suelo, actividad humana preponderante, entre otros.
Los efectos de la lluvia ácida en medios acuáticos (lagos, ríos, estanques) son más evidentes, toda vez que los organismos que en ellos habitan son más vulnerables a las variaciones de pH.
| ORGANISMO | LÍMITE QUE SOPORTA (pH) |
| trucha | 5.0 |
| perca | 4.5 |
| rana | 4.0 |
| salamandra | 5.0 |
| lombriz | 6.0 |
| mosca | 5.5 |
| acocil | 6.0 |
Los organismos adultos pueden ser mucho más resistentes a la acidez, no obstante, cuando los huevos o los jóvenes son afectados por ella, o cuando el alimento natural que los sostiene es abatido por la acidez, los adultos se debilitan o la población merma y puede llegar a desaparecer.
Algunas de las especies químicas que hay en la atmósfera como el SO2, NO, NO2 , CO, CO2 , NH3 , pueden interactuar con el vapor de agua del aire produciendo iones o ácidos que son los que forman la lluvia ácida.
El agua pura tiene un pH = 7 a 25ºC y una presión de una atmósfera, se ioniza formando iones hidrógeno o protones y iones oxidrilo o hidroxilo, con una concentración cada uno de 10-7 moles/L.
El agua de lluvia es ligeramente ácida porque el agua y el dióxido de carbono del aire forman ácido carbónico y tiene un pH entre 5.7 y 7. En lugares contaminados por ácido sulfúrico y ácido nítrico el pH de esa lluvia varía entre 5 y 3.
El dióxido de azufre y los óxidos nítrico y nitroso son originados principalmente por las termoeléctricas, los motores de combustión interna de coches y aviones y algunas otras industrias.
Casi todas las construcciones que hace el hombre como edificios, monumentos y maquinaria son corroídos por exposición prolongada a ácidos diluidos, sin embargo, sus efectos a largo plazo sobre la naturaleza son más importantes. El incremento de ácidos en el suelo acelera la velocidad de lixiviación de los nutrientes vitales como el calcio, para las plantas y la vida acuática (afecta el desarrollo de los huevos de los peces).
La lluvia ácida se forma gracias a reacciones como:
| CO2 + H2O <========> H2CO3 SO2 + H2O --------> H2SO3 2 SO2 + O2 --------> 2 SO3 SO3 + H2O -------> H2SO4 |
Las reacciones químicas directas del nitrógeno generalmente requieren altas temperaturas, debido a su poca reactividad química. Su reacción con el oxígeno puede efectuarse usando una descarga eléctrica de alto voltaje:
N2 + O2 -----> 2 NO. (Óxido nítrico, gas incoloro).
2 NO(G) + O2(G) -----> 2 NO2(G) . (Bióxido de nitrógeno, gas café).
El bióxido de nitrógeno existe en equilibrio con su dímero, el tetróxido de dinitrógeno, N2O4 , que es un gas incoloro y se licua a 21.3ºC.
NO2 (G) <========> N2O4 (G).
El dióxido de nitrógeno se descompone por la acción de la luz solar en óxido nítrico y oxígeno atómico (es muy reactivo).
NO2 (G) + hv (radiación solar) -------> NO(G) + O (G).
El bióxido de nitrógeno se combina con el agua produciendo ácido nítrico y óxido nítrico o ácido nítrico y ácido nitroso, según la cantidad de bióxido de nitrógeno que reaccione con el agua:
3 NO2 (G) + H2O(V) --------> 2 HNO3(L) + NO(G) .
2 NO2 (G) + H2O(V) ---------> HNO3(L) + HNO2 (L).

* Introducción:
Efecto invernadero, término que se aplica al papel que desempeña la atmósfera en el calentamiento de la superficie terrestre. La atmósfera es prácticamente transparente a la radiación solar de onda corta, absorbida por la superficie de la Tierra. Gran parte de esta radiación se vuelve a emitir hacia el espacio exterior con una longitud de onda correspondiente a los rayos infrarrojos, pero es reflejada de vuelta por gases como el dióxido de carbono, el metano, el óxido nitroso, los halocarbonos y el ozono, presentes en la atmósfera. Este efecto de calentamiento es la base de las teorías relacionadas con el calentamiento global.
El contenido en dióxido de carbono de la atmósfera ha venido aumentando un 0,4% cada año como consecuencia del uso de combustibles fósiles como el petróleo, el gas y el carbón; la destrucción de bosques tropicales por el método de cortar y quemar también ha sido un factor relevante que ha influido en el ciclo del carbono. La concentración de otros gases que contribuyen al efecto invernadero, como el metano y los clorofluorocarbonos, está aumentando todavía más rápido. El efecto neto de estos incrementos podría ser un aumento global de la temperatura, estimado en 2 a 6 °C en los próximos 100 años. Un calentamiento de esta magnitud alteraría el clima en todo el mundo, afectaría a las cosechas y haría que el nivel del mar subiera significativamente. De ocurrir esto, millones de personas se verían afectadas por las inundaciones.
Según un estudio reciente, publicado por la revista Nature, la primavera es más larga debido en parte al efecto invernadero. Este estudio afirma que desde principios de 1980 la primavera se adelanta y la vegetación crece con mayor vigor en las latitudes septentrionales; esto se debe al calentamiento global que ha afectado a una gran parte de Alaska, Canadá y el norte de Asia y Europa, que a su vez está relacionado con el efecto invernadero de origen humano (teoría según la cual la población humana ha contribuido a la concentración de gases, tales como el dióxido de carbono, en la atmósfera). Mediante el uso de imágenes obtenidas a través de satélites climáticos, los científicos proporcionan pruebas del cambio climático y aportan datos significativos para el estudio del calentamiento global del planeta.
* Factor que produce el efecto invernadero
El ciclo biogeoquímico del carbono controla, de forma natural, la trasferencia de este elemento entre la tierra, los océanos y la atmósfera.
El carbono se encuentra en la naturaleza disponible para ser utilizado por los seres vivos de dos maneras fundamentales: formando parte del anhídrido carbónico de la atmósfera (CO2), o bien disuelto en agua. Básicamente, el ciclo biológico consiste en la incorporación del carbono inorgánico en forma de CO2 a los compuestos orgánicos, por la acción de los organismos fotosintéticos, que reducen el CO2 a hidratos de carbono; a su vez, esos compuestos orgánicos son oxidados en la respiración de los organismos, liberándose nuevamente CO2.
El CO2 también se libera a la atmósfera por otra vía, consecuencia del ciclo geoquímico del carbono; y es que la fauna marina (corales y plancton) sintetiza carbonato cálcico (CaCO3) para construir sus conchas o sus esqueletos, a partir de iones calcio y bicarbonato, liberando en el proceso CO2 a la atmósfera; ambos iones, junto con el dióxido de sílice (SiO2), proceden de la meteorización de los minerales del grupo de los carbonatos y los silicatos, y son transportados por los ríos hasta el mar. Cuanto estos organismos mueren se entierra en el fondo del océano para formar las rocas sedimentarias; sin embargo, en las zonas más profundas de la Tierra, la temperatura permite la combinación de CaCO3 y SiO2 para formar silicato cálcico y CO2, el cual retorna también a la atmósfera, bien de forma drástica en el curso de una erupción volcánica, bien a través de un manantial carbónico.
Los procesos naturales de la fotosíntesis y de la respiración normalmente se equilibran, así como los procesos geológicos. Durante los 10.000 últimos años, la concentración de dióxido de carbono en la atmósfera ha permanecido relativamente constante, y su volumen constituye solo un 0,03% del volumen total de la atmósfera. Sin embargo, esta pequeña cantidad cumple una función muy importante, pues el dióxido de carbono absorbe calor de los rayos solares. Desde el siglo pasado, la concentración atmosférica de CO2 ha ido aumentando progresivamente, debido principalmente al incremento de la combustión de los combustibles fósiles y a la destrucción de las selvas tropicales del planeta. La oxidación de la biomasa de las selvas destruidas, bien por la quema o bien por la acción metabólica de los descomponedores, libera grandes cantidades de dióxido de carbono; y además, el dióxido de carbono que había sido utilizado por los árboles y las plantas en la fotosíntesis, ahora permanece en la atmósfera.
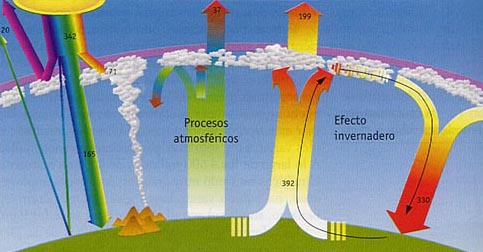
El efecto que producen estos fenómenos se denomina efecto invernadero y se traduce en un aumento de la temperatura media de la Tierra, que ya se empieza a notar y aumentará considerablemente en los próximos años. Como consecuencia del aumento de temperatura se producirán drásticas variaciones de las precipitaciones en las distintas partes del planeta y por consiguiente también en la productividad primaria; una elevación del nivel de los océanos, debido a la fusión del hielo polar; y la desaparición de muchas especies que no podrán adaptarse a las nuevas condiciones ambientales.
Actualmente, se está trabajando a fondo en la búsqueda de posibles soluciones que permitan hacer más lenta la tasa de crecimiento de la población humana, así como evitar el desmonte de las selvas tropicales para proveer tierra para el cultivo o para pastorear el ganado, y de esta manera, dejar las áreas selváticas como reservas inalteradas.
También se está considerando la utilización de combustibles alternativos, como el metanol puro en la propulsión de turismos, lo que reduciría la emisión de hidrocarburos y de gases que contribuyen al efecto invernadero, aliviando también la explotación de otros recursos. También se ha comprobado que el azufre procedente de la industria y del fitoplancton forma partículas con diversos efectos en el entorno. Uno de ellos es el enfriamiento de la Tierra, al difundir la luz solar devolviéndola al espacio, amortiguando así el efecto invernadero.
* ¿Que es el efecto invernadero?
La tierra se calienta gracias a la energía del Sol. Cuando esta energía llega a la atmósfera, una parte es reflejada de nuevo al espacio, otra pequeña parte es absorbida, y la restante llega a la tierra y calienta su superficie. Pero cuando la tierra refleja a su vez la energía hacia la atmósfera, ocurre algo diferente. En lugar de atravesarla y llegar al espacio, los gases de la atmósfera absorben una gran parte de esta energía. Esto contribuye a mantener caliente el planeta.
De esta manera, la atmósfera deja que la radiación solar la atraviese para calentar la Tierra, pero no deja salir la radiación que la Tierra irradia hacia el espacio. En un invernadero ocurre lo mismo, salvo que en el invernadero se utiliza cristal, en vez de gases, para retener el calor. Por eso llamamos a este fenómeno efecto invernadero.
Los gases invernadero de la atmósfera cumplen la función de mantener la temperatura media adecuada para la Tierra, a pesar de que las temperaturas varíen mucho de un lugar a otro. Si estos gases aumentaran, retendrían demasiado calor. Esto provocaría el recalentamiento del planeta.
* ¿Cómo atrapa la atmósfera la energía que irradia la tierra hacia el espacio?
La atmósfera contiene unos gases que, aunque existen en pequeñas cantidades, retienen el calor que irradia la Tierra. Entre los gases naturales que retienen el calor están:
- Dióxido de carbono: Es el más abundante gas invernadero. Existe de forma natural en la atmósfera, pero la actividad humana, sobre todo la utilización de carburantes y la deforestación, está contribuyendo a que aumente.
- Metano: Es un gas oloroso que emerge de lugares pantanosos tales como los arrozales y los vertederos. También proviene de los excrementos de los herbívoros estabulados
- Óxido de nitrógeno: Se produce por el uso de fertilizantes químicos y por la combustión de carburantes. También se produce de forma natural gracias a las bacterias del suelo.
- El vapor de agua y el ozono:
Todos ellos son importantes gases invernadero.
Pero la atmósfera contiene unos gases artificiales, fabricados por el hombre, que contribuyen el efecto invernadero. Entre ellos destacan los CFC (clorofluorocarbonos), elementos químicos responsables en gran medida de la destrucción de la capa de ozono que protege la vida. Si la atmósfera no tuviese dos gases que se producen de forma natural: el dióxido de carbono y el vapor de agua, la Tierra estaría 30 grados centígrados más fría de lo que está en la actualidad. Pero la polución está incrementando la cantidad de gases invernadero presentes en la atmósfera, y corremos el riesgo de que la Tierra se recaliente.
* El dióxido de carbono: el principal culpable.
El carbón, el petróleo y el gas natural son combustibles fósiles. Los quemamos en nuestras calderas, fábricas, coches y centrales térmicas para producir calor y energía. Se llaman combustibles fósiles porque se han formado a lo largo de millones de años de los restos de plantas y animales enterrados bajo el suelo. Pero los combustibles fósiles contienen grandes cantidades de carbono y, cuando se queman, liberan la energía que han acumulado durante millones de años. Entonces emiten dióxido de carbono a la atmósfera. Este gas contribuye a aumentar el efecto invernadero. No sólo quemamos combustibles fósiles liberando dióxido de carbono a la atmósfera. También estamos destruyendo la selva a fin de ganar terreno para la agricultura. La quema de la selva es una verdadera tragedia para la Tierra, puesto que su combustión libera grandes cantidades de dióxido de carbono a al atmósfera. Además, desaparecen los árboles que podrían absorber este gas. Así, la deforestación contribuye doblemente al efecto invernadero. La selva nos ha proporcionado muchas sustancias de gran utilidad. También constituye el hábitat de muchas tribus que están desapareciendo y de una importante fauna.
* Otros culpables.
El dióxido de carbono es el más abundante gas invernadero, pero hay otros muchos. Hasta ahora se han identificado unos 30, y es probable que existan otros de los que aún no tenemos conocimiento. Muchos gases invernadero existen en la atmósfera en pequeñísimas cantidades. Sin embargo, desgraciadamente, su poder de atrapar el calor es aterrador. Se estima que el del metano es unas 30 veces mayor que el del dióxido de carbono; el óxido de nitrógeno, 150 veces; el ozono de superficie, 2000 veces; y el CFC, de 10 a 23000 veces. Algunos de estos gases tienen una vida muy larga en la atmósfera: aunque el ozono de superficie sólo dura unas semanas, el óxido de nitrógeno puede sobrevivir unos 170 años. Se calcula que unos CFC duran aproximadamente un siglo, y otros tienen una vida de hasta 20.000 años. Estas estadísticas nos demuestran que vamos a tener que enfrentarnos con un recalentamiento de la Tierra durante mucho tiempo.
* La tierra se recalentiza.
El tiempo cambia de día en día, y unos grados más o unos grados menos entre un día y el siguiente nos parecen muy pocos. Sin embargo, cuando nos referimos a la temperatura media mundial, unos grados de más o de menos constituyen una gran diferencia. Los científicos opinan que si los gases invernadero se duplican, la temperatura media mundial se incrementará entre 1.5 y 4.5 grados centígrados. Si tenemos en cuenta que entre la temperatura media que reinaba durante la última glaciación y la actual sólo hay una diferencia de 4 grados centígrados, podemos imaginarnos fácilmente que un incremento semejante podría acarrear unas consecuencias catastróficas. Las condiciones climatológicas cambiarían a escala mundial. Los científicos estiman que las temperaturas en el sur de Europa serían superiores a la media global de subida. Con veranos menos lluviosos, algunas zonas podrían convertirse en desiertos. El efecto invernadero podría, a corto plazo, favorecer determinadas regiones, como, por ejemplo, Siberia, donde mejoraría la agricultura. Pero al derretirse la capa de hielo que la recubre permanentemente, podrían producirse escapes de metano.
* La subida del nivel del mar.
Si la Tierra se recalentara, los glaciares de las montañas y los hielos del polo Norte y de la Antártida empezarían a derretirse. Nadie sabe con exactitud cuánto podría subir el nivel de las aguas del mar. Pero si no se toman medidas para que cese el incremento de la temperatura media mundial, el nivel podría subir de 20 a 40 cm para principios del próximo siglo, y seguir subiendo. Incluso una pequeñísima subida del nivel de las aguas del mar podría tener unas consecuencias catastróficas. Por ejemplo, gran parte de Holanda ha sido ganada al mar, y vastas extensiones del país están por debajo del nivel del mar. Si este nivel sube, se podrían inundar todos esos terrenos u obligar a construir nuevos y caros diques de contención. Las islas Maldivas, en el océano Índico, también son muy bajas, y si el nivel del mar subiera un metro, desaparecerían casi por completo bajo las olas del mar. Si el nivel del mar subiera de 4 a 8 metros, las consecuencias serían aún más catastróficas.
* ¿Cómo sabemos que están aumentando los gases invernadero y que está subiendo la temperatura media mundial?
Gracias a las burbujas de aire atrapadas hace mucho tiempo entre los hielos de Groenlandía y de la Antártida podemos comparar el aire de entonces con el actual. De esta manera se comprueba que los gases invernadero han ido incrementando gradualmente su presencia en la atmósfera durante los últimos años. Por otro lado, los datos recogidos sobre el clima a lo largo de muchos años demuestran que la temperatura media mundial se ha incrementado en medio grado centígrado en los últimos cien años.
* ¿Qué se puede hacer?
Para evitar los posibles peligros que nos acechan si el planeta se recalienta, tenemos que empezar por reducir la cantidad de gases invernadero que liberamos a la atmósfera. Para disminuir los niveles del dióxido de carbono, hay que quemar menos combustible fósil. Esto se puede conseguir si utilizamos energías alternativas. El racionalizar y optimizar el consumo energético también es una manera eficaz de disminuir la cantidad de dióxido de carbono que emitimos a la atmósfera. Otra manera de reducir el nivel de dióxido de carbono es detener la tala y quema de los bosques. También podemos plantar árboles, que obtienen el dióxido de carbono del aire y lo transforman, evitando que vaya a la atmósfera. Un problema muy grave es la destrucción de la selva tropical.

* Grafico.
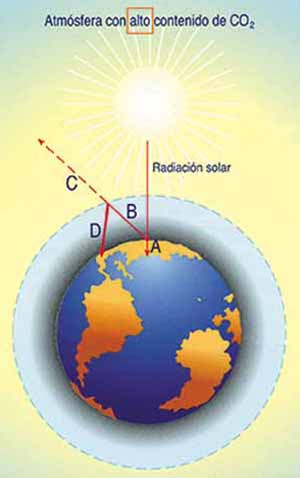
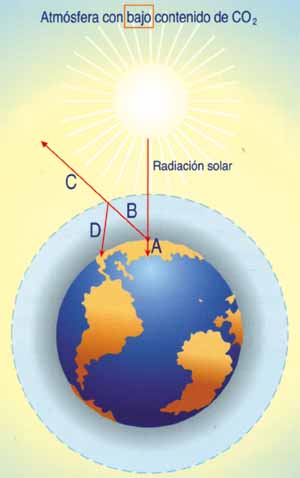
Cuanto mayor es la concentración de CO2 en la atmósfera, mayor es D en relación a C. El resultado es que la temperatura, como en un invernadero, tiende a ascender.
Los gráficos superiores muestran una comparativa del comportamiento de la atmósfera según su contenido de dióxido de carbono, C02.
A representa la energía absorbida por la tierra.
B la energía calorífica reflejada por la tierra
C la fracción de energía reflejada devuelta al espacio
D Fracción de energía reflejada que de nuevo es absorbida por la atmósfera.
*http://www.redes.org.uy/estudiantes/diccionario/conceptos/lluvia.htm
*enciclopedia universal micronet 2001
*enciclopedia encarta 99
*http://www.revistadelsur.org.uy/revista.078/Ambiente2.htm
*http://www.sagan-gea.org/hojared/Hoja13.htm
*http://www.esi.unav.es/asignaturas/ecologia/Hipertexto/10CAtm1/353BalEn.htm
*http://www.expoindustria.net/lluvia_acida.htm
*http://www.expoindustria.net/invernadero.htm
1
Descargar
| Enviado por: | Paloma Sanchigar |
| Idioma: | castellano |
| País: | España |
