Química
Hidróxido de Sodio
HIDRÓXIDO DE SODIO
INTRODUCCIÓN:
El Hidróxido de Sodio es una sustancia incolora e higroscópica que se vende en forma de trozos, escamas, hojuelas, granos o barras. Se disuelve en agua con fuerte desprendimiento de calor y la disolución acuosa se denomina lejía de sosa. Tanto la sosa cáustica como la lejía atacan la piel.
En su mayor parte la sosa cáustica y la lejía de sosa se obtienen en la electrólisis cloro- álcali. Sin embargo, se obtiene una pequeña parte por caustificación de Carbonato de Sodio. Se calienta una solución de Carbonato de Sodio con la cantidad correspondiente de cal apagada (Hidróxido de Calcio) así precipita el Carbonato de Calcio insoluble y en la solución queda Hidróxido de Sodio.
De este método se obtiene el nombre de sosa cáustica para el Hidróxido de Sodio.
Na2CO3 + Ca(OH)2 ! CaCO3 ! + 2 NaOH
APLICACIONES:
La sosa cáustica tiene muchas aplicaciones en la industria química, principalmente en forma de lejía de sosa, que se prepara donde ha de usarse y en cualquier concentración deseada por disolución en agua de la sosa sólida. Como campos principales de empleo citaremos: industrias de algodón, seda artificial, plásticos, textiles y de jabón, en la fabricación de diversos productos químicos, etc.
ALMACENAJE Y TRANSPORTE:
Como la sosa cáustica sólida es fuertemente higroscópica y reacciona rápidamente con el Dióxido de Carbono del aire, formando Carbonato de Sodio:
2 NaOH + CO2 ! Na2CO3 + H2O
Se envasa herméticamente en tambores y así se la amacena y distribuye. Como material de construcción para envases y depósitos es adecuado el hierro. El aluminio no puede emplearse, porque la lejía de sosa la disuelve formando aluminato, pero es posible emplear plásticos para el recubrimiento de vasijas. En el trabajo con sosa o con lejía es necesario utilizar gafas protectoras, porque tanto trocitos de sólido como gotas de solución atacan rápidamente los ojos.
MÉTODOS DE OBTENCIÓN
ELECTRÓLISIS CLORO-ÁLCALI:
Los productos principales de la electrólisis de Cloruro de Sodio, Cloro y sosa cáustica ya estaban asociados con anterioridad, pues ambos están en relación con la fabricación de sosa por el método Le Blanc. El Cloro se obtenía del Ácido Clorhídrico, producto secundario del método Le Blanc, la sosa cáustica a partir del producto principal, la sosa misma.
-
MÉTODO LE BLANC:
1- A partir de Cloruro de Sodio y Ácido Sulfúrico se obtienen Sulfato de Sodio y Cloruro de Hidrógeno.
2 NaCl + H2SO4 ! Na2SO4 + 2 HCl !
2- El Sulfato de Sodio se reduce con coque y se calcina con caliza, así se obtiene Carbonato de Sodio, Sulfuro de Calcio y Dióxido de Carbono.
Na2SO4 + CaCO3 + 2 C ! Na2CO3 + CaS + 2 CO2!
3- Por extracción con agua pueden separarse el Carbonato de Sodio (soluble) y el Sulfuro de Calcio (insoluble).
4- El Carbonato de Sodio puede tratarse con cal apagada para obtener una solución de Hidróxido de Sodio.
Na2CO3 + Ca(OH )2! CaCO3 ! + 2 NaOH
Al pasar al método de Solvay fue preciso obtener Cloro a partir de otras fuentes de Ácido Clorhídrico, sin que se alterase el cuadro en lo que se refiere a la sosa cáustica.
-
MÉTODO SOLVAY:
1- Haciendo pasar Amoníaco y Dióxido de Carbono (gaseosos) por una solución saturada de Coluro de Sodio se forma Carbonato ácido de Sodio y Cloruro de Amonio (ambos insolubles).
NaCl + NH3 + CO2 + H2O ! NaHCO3 + NH4Cl
2- El Carbonato ácido de Sodio se separa de la solución por filtración y se transforma en Carbonato de Sodio por calcinación:
2 NaHCO3 ! Na2CO3 + H2O + CO2!
3- El Cloruro de Amonio obtenido se hace reaccionar con Hidróxido de Calcio y se recupera Amoníaco.
2 NH4Cl + Ca(OH)2 ! 2 NH3! + 2 H2O + CaCl2
4- El Hidróxido de Calcio se produce en la misma fábrica por calcinación de Carbonato de Calcio (piedra caliza) y así se produce el Dióxido de Carbona necesario en la ecuación 1.
CaCO3 ! CaO + CO2!
En 1888 se descubrió el método del diafragma y se realizó la primera electrólisis técnica Cloro- álcali. El método de Griesheim se extendió triunfalmente por todo el mundo y fue piedra fundamental para nuevos desarrollos técnicos de procesos electroquímicos (obtención de Aluminio, Magnesio, Sodio, etc.).
Desde entonces, Cloro y sosa cáustica están íntimamente unidos, y el aumento en consumo de uno de ellos se traduce en exceso de producción del otro. Por ejemplo, cuando después de la primera guerra mundial, aumentó abruptamente el consumo de sosa cáustica para la industria de la seda artificial, el empleo del Cloro producido resultó un problema insoluble e hizo necesario la búsqueda de nuevos campos de aplicación para el Cloro. Esta búsqueda fue coronada con tal éxito que, desde hace unos treinta años, la situación ha cambiado por completo y el ulterior desarrollo de la electrólisis Cloro-álcalis está hoy subordinado a las necesidades de Cloro.
ELECTRÓLISIS EN FASE FUNDIDA POR EL MÉTODO DE DOW: (Gráfico 1)
En la célula , revestida con ladrillos de chamota, (1) el ánodo de grafito (A) penetra por la parte inferior, mientras el cátodo de hierro (B) rodea al ánodo anularmente.
El espacio catódico está separado por ambos lados del resto de la célula mediante una tela metálica.
Sobre el ánodo hay una campana (C), que capta el Cloro gaseoso, depositado en el ánodo (A) para que no se ponga en contacto con el Sodio fundido. Así se puede obtener separadamente Sodio fundido y Cloro gaseoso. El Sodio flota sobre el Cloruro de Sodio fundido, sobre el cátodo (B), de dónde se extrae y se pasa a un depósito colector (D).
La producción del fundido tiene lugar en el depósito superior (E), por encima de la campana, dónde se va cargando continuamente Cloruro de Sodio sólido.
2 NaCl ! 2 Na + Cl2!
MÉTODO DEL DIAFRAGMA: (Gráfico 2)
La célula horizontal en el método del diafragma, la célula Billiter (2) está separada por el diafragma (A) , que frecuentemente es formado por varias capas de asbesto, en un espacio anódico (B) y otro espacio catódico (C). También aquí se emplean como ánodos electrodos de grafito y como cátodo parrillas de Hierro. El electrolito es una solución purificada y saturada de Cloruro de Sodio (3) que entra continuamente por la parte superior.
Mediante la aplicación de una corriente contínua de unos cuatro voltios los iones Cloruro van al ánodo, se descargan, se unen para dar moléculas y abandonan en forma de gas el espacio anódico por (F). De los iones Na+ y H+ presentes en el cátodo se descargan solamente los últimos por su potencial de separación más positivo. El Hidrógeno se recoge por debajo del diafragma y se extrae por (D). En el espacio catódico queda una solución de lejía de sosa que contiene Cloruro de Sodio; unos 120 g de Hidróxido de Sodio y unos 140 g de Cloruro de Sodio. La disolución se extrae por (E). Unas 50 a 100 células se unen para constituir una batería.
2 NaCl + 2 H2O ! 2 NaOH + Cl2! + H2!
MÉTODO DE LA AMALGAMA: (Gráfico 3)
En la célula, algo inclinada hacia un lado (4), el ánodo consta también de varios electrodos de grafito (A) mientras el cátodo lo constituye el Mercurio (B) que cubre el suelo y que fluye en él lentamente. La célula no tiene diafragma. El electrolito es también aquí una solución purificada y saturada de Cloruro de Sodio que entra continuamente por (C). Se trabaja con corriente contínua con 4,6 voltios y el Cloro formado en el ánodo sale en forma gaseosa (D). Los iones Sodio se descargan en el cátodo de Mercurio y rápidamente forman con él la amalgama de Sodio que fluye fuera de la célula con un contenido en Sodio de alrededor de 0,2 % (E). Por medio de una bomba (F) se hace pasar la amalgama a un depósito (G), una torre rellena con grafito en la que se produce la descomposición de la amalgama con agua, con producción de Mercurio, lejía de sosa (H) e Hidrógeno (I). El Mercurio puro se recoge en el fondo de la torre y se bombea (J) de nuevo a la célula de electrólisis.
2 Na + Hg2 + 2 H2O ! 2 NaOH + Hg2 + H2!
TRATAMIENTO DE LOS PRODUCTOS DE ELECTRÓLISIS: (Gráfico 4 y 5)
El Hidrógeno producido en los métodos de diafragma y de la amalgama es de 95 %. La mayor parte de las veces se saca con Ácido Sulfúrico concentrado y mediante compresores (5) se le almacena en botellas de acero (6) si no se tiene para él la aplicación en fábricas propias.
La lejía de Sosa del método de diafragma es solamente del 12 % y contiene mucho Cloruro de Sodio. Se la concentra fuertemente en evaporadores de múltiple efecto (7), con lo que la mayor parte de Cloruro de Sodio precipita y se separa por centrifugación (no dibujado). La lejía de Sosa purificada de ésta manera es de 50 % y contiene todavía 2 % de Cloruro de Sodio. Si se requiere de mayor pureza debe recurrirse a un tratamiento de cristalización, el cuál es muy laborioso.
En el método de la amalgama se obtiene una lejía de sosa muy pura, completamente exenta de Cloruro de Sodio y otras impurezas, con una concentración de 50 %, que se puede aumentar fácilmente hasta un 75 %.
La lejía de sosa de 50 % se vende como tal (8) o se evapora hasta obtenerla sólida y se envasa en barriles (9).
El Cloro se liquida y se expende en vagones tanques a presión (10) o en botellas de acero.
El Sodio metálico, procedente de la electrólisis en fase fundida, no necesita más purificación y se envasa en latas (11) o barriles herméticos para su distribución al comercio.
CARACTERÍSTICAS DE LOS SUBPRODUCTOS OBTENIDOS
-
CLORO
Es un gas verde amarillento de olor picante y muy venenoso. Es dos veces más pesado que el agua y su punto de fusión es - 100,9 oC . Se disuelve moderadamente en agua y es uno de los elementos más reactivos. Debido a su gran reactividad no existe en estado elemental en la naturaleza. Los metales no nobles, son atacados formando Cloruros. Mezclado con Hidrógeno forma una mezcla detonante.
El Cloro tiene muchas aplicaciones en la industria química, para la fabricación de disolventes, aditivos de la gasolina, plásticos, fibras químicas, líquidos refrigerantes, etc.
-
HIDRÓGENO
Elemento gaseoso reactivo, insípido, incoloro e inodoro.
Sus puntos de ebullición y fusión son los más bajos de todas las sustancias, a excepción del Helio. El Hidrógeno líquido, obtenido por primera vez por el químico británico James Dewar en 1898 , es incoloro (excepto en capas gruesas, que tienen un aspecto azul pálido). Si se deja evaporar rápidamente bajo poca presión se congela transformándose en un sólido incoloro. El Hidrógeno en estado libre sólo se encuentra en muy pequeñas cantidades en la atmósfera. El hidrógeno reacciona con una gran variedad de elementos no metálicos. También se combina con ciertos metales como Sodio y Litio, formando hidruros. Actúa como agente reductor de óxidos metálicos como el Óxido de Cobre, extrayendo el Oxígeno y dejando el metal en estado puro. Industrialmente se producen grandes cantidades de Hidrógeno a partir de los combustibles gaseosos. El Hidrógeno se separa del vapor de agua, del gas natural y del gas de hulla, bien por licuación de los demás componentes del gas, o bien por conversión catalítica del Monóxido de Carbono en Dióxido de Carbono, que resulta fácilmente extraíble. El Hidrógeno es un producto derivado importante en muchas reacciones de electrólisis. Se emplean grandes cantidades de Hidrógeno en la elaboración del Amoníaco y en la síntesis de Alcohol Metílico. La hidrogenación de aceites para producir grasas comestibles, la de la hulla para producir petróleo sintético, y la que tiene lugar en el refinado del petróleo, requieren grandes cantidades de Hidrógeno. Es el gas menos pesado que existe y se ha utilizado para inflar globos y dirigibles. Sin embargo, arde fácilmente y varios dirigibles, como el Hindenburg, acabaron destruidos por incendios de Hidrógeno. El Helio, que tiene un 92% de la capacidad de elevación del Hidrógeno, y además no es inflamable, se emplea en su lugar siempre que es posible. También se usa el Hidrógeno en sopletes para corte, fusión y soldadura de metales.
-
SODIO:
Es un elemento metálico blanco plateado, extremamente blando y muy reactivo. Es uno de los metales alcalinos de la tabla periódica. El sodio elemental es un metal tan blando que puede cortarse con un cuchillo. Tiene una dureza de 0,4. Se oxida con rapidez al exponerlo al aire y reacciona violentamente con agua formando hidróxido de sodio e hidrógeno. Tiene un punto de fusión de 98 °C, un punto de ebullición de 883 °C y una densidad relativa de 0,97. Su masa atómica es 22,9898.
Sólo se presenta en la naturaleza en estado combinado. Se encuentra en el mar y en los lagos salinos como Cloruro de Sodio. El Sodio ocupa el séptimo lugar en abundancia entre los elementos de la corteza terrestre. Es un componente esencial del tejido vegetal y animal.
IMPORTANCIA DE LA CONTAMINACIÓN POR MERCURIO:
Este tema es de mayor importancia debido a su peligrosidad y se encuentra en relación con un método de obtención de Hidróxido de Sodio. Éste es el método de la Amalgama descripto anteriormente.
El vapor de mercurio y sus sales solubles en agua corroen las membranas del organismo. El envenenamiento progresivo, que se da al ingerir durante largos periodos pequeñas cantidades del metal o de sus sales liposolubles, en especial el metilmercurio, llega a provocar daños irreversibles en el cerebro, hígado y riñón. A causa del aumento de la contaminación del agua, se han encontrado cantidades significativas de mercurio en ciertas especies de peces, creciendo la preocupación por los vertidos incontrolados del metal a las aguas.
Una posibilidad que da lugar a la movilización del Hg es a través de su metilación, que corresponde a la formación de un compuesto organometálico. En el caso concreto del mercurio, se forma el metil-mercurio, CH3Hg+, el cual, al igual que otros compuestos organometálicos, es liposoluble. En consecuencia, estos compuestos presentan una elevada toxicidad, puesto que pueden atravesar fácilmente las membranas biológicas y, en particular, la piel, y a partir de aquí, la incorporación del metal en la cadena trófica está asegurada. La metilación de metales inorgánicos por bacterias es un fenómeno geoquímico relativamente importante. El metilmercurio es un compuesto mucho más tóxico que el mercurio.
El vapor de mercurio elemental liberado en la atmósfera, es oxidado a Hg++ mediante ozono, energía solar y vapor de agua. Una vez formado, el mercurio iónico Hg++ es arrastrado de la atmósfera por las lluvias y depositado sobre ambientes terrestres y acuáticos donde es convertido en metil mercurio en el suelo. El metil mercurio puede ser fácilmente transportado del suelo al medio acuático. También se pierde Mercurio durante todo el proceso y dicho Mercurio termina en los ríos, en donde es fácilmente tomado por los peces y es al menos 100 veces más tóxico que el Hg metálico.
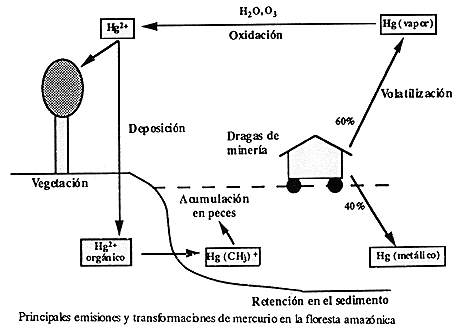
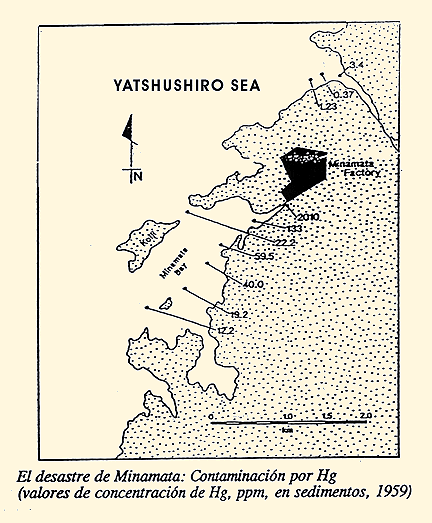
Como ejemplo podemos citar la bahía de Minamata, en el sur del Japón, se produjo una enfermedad denominada "Enfermedad de Minamata", debida al consumo de pescado y mariscos contaminados con metil mercurio, debido al paso de Hg++ a metilmercurio por acción bacteriana. La producción de metil-Hg por bacterias y su liberación en el medio acuático es un mecanismo de defensa que protege los microbios del envenenamiento de Hg. La metilación bacteriana movilizó el Hg almacenado en los sedimentos de la bahía. Este mercurio procedía de una fábrica de plásticos que utilizaba Hg como catalizador y vertía los residuos en la Bahía.
Por todo esto cuando se trabaja con Mercurio debe tenerse el cuidado de que todo resto de amalgama sea recuperada y almacenada en recipientes cerrados e inmersos en solución fijadora de película radiográfica evitando la liberación de vapores de Mercurio.
Descargar
| Enviado por: | PIM |
| Idioma: | castellano |
| País: | Argentina |
