Química
Halógenos
-
HALÓGENOS:
Los fenicios y los griegos de la antigüedad utilizaron la sal común para la conservación de alimentos, especialmente en la salazón del pescado.
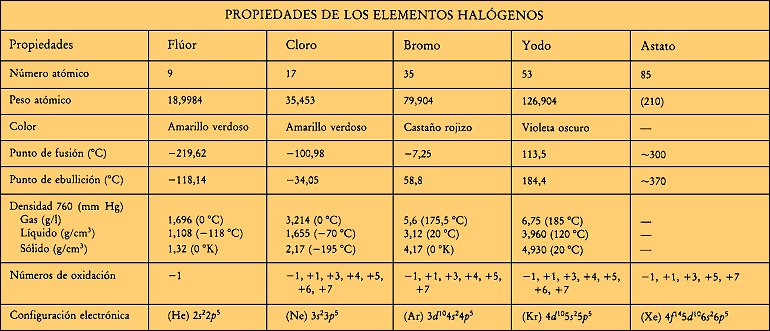
Proviene del griego hals, 'sal'; genes, 'nacido', en química, cinco elementos químicamente activos, estrechamente relacionados, el principal de ellos es el cloro; los otros tres son: el flúor, el bromo y el yodo, que forman el grupo 17 (o VIIA) de la tabla periódica de clasificación de los elementos químicos
El nombre halógeno, o formador de sal, se refiere a la propiedad de cada uno de los halógenos de formar, con el sodio, una sal similar a la sal común (cloruro de sodio). Todos los miembros del grupo tienen una valencia de -1 y se combinan con los metales para formar halogenuros (también llamados haluros), así como con metales y no metales para formar iones complejos. Los cuatro primeros elementos del grupo reaccionan con facilidad con los hidrocarburos, obteniéndose los halogenuros de alquilo.
Los halógenos, grupo de elementos químicos puros formado por el flúor, el cloro, el bromo, el yodo y el astato, componen el grupo VII A
-
Propiedades y compuestos
La reactividad o capacidad de combinación con otros elementos es tan grande en los halógenos que rara vez aparecen libres en la naturaleza. Se encuentran principalmente en forma de sales disueltas en el agua de mar o en extensos depósitos salinos originados en épocas geológicas antiguas por evaporación de mares interiores. El último elemento del grupo, el astato, nombre que significa inestable, se obtiene al bombardear bismuto con partículas alfa (núcleos de helio), por lo que constituye un producto asociado a las distintas series radiactivas.
El estado físico de los halógenos en condiciones ambientales normales oscila entre el gaseoso del flúor y el cloro y el sólido del yodo y el astato; el bromo, por su parte, es líquido a temperatura ambiente.
Otras propiedades físicas, como los puntos de fusión y de ebullición, la densidad y el radio medio del átomo, varían en orden creciente del flúor al yodo. El calor específico -definido como cantidad de calor que ha de absorber 1 g de sustancia para aumentar 1 °C su temperatura- disminuye en la misma relación.
La característica química fundamental de los halógenos es su capacidad oxidante, por la que arrebatan electrones o unidades elementales de carga a otros elementos y moléculas de signo eléctrico negativo para formar iones también negativos denominados aniones haluro. La energía de oxidación de los halógenos es máxima en el flúor y se debilita hasta el yodo. El astato, por su naturaleza radiactiva, forma escasos e inestables compuestos.Los iones haluro, relativamente grandes e incoloros, poseen una alta estabilidad, en especial en el caso de los fluoruros y cloruros.
-
Aplicaciones en general mas importantes de los Halógenos:
Los derivados del flúor tienen una notable importancia en el ámbito de la industria. Entre ellos destacan los hidrocarburos fluorados, como el anticongelante freón y la resina teflón, lubricante de notables propiedades mecánicas. Los fluoruros son útiles como insecticidas. Además, pequeñísimas cantidades de flúor añadidas al agua potable previenen la caries dental.
El cloro encuentra su principal aplicación como agente de blanqueo en las industrias papelera y textil. Asimismo se emplea en la esterilización del agua potable y de las piscinas, y en las industrias de colorantes, medicamentos y desinfectantes.
Los bromuros actúan médicamente como sedantes, y el bromuro de plata se utiliza como un elemento fundamental en las placas fotográficas.El yodo, cuya presencia en el organismo humano resulta esencial y cuyo defecto produce bocio, se emplea como antiséptico en caso de heridas y quemaduras.

Los halógenos se encuentran en la naturaleza
principalmente en forma de sales disueltas
en el agua del mar.
a) EL CLORO Y SUS COMPUETOS:
-
Historia y estado natural:
El cloro, descubierto en Scheele en 1774, sólo fue perfectamente estudiado en 1809 por Gay-Lusac, Thénard y Dhabi. No existe este cuerpo en estado libre, pero si, y abundantemente, formando compuestos, cloruro de sodio NaCl (sal marina, sal gema), cloruro de potasio, de magnesio, etc.
-
Preparación:
En los laboratorios:
Se oxida el ácido clorhídrico HCl por medio del dióxido de manganeso MnO (método de Scheele):
4 HCl + MnO ------------- MnCl + 2 H O + Cl
Para que la reacción se produzca, debe calentarse lentamente y el cloro se recoge por desplazamiento en un frasca abierto al aire.
Preparación Industrial:
Actualmente en la industria se emplea de preferencia la electrólisis de cloruro de sodio. Se hace pasar una corriente eléctrica por una solución concentrada de cloruro de sodio. El ánodo ( + ) es de carbón comprimido y el cátodo ( - ) de hierro. Los dos electrodos están separados por un tabique poroso.
El cloro va hacia el electrodo positivo, en tanto que, en el electrodo negativo, el sodio, al contacto con el agua, da hidrógeno (que se recoge) y sosa.
El método “Deacon”, que todavía se emplea, consiste en oxidar el ácido clorhídrico mediante el oxigeno del aire:
4 HCl + O 2 H O
-
Propiedades Físicas:
Es un gas de color amarillo verdoso, de olor característico sofocante ( es peligroso respirarlo pues provoca hemoptisis). Es aproximadamente 2 ½ veces más denso que el aire (d = 2.57 ).
Es bastante soluble en H O (agua de cloro). En condiciones normales de presión se licua a 35º y se solidifica a -102º .
-
Propiedades Químicas:
El cloro, cuerpo de fuertes afinidades químicas, se combina con casi todos los cuerpos simples, desprendiendo calor.
Acción sobre los metales.- el cloro ataca a todos los metales, a unos en frio y a otros en caliente. Se obtienen compuestos llamados cloruros. Ejemplo: el sodio se inflama espontáneamente en cloro:
Na + ½ Cl Na Cl
Otro ejemplo es cuando el cloro ataca al mercurio a la temperatura ordinario o temperatura ambiente:
Hg + Cl Hg Cl
Un ejemplo mas es cuando el cobre, calentado ligeramente, produce incandescencia en atmósfera de cloro y forma cloruro, que cae al fondo del recipiente.
Acción sobre los metaloides.- un ejemplo de esto es cuando tenemos fósforo introducido en un frasco que contenga cloro se inflama espontáneamente, produciendo pentacloruro PCl ,o tricloruro PCl, según haya o no exceso de cloro.Otro ejemplo es cuando el hidrógeno inflamado continúa ardiendo en cloro, produciendo gas clorhídrico:
Cl + H 2HCl
Un ejemplo mas es; si en la oscuridad, ponemos en una probeta dos volúmenes iguales de cloro y de hidrógeno y cerramos la probeta con un obturador de cartón, no se produce reacción alguna; pero si dirigimos hacia esta misma probeta un haz de rayos solares, se produce la combinación, y la elevada temperatura del gas resultante hace saltar violentamente el obturador.
Esta propiedad, que hace que del cloro un deshidrogenante, tiene las consecuencias siguientes:
1ª. La descomposición del hidrógeno sulfurado H S y del amoniaco NH por el cloro o por los cuerpos susceptibles de desprender cloro (lejía, cloruro de cal) y el empleo de dichos cuerpos como desinfectantes.
2ª. La descomposición del agua por el cloro.- Si observamos lo que sucede en un frasco que contenga agua de cloro, expuesto a la luz solar, veremos que le nivel baja en el frasco en virtud de la presión que sobre el agua ejerce un gas que, por sus propiedades comburentes, reconoceremos es el oxígeno:
Cl + H O 2 HCl + ½ O
El cloro, en presencia de H O, tiene, pues, indirectamente, papel oxidante.
3ª. La descomposición de los carburos de hidrógeno. Si impregnamos un papel secante de esencia de trementina y lo introducimos en un frasco que contenga cloro, vemos que dicho papel se inflama y se produce un humo negro (carbono libre) y vapores de ácido clorhídrico.
C H + 8 Cl 10 C + 16 HCl
4ª. Destrucción de las materias orgánicas por el cloro, desintegra el tapón de corcho que tapa la botella de lejía, una tela de lana, de seda, etc. El cloro destruye, por desintegración, las materias orgánicas que contienen, por lo general, carbono, oxigeno, hidrógeno y nitrógeno.
5ª. El Cloro es un decolorante; muchas materias colorantes orgánicas pueden ser decoloradas por el cloro, ya por pérdida de hidrógeno, ya por oxidación (en presencia del agua).
6ª. El cloro es un depurador bacteriológico, destruye los microbios por oxidación, y por eso se emplea sus solución como antiséptico, para desinfectar lo cuartos de los enfermos, los objetos que están usando, etc.
Acción sobre las bases: NaOH e Ca(OH) . El cloro forma con la sosa, la potasa y la cal cuerpos impropiamente llamados cloruros colorantes.
1.- La legía.- Si se hace llegar una corriente de cloro a una solución diluida de sosa cáustica (NaOH) se obtiene lejía, que tiene las mismas propiedades que el cloro que desprende por acción del calor y de los ácidos:
2 HaOH + Cl NaClO + NaCl + H O
(Es una mezcla de hipoclorito y de cloruro de sodio.) Se obtiene también por electrólisis del cloruro de sodio disuelto sin diafragma poroso: la sosa, que se forma en el cátodo, para al ánodo, donde se produce cloro.
Puede también prepararse mezclando una solución de cloruro de cal con una solución de cristales de sosa. Esta preparación, llamada generalmente lejía, es, más exactamente, el licor de Labarraque. La verdadera lejía, con propiedades absolutamente análogas, puede obtenerse mezclando con la disolución de cloruro de calcio una disolución de carbonato de potasio. Es una mezcla de hipoclorito de cloruro de potasio.
2.- Cloruro de Cal .- Si se hace pasar una corriente de cloro sobre cal apagada extendida sobre el suelo o sobre tabletas horizontales colocadas a lo largo de los muros de una pieza de albañilería en capas de 10 a 15 cm., se obtiene cloruro de cal. Puede admitirse, por analogía con la reacción ya comprobada con la sosa y la potasa, que la cal se transforma en una mezcla de hipoclorito y de cloruro de calcio:
S Cl + 2 CaO Ca (ClO) + Ca Cl
Se admite que el cluroro de cal responde mejor a la fórmula: CaCl O.
-
Aplicaciones del cloro y de los cloruros decolorantes:
El cloro se emplea como desinfectante, antiséptico, decolorante (blanqueo de algodón crudo, de la pasta de papel, de la ropa), usos que derivan de las propiedades que acabamos de estudiar.
b) ACIDO CLORHIDRICO:
-
Preparación:
Se obtiene por acción del ácido sulfúrico sobre el cloruro de sodio, calentando a 150º :
H SO + NaCl NaHSO + HCl
A temperatura mayores de 350º, el sulfato ácido de sodio reacciona a su vez:
NaHSO + NaCl Na So + HCl
En ambas reacciones se obtiene gas clorhídrico. El ácido clorhídrico es la solución de este gas en agua.
-
Propiedades Físicas:
Es un gas incoloro, de olor picante y sabor muy ácido. Es más denso que el aire. Licuado hierve a -83.7º y solidifica hacia -111º . Es muy soluble. A 0 grados, por ejemplo, 1 litro de agua disuelve, aproximadamente, 500 litros de gas clorhídrico. Esta gran solubilidad se demuestra mediante el experimento siguiente:
Se llena con gas clorhídrico un frasco de cuello estrecho y se cierra con un tapón atravesado por un tubo afilado en uno de sus extremos, el cual se introduce en el frasco. Se invierte éste sobre un recipiente lleno de agua. El gas clorhídrico entra en contacto con el agua, a través del tubo, y comienza a disolverse. Se produce un vacío parcial en el frasco, y por consiguiente, el agua sube en este último. Si el agua de la cubeta se ha coloreado previamente con tintura de tornasol azul; al penetrar en el frasco cambia de color y pasa a rojo violeta, a causa de la reacción ácida del gas clorhídrico.
-
Propiedades Químicas:
El ácido clorhídrico presenta todas las propiedades químicas de un ácido fuerte.
1.- Acción sobre los reactivos coloreados:
Estas substancias tienen la propiedad de cambiar de color en presencia de cuerpos ácidos cono HCl y en presencia de bases como la sosa NaOH. La tintura de tornasol de color morado se vuelve roja en presencia de HCl. La heliantina color rojo anaranjado tomo color rojo franco. La ftaleína, por lo general incolora, y que se vuelve rojo violeta con una gota de sosa, se decolora con HCl.
2.- Acción sobre las Bases:
El amoniaco.- Si se colocan próximos dos frascos, uno que contenga amoniaco y otro ácido clorhídrico, se forman humos blancos de cloruro de amonio.
Si en una disolución de tornasol, enrojecido por el ácido clorhídrico, se vierte gota a gota un poco de potasa en disolución, llega un momento en que el tornasol se vuelve azul. Si cesamos la experiencia y analizamos el resultado, comprobaremos la presencia de una sal: el cloruro de potasio:
KOH + HCl KCl + H O
El ácido HCl reacciona sobre todas las bases con formación de una sal y de agua. Esta reacción se llama neutralización. Permite calcular el título de soluciones ácidas o alcalinas (número de moles por litro) cuando se conocen la concentración de una de las soluciones y los volúmenes empleados.
3.- Acción sobre los metales:
Se combina con la mayor parte de los metales, produciendo un cloruro e hidrógeno libre. En estas reacciones, el cloruro se combina con el metal, conforme a la valencia de este último:
K + HCl KCl + ½ H
Fe + 2HCl FeCl + H
El ácido clorhídrico aislado no tiene acción sobre el oro ni sobre el platino.
La afinidad del cloro por los metales se manifiesta, aún cuando el ácido se encuentre en presencia de óxidos metálicos. En este caso, el cloro se combina con el metal, y el hidrógeno con el oxigeno, produciendo agua y un cloruro soluble:
ZnO + 2HCl ZnCl + H O
Esta propiedad tiene gran aplicación en el desoxidado de metales.
4.- Acción sobre las sales:
Acción sobre el Yeso: El ácido clorhídrico descompone el carbonato de calcio, formando cloruro de calcio, con desprendimiento de anhídrido carbónico:
2 HCl + CaCO CaCl + CO + H O
Con las sales, el ácido clorhídrico forma cloruros. Algunas gotas de una solución de nitrato de plata, vertidas en ácido diluido, dan un precipitado blanco de cloruro de plata:
AgNO + HCl AgCl + HNO
Este precipitado se ennegrece por acción de la luz. El nitrato de plata es el reactivo del ácido clorhídrico y de los cloruros.La presencia de un cloruro en una solución se pone de manifiesto por la formación de un precipitado blanco al agregar algunas gotas de una solución de nitrato de plata (AgNO ).
La solución de ácido clorhídrico puede descomponerse, formando cloro.
Si en una solución de ácido clorhídrico se añade óxido de manganeso negro, MnO se desprende un gas verdoso: cloro. Este es el principio de la preparación de este gas por el método de Scheele.
-
Aplicaciones:
El ácido clorhídrico, en forma de solución que los antiguos llamaron espíritu de la sal y ácido muriático se emplea industrialmente para la desoxidación de metales, la preparación de los cloruros, se la gelatina, etc.
También se emplea mucho en los laboratorios. Oxidado, sirve para preparar cloro y cloruros de colorantes.
-
Cloruros:
El más importante es el cloruro de sodio NaCl, que se extrae del agua de mar (sal marina que se obtiene mediante la evaporación del agua de mar) o del suelo (sal gema) y que, además de emplearse en la alimentación, es la base de numerosas industrial químicas.
El cloruro de potasio KCL, mezclado con cloruro de sodio y cloruro de magnesio, constituye la carnalita (Potasa de Alsacia, sal de Stassfurt): El cloruro férrico FeCl , o percloruro de hierro, es un hemostático. El cloruro de mercurio HgCl (bicloruro o sublimado) es un antiséptico (desinfección de heridas); el cloruro mercurioso, HgCl (protocloruro o calomelanos) se emplea como purgante y vermífugo. El cloruro de plata AgCl se emplea en fotografia, así como el cloruro de Oro, AuCl .
Todos los cloruros son solubles, excepto los de plata, de mercurio y de plomo, en los que el metal es monovalente.
c) OTROS HALÓGENOS, SUS COMPUESTOS:
-
Fluor (F= 19):
No existe libre en la naturaleza, pero sí en combinaciones en gran número de rocas, especialmente en:
La fluorina CaF que se encuentra en Groenlandia.
La criolita AIF ,3 NaF.
Fue el célebre químico francés Henri Moissan quien lo aisló por primera vez en 1886, utilizando la electrólisis del ácido fluorhídrico, HF, hecho conductor mediante la adición de fluoruro de potasio KF.
Este cuerpo tiene mayores y más potentes afinidades que el cloro. Es un gas amarillo verdoso, de color menos intenso que el cloro, de densidad 1.3, que se licua en forma de líquido amarillo claro que hierve a -187º y se solidifica a -233º .
Tiene olor penetrante que irrita, destruye los tejidos y actúa sobre todos los elementos, excepto el oxígeno, el carbono y el nitrógeno, aun a temperatura de -200º .
Se guarda en frascos de platino bien secos, pues descompone el agua:
F + H O 2 HF + ½ O
-
Acido fluorhídrico (HF):
Para prepararlo, se trata el fluoruro de calcio por ácido sulfúrico en una retorta de plomo:
Ca F + 4 HF SiF + 2 H O
Se utiliza en estado de solución para grabar el vidrio.
-
Bromo (Br = 80):
Fue descubierto en 1826 por el químico francés Balard en las aguas madres de las salinas del Mediterráneo; existe en forma de bromuros de potasio y de sodio (KBr y NaBr) en el agua de mar.
Puede obtenerse bromo a partir del bromuro de potasio mediante una corriente de cloro:
KBr + ½ Cl Br + KCl
Puede tratarse el bromuro por el mismo método que el cloro (método de
Scheele).
Es un líquido de color rojo oscuro, volátil, de olor fuerte y sofocante que provoca tos y hemoptisis. Produce quemaduras peligrosas que tardan en cicatrizar. Su densidad a 0 grados es de 3.l9. Se solidifica a -7º y hierve a 59º ; se disuelve en agua en una proporción aproximada de 3% (agua de bromo). Sus propiedades químicas recuerdan las del cloro, aunque menos energéticas. Con el hidrógeno, la reacción no se produce sino a temperatura bastante elevada:
½ H + Br HBr (ácido bromhídrico)
El agua de bromo se descompone lentamente por acción de la luz; una mezcla de vapor de agua y de vapor de bromo al rojo da la reacción:
H O + 2 Br 2HBr + ½ O
Sus aplicaciones son como las del cloro, es decolorante y antiséptico.
-
Acido Bromhídrico (HBr):
Es un gas incoloro de olor fuerte e irritante, más soluble que el ácido clorhídrico. Tiene todas las características de un ácido fuerte, pero es menos estable que el ácido clorhídrico, cuyas características ya habíamos estudiado en párrafos anteriores.
-
Yodo (I = 127):
Se halla en combinación en los nitratos de Chile y del Perú que contienen 2/1000 de su peso en yodo; en el agua de mar en muy pequeña cantidad (0.002 g por litro), y principalmente en algas furáceas y en algunos organismos (tiroides e hígado de peces marinos).
Fue descubierto en 1813 por Courtois en la cenizas del varec.
Puede obtenerse el yodo de las aguas-madres y de las cenizas de varec, tratando esas aguas por una corriente de cloro. El yodo se precipita y se purifica luego por sublimación.
Es un cuerpo sólido, de color gris acero, dotado de brillo metálico, su olor no es desagradable, pero sí picante y produce lagrimeo. Cristaliza en lagrimas brillantes. Para obtenerlo en hermosos cristales, basta sublimarlo, es decir, hacerlo pasar directamente del estado sólido al estado gaseoso, calentándolo en pequeñas cantidades. Su vapor, de color violeta, se condensa al contacto de las paredes del vaso, produciendo hermosos cristales.
Densidad: 4.498. El yodo se funde a 114º y hierve a 184º .
Es muy poco soluble en el agua, pero bastante soluble en alcohol, el éter, el cloroformo y el sulfuro de carbono.Con el almidón da un color azul, que desaparece por el calor y reaparece por enfriamiento.
Las propiedades químicas del yodo son muy parecidas a las del bromo, pero sus afinidades son menos claras. El yodo sólo se combina con el hidrógeno a 400º y la reacción es reversible:
I + H HI (ácido yodhídrico)
Por el contrario, el yodo tiene más afinidad por el oxígeno que el cloro y el bromo; desplaza estos dos cuerpos de sus combinaciones oxigenadas, mientras que es desplazado por éstos de sus combinaciones metálicas.
Aplicaciones.- El yodo se emplea en medicina (tintura de yodo, vino yodado, algodón yodado o algodón termógeno, yodoformo, etc.).
-
Acido yodhídrico (HI):
Es un gas incoloro, de olor desagradable, muy soluble en el agua, pero poco estable. Se descompone a 280º en yodo e hidrógeno (método de hidrogenación de Berthelot). Se prepara por la acción del yodo sobre el fósforo rojo:
3 I + P PI
Y luego del agua sobre el compuesto formado:
PI + 3H O 3 HI + H PO
-
Sales de los ácidos anteriores:
Según la nomenclatura química, los ácidos que acabamos de estudiar, combinados con los metales forman sales llamadas: fluoruros, bromuros y yoduros, análogos a los cloruros.
1.- Los Fluoruros tienen pocas aplicaciones.
2.- Entre los Bromuros, el de plata se emplea fotografía mucho más que el cloruro correspondiente. El bromuro de potasio se emplea en medicina y en fotografía.
3.- Los Yoduros son, en general, muy coloreados. El yoduro de potasio se emplea en medicina.
-
GLOSARIO:
-
ÁNODO. (Del gr. ánodos, camino ascendente.) m. Fís. Electrodo por donde entra la corriente en un electrólito. II Polo positivo de una pila. (V. Cátodo.).
-
BROMURO. m. Quím. y Ter. Combinación del bromo con un radical simple o compuesto. Por su acción sedante sobre el sistema nervioso se usa en la hiperexcitabilidad psíquica (ansiedad, insomnio) y motora (epilepsia).
-
CALOMELANOS. (Del gr. kalós, bello, y melas, - Cloruro mercurioso, usado como antiséptico intestinal, vermífugo y colorante.
-
CATALIZADOR. (De catálisis.) m. Quím. Cuerpo que puede producir la transformación catalítica.
-
CÁTODO. (Del gr. káthodos, camino descendente.) m. Fís. En la electrólisis, electrodo negativo, hacia el cual se mueven los cationes. ll En tubos de vacío, conductor cargado negativamente.
-
CLORURO. m. Quím. Sal del ácido clorhídrico. ll Compuesto binario del cloro. ll - de cal. Quím. Hipoclorito de cal. ll - de sodio o sódico. Quím. Sal común.
-
DESHIDROGENAR. tr. Quím. Quitar a un cuerpo el hidrógeno que contiene. Ú.t.c.r.
-
ELÉCTRODO. (Del gr. élektron, ámbar, y odós, camino.) m. Elec. Conductor por el cual se mantiene una corriente dentro de un líquido. II Fís. Barra o lámina que forma cada polo, en un electrólito, un arco eléctrico, o un tubo de vacío. II Elemento terminal de un circuito.
-
ELECTRÓLISIS. (Del gr. élektron [v. eléctrico] y lysis, disolución.) f. Quím. Descomposición de una sustancia en solución, o en estado de fusión, por la electricidad.
-
FLUORURO. m. Quím. Sal del ácido fluorhídrico.
-
LEJÍA. (Del lat. lixivia.) f. Agua en que se han disuelto álcalis o sus carbonatos. || fig. y fam. Reprensión fuerte o satírica.
-
MONOVALENTE. (Del gr. monos, único, y el lat. valens, -entis, que tiene fuerza o potencia.) adj. Quím. Dícese de los cuerpos simples o de los radicales que sólo tienen libre una valencia.
-
NITRATO. m. Quím. Cualquier sal o éster del ácido nítrico. Il --de Chile. Abono nitrogenado natural que se encuentra en yacimientos situados en la zona desértica del norte de Chile.
-
PROBETA. (De probar.) Tubo de cristal, cerrado por un extremo y destinado a contener líquidos o gases. II Muestra de cualquier sustancia o material para probar su elasticidad, resistencia, etc.
-
PROTOCLORURO. m. Quím. En una serie de cloruros, de un elemento, o radical, el que contiene la menor proporción de cloro.
20
Descargar
| Enviado por: | El remitente no desea revelar su nombre |
| Idioma: | castellano |
| País: | México |
