Química
Enlace químico
Enlaces químicos
La manera en que los átomos se enlazan ejerce un efecto profundo sobre las propiedades físicas y químicas de las sustancias. Por ejemplo, al respirar monóxido de carbono, las moléculas de CO se enlazan fuertemente a ciertas sustancias presentes en los glóbulos rojos de la sangre haciendo que estos queden como mineralizados, incapaces de transportar oxígeno, perdiendo así sus propiedades vitales. Entonces debemos preguntarnos: ¿Qué es el enlace químico?, ¿Cómo se da?, ¿Qué lo facilita?, ¿Qué lo impide?, ¿Qué determina que unos sean más fuertes que otros? Estas interrogantes son fundamentales en el estudio de la química, pues los cambios químicos, que pueden ser para bien o para mal,
son esencialmente una alteración de los enlaces químicos.
1. ¿Qué mantiene unidos a los átomos?
Un concepto básico en química es el estudio de cómo los átomos forman compuestos. La mayoría de los elementos que conocemos existen en la naturaleza formando agrupaciones de átomos iguales o de distintos tipos, enlazados entre sí.
2. ¿Por qué queremos entender cómo se enlazan las partículas
materiales unas con otras?
Si comprendemos el mecanismo del enlace químico, este conocimiento puede llevarnos a controlar la formación o ruptura de estos enlaces, por consiguiente, la formación o deformación de sustancias, dependiendo siempre de lo que estemos necesitando.
3. Regla del octeto y estructura de Lewis
A inicios del siglo XX, en 1916, de manera independiente, los científicos Walter Kossel y Gilbert Lewis concluyeron que la tendencia que poseen los átomos de lograr estructuras similares a las del gas noble más cercano explica la formación de los enlaces químicos. Esta conclusión es mundialmente conocida como la Regla del Octeto y se enuncia de la siguiente manera:
“Cuando se forma un enlace químico los átomos reciben, ceden o comparten electrones de tal forma que la capa más externa de cada átomo contenga ocho electrones, y así adquiere la estructura electrónica del gas noble más cercano en el sistema periódico”.
No obstante, hay muchas excepciones a esta regla y hasta se han logrado sintetizar algunos compuestos de los gases nobles.
Una de las claves de la comprensión de la fuerza motriz del enlazamiento químico, fue el descubrimiento de los gases nobles y su comportamiento químico relativamente inerte. Los gases nobles han sido utilizados cuando se ha hecho necesario tener una sustancia inactiva. Los buzos normalmente usan una mezcla de nitrógeno y oxígeno a presión para respirar bajo el agua. Sin embargo, cuando esta mezcla de gases es usada en profundidades, donde la presión es muy alta, el gas nitrógeno es absorbido por la sangre, con la posible consecuencia de causar desorientación mental. Para evitar este problema, se puede sustituir por una mezcla de oxígeno y helio. El buzo todavía obtiene el oxígeno necesario, pero el inactivo helio que se disuelve en la sangre no causa desorientación mental. El único inconveniente radica en que la menor densidad de la mezcla puede cambiar el ritmo de la vibración de las cuerdas vocales, y el buzo puede emitir sonidos similares al del pato Donald.
3.1 ¿Cómo diseñar una estructura de Lewis?
La estructura de Lewis permite ilustrar de manera sencilla los enlaces químicos, en ella, el símbolo del elemento está rodeado de puntos o pequeñas cruces que corresponden al número de electrones presentes en la capa de valencia.
3.2 Parámetros a considerar en una estructura de Lewis
- Escribe el número total de electrones de valencia.
- Considera que cada enlace se formará a partir de dos, y solo dos, electrones.
- Cada átomo deberá cumplir con la regla del octeto. Excepto el hidrógeno que deberá tener solo 2 electrones para cumplir con la regla del dueto.
4. Clasificación de las sustancias de acuerdo a sus propiedades
Parece lógico suponer que las propiedades características de las sustancias aporten alguna información acerca de la forma en que están unidos los átomos que las forman.
La materia que nos rodea se presenta en forma de sustancias con distinto aspecto y propiedades. El conocimiento de estas propiedades puede aportar alguna información acerca de las fuerzas que hacen unirse a las partículas en una sustancia. Así, por ejemplo, los puntos de fusión y ebullición de las diversas sustancias son indicativos de la mayor o menor fuerza de enlace entre las partículas (átomos, iones o moléculas) que constituyen el sólido o líquido. Por otra parte si una sustancia en determinadas condiciones conduce la corriente eléctrica, podría pensarse también en la existencia de partículas cargadas. Otras
propiedades pueden ser la solubilidad, la facilidad de deformación o fragilidad de los sólidos, etc.
La diversidad de propiedades existentes (densidad, temperaturas de fusión y ebullición, dureza, solubilidad en diferentes líquidos, conductividad,..) hace que resulte difícil clasificar en unos pocos grupos a todas las sustancias y cualquier regla que se establezca para ello dejará fuera a sustancias con propiedades intermedias o atípicas. No obstante, a pesar de ello ha sido posible clasificar a la mayor parte de las sustancias en tres grandes grupos que evidencian la existencia de cuatro formas fundamentales de unión entre los átomos, es decir de cuatro tipos de enlace:
En primer lugar nos encontramos con sustancias como el cloruro de sodio, yoduro de potasio, cloruro de magnesio, etc… que son compuestos de aspecto cristalino, frágiles y con elevados puntos de fusión y ebullición. Son, en general, más o menos solubles en disolventes del tipo del agua y no lo son en disolventes del tipo del benceno. No son conductores de la corriente en estado sólido, pero sí cuando se presentan fundidos o en disolución. La existencia de este tipo de sustancias, entre las que hemos citado como ejemplos típicos a las sales, está ligada a una forma de enlace que, por razones que luego veremos, se denomina enlace iónico, designando consecuentemente dichas sustancias
como compuestos iónicos.
En segundo lugar, nos encontramos con sustancias como el oxígeno, hidrógeno, nitrógeno, dióxido de carbono, naftaleno, agua, amoniaco, etc, muchas de las cuales se encuentran, a temperatura y presión ordinarias, en forma de gases constituidos por moléculas de una gran estabilidad pues resisten, en general, temperaturas elevadas sin descomponerse. En cambio cuando se hallan en estado sólido o líquido tienen por lo general bajos puntos de fusión y de ebullición. Por otra parte, los sólidos de esta clase no se disuelven en disolventes del tipo del agua, haciéndolo en los del tipo del benceno y no conducen la corriente eléctrica en estado líquido ni tampoco lo hacen sus disoluciones. El comportamiento de estas sustancias hace suponer la existencia de fuertes uniones
intramoleculares dada la estabilidad de dichas moléculas, y de débiles uniones intermoleculares, teniendo presente la facilidad con que se logra separar las moléculas. Es decir, se pone de manifiesto la existencia en este tipo de sustancias de dos formas de enlace asociadas, denominándose a la primera enlace covalente y conociéndose las débiles interacciones intermoleculares como fuerzas de van der Waals (profesor de la Universidad de Amsterdam, premio Nobel en 1910, que modificó la ecuación general de los gases teniendo en cuenta, entre otras cosas, que entre sus moléculas podían existir fuerzas de atracción). En algunos casos se presenta sólo una de estas formas de unión. Así, se ha conseguido solidificar a los gases nobles que en condiciones normales se presentan como gases formados por átomos sueltos, en esos sólidos sólo estarán presentes, pues, las débiles fuerzas de van der Waals que aquí se ejercen entre partículas monoatómicas. Por otra parte el diamante, carbono puro, es un ejemplo de sustancia cuyos cristales constituyen verdaderas moléculas gigantes en las que todas las uniones entre átomos de carbono tienen las características del enlace covalente.
Por último, nos referiremos a los metales, cuya propiedad más típica es su carácter conductor del calor y la electricidad en estado sólido. Los metales constituyen más de las tres cuartas partes de los elementos del sistema periódico por lo que no es de extrañar que exista una gran variedad en propiedades tales como dureza, punto de fusión, etc. Muchos de ellos tienen un brillo característico y son fácilmente deformables, es decir, son dúctiles y maleables (se separan fácilmente en hilos y láminas). El tipo de enlace existente entre los átomos de un metal se denomina, por razones evidentes, enlace metálico.
En resumen, pues, el estudio de las propiedades de las sustancias nos permite agruparlas en tres grandes tipos poniendo en evidencia la existencia de cuatro formas distintas de interacción entre partículas: enlace iónico, enlace covalente, fuerzas intermoleculares y enlace metálico.
5. Tipos de enlace
Sabemos que la manera en que los átomos se enlazan ejercen un efecto profundo sobre las propiedades físicas y químicas de las sustancias. ¿Qué es un enlace químico? Aunque esta pregunta se puede responder de diversas formas, el enlace se define como la fuerza que mantiene juntos a grupos de dos o más átomos y hace que funcionen como unidad. Por ejemplo en el agua la unidad fundamental es la molécula H-O-H cuyos átomos se mantienen juntos por dos enlaces O-H. Se obtiene información acerca
de la fuerza del enlace midiendo la energía necesaria para romperlo, o sea la energía de enlace.
Veremos cómo los átomos interaccionan entre sí de diversas formas para formar agregados y se considerarán ejemplos específicos para ilustrar los diversos tipos de enlace. Existen tres tipos importantes de enlaces que se forman entre los átomos de un compuesto: iónico (o electrovalente), covalente (polar, no polar y el coordinado) y el enlace metálico.
5.1. Formación de iones y del compuesto iónico
En experiencias sencillas hemos podido ver que al disolver en agua cloruro de sodio sólido, la disolución resultante conduce la electricidad; esto indica que el cloruro de sodio está compuesto por iones Na+ y Cl-.
Así cuando el sodio y el cloro reaccionan para formar cloruro de sodio, los átomos de sodio transfieren electrones a los átomos de cloro para formar los iones Na+ y Cl- que se agregan a continuación para formar cloruro de sodio sólido. Esta sustancia sólida resultante es dura; tiene punto de fusión de aproximadamente 800°C. La gran fuerza de enlace en el cloruro de sodio se debe a las atracciones entre iones de carga opuesta que se encuentran muy cercanos entre sí. Este es un ejemplo de enlace iónico.
Cuando un átomo que pierde electrones con relativa facilidad reacciona con otro que tiene alta afinidad electrónica se forman sustancias iónicas; en otras palabras la formación de un compuesto iónico se debe a la reacción entre un metal y un no metal.
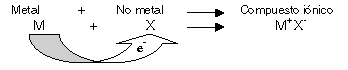
El enlace iónico se forma cuando un átomo que pierde electrones relativamente fácil (metal) reacciona con otro que tiene una gran tendencia a ganar electrones (no metal).
Los compuestos unidos por enlaces iónicos forman redes cristalinas de iones, que denominamos cristal. La red cristalina es una estructura gigante que contiene un número indefinido de iones (las cargas positivas son iguales, en cantidad, a las negativas), de manera que el conjunto sea eléctricamente neutro.
6. Electronegatividad
Linus Pauling definió la electronegatividad como La capacidad que tienen los átomos de atraer y retener los electrones que participan en un enlace químico. La electronegatividad se ha establecido en escala de 0 hasta 4. Pauling asignó de manera arbitraria un valor de 4 al fluor que es el elemento con más capacidad para atraer electrones. En química los valores de electronegatividad de los elementos se determinan midiendo las polaridades de los enlaces entre diversos átomos. La polaridad del enlace depende de la diferencia entre los valores de electronegatividad de los átomos que lo forman.
7. El enlace covalente
El modelo de enlace entre iones no se puede utilizar para explicar la unión entre cualquier pareja de átomos. Si dos átomos son iguales, no existe ninguna razón que justifique que uno de estos átomos se transforme en ión. Para justificar estas situaciones se utiliza otro modelo de enlace. Cuando los átomos que forman un enlace comparten sus electrones con la finalidad de cumplir con la regla de los ocho, se forma un enlace. El tipo de enlace que se observa en la molécula de hidrógeno y en otras moléculas en que los electrones son
compartidos por los dos núcleos se llama enlace covalente. En la molécula de H2 los electrones residen principalmente en el espacio entre los núcleos en donde son atraídos de manera simultánea por ambos protones. El aumento de fuerzas de atracción en esta zona provoca la formación de la molécula de H2 a partir de dos átomos de hidrógeno separados. La formación de un enlace entre los átomos de hidrógeno implica que la molécula H2 es más estable por determinada cantidad de energía, que dos átomos separados (energía de enlace).
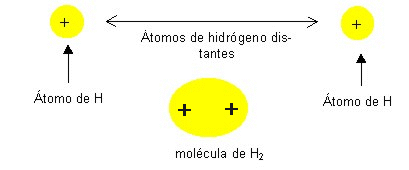
Cuando dos átomos idénticos se acercan los dos electrones son atraídos de manera simultánea por ambos núcleos. Así se forma el enlace.
7.1. Otros tipos de enlaces covalentes entre los átomos
Hasta el momento se han considerado dos tipos de enlace extremos. En el enlace iónico, los átomos que participan son tan distintos que ganan o pierden uno o más electrones para formar iones con carga opuesta.
El enlace se debe a las atracciones entre los iones. En el enlace covalente dos átomos idénticos comparten electrones de manera igual.
La formación del enlace se debe a la atracción mutua de los dos núcleos hacia los electrones compartidos. Entre estos extremos se encuentran casos intermedios en los cuales los átomos no son tan distintos que ganen o pierdan electrones en su totalidad, pero son bastante distintos para que haya un compartimento desigual de electrones y se forme lo que se conoce como enlace covalente polar.
La molécula de fluoruro de hidrógeno (HF) contiene este tipo de enlace en el cual existe la siguiente distribución de carga:
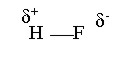
En donde la letra griega (delta) indica una carga parcial o fraccionaria.
7.2. Enlace covalente múltiple
La formación de la molécula de O2, se puede explicar así por la compartición de dos electrones de valencia aportados por cada átomo formándose un enlace covalente doble entre los átomos de oxígeno
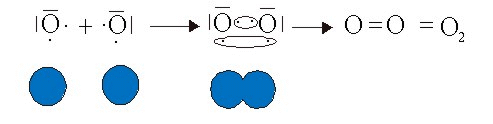
7.3. ¿Cómo se forma un enlace covalente coordinado?
Cuando el par de electrones compartidos pertenece solo a uno de los átomos se presenta un enlace covalente coordinado o dativo. El átomo que aporta el par de electrones se llama donador y el que los recibe receptor o aceptor.
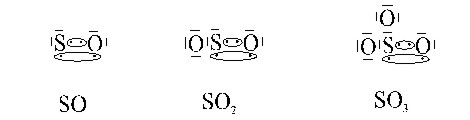
El donador será siempre el elemento menos electronegativo, tal como se muestra en el ejemplo entre el xígeno y el azufre, que puede dar lugar a las moléculas correspondientes a distintos óxidos de azufre. Este enlace una vez formado no se diferencia para nada del enlace covalente normal. Sin embargo debido a cómo se origina se le puede denominar enlace covalente dativo o coordinado. Conviene tener en cuenta que no siempre las moléculas que teóricamente se podrían formar utilizando este tipo de enlace, existen en la
realidad, ya que en ello intervienen también otros factores que aquí no hemos tenido en cuenta, como por ejemplo, el tamaño de los átomos que van a enlazarse y la propia geometría o forma de las moléculas.
7.4. Conductividad del enlace covalente
La falta de conductividad en estas sustancias se puede explicar porque los electrones de enlace están fuertemente localizados atraídos por los dos núcleos de los átomos enlazados. La misma explicación se puede dar para las disoluciones de estas sustancias en disolventes del tipo del benceno, donde se encuentran las moléculas individuales sin carga neta moviéndose en la disolución. Dada la elevada energía necesaria para romper un enlace covalente, es de esperar un elevado punto de fusión cuando los átomos unidos extiendan sus enlaces en las tres direcciones del espacio como sucede en el diamante; no obstante,
cuando el número de enlaces es limitado como sucede en la mayor parte de las sustancias (oxígeno, hidrógeno, amoníaco, etc.) con enlaces covalentes, al quedar saturados los átomos enlazados en la molécula, la interacción entre moléculas que se tratará más adelante, será débil, lo que justifica que con frecuencia estas sustancias se encuentren en estado gaseoso a temperatura y presión ordinarias y que sus puntos de fusión y ebullición sean bajos.
8. Enlace metálico
Por último el enlace metálico, su importancia la podemos ver en el hecho de que las 3/4 partes de elementos del sistema periódico son metales. El papel que estas sustancias han tenido en el desarrollo de la humanidad es tan importante que incluso se distingue entre la edad de piedra, la edad del bronce y la del hierro. De los 90 elementos que se presentan en la naturaleza algunos metales como el sodio y el magnesio, pueden extraerse de los océanos donde se encuentran disueltos. Los demás metales se suelen obtener a partir de depósitos minerales que se hallan encima o debajo de la superficie terrestre. Algunos metales son tan poco reactivos que es posible encontrarlos directamente en forma elemental, este es el caso
del oro, la plata y el platino. Otros se encuentran formando parte de distintos compuestos químicos. En general presentan propiedades muy peculiares que los han diferenciado desde hace siglos de las restantes sustancias, tales como: ser excelentes conductores del calor y la electricidad en estado sólido, ser fácilmente deformables (lo que permite trabajarlos y fabricar con ellos objetos de distintas formas). Por otra parte suelen presentarse como sólidos de dureza variable, con muy diversos puntos de fusión y ebullición (el galio,
por ejemplo, funde a 2978° mientras que otro metal, el tantalio, lo hace a casi 3000°).
A partir del siglo XVIII el desarrollo de la máquina de vapor y de los motores de explosión, suponen un enorme desarrollo de la industria siderúrgica, al tener que fabricar vías de ferrocarril, puentes, trenes, automóviles, barcos, monumentos, etc. Otra propiedad general de los metales, como es su capacidad para conducir la corriente en estado sólido, permitió más tarde transportar energía eléctrica de unos lugares a otros utilizando largos cables de cobre. Sin ello no hubiera sido posible la electrificación de ciudades y pueblos. Otros metales muy importantes son los llamados metales preciosos como la plata y el oro, usados
desde la antigüedad en la fabricación de joyas y de monedas.
Tampoco podemos olvidar la utilización cada vez mayor de ciertos metales que tienen propiedades muy específicas, como los ejemplos que, en orden aleatorio, se citan a continuación: El aluminio en la construcción de diversos vehículos y en la industria de la construcción en general, por su baja densidad y resistencia a la corrosión. El calcio es un metal que forma parte de los huesos y dientes. La luz emitida por algunos metales, como el sodio y el mercurio, en estado de vapor e incandescentes se utiliza en iluminación de casa y ciudades. Metales como el cinc, el cadmio y el mercurio, se utilizan en la fabricación de pilas eléctricas. Uno de los usos del plomo, es como barrera frente a radiaciones (así las personas que trabajan con aparatos de rayos X se protegen con delantales y guantes de plomo), etc.
Desde el punto de vista electrónico los átomos de los metales se caracterizan por tener pocos electrones de valencia. Además dichos electrones tienen mucha facilidad para moverse en el nivel de energía en el que se encuentran (nivel más externo) lo cual podemos interpretar (en una primera aproximación) como una consecuencia de que éste se encuentre tan vacío.
Si tomamos como ejemplo el átomo de sodio, podemos plantearnos el problema de cómo explicar la existencia de un cristal de sodio metálico. Si intentamos aplicar el concepto de enlace covalente desarrollado en el punto anterior, nos encontramos con una dificultad: cada átomo de sodio, en su nivel de energía más externo, sólo tiene un electrón por lo que le faltarían 7 más para completar su octeto.
Existen muchos metales para los que la resistencia al paso de la corriente es prácticamente nula por debajo de una temperatura determinada (temperatura crítica). Este fenómeno se llama superconductividad y fue descubierto en 1911 por el físico holandés H. Kamerling Onnes. Así, por ejemplo, la temperatura crítica del mercurio es de -268.8°C. De hecho se han observado corrientes eléctricas en anillos metálicos superconductores que se han mantenido durante años sin pérdidas aparentes. Naturalmente es preciso gastar energía en mantener el anillo a la temperatura adecuada. En la actualidad se está investigando intensamente en la obtención de materiales que presenten superconductividad a temperaturas más altas.
Una de las líneas de investigación es trabajar con unos nuevos materiales que tienen óxido de cobre en su composición (cupratos). De momento el récord se obtuvo en 1993 con una temperatura crítica de -138°C
Si se consiguiera fabricar materiales que presentaran el fenómeno de la superconductividad a temperaturaambiente ocurriría una verdadera revolución ya que se podría transportar la corriente eléctrica sin sufrir apenas ninguna pérdida de energía, las máquinas eléctricas trabajarían más rápido y sin calentarse con un consumo de energía mucho menor (casi el 15 % de la factura de electricidad proviene de pérdidas debidas a la resistencia eléctrica), la contaminación atmosférica disminuiría, se podrían crear campos magnéticos muy
potentes.
El modelo establecido para explicar el enlace metálico también es coherente con otras propiedades características de los metales como, por ejemplo, la posibilidad de deformación sin que se produzca la rotura del cristal (como ocurre en los sólidos iónicos) ya que la deformación del cristal supone únicamente un desplazamiento de los planos de la red que conduce a una nueva situación que apenas se diferencia en nada de la anterior. En las figuras siguientes se pueden diferenciar de forma simple estos fenómenos:
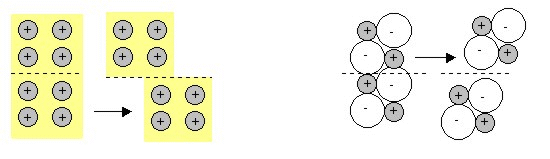
(Comparación entre el comportamiento de un sólido metálico y otro iónico cuando se someten a una fuerza)
Análogamente el hecho de que los metales sean mucho mejor conductores del calor que materiales como la madera o el corcho blanco, se puede explicar también por la facilidad con que en los primeros se pueden mover los electrones de valencia y pueden vibrar los restos atómicos positivos. Todos hemos notado alguna vez lo bien que un metal transmite el calor cuando, por ejemplo, tocamos un objeto metálico que ha estado expuesto un tiempo al sol. La sensación es muy distinta que si tocamos un objeto de madera (igualmente expuesto) el cual nos parece que está a menor temperatura porque transmite mucho peor el calor a nuestra piel. Es por eso que los metales son muy malos aislantes térmicos.
9. Fuerzas intermoleculares
Los átomos al unirse mediante enlaces covalentes pueden formar moléculas. Así, por ejemplo, sabemos que cuando el hidrógeno reacciona con el oxígeno se obtiene agua y que cada molécula de agua está formada por dos átomos de hidrógeno y uno de oxígeno unidos mediante enlaces covalentes. Sin embargo el agua es una sustancia que además de encontrarse en estado gaseoso puede ser líquida o sólida (hielo), de modo que se nos plantea la cuestión de cuál es el mecanismo mediante el que las moléculas de agua se unen
entre sí, ya que si no existiera ninguna fuerza de enlace entre ellas el agua siempre se encontraría en estado gaseoso. El mismo tipo de razonamientos podría hacerse para el caso de otras sustancias covalentes como por ejemplo, el I2, que en condiciones ordinarias se encuentra en estado sólido. Por otra parte, sabemos que muchas sustancias covalentes que a temperatura y presión ambientales se hallan es estado gaseoso, cuando se baja la temperatura lo suficiente pueden licuarse o solidificarse. De esta forma se puede
obtener, por ejemplo, dióxido de azufre sólido enfriando SO2 a una temperatura inferior a -76°C.
¿Cómo se unen entonces las moléculas?
A continuación abordaremos este problema.
Como ya hemos señalado, las fuerzas de atracción entre moléculas (monoatómicas o poliatómicas) sin carga neta se conocen con el nombre de fuerzas intermoleculares o fuerzas de van der Waals. Dichas fuerzas pueden dividirse en tres grandes grupos: las debidas a la existencia de dipolos permanentes, las de enlace de hidrógeno y las debidas a fenómenos de polarización transitoria (fuerzas de London). A continuación
realizaremos un estudio elemental de cada uno de dichos grupos.
9.1. Atracción entre dipolo y dipolo
Existen gases cuyas moléculas están formadas por átomos que tienen diferente electronegatividad (enlace covalente polar) y que se hallan dispuestos de forma que en la molécula existen zonas con mayor densidad de electrones que otras (polo negativo y positivo respectivamente). Este es el caso, por ejemplo, de los gases fluoruro de hidrógeno (HF), cloruro de hidrógeno (HCl), bromuro de hidrógeno (HBr) y ioduro de hidrógeno (HI). Anteriormente ya hemos representado algunas de estas moléculas.
9.2. Enlace de hidrógeno
Anteriormente hemos estudiado el enlace covalente polar en el que hemos visto que en la molécula se forman dos zonas claramente diferenciadas, una con un exceso de carga negativa (la correspondiente al átomo más electronegativo) y otra con un defecto de carga negativa (la correspondiente al átomo menos electronegativo). Un caso de polaridad especialmente interesante es el que corresponde a moléculas tales como por ejemplo H2O, HF o NH3 en las que los átomos de hidrógeno se hallan unidos a otros átomos mucho más electronegativos.
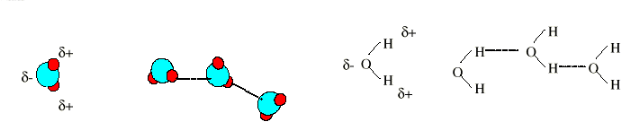
El enlace anterior entre el oxígeno y el hidrógeno de moléculas de agua distintas (representado aquí por una línea punteada) recibe el nombre de enlace de hidrógeno. Un enlace de hidrógeno es una unión de tipo intermolecular generada por un átomo de hidrógeno que se halla entre dos átomos fuertemente electronegativos. De hecho sólo los átomos de F, O y N tienen la electronegatividad y condiciones necesarias para intervenir en un enlace de hidrógeno. La clave de la formación del enlace de hidrógeno es el carácter fuertemente polar del enlace covalente entre el hidrógeno H y otro átomo (por ejemplo O). La carga parcial positiva originada en el átomo de hidrógeno atrae a los electrones del átomo de oxígeno de una molécula vecina. Dicha atracción se ve favorecida cuando ese otro átomo es tan electronegativo que tiene una elevada carga parcial negativa.
El hidrógeno es el único átomo capaz de formar este tipo de enlace porque al ser tan pequeño permite que los otros átomos más electronegativos de las moléculas vecinas puedan aproximarse lo suficiente a él como para que la fuerza de atracción sea bastante intensa. Este tipo de enlace intermolecular es el responsable, por ejemplo, de la existencia de océanos de agua líquida en nuestro planeta. Si no existiera, el agua se encontraría en forma de vapor.
9.3. Fuerzas de London
Supongamos que una molécula monoatómica de helio se acerca bastante a otra. En ese caso, debido al movimiento de los electrones, aunque la molécula sea neutra, se pueden producir en momentos determinados zonas de la molécula con mayor densidad de electrones que otras, es decir, las moléculas pueden tener a veces polaridad eléctrica. De acuerdo con esta idea, podemos pensar en el átomo de helio no polar como un átomo en el que los electrones se encuentran en los lados opuestos del núcleo y alineados con el mismo (a). En todas las demás posiciones los átomos de helio presentarán una cierta polaridad debido a que el centro de la carga negativa no coincidirá con el de la positiva (b).

Si dos átomos de helio convenientemente polarizados y orientados se acercan el uno al otro lo suficiente, la fuerza de atracción eléctrica puede ser lo bastante intensa como para que se produzcan uniones intermoleculares (c). Esto se puede conseguirse bajando mucho la temperatura con lo que el movimiento es más lento. Una molécula polarizada puede incluso polarizar a otra vecina a ella que no lo esté (inducir un dipolo). Este tipo de fuerzas entre moléculas se denominan específicamente fuerzas de London. En la mayoría de los casos se trata de fuerzas muy débiles, aunque van aumentando con el tamaño molecular porque los átomos grandes al tener más electrones se pueden deformar con mayor facilidad. Así, el yodo a temperatura ambiente se puede presentar en forma de cristales de color violeta formados por la unión por fuerzas de London de moléculas de I2.
Descargar
| Enviado por: | Gel |
| Idioma: | castellano |
| País: | Chile |
