Química
Enlace covalente
Introducción:
En este trabajo hablaremos sobre los enlaces covalentes, de sus distintas clasificasiones y formas.
Desarrollo:
El enlace covalente
El enlace covalente consiste en el compartimiento de pares de electrones por dos átomos, dando lugar a moléculas y puede ser polar o no polar.
El enlace covalente puede dar lugar a compuestos sólidos cristalinos de malla rígida tridimensional que une a cada uno de los átomos con todos los demás, en los que la totalidad del cristal es una sola molécula (p. ej., el cuarzo y el diamante), o bien a moléculas discretas que, en estado sólido, están unidas por fuerzas intermoleculares y reciben el nombre de cristales moleculares. Estos compuestos, en cualquiera de los estados de agregación, están formados por las mismas moléculas y sólo se diferencian en la ordenación de éstas.
El modelo de enlace entre iones no se puede utilizar para explicar la unión entre cualquier pareja de átomos. Si dos átomos son iguales, no existe ninguna razón que justifique que uno de estos átomos se transforme en ión. Para justificar estas situaciones se utiliza otro modelo de enlace. Cuando los átomos que forman un enlace comparten sus electrones con la finalidad de cumplir con la regla de los ocho, se forma un enlace. El tipo de enlace que se observa en la molécula de hidrógeno y en otras moléculas en que los electrones son compartidos por los dos núcleos se llama enlace covalente. En la molécula de H2 los electrones residen principalmente en el espacio entre los núcleos en donde son atraídos de manera simultánea por ambos protones. El aumento de fuerzas de atracción en esta zona provoca la formación de la molécula de H2 a partir de dos átomos de hidrógeno separados. La formación de un enlace entre los átomos de hidrógeno implica que la molécula H2O es más estable por determinada cantidad de energía, que dos átomos separados (energía de enlace).
Otros tipos de enlaces covalentes entre los átomos
Hasta el momento se han considerado dos tipos de enlace extremos. En el enlace iónico, los átomos que participan son tan distintos que ganan o pierden uno o más electrones para formar iones con carga opuesta. El enlace se debe a las atracciones entre los iones. En el enlace covalente dos átomos idénticos comparten electrones de manera igual. La formación del enlace se debe a la atracción mutua de los dos núcleos hacia los electrones compartidos. Entre estos extremos se encuentran casos intermedios en los cuales los átomos no son tan distintos que ganen o pierdan electrones en su totalidad, pero son bastante distintos para que haya un compartimento desigual de electrones y se forme lo que se conoce como enlace covalente polar. La molécula de fluoruro de hidrógeno (HF) contiene este tipo de enlace en el cual existe la siguiente distribución de carga:
Enlace covalente multiple
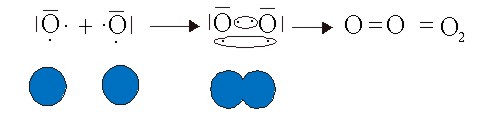
Hasta ahora hemos analizado la formación de enlaces sencillos, es decir aquellos en que se comparten un solo par de electrones entre los átomos, como en el hidrógeno. Alguno elementos del sistema periódico tienen la particularidad de poder establecer uniones covalentes en las que se comparten varios electrones formándose enlaces covalentes múltiples. Este es el caso, por ejemplo, de las moléculas de oxígeno y nitrógeno. En efecto, el oxígeno es un elemento que se encuentra en la sexta columna del sistema periódico por lo que tiene seis electrones de valencia y le faltan dos para completar el octeto.
Enlace covalente coordinado
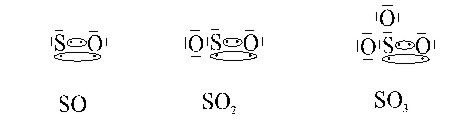
Cuando el par de electrones compartidos pertenece solo a uno de los átomos se presenta un enlace covalente coordinado o dativo. El átomo que aporta el par de electrones se llama donador y el que los recibe receptor o aceptor. El donador será siempre el elemento menos electronegativo, tal como se muestra en el ejemplo entre el oxígeno y el azufre, que puede dar lugar a las moléculas correspondientes a distintos óxidos de azufre. Este enlace una vez formado no se diferencia para nada del enlace covalente normal. Sin embargo debido a cómo se origina se le puede denominar enlace covalente dativo o coordinado. Conviene tener en cuenta que no siempre las moléculas que teóricamente se podrían formar utilizando este tipo de enlace, existen en la realidad, ya que en ello intervienen también otros factores que aquí no hemos tenido en cuenta, como por ejemplo, el tamaño de los átomos que van a enlazarse y la propia geometría o forma de las moléculas.
Conductividad del enlace covalente
La falta de conductividad en estas sustancias se puede explicar porque los electrones de enlace están fuertemente localizados atraídos por los dos núcleos de los átomos enlazados. La misma explicación se puede dar para las disoluciones de estas sustancias en disolventes del tipo del benceno, donde se encuentran las moléculas individuales sin carga neta moviéndose en la disolución. Dada la elevada energía necesaria para romper un enlace covalente, es de esperar un elevado punto de fusión cuando los átomos unidos extiendan sus enlaces en las tres direcciones del espacio como sucede en el diamante; no obstante, cuando el número de enlaces es limitado como sucede en la mayor parte de las sustancias (oxígeno, hidrógeno, amoníaco, etc.) con enlaces covalentes, al quedar saturados los átomos enlazados en la molécula, la interacción entre moléculas que se tratará más adelante, será débil, lo que justifica que con frecuencia estas sustancias se encuentren en estado gaseoso a temperatura y presión ordinarias y que sus puntos de fusión y ebullición sean bajos.
Descargar
| Enviado por: | Wasted |
| Idioma: | castellano |
| País: | Chile |
