Salud
Enfermedades asociadas al SIDA (Síndrome De Inmunodeficiencia Adquirida) y su epidemiología
Virus de la Inmunodeficiencia Humana y el Síndrome de Inmunodeficiencia Adquirida
Introducción:
A finales de la década de 1960 se reconoció que una clase inusual de virus, los retrovirus, transportaba la información genética en moléculas de ARN. Si bien esto no era novedad, si lo fue el hecho de que estos virus contenían una enzima nunca vista hasta entonces. Esta enzima es la transcriptasa inversa, capaz de sintetizar una cadena de ADN a partir de un molde de ARN, invirtiendo el flujo convencional de la información genética. Otra característica de estos virus es que este ADN se integra en el genoma celular quedando latente y denominándose provirus. Esta capacidad de integración hace que puedan llegar a provocar tumores.
Uno de estos retrovirus, el Virus de la Inmunodeficiencia Humana (V.I.H.), es el agente causal de una de las enfermedades más temibles de nuestro tiempo: el Síndrome de Inmunodeficiencia Adquirida (S.I.D.A.). Esta enfermedad, catalogada por la O.M.S. como una de las tres causas de mortalidad más importantes en la próxima década, fue identificada por primera vez en varones homosexuales de Nueva York y de San Francisco en 1981. En un primer momento no se logro identificar el agente causal de la enfermedad, y no fue hasta 1984 cuando se relacionó la enfermedad con un virus descubierto en 1978, al que se acabó denominando VIH. Este virus estaba integrado en la familia de los retrovirus, en la clase de los lentivirus. Esta enfermedad demostró ser fatalmente mortal debido tanto al desarrollo de la infección, que degenera totalmente el sistema inmunitario del enfermo, así como a la falta de tratamiento efectivo, que impide matar al virus una vez se ha producido la infección.
La falta de tratamiento, la larga duración de la enfermedad y la relativamente facilidad de contagio ha provocado una epidemia de considerables dimensiones, existiendo zonas de Africa y del sudoeste asiático en las que cerca del 50% de la población está infectada y las probabilidades de contagio son cercanas al 100%. Una de las grandes incógnitas del VIH es su origen, que se intenta explicar por medio de dos teorías: la primera de ellas postula que proviene de una mutación sufrida por el VIH, que le permitió dar el salto de especie desde los simios a los humanos, y la segunda dice que las cepas infectivas siempre estuvieron allí y que no se ha propagado antes al existir menos contactos entre las poblaciones. Este contacto, antes inexistente, es una de las causas que explican la rápida propagación del virus. También se piensa que han contribuido tanto a su propagación los cambios ocurridos en los hábitos sexuales de las poblaciones residentes en los lugares de origen del VIH, como el aumento de personas adictas a las drogas de administración intravenosa y el hábito de compartir jeringuillas. Otra de las razones que hacen tan temible esta epidemia, a diferencia de otras epidemias que ha existido a lo largo de la historia, es que no va a desaparecer ni a atenuarse de forma espontanea. Otras epidemias se controlaron de forma natural al ser sumamente mortales. El hospedador moría antes de poder contagiar la enfermedad y se seleccionaban, por cambios evolutivos, aquellas cepas de la enfermedad menos virulentas. En el caso del SIDA, el enfermo no muere inmediatamente después del contagio, sino que vive, como portador de la enfermedad, un largo periodo de tiempo durante el cual es capaz de contagiar la infección a un gran número de personas.
Una de las cosas relacionadas con esta enfermedad que hay que diferenciar es entre seropositivo, que es aquella persona que tiene anticuerpos, y por tanto el virus, en sangre, es decir, la persona infectada, y enfermo de SIDA, que es la persona, infectada por el VIH, en la que la enfermedad ha entrado el la fase terminal, en la que el sistema inmunológico esta muy alterado, y se caracteriza por una serie de infecciones oportunistas concretas, como infecciones por Candida, Cryptococcus, Cryptosporidium, Citomegalovirus, Toxoplasma, Salmonella, etc., así como algunos tipos de tumores, como el sarcoma de Kaposi, de cerebro, etc. Estas enfermedades, normalmente controlables por nuestras defensas, se desarrollan en estos pacientes de formas nunca observadas hasta entonces, llegando incluso al extremo de ser totalmente asintomáticas en personas inmunocompetentes, y mortales en pacientes de SIDA.
Virus de la Inmunodeficiencia Humana (VIH):
1- Estructura general
2- Estructura genómica
El VIH pertenece a la familia Retroviridae, que se caracterizan por ser virus envueltos y sensibles al éter, esféricos, de un diámetro de unos 100nm con una cápside posiblemente icosaédrica, que encierra el genoma del virus, en forma de ARN. Este ARN es una molécula monocatenaria de polaridad positiva y de unos 10Kd. Al igual que los ARNm celulares, tiene una cola de poli(A) en el extremo 3´, así como un recubrimiento en el 5´. Cada virión contiene dos moléculas de ARN que se mantienen enlazadas por una estructura de enlace dimérica cerca del extremo 5´. El dímero de ARN (70S) se disocia tras la desnaturalización en dos moléculas genéticamente idénticas, así pues, el virión es diploide. Los viriones contienen además algunos ARNt.
El extremo 5´contiene en dirección 5´3´: el recubrimiento; un terminal redundante; la secuencia U5 (que significa 5´ única), y el sitio de unión del cebador (PBS), complementario del extremo 3´ de un ARNt unido a él. El ARNt ligado es el cebador de la transcriptasa inversa. Despues están dos secuencias muy inportantes: el sitio de unión del dímero (DLS), donde las dos copias de ARN presentes en los viriones se mantienen juntas, y la señal de ensamblaje (ðð, que hace posible el ensamblaje del ARN en los viriones. A continuación se situa el gen gag.
Más allá del extremo final del gen env, el extremo 3´ contiene: la región de la cadena + del cebador (P+), que es importante en la transcripción inversa; la secuencia (U3) única, que contiene señales imortantes para la transcripción del provirus; la redundancia terminal (R), identica a la del extremo 5´, y una cadena de poli(A).
La organización general del genoma, con sus repeticiones terminales que encierran a los genes, es análoga a la de los transposones eucariotas.
De los genes que codifica el ARN vírico, los más importantes, y presentes en todos los retrovirus, son:
-
El gen gag, codifica tres o cuatro proteínas centrales.
-
El gen pol, codifica la transcriptasa inversa y de la integrasa.
-
El gen env, codifica las dos glucoproteínas de la envoltura.
Además de estos genes, comunes a todos los retrovirus, el VIH presenta otros seis genes. Estos genes codifican funciones importantes para la regulación del complejo ciclo de replicación del virus, que puede existir en un estado de latencia en las células infectadas y luego experimentar una rápida replicación en el momento apropiado. Estos genes son:
-
El gen vif
-
El gen tat
-
El gen rev
-
El gen vpr
-
El gen nef
-
El gen vpu, en el VIH-1, y el gen vpx, en el VIH-2
Los productos de los genes gag y pol son procesados por una proteína vírica que forma parte de la poliproteína pol, mientras que el producto del gen env, de 160 Kd es procesado por una proteasa celular. Las proteínas de los seis genes más pequeños regulan la expresión de los demás genes.
3- Ciclo biológico
El ciclo de replicación del VIH es muy similar al de los demás retrovirus, pero encierra unas complicaciones que lo hacen diferente a casi todos los demás retrovirus. Su ciclo biológico incluye los siguientes pasos:
-
Unión: Una vez cerca de un LTh, el VIH reconoce la molécula receptora CD4 y se une a ella a través de su glucoproteína de envoltura Env o gp160, formada por dos subunidades: gp120, una proteína recubierta de azúcares, que interactúa con el receptor CD4, y gp41, una pequeña proteína que ancla a gp120 a la membrana. Esto determina que solo las células que presentan este receptor CD4 en su superficie puedan ser infectadas por el VIH.
-
Fusión: Una vez unidas las proteínas CD4 y gp120, el siguiente paso es la fusión de las membranas. Como resultado, el virión pierde su integridad y su morfología características. El ARN genómico dentro del centro viral, que incluye la transcriptasa inversa es liberado hacia el citoplasma
-
Síntesis del ADN: La síntesis de ADN vírico comienza en el citoplasma menos de una hora después de la infección. Se produce primero una cadena negativa por la acción de la transcriptasa inversa, y antes incluso de que se complete, se inicia la síntesis de la cadena de ADN positiva. Cuando se completa la síntesis de la cadena negativa, la parte de ARN todavía ligada al ADN es degradada por la ARNasa H.
Durante la replicación se modifica el número de nucleótidos que tiene el ADN vírico: los dos extremos se han igualado, formando dos zonas con la misma secuencia y que se conocen como repeticiones terminales largas (LTR). Cada LTR contiene una señal para la adición del recubrimiento, una secuencia TATA y un sitio CAT, que determina el inicio de la transcripción, así como un sitio para la adicción de poli(A). La LTR 3´ aporta las señales de terminación, pero puede iniciar la transcripción sí la LTR 5´. Cada LTR tiene en los extremos repeticiones directas cortas del sitio de integración en las células. También se produce la circularización de la molécula, por la unión de las secuencias LTR.
La Enzima fundamental en este proceso es la transcriptasa inversa. Esta enzima, codificada por el gen pol, es una enzima multifuncional, en la que cada función es llevada a cabo por partes independientes de la enzima, con las siguientes actividades:
ADN polimerasa ARN-dependiente: sintetiza una cadena de ADN complementaria del molde, como extensión del ARNt unido al molde que funciona como cebador.
ADN polimerasa ADN-dependiente: construye una cadena de ADN positiva complementaria de la cadena recién producida, dando lugar a una hélice de ADN bicatenaria.
ARNasa H: degrada la cadena de ARN a híbridos ARN-ADN, dejando un oligonucleótido como cebador para la síntesis de la cadena de ADN positiva, y escinde el ARNt cebador.
Integrasa: integra el ADN vírico bicatenario en el ADN celular.
-
Integración: Las LTR son decisivas para la integración del ADN vírico en el ADN celular. Solo son integradas las moléculas circulare, con las dos LTR conectadas extremo a extremo en una repetición directa. La integrasa corta las dos cadenas, produce dos cortes escalonados en el ADN circular e inserta el ADN vírico en él. La transcripción normal, que se inicia en la LTR 5´ y termina en la LTR3´, da lugar al ARN presente en los viriones. Rara vez se escinden estos provirus por recombinación entre las LTR.
-
Síntesis de las proteínas víricas: La síntesis de las proteínas víricas tiene lugar sobre dos mensajeros principales. Un mensajero de 35S, probablemente idéntico al del ARN que se incorpora en los viriones, es el molde para la síntesis del precursor de la proteína Gag. El gen pol contiguo esta fuera del marco del gag y es leído el 5% del tiempo mediante ribosomas que desplazan el marco, originando una poliproteína Gag-Pol. Un segundo mensajero de 24S, empalmado a partir del ARN 35S, es el molde para el precursor de Env, que también se lee en un marco diferente. Los distintos precursores son escindidos después a sus productos finales. El procesamiento se lleva a cabo mediante una proteasa vírica.
-
Maduración: La poliproteína Env penetra en el aparato de Golgi, donde es glicosilada. De aquí pasa a la membrana plasmática. La mayor parte de la proteína Gag permanece en el citosol, pero una parte sigue la misma ruta que Env y es glicosilada y alcanza el lado exterior de la membrana plasmática. Los precursores Gag y Gag-Pol, junto con el ARN vírico, inician el ensamblaje de neurocápsides bajo la membrana plasmática celular. Al mismo tiempo se produce la gemación de los viriones y, en el mismo proceso, son escindidas las proteínas. La secuencia ð de empaquetamiento del ARN vírico es esencial para el ensamblaje de la neurocápside.
-
Latencia y transactivación: El ciclo de replicación anterior es común para todos los retrovirus, pero el VIH y otros virus relacionados son inusuales en diversas formas:
La infección también involucra una fase de latencia durante las células infectadas contienen provirus pero no expresan ARN o proteínas virales.
La expresión de las macromoléculas virales está sujeta a la regulación por parte de los productos génicos virales que operan como elementos solubles. Este fenómeno se conoce como transactivación. Por lo menos, los genes tat y rev actúan como factores de la transactivación, lo cual aumenta mucho la expresión de las ARN y las proteínas virales. El gen tat lleva a la elaboración de un mayor nivel de ARN por parte de la ARN polimerasa y el gen rev afecta a la forma en que los ARN son procesados y traducidos en la proteína C.
Los provirus contienen señales que pueden empezar la expresión cuando las células infectadas por el VIH son estimuladas por el antígeno o afectada por algunos otros virus. Estos aspectos parecen estar relacionados de forma importante: después de la infección de los linfocitos y de la integración del provirus el proceso infeccioso puede ser detenido, para ser reiniciado mucho después de una forma explosiva por estímulos desconocidos. El resultado es un alto nivel de transactivación, con la consecuencia de una explosiva producción viral y una rápida muerte de las células. La necesidad de estímulos secundarios para completar el ciclo de la replicación puede ser el responsable del momento impredecible de aparición de la enfermedad.
SINDROME DE INMUNODEFICIENCIA ADQUIRIDA:
1-Definición de SIDA:
El SIDA es el conjunto de manifestaciones clínicas que acompañan a las últimas fases del desarrollo de la infección del VIH. Las principales características del SIDA se deben a la unión selectiva de la glucoproteína del VIH gp160 con la glucoproteína CD4 de los LTh y en los macrófagos, así como en algunos otros tipos de células. La infección de estas células por el VIH conduce finalmente a la perdida de una gran cantidad de respuestas inmunes y a la aparición recurrente de graves infecciones debidas a microorganismos oportunistas: virus, bacterias u hongos muy comunes y de baja virulencia, que prácticamente solo son patógenos para los individuos cuyas defensas inmunes están gravemente alteradas. Otra característica es la alta incidencia de tumores malignos, en especial sarcoma de Kaposi (una neoplasia vascular de piel, poco frecuente y que sólo suele aparecer en pacientes mayores de 60 años) y de linfomas de células B.
El aislamiento del VIH-1 a partir de los tejidos de los individuos con SIDA, y el descubrimiento de una línea de células T en las que podía ser cultivado, ha permitido producir grandes cantidades del virus y de sus antígenos y anticuerpos, que se han utilizado para el diagnóstico serológico y para la producción de sondas de ácidos nucleicos para el ARN vírico y su ADN complementario. Mediante estos reactivos se ha podido detectar un gran reservorio de pacientes infectados asintomáticos, así como también se ha podido trazar un mapa de diseminación de la enfermedad.
La enfermedad sintomática aparece de dos formas diferentes. Las personas que padecen complejo relacionado con el SIDA (CRA) presentan adenopatías generalizadas, febrícula y una acusada perdida de peso (probablemente a consecuencia de una producción excesiva de IL-1, también llamada caquectina) En el SIDA florido, estos síntomas se acompañan de infecciones oportunistas recurrentes (p.e. neumonía por Pneumocystis carinii), sarcoma de Kaposi o ambos.
Pero mientras el VIH está dañando el sistema inmunológico del paciente, este también está tratando de defenderse de la infección y de destruir al microorganismo. Frente al VIH el sistema inmune se estimula de dos formas. La respuesta humoral consiste en que un macrófago degrade las partículas del VIH y presente los fragmentos, o antígenos, a los LT CD4 o auxiliadores. A continuación estas células liberan moléculas que hacen que los LB maduren y produzcan moléculas de anticuerpo capaces de marcar a los viriones del VIH para su destrucción. La respuesta celular empieza cuando un macrófago infectado por el VIH exhibe fragmentos víricos que son reconocidos por los LT CD8 o citotóxicos. Los LTh provocan entonces que los LTc destruyan a otras células infectadas por el VIH. Algunos de los LT y LB terminan por convertirse en células de memoria de larga vida, que reaccionan con prontitud en el caso de futuras exposiciones al VIH. Es posible que las vacunas contra el VIH necesiten provocar ambas respuestas inmunes, la humoral y la celular para ser eficaces.
2-Enfemedades asociadas:
Durante el desarrollo del SIDA, el nivel de LTh va descendiendo de forma progresiva. Este descenso provoca que el organismo del enfermo no pueda hacer frente a una serie de infecciones y tumores que normalmente se mantienen bajo control. Muchas de estas enfermedades son asintomáticas y bastante comunes en personas inmunocompetentes, por lo que es imposible mantener al enfermo de SIDA fuera de contacto con el agente causal. Aparte de las infecciones típicas de los enfermos inmunodeprimidos, también se ve aumentado el número de infecciones más comunes, pero que en este caso, ven aumentada su patogenicidad debido al la menor capacidad de defensa del organismo.
Las complicaciones más típicas de los enfermos de SIDA se pueden dividir según el agente que las causa en:
Infecciones provocadas por microbacterias.
Infecciones provocadas por hongos.
Infecciones provocadas por protozoos.
Infecciones provocadas por virus.
Tumoraciones, linfomas y sarcomas.
Alteraciones neurológicas.
Otras complicaciones.
1-Infecciones provocadas por microbacterias:
Complejo por Mycobacterium Avium (MAC)
Agente causante: Mycobacterium Avium y Mycobacterium Intracellulare son los agentes causantes de los MAC. Esos gérmenes se encuentran en el agua, el suelo, las comidas y en una gran variedad de especies animales (fundamentalmente aves).
Cómo se inicia: Cuando se produce un MAC en personas sin VIH, usualmente lo que produce es una infección en el tracto respiratorio. En las personas infectadas por VIH, el MAC es un fenómeno que puede estar localizado en los distintos órganos y sistemas del cuerpo, especialmente aquellos que cuentan con gran número de fagocitos mononucleares (un tipo de célula del sistema inmunitario), en concreto, en el hígado, el bazo y la médula ósea.
Su incidencia en las personas con VIH: El MAC puede presentarse entre un 18% y un 50% de las personas con VIH. El número de personas seropositivas al VIH que padecen de MAC en algún momento ha ido incrementándose en los últimos años, con lo cual el MAC va cobrando cada vez más importancia dentro del cuadro de las infecciones oportunistas. El riesgo de desarrollar MAC en varias partes del cuerpo aumenta considerablemente según disminuya el número de CD4, concentrándose el mayor riesgo en aquellas personas con menos de 125 CD4 y que hayan tenido ya alguna infección oportunista, superada o en curso.
Síntomas del MAC, y cómo afecta al organismo: Los signos y síntomas del MAC son generalmente poco específicos: fiebre, sudoración nocturna, pérdida de peso, debilidad general, anorexia (falta de apetito). Si se tiene además diarrea, dolor abdominal o mala absorción intestinal (heces pastosas), puede indicar que el MAC está afectando al sistema gastrointestinal. También es frecuente observar aumentos de tamaño en el hígado y en el bazo. En las analíticas, se puede observar anemia (poca hemoglobina o pocos glóbulos rojos o ambas cosas), neutropenia (descenso en el número normal de neutrófilos - un tipo de leucocito o glóbulo blanco-) y niveles elevados de una enzima denominada fosfatasa alcalina. Algunos síntomas en el sistema respiratorio, como dificultad para respirar, fatiga, exceso de mucosidad y silbidos, que suelen ser comunes en el MAC para las personas sin VIH, son raros o infrecuentes en las personas con VIH.
¿Cómo se diagnostica? : Los cultivos de muestras de la sangre o de la médula ósea son el método más común de diagnóstico del MAC. Un MAC diseminado (localizado en varias zonas del cuerpo) y, por tanto, ya instalado, produciendo síntomas, se puede determinar por medio de un solo cultivo positivo en una muestra de sangre. Un resultado positivo en el análisis de un esputo (expectoración, flema o saliva) puede representar un anuncio de futura sintomatología o que el MAC está comenzando a instalarse en el cuerpo. En general, puede decirse que el MAC suele darse en personas con una infección por VIH avanzada, con menos de 100 CD4 y con un historial previo de infecciones oportunistas.
Tratamiento del MAC: No se ha establecido un estándar para el tratamiento del MAC. No obstante, las recomendaciones generales incluyen el uso de terapias de combinación con, al menos, dos sustancias, una de las cuales suele ser o bien claritromicina (500 mg dos veces al día) o bien azitromicina (500 mg por día) y la otra es, generalmente, etambutol (una dosis diaria de 15 mg por cada kilo de peso de la persona). Para terapias con tres sustancias, aparte de las ya mencionadas, suele añadirse una de las siguientes: rifabutin (de 300 a 450 mg por día). rifampin (100 mg por cada kilo de peso de la persona diariamente), amikacin (7,5 mg por kilo de peso o 15 mg por kilo de peso diariamente), y ciprofloxacín (de 500 a 700 mg dos veces al día). Las respuestas clínicas (signos y síntomas) y microbiológicas (resultados de las analíticas) suelen ser evidentes en un período de 4 a 6 semanas después de haber iniciado el tratamiento. Después de este período, el tratamiento debe ser continuado siempre. En el caso de que se observe de nuevo la presencia del Mycobacterium en la sangre, aunque los síntomas hayan remitido, para evitar una recaída, debe hacerse un test para probar "in vitro" la eficacia de la azitromicina y de la claritromicina, con el fin de sustituirlas por otros antibióticos si fuera necesario. Este mismo enfoque terapéutico puede ser aplicado también en los niños que presenten MAC.
Profilaxis del MAC: Una dosis de 300 mg de rifabutin diariamente, o bien una de 500 mg de claritromicina dos veces al día o bien una de 1200 mg de azitromicina son las consideraciones terapéuticas aprobadas en los EE.UU. como profilaxis para las personas con VIH y conteos de CD4 menores de 200.
Salmonelosis
Agente causante: Las bacterias de la familia Salmonellae son una subfamilia de tipo gram - negativo, sin formación de esporas, del género Enterobacteriaceae (esto es, bacterias del sistema gastrointestinal o digestivo). La Salmonella Typhosa causa las fiebres tifoideas y los otros tipos de Salmonella (las más frecuentes en las personas con VIH), ocasionan diarreas y bacteriemia (infección de la sangre).
Cómo se inicia: La infección se produce frecuentemente por vía oral y como resultado de haber ingerido agua o alimentos contaminados (prestar especial atención a las salsas, mayonesas y "platos fríos" en verano o en zonas de clima húmedo y cálido en cualquier época del año). Esta bacteria se multiplica en el cuerpo una vez que ha llegado al intestino delgado. En las personas con VIH, las infecciones por Salmonella se diseminan usualmente afectando a varios sistemas del cuerpo.
Su incidencia en las personas con VIH: La Salmonelosis es una infección oportunista relativamente poco frecuente en las personas con VIH, sin embargo, la incidencia de Salmonelosis es hasta 20 veces mayor en personas infectadas por el VIH que en aquellas sin VIH. Si se observa de modo recurrente (varias veces a lo largo de un cierto tiempo) la presencia de Salmonella en la sangre (septicemia por Salmonella), se puede considerar que es un signo suficiente como para establecer un diagnóstico de SIDA en una persona infectada por VIH.
Síntomas de la Salmonelosis y cómo afecta al organismo: La mayoría de las personas presentan síntomas no específicos tales como fiebre, escalofríos, sudoración, pérdida de peso, diarrea y anorexia. Aunque las enterocolitis (inflamaciones del colon de los intestinos) son bastante frecuentes en las personas con SIDA, usualmente no están causadas por la Salmonella.
¿Cómo se diagnostica? : A través de cultivos bacterianos de la sangre (hemocultivos) o de las heces (coprocultivos).
Tratamiento de las Salmonelosis: Para las personas sin VIH el tratamiento consiste simplemente en hidratación oral y modificaciones en la dieta hasta que pase la infección. En las personas con VIH, más aún si están en fase SIDA, el tratamiento debe incluir una terapia con antibióticos. La ampicilina, el ciprofloxacín, el cloranfenicol, y el TMP/SMX son efectivos. Es muy frecuente una recaída, por lo cual, una vez superada la fase aguda (con síntomas y tratamiento de choque con antibióticos), se recomienda seguir una terapia de mantenimiento con ciprofloxacín.
Sífilis y Neurosífilis:
Agente causante: El Treponema pallidum es una bacteria en forma de espiral (espiroqueta) y es el causante de la sífilis.
Cómo se inicia: Muy rápidamente después del momento de la infección inicial, este microorganismo se instala en el sistema linfático (ganglios) y/o en la sangre y se disemina por todo el cuerpo. Casi todos los órganos del cuerpo pueden verse afectados, incluyendo el SNC: sistema nervioso central (cerebro y nervios responsables de la motricidad y de la sensibilidad).
Su incidencia en las personas con VIH: La presencia del VIH, máxime si la persona está en fase de SIDA, puede acelerar la evolución de una sífilis, particularmente, la neurosífilis (daño al SNC) puede aparecer antes en las personas con VIH que en aquellas que no lo tienen.
Síntomas y cómo afecta al organismo: La infección por Treponema pallidum se caracteriza en su primer momento por la aparición de un chancro o llaga en el punto de entrada de este microorganismo en el aparato genital. También es posible que este chancro inicial en algunas personas no llegue a desarrollarse y, así mismo, puede suceder que aparezcan varios chancros en diferentes zonas que desaparezcan paulatinamente durante las primeras 4 a 6 semanas después de la infección. Acompañando a la aparición de los chancros, se produce una linfoadenopatía (linfo = linfático, adeno = ganglio o nudo, patía = alteración, esto es, una inflamación de los ganglios con dolores o molestias en las zonas próximas). Posteriormente, en la fase secundaria de la sífilis, cuando los chancros tienden a desaparecer, puede aparecer una erupción en la piel algo difusa (rash), continúan o se intensifican las linfoadenopatías y aparecen varios síndromes constitucionales (padecimientos leves generalizados) como dolores articulares leves y fiebres recurrentes. Es importante señalar que la neurosífilis (afectación del SNC) puede ocurrir en cualquier etapa de la sífilis: así, la meningitis sifilítica y la sífilis meningovascular ocurren tempranamente, unos meses o pocos años después de la primera infección; y la paresis (paralización o dificultad de movimientos de los miembros) puede ocurrir más tarde (de 5 a 30 años después de la primera infección). Además de la neurosífilis, la sífilis en su estado avanzado puede afectar cualquier órgano del cuerpo, produciendo lesiones fibrosas y afectando al sistema cardiovascular.
¿Cómo se diagnostica? : En la primera fase de la infección, las pruebas de campo oscuro y de inmunofluorescencia de anticuerpos hechas con muestras tomadas del chancro suelen ser definitivas para determinar la infección, siempre que su resultado sea positivo. Existen también pruebas serológicas no específicas que pueden ser útiles para monitorizar la respuesta de la sífilis cuando se aplica un tratamiento. Existen, igualmente, pruebas específicas que sirven para establecer un diagnóstico claro; estas pruebas específicas siempre darán positivo, de por vida, aunque la infección remita como consecuencia del tratamiento, y es por esa razón que no se las utiliza para monitorizar la infección. En las personas con VIH, pueden darse resultados de falso positivo en las pruebas serológicas, debido posiblemente a alteraciones en el funcionamiento de los linfocitos B (productores de anticuerpos) o a otros procesos poco frecuentes en el funcionamiento del sistema inmunitario. Por el contrario, es muy raro que se produzca un resultado de falso negativo. Para diagnosticar la neurosífilis, se hace necesario un examen del líquido cefalorraquídeo, esto se hace por medio de una punción lumbar. No obstante, en el caso de las personas con VIH, la prueba de detección en el líquido cefalorraquídeo del VDRL (marcador de sífilis) puede no ser un indicador claro, ya que es frecuente que las personas con VIH tengan altos niveles de VDRL en el líquido cefalorraquídeo sin que eso indique que hay un proceso de neurosífilis.
Tratamiento de la Sífilis: El tratamiento estándar para la sífilis en su estadio temprano es la penicilina (benzatine, penicilina G). En cuanto a las personas con VIH, no se han llevado a cabo estudios para establecer cuáles sustancias y dosis podrían ser más efectivas que dicho tratamiento estándar. Las recomendaciones de los CDC (Centers of Disease / Control de Enfermedades) en EE.UU. son 2,4 millones de unidades de benzatine penicilina G administradas por vía intramuscular, para todas las personas, con o sin VIH. Otros investigadores proponen dosis más altas (tres dosis de 2,4 millones de unidades, una cada semana, durante tres semanas) para prevenir posibles recaídas y la aparición de neurosífilis. Otra sustancia, la ceftriaxona (500 mg o 1 gr intramuscular diariamente durante 10 días) podría ser un régimen alternativo eficaz, pero no ha sido, hasta la fecha, estudiado suficientemente. Para las personas VIH+ alérgicas a la penicilina que tengan sífilis en fase temprana, algunos médicos utilizan doxyciclina como alternativa o bien ceftriaxona. Para las personas VIH+ con sífilis latente (varios años de infección sin síntomas aparentes), las recomendaciones de los CDC son tomar 7,2 millones de unidades de benzatine penicilina en tres dosis (una a la semana) por inyección intramuscular. Para las personas VIH+ con síntomas de neurosífilis o con neurosífilis establecida, las recomendaciones incluyen de 2 a 4 millones de unidades de penicilina G potásica hidratada cristalina cada cuatro horas en un período de 10 a 14 días (una dosis diaria total de 12 a 24 millones de unidades). Otros regímenes alternativos incluyen la opción de la penicilina procaína en cantidades de 2 a 4 millones de unidades en inyección intramuscular añadiendo probenecida (500 mg intramuscular) cuatro veces al día por un intervalo que va de 10 a 14 días.
Profilaxis de la sífilis: El método más eficaz es el uso del preservativo en todas las relaciones sexuales que impliquen penetración y/o contacto con las mucosas genitales, así como evitar el contacto de la mucosa de la boca con secreciones genitales o mucosas genitales de otras personas utilizando un preservativo o una barrera de látex. Si se sospecha que se ha estado bajo riesgo de sífilis, un tratamiento similar al indicado para la sífilis temprana puede ser eficaz.
Tuberculosis
La tuberculosis es la infección oportunista relacionada con el SIDA más frecuente en España.
Agente causante: En las personas con VIH el agente causante suele ser el Mycobacterium tuberculosis.
Cómo se inicia: El foco inicial de la infección está en los alvéolos de los pulmones (la parte última de los pulmones a través de la cual la sangre se nutre de oxígeno y se desprende de los gases residuales del metabolismo, es decir, donde se produce, concretamente, la respiración.) La tuberculosis extrapulmonar (en sitios diferentes de los pulmones) es muy poco frecuente en las personas sin VIH, pero es muy común en las personas VIH+. En este último caso, el sistema linfático suele ser la parte más frecuentemente afectada, así como también pueden producirse meningitis por tuberculosis.
Su incidencia en las personas con VIH: Las personas con VIH son particularmente susceptibles a la infección con el Mycobacterium tuberculosis, y el curso de la infección es bastante rápido. La tasa de tuberculosis extrapulmonar es mucho más elevada que en las personas sin VIH, particularmente en las personas con bajo número de CD4. Se han detectado brotes de tuberculosis en personas VIH+ en el ámbito hospitalario. En este punto es importante resaltar que casi el 40% de las personas con VIH que entran en contacto con una persona afectada por la tuberculosis son susceptibles de infectarse, tanto si la han padecido o no ellos mismos en algún momento anterior.
Síntomas y cómo afecta al organismo. La tuberculosis produce quistes o fibrosis en las zonas afectadas, dañando de un modo importante la estructura y el funcionamiento de las mismas. Aparte de su foco principal de actividad en el seno de los pulmones (alvéolos), también puede afectar a los ganglios del sistema linfático y a otras zonas del cuerpo, particularmente al sistema nervioso. Los síntomas son los mismos tanto en las personas con VIH como sin él: tos, pérdida de peso, fiebre, sudoraciones nocturnas, fatiga. Sin embargo, particularmente en las personas con VIH, estos síntomas "característicos" de la tuberculosis podrían ser leves o no darse en algunos casos, lo cual no implica que el curso de la infección sea menos intenso.
¿Cómo se diagnostica? La sensibilidad de los tests de tuberculina (una sustancia producida por el Mycobacterium tuberculosis) en la piel (pruebas PDD o Mantoux) se ve reducida en la mayoría de los casos de las personas con VIH que tengan un nivel muy bajo de CD4, no obstante, este tipo de pruebas debe hacerse de todas maneras, ya que una prueba positiva indica en cualquier caso que la persona ha estado expuesta al Mycobacterium tuberculosis, aunque no pueda determinarse con ello si existe una infección activa en curso. La diagnosis certera de la tuberculosis requiere de un cultivo en laboratorio que permita el aislamiento del Mycobacterium t.
Tratamiento de la Tuberculosis: Recientemente se ha constatado el aumento en la prevalencia (permanencia) de formas multirresistentes de la tuberculosis en las personas con VIH, esto es, de tuberculosis que son cada vez más difíciles de tratar debido a las resistencias desarrolladas a los antibióticos utilizados como tratamiento. Por tanto, a todas las personas con VIH que tengan Mycobacterium tuberculosis, debería hacérseles pruebas de susceptibilidad a la acción de los antibióticos (para determinar cuáles son más eficaces o las posibles resistencias) en la primera muestra de cultivo que se tome para establecer el diagnóstico de tuberculosis. Los resultados de estas pruebas de sensibilidad deberían servir como base para las decisiones a tomar acerca de las posibles opciones de tratamiento. El tratamiento inicial para Mycobacterium tuberculosis no resistentes debería incluir cuatro sustancias, que serían, durante los primeros dos meses de tratamiento: isionazida, rifampin, pyrazinamida y etambutol o estreptomicina. Si el Mycobacterium tuberculosis presenta algún tipo de resistencias (no susceptibilidad a los antibióticos), después de estos dos meses iniciales, debe continuarse la terapia con isoniazida y rifampin. Ya que no hay suficientes datos que avalen la posibilidad de que un tratamiento de seis meses sea suficiente para personas con VIH, se ha establecido que la duración del tratamiento en este caso sea de 9 meses y, en todo caso, al menos de 6 meses después de haber detectado el Mycobacterium tuberculosis en el esputo (expectoración, saliva). Ya que una de las causas más importantes del fallo en la terapia para la tuberculosis suele ser la falta de un adecuado cumplimiento de las tomas y horarios por parte de las personas bajo tratamiento, se recomienda a los médicos establecer, al menos durante los primeros seis meses, una estrategia de seguimiento intensivo de la toma del tratamiento junto con la persona tratada, con el fin de evitar un mal cumplimiento terapéutico (manera en la que se toma la medicación). Las personas con VIH afectadas por Mycobacterium tuberculosis suelen tener problemas de mala absorción intestinal de los antibióticos, por lo cual es muy importante que se incluyan pruebas para determinar el nivel de absorción de estos, especialmente en los casos en los que el tratamiento no se muestra suficientemente eficaz.
Las tuberculosis multirresistentes: origen, enfoque y tratamiento: En este caso, el Mycobacterium tuberculosis se muestra insensible o resistente a uno o varios de los antibióticos disponibles. Este es un caso particularmente frecuente en zonas donde conviven un número elevado de personas afectadas por la tuberculosis, como pueden ser los hospitales y las prisiones. Esto se debe a que los tratamientos, especialmente si son poco contundentes o están prescritos de forma inadecuada, seleccionan cepas resistentes y favorecen su desarrollo, de modo que son las que están "disponibles" con más frecuencia para infectar a nuevas personas. La mortalidad en estos casos es más elevada y la velocidad a la cual se desarrolla la infección es también superior. También una reinfección en una persona que previamente haya pasado por una tuberculosis puede dar lugar a la aparición de multirresistencias, esto puede ocurrir tanto si se está bajo terapia contra el primer episodio de tuberculosis como si ya se ha terminado el período de tratamiento. En general, se ha determinado que la principal causa de la aparición de multirresistencias se debe a la mala aplicación de tratamientos, que consiste, fundamentalmente, en añadir simplemente una nueva sustancia a un pool o cóctel que ya se muestra ineficaz. Por ello, cuando se inicia un tratamiento en personas con una tuberculosis multirresistente ya confirmada (entre otras cosas, por la escasa o nula eficacia de los tratamientos recomendados como iniciales o de mantenimiento), hay que hacer una cuidadosa evaluación de la historia de tratamiento y de la sensibilidad del Mycobacterium tuberculosis "in vitro" (en el laboratorio, fuera del cuerpo) a las distintas sustancias disponibles. En estos casos, la persona afectada debe permanecer hospitalizada y el régimen de tratamiento debe incluir una combinación de cuatro a siete sustancias diferentes. Las sustancias con una utilidad potencial en un tratamiento orientado a una tuberculosis multirresistente son: pyrazinamida, etambutol, estreptomicina, ofloxacina, ciprofloxacín, etionamida, cycloserina, capreomicina, levofloxacina y PAS.
Profilaxis de la tuberculosis: Las recomendaciones de los CDC son que las personas con VIH con presencia latente de Mycobacterium tuberculosis (infectados pero asintomáticos), que se puede determinar por un test PPD o Mantoux superior a 5 mm, o si han tenido un resultado positivo en este mismo test en algún momento anterior y no siguieron después ningún tipo de tratamiento, reciban un tratamiento preventivo con isoniazida durante 12 meses. Este mismo tratamiento puede ser también el indicado para personas con VIH que vivan en zonas o estén en circunstancias en las cuales se dé una alta tasa de tuberculosis en la población. Como las personas con VIH tienen facilidad para desarrollar neuropatías periféricas (uno de los efectos del isoniazida), se recomienda añadir pyridoxina a este tratamiento para reducir su intensidad o prevenir su aparición. En cuanto a las posibilidades de uso de la vacuna BCG como método de profilaxis, aunque la eficacia de esta vacuna podría alcanzar hasta el 50% de protección como media, lo cierto es que, en el momento actual, se conocen casos de personas con VIH que han desarrollado tuberculosis como consecuencia de la aplicación de la vacuna y que, en general, no está recomendado su uso para el caso de adultos con VIH.
2- Infecciones provocadas por hongos.
Aspergilosis:
Agente causante: Los hongos pertenecientes al género Aspergillus incluyen numerosas especies, de amplia distribución y todas ellas causantes de distintas enfermedades. Los Aspergillus se encuentran frecuentemente en la vegetación en descomposición y en la tierra.
Cómo se inicia: La aspergilosis se establece en determinadas zonas del cuerpo, tales como los pulmones y los senos (cavidades en el cráneo por detrás de la frente y de la nariz, recubiertas de mucosa y que sirven para calentar y humedecer el aire antes de que llegue a los pulmones, al ser cavidades húmedas, de forma irregular y estar cerradas, son susceptibles de numerosas infecciones, tanto en las personas con VIH como en las que no lo tienen) También la aspergilosis puede diseminarse y volverse extrapulmonar.
Su incidencia en las personas con VIH: La aspergilosis es relativamente común en las personas con neutropenia (bajo número de neutrófilos: un tipo de glóbulo blanco) debido a la quimioterapia aplicada para tratar el cáncer, así como en aquellas personas que reciben tratamientos inmunosupresores para que no rechacen los transplantes de órganos. En las personas con VIH la aspergilosis es más bien una infección poco frecuente, aunque, como sucede con muchas de las infecciones oportunistas hasta ahora poco frecuente, son cada vez más numerosos los casos en las personas con infección por VIH avanzada con un sistema inmunitario muy deteriorado.
Síntomas de la aspergilosis y cómo afecta al organismo: Tos, molestias en la garganta, dolor en el pecho, dificultad para respirar, fiebre y sudoración nocturna, así como dolor en los senos craneales y nasales. Generalmente se considera como factores predisponentes de la aspergilosis a la neutropenia, el uso de esteroides durante largo tiempo, el uso de marihuana, infecciones o afecciones anteriores relacionadas con los pulmones o el sistema respiratorio e infección por citomegalovirus (CMV). La aspergilosis afecta seriamente al funcionamiento del sistema respiratorio y puede empeorar el estado clínico de las personas con VIH.
¿Cómo se diagnostica? A través de la obtención de muestras por aspiración de los senos y de los pulmones, o por medio de un lavado bronco-alveolar y por cultivo y observación al microscopio de una muestra de esputo.
Tratamiento de la aspergilosis: El estándar de tratamiento es el uso de amfotericina B intravenosa. También el itraconazol oral ha sido aprobado por la FDA (Food and Drug Administration de los EE.UU.) como terapia en las formas iniciales o leves de aspergilosis.
Candidiasis:
Agente causante: Candida albicans es el hongo que infecta con mayor frecuencia a las personas con VIH/SIDA y es el principal responsable de la mayoría de los casos de candidiasis orofaríngea (en la boca y la faringe). Otras especies de Cándida, como C. glabrata, C. parapsilosis, C. tropicalis y C. krusei pueden ocasionar también candidiasis oral con sintomatología en las personas con VIH.
Cómo se inicia: Las esporas de la Cándida anidan en las mucosas expuestas del organismo, tales como la mucosa de la boca y la de la vagina, en las cuales las condiciones de humedad constante, así como el calor, favorecen su proliferación. También puede aparecer en el resto del tracto gastrointestinal y en algunas zonas de la piel.
Su incidencia en las personas con VIH: La infección por cándida es relativamente frecuente en la vagina de las mujeres no VIH y generalmente remite con tratamiento. En las personas con VIH, la cándida se asienta con mayor intensidad y puede ser recurrente, a pesar de los tratamientos que se apliquen. Además, prolifera en zonas del cuerpo tales como la boca y la garganta en las cuales no es habitual su presencia en el caso de las personas sin VIH.
Síntomas de la Candidiasis y cómo afecta al organismo: Su manifestación más clara es la aparición de placas blancas, de apariencia pastosa, endurecidas en las mucosas o en las zonas afectadas. Produce sequedad en la boca (sensación de boca pastosa), altera el sentido del gusto, llega a producir úlceras bucales muy dolorosas que dificultan la ingestión de alimentos sólidos o líquidos y que ocasionan dificultades para tragar.
¿Cómo se diagnostica? Por simple examen visual (observación de las placas blancas y de las ulceraciones); por cultivo de una muestra de las mucosas obtenido por raspado.
Tratamiento de las candidiasis:
Candidiasis orofaríngea: Para la candidiasis orofaríngea las sustancias que se utilizan son el fluconazol y el clotrimazol. También se aplican el ketoconazol, el itraconazol y la nistatina. El fluconazol aplicado en dosis de 100mg diariamente y el clotrimazol en dosis de 10 mg cinco veces al día durante unos 14 o 15 días logran una mejora sustancial o la curación en un alto porcentaje de las personas con candidiasis oral. Estas sustancias también se pueden aplicar en forma de suspensión oral, siendo en este caso más efectivo el fluconazol que la nistatina y mostrándose el itraconazol en suspensión oral como una alternativa al fluconazol y al cotrimazol en el tratamiento.
Candidiasis esofágica: En la mayoría de los casos el tratamiento con fluconazol (100 mg diariamente) se muestra más eficaz que el ketoconazol (200 mg diariamente. Este tratamiento se realiza durante dos semanas o hasta que remitan los síntomas y luego se continúa por un período de hasta ocho semanas. El itraconazol en solución oral es también una alternativa al fluconazol en el tratamiento de la candidiasis esofágica, en dosis de 100 a 200 mg diariamente.
Candidiasis vaginal: Los tratamientos más comunes son los de aplicación tópica (sobre la superficie afectada) con clotrimazol o miconazol durante una semana. Si la candidiasis vaginal es recurrente o persistente a pesar de este tratamiento, entonces se recomienda un tratamiento por vía oral con 200 mg de fluconazol o 400 mg de ketoconazol una vez al día, durante dos semanas.
Tratamiento de las Candidiasis resistentes al fluconazol: A pesar de que normalmente las candidiasis remiten con los tratamientos descritos, ocasionalmente pueden aparecer casos de resistencia al fluconazol, que ocurren entre un 5% y un 10% de las personas con VIH que tengan con un conteo bajo de CD4 (menos de 150) y que hayan estado recibiendo tratamiento con fluconazol durante un cierto tiempo. En estos caos, como se ha comentado, el itraconazol en solución oral, en dosis de 100 mg dos veces al día y, para los casos más graves, en personas con muy pocos CD4 (menos de 50) se recomienda el uso de amfotericina B intravenosa, que se ha mostrado eficaz en el tratamiento de las candidiasis resistentes al fluconazol y con resistencias cruzadas a los azoles en general (ketoconazol, itraconazol, etc.) Otra posibilidad es la aplicación de amfotericina B por vía oral, en dosis de 500 mg por día, durante 2 a 4 semanas, que está siendo actualmente objeto de estudio en fase II pero de la que se adelantan ya resultados positivos.
Profilaxis de las Candidiasis: En general, especialmente en personas con conteos de CD4 por debajo de 200, la posibilidad de profilaxis debe ser tenida en cuenta. Particularmente si ha habido algún episodio de infecciones fúngicas con anterioridad. Las sustancias que se utilizan para la profilaxis son las mismas que se utilizan para el tratamiento, aunque en dosis más bajas. Un apunte interesante es el resultado de un estudio recientemente concluido que sugiere que la ingestión de yogures que contengan Lactobacillus acidophillus (como los "actimel", "bio", etc., que se comercializan habitualmente) contribuye a disminuir la colonización y la infección de las mucosas por parte de la Candida.
Coccidiomicosis:
Agente causante: Coccidioides immitis es un hongo que se encuentra fundamentalmente en la tierra y que es endémico en algunas zonas de Estados Unidos, México y América Central y del Sur. Aunque se haya distribuido por zonas más amplias del planeta.
Cómo se inicia: La infección se produce al inhalar las arthroconidia, que constituyen una etapa en la metamorfosis de estos hongos, y que se encuentran dispersas por el aire en las zonas donde éste está presente.
Su incidencia en las personas con VIH: La infección por el Coccidioides immitis puede ocasionar síntomas de importancia en el sistema respiratorio, particularmente en los pulmones, en las personas con un conteo de CD4 bajo (menor de 150). En casos muy avanzados, puede llegar a afectar al cerebro y al sistema nervioso en general, produciendo meningitis.
Síntomas de la coccidiomicosis y cómo afecta al organismo: Los síntomas suelen ser poco específicos, incluyen malestar general, pérdida de peso, fatiga y tos. Aproximadamente el 45% de las personas con coccidiomicosis sufren de infección retículo-nodular en los pulmones, un 35% presentan infección pulmonar focalizada y un 15% llegan a ver afectados otros órganos del cuerpo (especialmente las personas con menos de 100 CD4) tales como: riñones, bazo, sistema linfático, cerebro y glándula tiroides.
¿Cómo se diagnostica? Por medio de un examen del esputo o por cultivo de muestras de los pulmones obtenidas por broncoscopia. También se pueden utilizar pruebas serológicas de anticuerpos específicos para el C. immitis. Existe un test de sensibilidad en la piel (similar a los de la tuberculosis) utilizando una sustancia producida por el C. immitis: la coccidioidina (un tipo de proteína), que se suele utilizar en zonas con problemas endémicos de coccidiomicosis, pero que no tiene valor como método de predecir si se ha producido o no una infección, por lo cual, se desaconseja utilizarlo como único marcador para saber si hay o no una infección establecida.
Tratamiento de la coccidiomicosis: El tratamiento estándar es la amphotericina B (0,5 mg por cada kilo de peso de la persona una vez al día, por vía intravenosa). También se utiliza con frecuencia el fluconazol oral (400 mg diarios) como tratamiento. El itraconazol ha sido utilizado con éxito en personas sin VIH y se están realizando estudios comparativos de itraconazol con fluconazol para las personas con VIH.
Profilaxis: Se han llevado a cabo estudios con fluconazol (200 mg diarios) como profilaxis, pero los resultados han sido más bien poco importantes. Se aconseja evitar desplazarse a zonas en las que se conozca la presencia endémica o crónica de coccidiomicosis.
Meningitis por criptococos:
Agente causante: El Criptococo neoformans es un hongo con forma de levadura que se encuentra en casi todo el Mundo, en especial en los suelos contaminados con excrementos de aves.
Cómo se inicia: La meningitis por criptococo se instala inicialmente en el cerebro, y también en los pulmones. En los estadíos avanzados de la infección, ésta puede afectar a casi cualquier órgano del cuerpo.
Su incidencia en las personas con VIH: En las personas con VIH el curso de esta infección es acelerado y, si la persona no ha estado nunca bajo tratamiento antirretroviral contra el VIH y tiene un alto grado de deterioro del sistema inmunitario, la curación o el control de la infección por Criptococo neoformans con los tratamientos disponibles actualmente puede no ser fácil de alcanzar debido a que, en estas condiciones, se da un alto grado de fallos en la eficacia de las terapias.
Síntomas de la meningitis por criptococos y cómo afecta al organismo: Los síntomas más comunes son fatiga, fiebre, dolor de cabeza, nausea, pérdida de conocimiento y alteraciones neurológicas; así como infección pulmonar, que puede determinarse como neumonitis intersticial y lobular (inflamación de las estructuras internas del pulmón) y efusión pleural, que se manifiesta con dolor o incomodidad al respirar. No obstante, la infección pulmonar puede ser asintomática. En la evolución tardía, la fiebre puede ser alta y los ataques pueden conllevar la muerte.
¿Cómo se diagnostica? Por cultivo de muestra, por detección de antígenos del Criptococo en la sangre y por examen del líquido cefalorraquídeo (punción lumbar).
Algunas consideraciones particulares: Si se dan síntomas tales como letargo, sensación de confusión o inclusive el coma, esto puede indicar, en los casos en los que aún no se ha recibido tratamiento para la meningitis, un progreso acelerado hacia la muerte. Igualmente, anormalidades en la visión, tener menos de 35 años y no estar bajo terapia antirretroviral para el VIH son factores que inciden en el riesgo de una progresión muy rápida de la infección por Criptococo.
Tratamiento de las meningitis por criptococos: El tratamiento más utilizado dura dos semanas y consiste en aplicar amfotericina B (0,7 mg por kilo de peso, una vez al día, intravenoso) y flucytosine (25 mg por kilo y día), seguido además, por fluconazol oral (200 a 400 mg por día). Otras sustancias consideradas en los ensayos clínicos más recientes son la amfotericina B, el complejo lípido (ABLC) y el itraconazol como alternativa al fluconazol.
Tratamientos de mantenimiento a largo plazo: Estos son necesarios para evitar o retrasar la recurrencia o la reaparición de la infección por Criptococo neoformans. Para estas terapias de mantenimiento se ha demostrado que el fluconazol se muestra más eficaz que la amfotericina y que el itraconazol aunque éstos pueden ser alternativas en determinadas circunstancias.
Profilaxis de la meningitis por Criptococo: Las indicaciones de los CDC hablan de utilizar la terapia con fluconazol en adultos y adolescentes con menos de 50 CD4, en una dosis de 200 mg por día. Aunque también, debido a la poca frecuencia de las criptococosis en las personas con VIH, y a la posible aparición de resistencias, no se recomienda esta profilaxis como norma general, sino sólo en determinados casos. No hay que olvidar que el fluconazol es útil en el tratamiento de otras infecciones oportunistas más probables y que si se aplica indiscriminadamente o de modo poco adecuado, se podrían crear resistencias que dificulten su aplicación posterior o para tratar otra infección que no sea la criptococosis.
Histoplasmosis:
Agente causante: El Histoplasma capsulatum es un hongo endémico en el sur de los Estados Unidos y en Sudamérica, y se encuentra normalmente en la tierra con excrementos de aves o con restos en descomposición de otros tipos de material orgánico.
Cómo se inicia: Las esporas del hongo entran en el cuerpo por inhalación, a través de las vías respiratorias y se asientan en los pulmones, en el tracto gastrointestinal y en la piel.
Su incidencia en las personas con VIH: Las personas con menos de 100 CD4 son especialmente susceptibles a esta infección, sobre todo en las zonas geográficas en las que este hongo es endémico.
Síntomas y cómo afecta al organismo: Fiebre, pérdida de peso, lesiones ulcerativas en la piel, dificultades respiratorias, anemia e inflamación del hígado, el bazo, y los nódulos linfáticos.
¿Cómo se diagnostica? Por medio de cultivos de sangre o muestras de la médula ósea, así como por medio de biopsias de los tejidos afectados o por medio de la detección de antígenos al Histoplasma capsularum en la orina, el plasma, el líquido cefalorraquídeo o en una muestra obtenida por broncoscopia. El seguimiento de los niveles de antígenos en la sangre puede ser útil como medio para monitorizar la eficacia de una terapia y predecir si la infección puede rebrotar. Cabe comentar que las pruebas de antígenos para el Histoplasma capsularum son de difícil acceso fuera de los Estados Unidos, aunque cada vez son más los centros que la realizan.
Tratamiento de la histoplasmosis: La amfotericina B intravenosa y el itraconazol oral son las sustancias aprobadas para el tratamiento de la histoplasmosis. Se requiere, además, de un tratamiento de mantenimiento a largo plazo para prevenir el rebrote de la infección o una diseminación después de un brote inicial. Debido a que el itraconazol puede ser absorbido de modo distinto por cada persona, con el objeto de garantizar la efectividad del tratamiento se recomienda monitorizar los niveles en sangre de esta sustancia de dos a cuatro horas después de cada dosis durante la segunda semana entera y, después, del mismo modo, una vez cada tres meses. Los niveles óptimos de itraconazol a alcanzar en la sangre deben ser de 2 microgramos por mililitro de sangre durante el tratamiento inicial y de 1 microgramo por mililitro de sangre durante la terapia de mantenimiento. Otra sustancia alternativa es el fluconazol, aunque resulta menos eficaz que la amfotericina y que el itraconazol, esto es especialmente importante en el caso de las personas con problemas de absorción de itraconazol o con resistencias a esta sustancia.
Profilaxis de la histoplasmosis: El itraconazol en dosis próximas a los 200 mg diarios reduce la posibilidad de padecer histoplasmosis en personas con menos de 150 CD4. Del mismo modo que en el resto de las infecciones por hongos, conviene evitar el contacto con excrementos de animales (especialmente aves), materia orgánica en descomposición y tomar precauciones si se vive en zonas con presencia endémica de estos microorganismos.
3- Infecciones provocadas por protozoos:
Criptosporidiosis:
Agente causante: El agente causante es el Cryptosporidium parvum, que es un protozoo (animal unicelular) que parasita al ser humano y a los animales.
Cómo se inicia: La criptosporidiosis es una infección que afecta fundamentalmente al tracto gastrointestinal. La infección se produce a través del contacto oral-fecal. Esto es, a través de la ingestión de agua o alimentos contaminados con residuos fecales o por medio del contacto con residuos fecales de animales o por el contacto con la boca o la saliva de los mismos. En algunas ciudades si las aguas de la red de distribución se ven contaminadas con aguas fecales, se puede producir un foco de esta infección. Este hecho es habitual en ocasiones en las grandes ciudades de todos los países (en Europa ha sucedido en Londres, por ejemplo); por lo cual, hay que tener en cuenta también la calidad y la procedencia del agua de consumo diario.
Cómo afecta a las personas con VIH: Es una enfermedad de curso leve o moderado. Su intensidad, duración y la posibilidad de que se repita aún después de haber sido tratada está relacionada con el estado de la infección por VIH. En personas con más de 250 CD4 es frecuente a veces una desaparición espontánea. En personas con menos de 100 CD4 la enfermedad puede ser moderada y, en algunos casos grave. Sólo en algunos casos de personas con menos de 50 CD4 se ha observado una evolución grave o fulminante de esta infección.
Síntomas de la criptosporidiosis y cómo afecta al organismo: Los síntomas más frecuentes son diarrea acuosa, gases y dolores abdominales, pérdida de peso, pérdida del apetito y malestar general. Si la enfermedad se agrava, la persona puede llegar a morir por deshidratación y falta de sales, azúcares y nutrientes esenciales.
Cómo se diagnostica: La criptosporidiosis puede diagnosticarse por cultivo de las heces (coprocultivo) o por biopsia intestinal.
Tratamiento de la criptosporidiosis: No existe un tratamiento estándar para esta infección. Se recomienda el uso de azitromicina en dosis que van de 800 a 1800 mg por día durante períodos que abarcan de 2 a 4 semanas. El fin o la continuación del tratamiento dependen de los resultados de nuevas analíticas de las heces o de los intestinos que permitan comprobar si ha desaparecido o no el parásito o sus huevos. Otras sustancias que están actualmente en fase de estudio son la paromomicina, el letrazuril, la nitazoxanida, la claritromicina y la roxitromicina.
Profilaxis: La mejor profilaxis es asegurarse de la buena calidad del agua de consumo, lavar muy bien todos los alimentos, en particular los vegetales, evitar alimentos como la leche fresca recién ordeñada y evitar en lo posible el contacto con los residuos fecales y de comidas de los animales, en particular de los animales domésticos.
Isosporiasis:
Agente causante: El agente causante es un protozoario parásito que se encuentra comúnmente en zonas de clima tropical o subtropical (en España: Canarias, Ceuta, Melilla y la Costa del Sol). Su nombre es Isosopora belli.
Cómo se inicia la infección: La infección se produce por contacto con alimentos contaminados, agua contaminada o residuos fecales. El sitio de infección en el organismo es el intestino.
Cómo afecta a las personas con VIH: Al igual que otras infecciones causadas por protozoos, su evolución es más rápida y sus síntomas más acusados en las personas con VIH.
Síntomas y cómo afecta al organismo: Los síntomas son: diarrea no líquida, sin inflamación del abdomen, molestias en el abdomen y pérdida de peso. En general, los síntomas son muy similares a los de una criptosporidiosis.
Cómo se diagnostica: Fundamentalmente a través del análisis de las heces.
Tratamiento de la Isosporidiasis: El tratamiento oral con TMP/SMX (trimetoprim/sulfametoxazol) es eficaz en la mayoría de los casos. Las personas que no toleran las sulfonamidas (sulfamidas) pueden tener una opción terapéutica en el uso de la pirimetamina, utilizada en combinación con la leucovorina.
Profilaxis: Similar a la de la criptosporidiosis.
Microsporidiasis:
Agente causal: Las personas con VIH pueden verse infectadas por muchas clases de microsporidia. El más frecuente es el Enterocytozoon bieneusi (que afecta al sistema digestivo). Otros tipos son el Encephalitozoon hellem (que afecta principalmente al cerebro) y una especie recientemente identificada que, sin embargo, ya se ha encontrado en personas con VIH: Septata intestinalis (que afecta principalmente a los intestinos)
Cómo se inicia: La infección suele instalarse primero en los intestinos y luego se disemina hacia otras zonas del cuerpo, como los senos nasales y craneales. Los gérmenes patógenos suelen encontrarse en agua y alimentos contaminados, como es el caso de otras infecciones por protozoarios.
Cómo afecta a las personas con VIH: Fundamentalmente diseminándose a varias zonas del cuerpo. En algunos casos se ha relacionado la infección por microsporidia con casos de congestión e inflamación de la vesícula biliar y con otras molestias en el hígado de las personas con VIH. A este síndrome se le denomina Colangitis Relacionada con el Sida. En estadíos medios o avanzados de SIDA, hasta un 25% de las personas pueden estar infectadas por algunos de los protozoos de la familia microsporidia.
Síntomas y Cómo afecta al organismo: El E. bieneusi se encuentra fundamentalmente en los intestinos, aunque se han dado casos en los cuales está relacionado con algunos tipos de sinusitis. Los otros tres tipos de microsporidia se encuentran relacionados con síntomas diseminados por todo el cuerpo e intervienen particularmente en algunos casos de sinusitis y de problemas de infección de las mucosas que protegen al ojo. Los síntomas más característicos son diarreas y pérdida de peso. En cualquier caso, también es posible estar infectado por microsporidia y no presentar dichos síntomas. En las personas que presenten sinusitis o cualquier alteración de la mucosa de la nariz y de los senos nasales y craneales se debe siempre sospechar la presencia de microsporidia, por lo cual se recomienda hacer las analíticas de despistaje.
Cómo se diagnostica: El diagnóstico de las diferentes formas de criptosporidia es fácil y rápido ya que se puede detectar en muestras de heces, secreción nasal u orina.
Tratamiento de la mircrosporidiosis: No existe un tratamiento estándar. Se recomienda un tratamiento con albendazole (400 mg dos veces al día durante 4 a 6 semanas). Se observa una remisión de los síntomas aunque no una desaparición de la infección. No obstante, en una parte importante de las personas tratadas el albendazol produce cambios degenerativos en los microsporidia que dificultan o atenúan futuros rebrotes. Otra sustancia que está actualmente en fase de estudio es el metronidazol. Su uso en dosis de 500 mg diarios mejoraron los síntomas en las personas tratadas, pero el parásito permanecía inalterado a pesar de la buena respuesta sintomatológica al tratamiento. Se están haciendo igualmente estudios con talidomida de los cuales aún hay pocos resultados que indican, no obstante, que no aporta beneficios superiores a los del albendazol.
Profilaxis: Similar a la de otras infecciones por protozoarios.
Neumonía: Penumonia por Pneumocystis Carinii. (PCP)
Agente causal: El agente causal es el Pneumocystis Carinii. En general se le considera un protozoario parásito, aunque algunos estudios lo clasifican como un hongo. El hecho es que comparte características genéticas de ambos. El PC se transmite fundamentalmente por vía aérea entre personas.
Cómo se inicia: El PC es un germen que puede infectar los pulmones, los ojos, los oídos, la piel, el hígado y otros órganos del cuerpo. No obstante, incide fundamentalmente en los pulmones. El organismo probablemente infecta a la mayoría de las personas durante la infancia, pero normalmente no ocasiona complicaciones en las personas sin VIH.
Cómo afecta a las personas con VIH: Debido a que el microorganismo permanece en el cuerpo toda la vida, puede ocasionar problemas en cualquier momento si el sistema inmunitario está dañado, como en el caso de las personas con VIH. La mayor propensión de padecer una PCP por PC en las personas con VIH se da cuando su número de CD4 es inferior a 200. Si la persona con VIH no toma profilaxis en el momento adecuado, tiene altas probabilidades de padecer una PCP. En aquellos casos en los que la PCP alcanza un curso grave, en personas con un estado de SIDA muy avanzado, puede ser mortal.
Síntomas y cómo afecta al organismo: Los síntomas respiratorios de la neumonía por PC consisten en tos seca, dificultad respiratoria, presión en el pecho y fiebre (esto último no en todos los casos). Las personas afectadas por PCP pueden padecer de fatigas y pérdida de peso y, en ocasiones, fiebre, durante semanas o meses antes de tener los síntomas respiratorios. Si la persona no recibe tratamiento a tiempo, la PCP puede afectar gravemente la capacidad de los pulmones para oxigenar la sangre, lo cual podría conllevar la muerte.
Cómo se diagnostica: Se puede diagnosticar examinando una muestra de esputo o expectoración, por medio de una biopsia pulmonar, por análisis de los restos de un lavado broncoalveolar o por medio de una radiografía del tórax para determinar si hay signos de daño en los pulmones.
Tratamiento de la Pneumonía por PC:
En la fase aguda: al inicio de la infección y cuando los síntomas son importantes: La terapia estándar se basa en la combinación de TMP/SMX (trimetoprim/sulfametoxazol) en dosis de 75 mg por kilo de peso por día, por vía oral o intravenosa durante 21 días. Otras alternativas son la pentamidina intravenosa (3 a 4 mg por kilo de peso por día durante 2 a 3 semanas), la clindamicina con primaquina (600 mg intravenoso cada 8 horas de clindamicina y 15 mg de primaquina diariamente durante 21 días) o bien atovacuona (750 mg en jarabe dos veces al día durante 21 días). Finalmente, también se puede considerar el uso de trimetrexate con leucovorina (45 mg de trimetrexate intravenoso y 20 mg de leucovorin oral diariamente - las cantidades son por metro cuadrado de superficie afectada, por lo cual pueden ser menores o mayores según la extensión de las lesiones producidas por el PC-).
El tratamiento con TMP/SMX puede ocasionar efectos secundarios tales como erupciones en la piel, disminución del número de glóbulos rojos o blancos en la sangre, náusea, vómitos o deterioro en el funcionamiento de los riñones. Estos efectos tienden a atenuarse con el paso de los días y siempre desaparecen cuando se termina de tomar el tratamiento. En cuanto a la pentamidina, produce efectos similares y altera el funcionamiento del páncreas, lo que conlleva alteración en los niveles de azúcar en la sangre. Si se la toma durante períodos prolongados, puede alterar el funcionamiento del páncreas de modo permanente.
Tratamiento de mantenimiento: La mayoría de las personas con VIH/SIDA podría sufrir otro ataque de pneumonía si no siguen tomando medicación para prevenir su reaparición. Este uso continuado de la medicación es lo que se conoce como terapia de mantenimiento. Las dosis de mantenimiento son menores que las utilizadas en la fase aguda. La recomendación estándar es tomar la combinación TMP/SMX (trimetoprim/sulfametoxazol) (Bactrim y Septra - Septrim en algunos países-) de por vida. En el caso de las personas que no pueden tolerar el tratamiento con TMP/SMX, existe la alternativa de la pentamidina en aerosol que debe inhalarse una vez al mes. En el caso de que tampoco se pueda tolerar la pentamidina en aerosol, existen aún otras alternativas como la dapsona, la pirimetamina - sulfadoxina (Fansidar) o la pentamidina intravenosa, aunque la efectividad de estas últimas se presupone menor.
Profilaxis de la PCP:
En adultos: Cuando el nivel de CD4 se aproxima a los 250, tanto el médico como la persona afectada deben comenzar a evaluar la posibilidad de iniciar la profilaxis de la PCP. Si el número de CD4 es igual o menor a 200, es muy importante comenzar con el tratamiento. En niveles entre los 200 y los 100 CD4 la dapsona, la pentamidina y el TMP/SMX son aproximadamente igual de eficaces, así que la elección se hará en función de su tolerancia y facilidad de toma para la persona en tratamiento. En niveles inferiores a 100 CD4 la dapsona y la combinación TMP/SMX se mostraron más eficaces que otras sustancias.
En niños: Como los niños tienen normalmente un número mayor de CD4 que los adultos para un mismo estadío del VIH (debido a que es durante la infancia cuando estas células maduran y se especializan), los niveles de CD4 utilizados para evaluar el inicio y el tipo de tratamiento de profilaxis deben ir cambiando con la edad. Concretamente, se recomienda la profilaxis en los niños VIH de entre 1 y 11 meses de edad cuando el nivel de CD4 es menor de 1.500, en niños de entre 1 año y 5 años cuando los CD4 caen por debajo de 1.100 y en niños de 6 años o más, cuando los CD4 son menos de 500.
Toxoplasmosis:
Agente causal: El Toxoplasma gondii es el agente causante de la Toxoplasmosis. Se trata de un protozoario y es uno de los principales responsables de las infecciones en el sistema nervioso a lo largo de todo el planeta.
Cómo se inicia: La infección se produce por vía oral, a través de la ingestión de carne cruda o no bien cocinada (particularmente carne de cerdo y liebre), así como huevos y otros alimentos sin cocinar. Igualmente, se produce por el contacto con los excrementos de los gatos o por la tierra contaminada con los excrementos de estos animales. Otros animales como las aves de corral también pueden ser transmisores. El Toxoplasma gondii puede infectar los pulmones, la retina, el corazón, el páncreas, el hígado, el colon y los testículos.
Su incidencia en las personas con VIH: Una vez que el parásito invade el cuerpo, permanece en él. Pero en una persona con el sistema inmunitario sano, no causa mayores problemas. En una persona con VIH y con el sistema inmunitario afectado, el Toxoplasma puede reproducirse rápidamente y volverse agresivo. El cerebro resulta, en este caso, el órgano más afectado. Cuando eso se produce, ocurre una inflamación en el tejido cerebral que se conoce con el nombre de encefalitis toxoplásmica. El riesgo de desarrollar síntomas de toxoplasmosis se incrementa notablemente en las personas con VIH, infectadas por el Toxoplasma gondii y con menos de 75 CD4.
Síntomas de la toxoplasmosis y cómo afecta al organismo: Los síntomas más frecuentes son dolor de cabeza, sensación de confusión y fiebre. El dolor de cabeza es intenso y no mejora con analgésicos. Pueden darse además convulsiones si la fiebre es alta, problemas de visión y dificultad para hablar y caminar. En una fase avanzada aparecen problemas para poner atención a las cosas y cambios de personalidad. También puede producirse náuseas, mareos y vómitos.
Cómo se diagnostica: La infección por Toxoplasma gondii es difícil de diagnosticar, especialmente porque no todas las personas muestran síntomas. Normalmente, cuando se producen síntomas, se realiza una Tomografía Axial Computerizada (TAC) o una Resonancia Magnética del cerebro para ver si existe alguna alteración. Aún así, si no se detectan señales claras, se recomienda de todos modos iniciar un tratamiento (llamado de presunción). En muchas ocasiones, una respuesta positiva a este tratamiento es tomada como un signo de diagnóstico para la toxoplasmosis.
Tratamiento de la toxoplasmosis: En la fase inicial o aguda el tratamiento de choque estándar es la combinación de pirimetamina con sulfadiacina. La principal desventaja de este tratamiento es que tiene efectos secundarios importantes, que pueden aparecer hasta en un 40% de las personas. En este caso, una alternativa también eficaz y más fácil de tolerar es la combinación de clindamicina y pirimetamina. Usualmente se da también ácido folínico que ayuda a disminuir los efectos adversos de estas terapias.
Una vez que se aplica el tratamiento de choque, viene una fase de mantenimiento para evitar el rebrote de la toxoplasmosis. Estos tratamientos de mantenimiento deben seguirse de por vida, se utiliza la combinación de pirimetamina con sulfadiacina, en dosis menores que en el tratamiento inicial. En caso de intolerancia de la sulfadiacina, ésta puede sustituirse por la clindamicina.
Profilaxis de la Toxoplasmosis: La profilaxis comienza por evitar comer carnes o alimentos crudos o mal cocinados, evitar el contacto con la tierra y abonos de origen animal, evitar el contacto con los excrementos de los gatos y de las aves de corral. En general, las siguientes recomendaciones son útiles: Usar guantes cuando se trabaja en el jardín o en otros lugares con tierra o arena. Evitar comer carne cruda o poco cocinada y lavarse bien las manos después de tocar carne o vegetales crudos. Usar guantes y una mascarilla en la boca a la hora de limpiar las cajas de arena que se emplean para los desperdicios de los gatos o, preferentemente, pedir a otra persona que lo haga. Las cajas de desperdicios de los gatos deben ser limpiadas con frecuencia para reducir el riesgo de Toxoplasmosis. En las personas con menos de 150 CD4 se recomienda iniciar un tratamiento con trimetoprim y sulfametoxazol (TMP/SMX). Igualmente, la combinación de pirimetamina y dapsona parece ser eficaz. Otras posibilidades son la leucovorina en combinación con la pirimetamina, y la pentamidina en aerosol combinada con la dapsona.
4-Infecciones provocadas por virus:
Infección por Citomegalovirus:
Agente causante: El agente causante es el Citomegalovirus (CMV). Pertenece a la familia de los herpesvirus y se puede decir que, en la mayoría de los países, entre el 60% y el 90% de la población está infectada. El virus entra en el organismo por causa de un contacto directo entre mucosas o a través de transplantes de tejidos (piel, córnea, órganos enteros, etc.) o por una transfusión de sangre o plasma.
Cómo se inicia: El CMV al entrar en el organismo se instala en la retina, el colon y el esófago. También puede localizarse en los pulmones, el cerebro, el corazón, el timo, el páncreas, la laringe, la tiroides, los riñones, la vesícula biliar, el hígado y las glándulas suprarrenales.
Cómo afecta a las personas con VIH: En las personas sin VIH el CMV no suele ocasionar mayores problemas. En las personas con VIH, en cambio, el CMV puede ocasionar daños graves en la retina, en el cerebro y en aparato digestivo. El riesgo de verse afectados por el desarrollo de síntomas aumenta según disminuye el número de CD4. Habitualmente, la retinitis por CMV y las afecciones gástricas y neurológicas suelen manifestarse en fases avanzadas de SIDA, cuando el sistema inmunitario está muy deteriorado.
Síntomas de la Infección por Citomegalovirus y cómo afecta al organismo:
Retinitis por CMV: La infección por CMV en la retina (la parte del ojo sensible a la luz y que permite la visión) produce hemorragias y pus en ciertas áreas de la misma. Estos daños pueden limitar la visión y, si son extensos, pueden llegar a producir ceguera. Las primeras señales de una posible retinitis por CMV es la presencia de "flotadores", que son unas partículas oscuras que flotan delante de la retina como "manchas ante los ojos" y que dificultan la visión. También puede producirse visión borrosa y pérdida de la visión periférica. En algunos casos se puede producir dolor por detrás del ojo. Desde el exterior, se ve como una nube en el interior del ojo y se puede apreciar una ligera inflamación del humor vítreo (el líquido que rellena una de las cavidades del ojo).
Encefalitis por CMV: En general, el CMV no suele ocasionar problemas neurológicos. Sin embargo, se han observado casos de encefalitis (inflamación del tejido cerebral). Los síntomas suelen ser fiebre, dolor de cabeza y sensación de confusión.
Esofaguitis por CMV: Consiste en la inflamación del esófago (el conducto por el que los alimentos pasan de la garganta al estómago) Es también un problema poco frecuente. Sus síntomas son dificultad o dolor al tragar, sensación de dificultad para que la comida baje por la garganta y, en ocasiones, ataques de hipo y dolor en el pecho.
Colitis por CMV: Esta afección se da con frecuencia en estados avanzados de CMV, entre sus síntomas se cuentan diarreas persistentes, dolor abdominal, pérdida de peso, pérdida del control del esfínter rectal y deterioro de la salud en general.
Gastritis por CMV: Esta afección consiste en irritación y molestias en el estómago. Los síntomas pueden ser leves e, incluso, pasar desapercibidos. Sin embargo, en ocasiones, puede producir síntomas severos, tales como dolor abdominal en la zona del estómago, fiebre, hemorragias y diarreas.
Radiculopatía por CMV: Esta alteración se refiere a la inflamación o alteración de los nervios radiales que salen de la médula espinal para servir a los miembros inferiores (muslos, piernas y pies). Los síntomas son similares a los de una neuropatía periférica, concretamente: insensibilidad en las piernas, hormigueo y, en ocasiones, dolor. Además de esto, también pueden producirse problemas de incontinencia urinaria o rectal.
Cómo se diagnostica el CMV: Un oftalmólogo experimentado puede diagnosticar la retinitis causada por CMV cuando detecta el patrón característico de la infección en la retina en un examen rutinario de los ojos. Por ello, es fundamental que, según el estado de la infección por VIH/SIDA de la persona, el médico haga exámenes rutinarios de fondo de ojo, con el fin de advertir si hay o no signos de CMV. La encefalitis por CMV puede detectarse por medio de una biopsia de tejido cerebral o por medio de la detección del CMV en el líquido cefalorraquídeo (haciendo una punción lumbar). Para los demás casos de CMV se hace necesario tomar una muestra de tejido afectado y hacer un cultivo.
Tratamiento de la infección por CMV:
Retinitis por CMV. Tratamiento inicial: El tratamiento inicial es sistémico, es decir, que se aplica en todo el organismo a través de la sangre. El estándar es ganciclovir intravenoso (5 mg por kilo de peso dos veces al día), o bien foscarnet intravenoso (90 mg por kilo de peso dos veces al día) o bien cidofovir intravenoso (5 mg por kilo de peso una vez a la semana). Una vez que se ha completado la fase inicial con este tipo de tratamientos, se pasa a un tratamiento de mantenimiento de por vida, con dosis menores de las mismas sustancias. En algunos casos, se pueden combinar dos de estas sustancias para reforzar la eficacia del tratamiento. Principalmente ganciclovir y foscarnet.
El foscarnet y el ganciclovir son prácticamente equivalentes en los referente al control de la retinitis por CMV, si bien el foscarnet tiene una cierta actividad en contra del VIH que puede aportar beneficios adicionales a las personas en fases avanzadas de SIDA. El cidofovir, que es un análogo de nucleótido derivado de la citosina, al igual que el foscarnet tiene una cierta actividad en contra del VIH y tiene un tiempo de vida en las células bastante largo (por eso se lo administra una vez a la semana) El cidofovir debe ser dado junto con probenecida (4.000 mg cada vez que se administre el cidofovir) para disminuir el riesgo de toxcicidad en los riñones. Existe una formulación oral de ganciclovir que es menos eficaz que la intravenosa, pero que puede ser útil en la fase de prevención.
Para la retinitis por CMV también, aparte del tratamiento sistémico, se puede utilizar un tratamiento localizado. Este consiste en colocar un implante intraocular (dentro del ojo) de ganciclovir, que resulta más eficaz como tratamiento de choque en casos graves que la vía intravenosa. También se está estudiando la posibilidad de utilizar una inyección de cidovofir en el interior del ojo (intravítrea, dentro del humor vítreo), algunos estudios sugieren que con una sola inyección se puede controlar o retrasar la retinitis durante más de tres meses. Los estudios que están en marcha estipulan un tratamiento con una inyección una vez a la semana durante cuatro semanas y después un mantenimiento con una inyección cada dos semanas. El cidofovir, como en el caso de la administración intravenosa, debe ser tomado con probenecida. Algunos de los efectos secundarios de este tratamiento incluyen pérdida temporal de la visión en colores y ligeras inflamaciones del humor vítreo.
Hay nuevas sustancias en desarrollo como el adefovir que tienen efectos anti-VIH y que se están estudiando también como combinación con los antirretrovirales.
Gastritis por CMV: El tratamiento es básicamente similar que en el caso anterior.
Encefalitis y Radiculitis por CMV: El tratamiento de choque consiste en tres semanas con ganciclovir intravenoso en las dosis habituales.
El tratamiento Pediátrico: Actualmente se recomienda un tratamiento inicial con una inyección intravenosa de ganciclovir, que puede continuarse del mismo modo, o bien con la formulación oral, sea en forma de jarabe o de comprimidos. Todo esto está en estudio para determinar si el jarabe es tan eficaz como las píldoras y, en función de ello, establecer unos criterios estándar.
Tratamiento de mantenimiento: Una vez que se pasa la fase de tratamiento inicial o de choque, es preciso llevar un tratamiento de mantenimiento de por vida. El ganciclovir (5 mg por kilo intravenoso una vez al día) el foscarnet (90mg por kilo intravenoso una vez al día) y el cidofovir (5mg por kilo intravenoso cada dos semanas) han sido aprobados como estándar en la terapia de mantenimiento. Igualmente, el ganciclovir oral forma parte del estándar como terapia de mantenimiento (1000 mg tres veces al día) después de una terapia inicial con ganciclovir intravenoso y foscarnet intravenoso.
Resistencias a los tratamientos: En un 10% de los casos se ha observado resistencias al ganciclovir. Si la formulación es oral, las resistencias son menores. Muchas de las cepas del CMV resistentes al ganciclovir son susceptibles a los efectos del foscarnet, por lo cual éste es una buena alternativa en los casos de resistencias e intolerancias.
Profilaxis de la infección por CMV: Cuando el nivel de CD4 desciende por debajo de los 250, es recomendable hacerse una revisión de fondo de ojo al menos tres veces al año. Es un procedimiento muy sencillo. El estándar de profilaxis es el ganciclovir oral. Se recomienda iniciar su administración en un punto entre los 150 y los 100 CD4 en dosis próximas a los 1000 mg tres veces al día. Otras sustancias son el valaciclovir, que se ha mostrado moderadamente efectivo en la prevención de la retinitis por CMV en dosis de 800 mg diariamente. El acyclovir es una sustancia que se ha estado probando en combinación con antirretrovirales para el VIH como método de prevención del CMV, pero con resultados poco claros, en cambio, de este modo, sí que tiene un cierto efecto anti-VIH.
Hepatitis:
Agente causante: La familia de los virus de la hepatitis comprende hasta diez suptipos conocidos. Aunque los que están implicados en este padecimiento son concretamente, los virus del tipo A, B, C, D (delta) y G (No A, No B, No C).
Los distintos tipos de hepatitis:
Hepatitis A: La mayoría de los casos de hepatitis A no presentan síntomas apreciables. Una persona podría pasar el proceso de esta infección sin darse cuenta. Sus efectos son bastante leves y no se relaciona al virus tipo A con hepatitis crónicas ni con cirrosis. Se transmite principalmente a través del contacto de la boca con agua, alimentos, objetos contaminados por residuos fecales.
Hepatitis B: Más del 84% de las personas con VIH tiene anticuerpos a la hepatitis B ya que en algún momento ha estado en contacto con el virus tipo B. Esta alta tasa de infección por hepatitis B en las personas con VIH se explica porque el virus tipo B de la hepatitis y el VIH tienen las mismas vías de transmisión, esto es, a través de las relaciones sexuales, o por medio de transfusiones de sangre y hemoderivados, así como por el contacto con fluidos infectados (común en los profesionales sanitarios). Aunque algunos estudios sugieren que la presencia de la hepatitis B contribuye a acelerar la infección por VIH, lo cierto es que no hay evidencia clara de ello y, en la mayoría de los casos, no se ha podido comprobar.
Hepatitis C: La incidencia de la hepatitis C en las personas con VIH, particularmente las que se han infectado por la vía sangre/sangre: compartición de jeringuillas o recepción de transfusiones y hemoderivados, se incrementa día a día en todos los países, y en Europa, particularmente, en España, Francia e Italia. Aunque es rara la transmisión del tipo C del virus de la hepatitis por vía sexual, muchos estudios sugieren que la presencia del VIH puede ser un factor que facilite la entrada del virus C en el organismo a través de las mucosas. No se ha podido demostrar que la presencia del virus C de la hepatitis acelere la infección por VIH, en cambio, sí se sabe que el VIH puede acelerar el proceso de la infección de la hepatitis C, conduciendo mucho más rápidamente a una cirrosis.
Hepatitis D (delta): El virus tipo D sólo puede reproducirse en el organismo si está también presente el virus de tipo B. Lo que ocurre habitualmente es que la persona adquiere el virus D al mismo tiempo que el virus B o en un proceso de reinfecciones de distintas cepas del virus B. La infección por el virus D conduce a un tipo de hepatitis muy activa y agresiva, que se desarrolla rápidamente y que, en ocasiones, puede ser fulminante.
Hepatitis G (No A, No B, No C): En realidad incluye a varios subtipos del virus de la hepatitis responsables de la mayoría de los casos de hepatitis difusas y esporádicas que no son atribuibles a ninguno de los tipos A, B, C o D.
Cómo se inicia la hepatitis: Después de un período de incubación (en el que el virus está presente en el organismo de forma inactiva) que suele durar entre 60 y 160 días, las personas con VIH que tengan el tipo B del virus de la hepatitis sufren una inflamación aguda del hígado que se caracteriza por necrosis celular difusa o en forma de pequeños nódulos. En el caso de la hepatitis C el período de incubación es más corto, unos 50 días.
Cómo afecta a las personas con VIH: El problema fundamental que plantean las hepatitis a las personas con VIH es que limitan seriamente el metabolismo de los tratamientos en contra del VIH y de las demás infecciones oportunistas. Por lo cual, dificultan o impiden la toma de medicación que puede ser fundamental para mejorar o controlar el curso de la infección por VIH y de las demás infecciones relacionadas. En cuanto al curso de la infección por VIH en sí, no está demostrado que las hepatitis contribuyan a acelerarlo, aunque sí ocurre lo contrario, particularmente, el VIH puede acelerar el curso de hepatitis como la C y la D.
Síntomas de las hepatitis y cómo afectan al organismo: Las hepatitis comprometen el funcionamiento del hígado. Si evolucionan hacia el estado de cirrosis, pueden destruir definitivamente amplias zonas de este órgano con lo cual su función se ve gravemente disminuida. El hígado es el sitio en el que se metabolizan (se separan en sus componentes más sencillos para poder ser aprovechados por el cuerpo) buena parte de los alimentos (fundamentalmente las grasas, los glícidos y muchas de las vitaminas) así como casi todas las sustancias que entran en el organismo (medicamentos, aditivos alimenticios, metales pesados, etc.). Si su rendimiento disminuye, se pueden producir intoxicaciones graves debido a la acumulación de restos no metabolizados de todas estas sustancias. Estas intoxicaciones pueden llevar a la muerte de la persona afectada.
Hepatitis B: Se manifiesta generalmente con malestar general, anorexia, fiebre, ictericia (coloración amarillenta de la piel debido a la acumulación de bilirrubina) y una ligera inflamación del bazo (esplenomegalia) En general, este periodo agudo de la infección se sigue de un periodo de recuperación y autoinmunidad en el 95% de los casos. Aproximadamente un 5% de las personas no logran eliminar el virus y se transforman en portadores crónicos. En este caso, sólo las personas con VIH o con problemas inmunitarios tienden a desarrollar una hepatitis B crónica con síntomas recurrentes. Los niveles de ADN del virus tipo B de la hepatitis en la sangre se pueden controlar y sirven como pronóstico para determinar la evolución de la infección (igual que sucede con la carga viral del VIH).
Hepatitis C: Aproximadamente un 50% de las infecciones por hepatitis C progresan hasta llegar a un estado crónico. Muchas hepatitis C son asintomáticas, aún cuando se produzca cirrosis o carcinoma hepatocelular (un tipo de cáncer de hígado), por lo cual es fundamental su detección precoz. La cirrosis o, en el peor de los casos, los carcinomas, pueden aparecer en un plazo que va de 5 a 10 años después de la infección. Como se ha comentado antes, la presencia del VIH puede contribuir a empeorar y acelerar el proceso de la hepatitis C.
Cómo se diagnostican las hepatitis: Si se observan niveles elevados en la sangre de las enzimas de la bilis (transaminasas) y presencia de bilirrubina (bilis) en la orina, es casi seguro que existe un proceso inflamatorio en el hígado. En este punto, este proceso puede deberse a la acción de alguna sustancia: medicamento o alimento, o bien a la presencia de una hepatitis viral.
En el caso de la hepatitis B, el antígeno de superficie de este virus (antígeno a la parte superficial del virus, no al virus completo) se puede detectar en la sangre y es la primera indicación de una infección aguda (inicial) de hepatitis B. Una vez que se ha pasado la infección, en los casos - la mayoría- en los que la persona logra curarse, quedan los anticuerpos al virus tipo B en la sangre para toda la vida. Así, detectar esos anticuerpos al virus entero, significa que se ha producido la curación de la enfermedad y que se ha desarrollado inmunidad ante la misma. En cambio, si no se observan los anticuerpos completos, quiere decir que la infección no se ha curado y que se está transformando o se ha transformado en un proceso crónico.
En el caso de la hepatitis C, existen pruebas serológicas (en la sangre) desde el año 1989. No obstante, los antígenos pueden tardar muchos meses en aparecer en la sangre desde el primer momento de la infección. Los antígenos al virus tipo C también se pueden detectar en el citoplasma (interior) de las células hepáticas, para lo cual es necesario tener una muestra del hígado mediante una punción hepática. Recientemente se han desarrollado pruebas de "carga viral" para la hepatitis C que permiten saber el número de partículas virales y predecir la evolución de la infección.
Tratamiento de las hepatitis: La sustancia utilizada como tratamiento estándar es el Alfa interferón 2b (Intrón A) en las personas sin VIH. En las personas con VIH, los estudios combinando AZT e Intrón A han mostrado respuestas menos eficaces que el uso de Intrón A en las personas sin VIH. En estos casos, cuando se dejaba el tratamiento, se producía una rápida reaparición de la hepatitis. En algunos casos de hepatitis D el tratamiento con interferón 2 A (Roferon A) se mostró eficaz hasta en un 50% de las personas.
El 3TC (Epivir, Lamivudina) que es un conocido antirretroviral para el VIH ha sido estudiado por sus efectos en contra del virus B de la hepatitis. Los resultados son buenos y éste es uno de los criterios a favor de la introducción del 3TC en la combinación de tratamiento para el VIH.
El único tratamiento establecido para el momento en el tratamiento de la hepatitis del tipo C es el interferón alfa, en un tratamiento que dura aproximadamente un año (52 semanas) (se utiliza un tratamiento similar de 16 semanas para el virus tipo B).
Recientemente se ha logrado describir la estructura tridimensional de la proteasa del virus de la hepatitis C, por lo cual cabe esperar un futuro desarrollo de inhibidores de la proteasa para el virus C.
Infección por el virus Herpes Simplex:
Agente causante: Virus del herpes simplex de los tipos 1 y 2 (HSV1 y HSV2).
Cómo se inicia: Los herpesvirus infectan principalmente los tejidos epiteliales, es decir, todas las mucosas, la piel y el tejido nervioso. Suelen transmitirse por contacto de una mucosa sana (de una persona sin herpes) con una zona afectada por el herpes de otra persona. Es frecuente la transmisión por vía sexual.
Cómo afecta a las personas con VIH: Cuando una persona con VIH se infecta por el HSV (herpes simplex virus), la presencia del HSV puede hacer que el VIH infecte a células que habitualmente no hubiera infectado, en este caso, células sin receptor CD4, como los keratinocitos, que son las células de la piel superficial. Esto es muy importante, y apoya las tesis favorables a un tratamiento agresivo de supresión del HSV en las personas con VIH.
Síntomas del herpes virus y cómo afecta al organismo: Aparte de permitir que el VIH infecte a células de otro modo inmunes a él, el herpes virus produce unas pequeñas úlceras dolorosas con inflamación en diversas zonas de la piel y en las mucosas (genitales, boca, cara)
Cómo se diagnostica: La observación de las pequeñas úlceras debe ser tenida en cuenta como un indicio de herpes. El diagnóstico concreto se establece por medio de un cultivo del virus en una muestra tomada de la zona ulcerada o por una prueba de anticuerpos por inmunofluorescencia.
Tratamiento de la infección por el HSV: El tratamiento estándar es el acyclovir oral (800 mg tres veces al día). Este tratamiento no elimina al virus del organismo, pero reduce la intensidad y duración de los síntomas.
El famciclovir y el valaciclovir se han mostrado también como tratamientos efectivos en la infección por el HSV. Aunque ninguno de los dos se ha mostrado aún más eficaz que el acyclovir.
HSV resistente al acyclovir:
Cuando se produce la resistencia al acyclovir (generalmente después de un tratamiento largo de entre 4 y 6 meses), la única alternativa efectiva es el uso de foscarnet (60 mg por kilo, intravenoso cada 8 horas). Otras alternativas son tratamientos tópicos (sobre la misma lesión) con gel de cidofovir o con foscarnet en crema. Se están realizando estudios para evaluar la idoneidad del valaciclovir.
Herpes Zóster Virus:
Agente causante: El virus Varicela-Zóster (herpes zóster virus, VZV)
Cómo se inicia: El VZV se instala en los nervios cercanos a la columna vertebral. El herpes zóster produce la aparición de una serie de úlceras o manchas dolorosas en la misma dirección en la cual están los nervios infectados (se conoce vulgarmente como culebrilla). Principalmente afecta la cara y el tronco, cerca de la cintura. Esta afección aparece periódicamente, cada vez que el virus se reactiva. La forma de entrada en el organismo es por el contacto de una mucosa sana con la zona infectada.
Cómo afecta a las personas con VIH: La enfermedad tiene un curso similar que en las personas sin VIH, pero la intensidad y los rebrotes son más frecuentes y dolorosos. En algunos casos, puede producir neuralgias muy dolorosas (dolor en la zona de los nervios inflamados) y afectar, de ese modo, la sensibilidad de los miembros inferiores (piernas).
Síntomas del Herpes Zóster: Se manifiesta en forma de la aparición de una fila o hilera de vesículas inflamadas, y que producen comezón y dolor. Estas vesículas se distribuyen siguiendo la ubicación de algún nervio sensitivo que parte de la columna vertebral. Normalmente adoptan forma de ristra o cinturón.
Como se diagnostica: El diagnóstico, aparte de la manifestación visual que es muy característica, puede confirmarse por medio de un cultivo del virus a partir de una muestra tomada de las vesículas o por detección de anticuerpos al VZV por inmunofluorescencia.
Tratamiento del Herpes Zóster: Las formas severas de Herpes Zóster pueden requerir hospitalización y tratamiento con acyclovir intravenoso u otros agentes antiherpeticos. En el caso del acyclovir, la dosis estándar es de 800 mg 5 veces al día. Otra sustancia, la sorivudina, que se ha mostrado en estudios mucho más eficaz que el acyclovir, aún no ha obtenido su aprobación en EE.UU. debido a que no se consideran suficientes los datos que se han recogido en cuanto a sus efectos a largo plazo y otros criterios de seguridad en su aplicación.
El famciclovir está siendo estudiado actualmente como posible alternativa para el tratamiento de primeros brotes de herpes en personas con VIH (el acyclovir se utilizaría para brotes subsiguientes).
En niños: Hay un estudio en curso sobre la utilidad de la vacuna de la varicela zóster con virus vivo atenuado y otro sobre la aplicación de valaciclovir.
Infección por Papilomavirus Humano: (HPV)
Descripción: Tanto en Estados Unidos como en Europa, la presencia de papilomas anales y genitales de origen viral en las personas con VIH se está incrementando de forma constante en los últimos tiempos. Diversos estudios han demostrado que las mujeres con VIH son más propensas al desarrollo de papilomas en el fondo de la vagina y en el cuello del útero que las mujeres que no tienen VIH. En algunos casos, estos papilomas pueden degenerar en carcinomas (un tipo de cáncer).
Fundamentalmente, la infección por HPV produce papilomas (zonas endurecidas, costrosas, inflamadas y dolorosas) en el ano, en el recto y en el canal rectal, en el pene, en la uretra, en la vulva, en la vagina y en el cuello del útero. Es menos frecuente la presencia de papilomas en el esófago.
Cómo se diagnostica: Un examen de la vagina, el cuello del útero, el pene, la uretra y la región perianal permite detectar las lesiones. También una anoscopia, una colposcopia (visualización del interior de la vagina con un instrumento óptico), ambas con biopsia, son herramientas comunes de diagnóstico.
Tratamiento de los papilomas: Existen dos vías, por un lado, la extirpación o desecación de los papilomas con un láser de dióxido de carbono, la crioterapia (hipercongelación), la electrocaución (quemadura controlada del papiloma con electricidad), y la cirugía. Ocasionalmente se utiliza radioterapia. Por otro lado, se puede tratar con quimioterapia sistémica o con quimioterapia local, aplicando productos tóxicos sobre las zonas afectadas, estos productos suelen ser: ácido tricloroacético, resina de podophyllum, y 5-Fluoroacil (5-FU). Se están llevando a cabo estudios con interferón alfa inyectado en las lesiones, particularmente en el ano.
Molluscum Contagiosum.
Agente causante: El virus del molluscum contagiosum (MCV). Este es uno de los dos poxvirus que son capaces de infectar al ser humano. (El otro es el virus de la rubeola).
Cómo se desarrolla y afecta al organismo, síntomas: El MCV se manifiesta como una infección en la piel, habitualmente en el cuello, en la frente, el la parte superior del pecho o la espalda y en la zona de la barba en el rostro. Es una infección muy común en los niños sin VIH y en los adultos con VIH. No reviste ningún peligro de consideración y el tratamiento se realiza principalmente por razones cosméticas.
Tratamiento del Molluscum Contagiosum: La crioterapia (hipercongelación de la zona afectada) puede ser efectiva en la mayoría de los casos. También se han hecho estudios con interferón alfa (5 millones de unidades en inyección subcutánea diariamente durante 8 semanas) en personas con menos de 200 CD4, pero los resultados no han sido demasiado alentadores.
Leucoplasia Oral Velluda:
Agente causante: La leucoplasia oral velluda ha sido relacionada con el virus de Epstein-Barr y con el Papilomavirus Humano (HPV)
Cómo afecta a las personas con VIH: En las personas asintomáticas con VIH la Leucoplasia Oral Velluda puede ser una de las primeras manifestaciones sintomatológicas de la infección por VIH, por lo cual es importante tenerlo en cuenta en aquellas personas en las que su serología con respecto al VIH es desconocida. Su aparición implica que se ha producido ya un deterioro inmunológico importante. En general, se piensa que los hombres son más susceptibles que las mujeres a este padecimiento, aunque no se ha podido demostrar la causa.
Síntomas y cómo afecta al organismo: La Leucoplasia Oral Velluda consiste en unas lesiones blancas que aparecen en los bordes laterales de la lengua, en los labios y en la mucosa de la boca. Las lesiones no son lisas, sino estriadas y tienen la apariencia de vellosidades.
Cómo se diagnostica: Al observar estas lesiones blancas en la boca, o por medio de una biopsia de las mismas.
Tratamiento de la Leucoplasia Oral Velluda: El tratamiento usual es la aplicación sobre las lesiones de resina de podofilina, observándose mejorías en los primeros 4 o 5 días de tratamiento. Algunos estudios sugieren que una dosis alta de acyclovir (más de 3 gr por día) puede reducir o eliminar las lesiones en muy corto tiempo.
Leucoencefalopatía multifocal progresiva:
Agente causal: El virus JC (JCV)
Cómo se inicia y cómo afecta al organismo: El JCV infecta un tipo de célula nerviosa denominada oligodendrocito, que son las células cerebrales responsables de la producción de la mielina. El ataque del JCV a este tipo de células resulta en la pérdida o disminución del contenido de mielina del sistema nervioso central. La mielina es una sustancia fundamental para el funcionamiento de las células nerviosas, ya que es la responsable de la conductividad eléctrica de las neuronas. Las lesiones iniciales en el cerebro ocurren en zonas cercanas a los vasos sanguíneos, lo cual apunta a que la distribución inicial del JCV se hace por vía sanguínea. La Leucoencefalopatía Multifocal Progresiva ocurre con mucha mayor frecuencia en las personas con VIH que en las personas sanas. Un 70% de la población en EE.UU. y en Europa está infectada por el JCV. Se cree que la infección inicial se produce en la infancia y que, una vez instalado el virus en el organismo, las posibilidades de transmisión o contagio a otras personas son bastante reducidas entre adultos. Esta enfermedad puede afectar de un 3% a un 4% de las personas con VIH.
Síntomas: Se producen trastornos mentales, seguidos de dificultad para hablar o déficits del lenguaje, así como problemas en la visión, y debilidad general o focalizada. Los signos neurológicos son: falta de coordinación de movimientos, pérdida de la visión en uno de los ojos, debilidad o inmovilidad en una parte del cuerpo y dificultades para mantenerse en pie o para mantenerse quieto.
Cómo se diagnostica: El virus JC se puede detectar en el tejido cerebral (biopsia) y en la orina. También se puede hacer un diagnóstico si se detectan lesiones en el cerebro a través de una tomografía o de una resonancia magnética.
Tratamiento de la Leucoencefalopatía multifocal progresiva: No existe ningún tratamiento efectivo para esta enfermedad. Este padecimiento puede ser con frecuencia de evolución rápida y fatal. En muy pocos casos se ha observado supervivencia a largo plazo o remisiones. Se han hecho estudios para tratar con citosina-arabinoside (ara-C, citarabina) que ha logrado producir mejoras en un 65% de los casos. La forma de administración es por medio de una inyección en la médula espinal (intratecal). Se están haciendo estudios para evaluar las diferencias entre el tratamiento con ara-C intratecal e intravenosa (de más fácil aplicación).
5- Tumoraciones, linfomas y sarcomas:
Sarcoma de Kaposi:
Agente causante: Hasta hace poco tiempo el origen concreto del Sarcoma de Kaposi ha permanecido poco claro. Recientemente se han ido acumulando indicios que apuntan a la posibilidad de que el agente que desencadena esta enfermedad sea un virus de la familia de los herpesvirus, ya que se han identificado fragmentos de material genético de herpes virus humano del tipo 8 (HHV-8) en las lesiones provocadas en la piel por el sarcoma de Kaposi. Además de esto, hay evidencias cada vez mayores de que el desarrollo del sarcoma de Kaposi tiene mucho que ver con la producción de factores de crecimiento celular por parte de las células infectadas por el VIH o por parte de las propias células que componen el sarcoma de Kaposi. Entre estos factores se citan la proteína TAT del VIH 1, el factor de crecimiento básico de los fibroblastos (una célula abundante en la parte interna de la piel), la interleucina 1, el factor de necrosis celular, la interleucina 6 y otras.
Cómo se inicia: Inicialmente el sarcoma de Kaposi afecta a la piel, produciendo la aparición de unas manchas rojizas o púrpuras, que pueden endurecerse y formar placas. Estas manchas pueden aparecer en una zona concreta del cuerpo o en varias partes a la vez, indistintamente en la cara, en el tronco o en las extremidades. En muchas ocasiones, la zona en la que se localizan las manchas suele estar inflamada (edema). Una vez que aparecen las manchas, éstas tienden a seguir creciendo y proliferando.
Su incidencia en las personas con VIH: En los Estados Unidos y en otros países, el sarcoma de Kaposi es la enfermedad asociada al SIDA que se presenta con mayor frecuencia en las personas con VIH. No es el caso de España, en la cual la Tuberculosis ocupa el primer lugar como infección más frecuente. Aunque en los últimos tres años la incidencia del Sarcoma de Kaposi ha descendido en las personas con VIH, se observa al mismo tiempo un aumento en la tasa de mortalidad debida al Sarcoma de Kaposi en las personas que lo padecen.
Síntomas del Sarcoma de Kaposi y cómo afecta al organismo: Como se ha descrito anteriormente, el signo más evidente de la presencia de un sarcoma de Kaposi es la aparición de manchas púrpuras, rojizas o violáceas en la piel. El Sarcoma de Kaposi afecta más comúnmente a la piel, aunque con frecuencia afecta también a los ganglios linfáticos, la cavidad de la boca, y el tracto gastrointestinal. Las lesiones en el tracto gastrointestinal se observan en el 40% de los casos y suelen ser asintomáticas. En fases muy avanzadas del sarcoma de Kaposi, y en las personas con muy pocos CD4 (también en fase avanzada de la infección por VIH) se puede observar en algunos casos la invasión de los pulmones, provocando grandes dificultades para respirar y problemas respiratorios en general bastante severos. Cuando se han desarrollado tumores en las partes del cuerpo afectadas, particularmente en el tracto gastrointestinal, es frecuente ver la aparición de sangramientos por la boca o por el recto. En general, el curso natural de esta enfermedad puede ser muy variable y depende de la forma en la que se presente y del estadío de la infección por VIH en el que se encuentre la persona.
¿Cómo se diagnostica? A través de una biopsia de los tejidos afectados se puede confirmar la presencia de células alteradas que indican si se trata o no de un sarcoma de Kaposi. Si se sospecha la existencia de lesiones pulmonares, éstas se pueden detectar por broncoscopia. Aunque este método debe aplicarse con cautela debido a la probabilidad de que produzca sangramientos. En ese caso también los rayos X o un escáner pulmonar con galio (un mineral que permite observar mejor la estructura de los pulmones en una imagen obtenida por escáner) pueden ser útiles como método de diagnosis. La presencia de infiltrados pulmonares y densidades de tipo nodular en una radiografía, la poca absorción de galio por las estructuras del pulmón y la presencia de sangre en el esputo (expectoraciones) constituyen signos para un diagnóstico virtual de Sarcoma de Kaposi pulmonar, especialmente cuando se tienen otros indicios de que la persona pudiera estar afectada por el S de K. El sarcoma de Kaposi gastrointestinal se visualiza mejor a través de una endoscopia del aparato digestivo. Por contra, las biopsias dan resultados de falso negativo con frecuencia, debido a que las lesiones producidas por el Sarcoma de Kaposi en los órganos del sistema digestivo (esófago, intestinos) son profundas y no se pueden detectar superficialmente.
Tratamiento del Sarcoma de Kaposi, algunas consideraciones importantes: No existe una terapia curativa; el curso natural de la enfermedad puede variar mucho y muchas de las terapias que se utilizan tienen efectos secundarios importantes, tales como la supresión de la actividad de la médula, que puede producir disminución en el número de células del sistema defensivo (particularmente en el número de neutrófilos: neutropenia). A la hora de establecer una estrategia para el tratamiento, deben ser tenidos en cuenta muchos factores: la extensión y la localización de las lesiones, la presencia de síntomas asociados a los tumores (sangramientos, dolor, inflamación), los síntomas generales de la infección por VIH que estén presentes, la presencia simultánea de otra infección oportunista y el estado inmunológico de la persona. En general, las personas con Sarcoma de Kaposi que tengan más de 200 CD4, sin antecedentes de infecciones oportunistas y pocos problemas de sintomatología general de infección por VIH, tienen un pronóstico mucho mejor que el resto. El punto para iniciar un tratamiento puede establecerse debido a los problemas de apariencia física que esta enfermedad plantea a las personas afectadas. Si la persona está tomando sustancias que reduzcan la actividad de la médula ósea para tratar otras infecciones oportunistas (por ejemplo, ganciclovir para el citomegalovirus) entonces se aconseja iniciar el tratamiento del Sarcoma de Kaposi con una quimioterapia suave. Si se trata ya de controlar tumores desarrollados a partir de un Sarcoma de Kaposi, entonces se puede emprender una quimioterapia más agresiva, pero siempre se debe tener en cuenta que se pueden necesitar otros tratamientos para otras infecciones que también disminuyan la actividad de la médula, por lo cual hay que equilibrar cuidadosamente la quimioterapia para el Sarcoma de Kaposi con el fin de evitar un deterioro adicional del sistema inmunitario. En el caso de que la enfermedad progrese rápidamente y prolifere en varias partes del cuerpo, o cuando se desarrollan tumores que ponen en peligro el funcionamiento de órganos vitales, la quimioterapia sistémica (de impacto general en el organismo) puede contribuir a una regresión (reducción del tamaño y de la actividad) de los tumores y puede salvar la vida de la persona. Entre las sustancias que se han mostrado efectivas utilizadas en monoterapia, o, en algunos casos, en regímenes de combinación, se cuentan la doxorubicina liposomial, la daunorubicina liposomial, la belomycina, la doxorubicina, la etoposida, la vinblastina y la vincristina. Los factores de crecimiento hemopoyético (sustancias que estimulan la actividad de la médula) deben administrarse, en conjunto con las sustancias antes descritas, con el fin de paliar la posible disminución en la producción de células de la sangre por parte de la médula, durante todo el tiempo que dure la terapia.
Sustancias utilizadas en el tratamiento del Sarcoma de Kaposi:
Tratamiento sistémico: La daunorubicina liposomial (DaunoXome) es la primera terapia que se suele utilizar, en dosis de 40 mg por cada metro cuadrado de piel. Otra de las sustancias es la doxorubicina liposomial (Doxil), que también se considera como sustancia para tratamiento inicial. Actualmente se están llevando a cabo ensayos para estudiar la eficacia de estas sustancias en combinación con la adriamicina, la vincristina y la belomycina. No hay resultados claros que hablen de una mayor eficacia de estas combinaciones para todas las personas y habrá que esperar a finales de 1997/inicios de 1998 para saber más al respecto. Entre los efectos secundarios de esta terapia, se encuentran la pérdida de pelo, fatiga generalizada y la disminución de la actividad de la médula. En todo caso, estos síntomas son menores cuando se utiliza la daunorubicina liposomial que con las otras sustancias.
Tratamiento para el desarrollo de tumores: El interferón ALFA recombinante humano ha sido aprobado para el tratamiento de personas con más de 200 CD4. Se observa generalmente una regresión de los tumores en un plazo de dos a tres meses de tratamientos en aquellas personas que no tengan antecedentes de síntomas tales como fiebre, pérdida de peso, sudoración nocturna, etc., que no tengan historia previa de infecciones oportunistas y hayan tenido más de 200 CD4 en el momento de iniciar el tratamiento con interferón. Algunos de los efectos secundarios de este tratamiento pueden requerir una reducción de la dosis. Aunque el interferón alfa se aprobó para ser utilizado en monoterapia en dosis elevadas (más de 8 millones de unidades por día, en inyección subcutánea), estudios recientes sugieren que puede ser mucho más eficaz (y tener menos toxicidad) si se lo aplica a dosis más bajas (1 millón de unidades por día, subcutáneo) en combinación con antirretrovirales para el VIH (ha sido estudiado combinado con AZT y con ddI).
El taxol (paclitaxel), una sustancia obtenida del árbol del Tejo (taxus baccata) también está siendo estudiada como vía de tratamiento en dosis de 135mg por metro cuadrado de lesión, en inyección intravenosa.
Tratamiento tópico o dentro del área en la que están las lesiones: Las lesiones en el rostro o en otras partes expuestas del cuerpo se pueden tratar localmente (tratamiento tópico). En este caso, el factor recombinante plaquetario número 4 (rPF4) ha mostrado tener capacidad de producir una regresión en las lesiones tumorales si se lo inyecta directamente en la zona afectada.
Otra sustancia que se está evaluando es la gonadotropina humana coriónica (hCG), en dosis diarias que van de las 500 a las 2000 unidades. En las dosis más altas se ha observado la regresión de los tumores en más de la mitad de las personas tratadas.
Otras vías de tratamiento son la críoterapia (aplicar frío intenso sobre las lesiones) poniéndoles nitrógeno líquido y la terapia fotodinámica en combinación con poliporfirina y ácido retinóico 9-cis-trans, esto es, estimular la actividad de estas dos sustancias, que son una especie de pro-vitaminas, a través del uso de haces de luz de distintas longitudes de onda.
Finalmente, también está la opción de la radioterapia (aplicación de radioactividad), que se utiliza principalmente para los sarcomas de Kaposi que se localizan dentro de la boca y en la faringe. La radioterapia puede contribuir a reducir los edemas (las inflamaciones dolorosas) en las lesiones por S. de K. Sus efectos secundarios pueden ser inflamaciones de las mucosas de la boca y del tracto digestivo, fibrosis y ulceración de la piel en las zonas irradiadas. Cabe, por último, la probabilidad de que el Sarcoma reaparezca en las cercanías de las zonas irradiadas.
Linfomas
Descripción General: Los linfomas son una enfermedad que se caracteriza por un crecimiento incontrolado de los linfocitos, que, como hemos comentado, son las células básicas del sistema inmunitario. Esto es, que son un tipo específico de cáncer. Normalmente es una enfermedad rara, aunque, en la medida en la que las personas con VIH/SIDA tienen ahora una supervivencia mayor gracias a los nuevos tratamientos, hay una tendencia hacia la aparición de un mayor número de casos. En concreto, para las personas con VIH/SIDA se describen tres tipos de linfomas: el Linfoma Sistémico No Hodking, los linfomas del Sistema Nervioso Central y la enfermedad de Hodking o Linfoma de Hodking.
Linfoma Sistémico No Hodking:
Agente causante: Este punto, al igual que para el Sarcoma de Kaposi y los demás tipos de linfomas, no está demasiado claro. Se han identificado proteínas del HHV8, un subtipo del herpesvirus humano, en las biopsias de personas VIH con algún tipo de linfoma. La diferencia con el mismo virus encontrado en personas con Sarcoma de Kaposi es que los virus de este tipo de linfoma sistémico son hasta 80 veces más abundantes en el interior de los linfocitos B. También se asocia con frecuencia a este tipo de linfoma con el virus de Epstein-Barr, cuyo ADN puede detectarse hasta en un 50% de los casos de linfomas. También se cree que algunas sustancias producidas en gran cantidad por el propio organismo en respuesta a la infección por VIH, como las citoquinas (concretamente: Interleucina 6, Interleucina 10 y el Factor de Necrosis Tumoral) tienen gran influencia en estimular la proliferación de linfocitos B, lo cual podría determinar, bajo ciertas circunstancias, la aparición de linfomas.
Cómo se inicia: Fundamentalmente afecta a los linfocitos B. El proceso se inicia en los ganglios linfáticos y puede diseminarse a otras partes del organismo. Consiste en una reproducción incontrolada de los linfocitos B.
Cómo afecta a las personas con VIH: Los linfomas sistémicos en las personas con VIH/SIDA tienen que ver con estados avanzados de la infección por VIH que permiten, debido a la debilidad del sistema inmunitario, la colonización de determinadas zonas del cuerpo por virus de la familia herpesvirus o que producen un descontrol en la producción de citoquinas, que regulan la manera en la que actúa el sistema inmunitario y la velocidad y el modo en el cual éste se recupera a sí mismo. En las personas sin VIH suelen verse afectados otros tipos de linfocitos aparte de los LB. En las personas con VIH el problema se concentra en los linfocitos B.
Síntomas del Linfoma Sistémico No Hodking y cómo afecta al organismo: Aparte de su inicio en las zonas de producción de linfocitos, estableciéndose inicialmente en ganglios linfáticos próximos a los huesos y al bazo, el linfoma puede diseminarse y afectar a otras zonas del cuerpo como el sistema nervioso central, la propia médula ósea, el tracto gastrointestinal, las meninges (membranas que recubren al cerebro, a la médula espinal y a los nervios) y en el hígado. Otras zonas invadidas con menor frecuencia son la boca, el recto y el ano, el corazón y el pericardio (membrana que recubre y protege al corazón) y el canal de la vesícula biliar (donde llega la bilis al intestino para hacer la digestión de ciertos alimentos).
Físicamente, el linfoma se hace evidente porque se produce la aparición de masas o tumores que pueden, en algunos casos, ser palpados desde el exterior o que se revelan por medio de análisis. Los síntomas más frecuentes son inflamación del bazo (órgano que está detrás del estómago, por detrás y por encima del riñón izquierdo, y que se encarga de ser reservorio de sangre y de la maduración de los linfocitos B), obstrucción hepática, dolor en el recto y en el ano, arritmia cardíaca (el corazón late de forma irregular), síntomas de alteraciones gastrointestinales sin otra explicación y sangramiento gastrointestinal. También se puede presentar síndrome constitucional (fiebre alta, pérdidas de peso sin explicación, sudoraciones nocturnas.)
¿Cómo se diagnostica? Se hace por medio de una biopsia o de una análisis de la médula de los huesos, o bien del líquido cefalorraquídeo (que está en contacto con la médula espinal, en el interior de la columna vertebral), lo cual se hace por medio de una punción lumbar. Otros métodos son radiografías, o un escáner del cuerpo entero utilizando un reactivo fluorescente basado en sales de galio, también por una tomografía axial computerizada (TAC), por resonancia magnética. Otros signos son que la persona presente adenopatías no simétricas, esto es, que se inflamen los ganglios de un lado del cuerpo, pero no los correspondientes del lado contrario. Tener niveles de ácido úrico y de la enzima deshidrogenasa-lactato elevados pueden indicar también la necesidad de hacer una evaluación más profunda para detectar la presencia de linfomas.
Tratamiento del Linfoma Sistémico No Hodking: El tratamiento inicial es similar al de otras formas de cáncer. En este caso incluye quimioterapia citotóxica, esto es, que destruye las células afectadas por el linfoma. Las sustancias utilizadas son mBACOD, COMP, CHOP, NHL-7 y PRO-MACE/MOPP. Todas ellas son factores de regulación que ayudan a evitar la reproducción de los linfocitos B afectados. En las personas con VIH que tienen el sistema inmunitario muy debilitado, la combinación de una quimioterapia más suave con antirretrovirales para el VIH ha demostrado aumentar las posibilidades de supervivencia. Si se añaden factores de crecimiento celular (CGF) de los tipos G-CSF y GM-CSF en combinación con la quimioterapia, se puede facilitar el tratamiento ya que se reduce la toxicidad que este tiene para las células de la sangre en general. Otros tratamientos incluyen el uso de ciclofosfamida, doxorubicina y etoposida (C-D-E), que producen respuestas positivas en personas con menos de 100 CD y linfoma diseminado hasta en un 60% de los casos. Actualmente, la combinación C-D-E está en ensayo clínico de fase II. En los casos en los que las personas tratadas no responden a la quimioterapia, se está investigando en la vía del uso de anticuerpos monoclonales y también en la de la administración selectiva de interleucinas (IL) particularmente IL-2 e IL-6, que, en el laboratorio, han demostrado su capacidad para inhibir el crecimiento tumoral. También se está investigando el uso de una nueva sustancia, el MGBG (Metil-glioxal-bis-guanilhidrazona) Se cree que de algún modo contribuye a reducir la velocidad de proliferación del linfoma dificultando la actividad de determinadas enzimas.
Profilaxis del Linfoma Sistémico No Hodking: Se puede aplicar profilaxis contra el linfoma en las meninges (membranas que recubren al cerebro, médula espinal y nervios) utilizando ara-C (citosina arabinosida) o metotrexato en aquellas personas que tengan el linfoma ya establecido en otras partes del cuerpo. También se utiliza este tratamiento cuando se detectan células B alteradas en el líquido cefalorraquídeo, situación que se conoce con el nombre de meningitis limfomatosa. En general, como en la mayoría de las infecciones oportunistas, la mejor profilaxis es evitar llegar a un estado de deterioro inmunológico severo.
Linfoma del Sistema Nervioso Central:
Agente causante: Como ya se comentó al principio, no está clara la causa inicial de este tipo de enfermedad. Se ha encontrado presencia del virus de Epstein-Barr en el tejido de este tipo de linfoma lo cual sugiere que puede estar relacionado de alguna manera con su evolución.
Cómo se inicia: Los linfocitos de las zonas relacionadas con el Sistema Nervioso Central (SNC), particularmente el cerebro, la médula espinal y los grandes haces nerviosos son las células afectadas por este proceso. Se forman masas tumorales que se pueden diseminar por todo el SNC afectando severamente su funcionamiento.
Su incidencia en las personas con VIH: Esta enfermedad suele aparecer sólo en fases muy avanzadas de SIDA, cuando la capacidad de respuesta inmunitaria es mínima y otras infecciones oportunistas han deteriorado ya seriamente al organismo. Sin tratamiento, la media de supervivencia de las personas con VIH en las que se ha desarrollado este linfoma es de tan sólo dos meses. Aplicando altas dosis de radiación, este período se puede alargar hasta 4 ó 5 meses. Aunque las personas usualmente mueren por causa de las demás infecciones oportunistas, cuyo proceso se ve acelerado notablemente por la presencia del linfoma.
Síntomas del Linfoma del SNC y cómo afecta al organismo: Se pueden producir algunos signos de tipo neurológico como la parálisis parcial de partes determinadas del cuerpo (manos, rostro, parte del brazo o de la pierna, siempre en un sólo lado del cuerpo, no en ambos), también afasia (dificultad para hablar o para comprender una conversación). Otros signos son confusión, pérdida de la memoria y letargo. También pueden producirse cambios en la personalidad. No obstante, en algunos casos la única manifestación se reduce a un dolor de cabeza persistente y más o menos intenso. Los síntomas, en muchos casos, no se diferencian mucho de los de una toxoplasmosis cerebral (encefalitis por toxoplasmosis). Esto complica a veces un diagnóstico acertado. En cualquier caso, las pérdidas de sensibilidad en el rostro, o la parálisis de músculos en el cráneo o en la cara deben interpretarse siempre a priori como indicios de un Linfoma del SNC, hasta que un análisis más detallado permita determinar si se trata de otro tipo de problema.
¿Cómo se diagnostica? Una diagnosis definitiva sólo es posible en la mayoría de los casos a través de una biopsia del tejido cerebral (recogiendo una muestra directamente del cerebro). El problema es que resulta difícil realizar este tipo de biopsias bien porque el estado de salud general de la persona no lo indique o bien porque, al ser delicado el proceso, el equipo médico lo desestime ante la eventualidad de riesgos para el sistema nervioso central de la persona afectada. En esos casos, se utiliza principalmente la tomografía axial computerizada (TAC) y la resonancia magnética para establecer una diagnosis preliminar. Una punción lumbar, analizando el líquido cefalorraquídeo, permitiría, en algunos casos de este tipo de linfoma, establecer una diagnosis. En cualquier caso, si la biopsia no se puede hacer y si no se obtienen resultados por medio de la punción lumbar o del TAC, en aquellas personas que den serología negativa para la toxoplasmosis, y que presenten síntomas de linfoma del SNC, debería considerarse iniciar un tratamiento contra el linfoma del SNC. Del mismo modo, las personas que tengan serología positiva a la toxoplasmosis, y que, después de 1 a 2 semanas de tratamiento, no respondan con una mejoría apreciable, deberían ser evaluadas para determinar la presencia de un linfoma del SNC.
Tratamiento del Linfoma del SNC: El método estándar de tratamiento para las personas con VIH consiste en dar altas dosis de radiación a todo el cerebro. Algunos corticoesterioides como la dexametasona pueden añadirse a este tratamiento ya que contribuyen a reducir el tamaño de los linfomas. Normalmente, la radiación en altas dosis consigue la desaparición de los tumores por completo en hasta un 50% de los casos. Sin embargo, es frecuente una reaparición de los linfomas. El objetivo de la radioterapia, en el estado actual de las cosas, es, más que aumentar el tiempo de supervivencia de la persona, incrementar su calidad de vida. El papel de la quimioterapia (con sustancias similares que para el linfoma No Hodking) está actualmente siendo objeto de estudio. Hay indicios de que, combinada con la radioterapia, puede producir mejoras en el curso de esta enfermedad. Concretamente, se está llevando a cabo un ensayo clínico que contempla CHOD, G-CSF, radioterapia y citarabina (ensayo ACTG-252) y otro que contempla el uso de etoposida y cis-platino.
Enfermedad de Hodking:
Agente Causante: Como en los casos anteriores, su origen no está claro. Algunos indicios apuntan al propio VIH como agente desencadenante y otros hablan también de un posible papel del Virus Epstein-Barr.
Cómo se inicia: La enfermedad de Hodkings aparece fundamentalmente en los ganglios linfáticos y frecuentemente se extiende desde una zona en concreto hacia las zonas adyacentes.
Cómo afecta a las personas con VIH: La enfermedad de Hodking es mucho más frecuente en las personas con VIH que en las personas sin VIH. Su frecuencia depende del estado de la infección por VIH (generalmente se manifiesta en estados avanzados) y de otros factores que no están claros, pero que podrían tener algo que ver con el subtipo de VIH, con la evolución de éste en el organismo y, en menor medida, con la vía de transmisión por la cual se haya infectado la persona (mucosa/sangre o sangre/sangre).
Síntomas de la enfermedad de Hodking y cómo afecta al organismo: El curso clínico de la enfermedad de Hodking en las personas con VIH es en la mayoría de los casos difícil de predecir. Normalmente se manifiesta en estadíos muy avanzados de SIDA y, a diferencia de los otros linfomas, éste no afecta a un único tipo de células, sino a varia células linfáticas o sanguíneas a la vez.
En cuanto a los síntomas, en las personas sin VIH se manifiestan por adenopatías (inflamación de los ganglios) principalmente en la zona del cuello. En las personas con VIH, en cambio, se dan una serie de síntomas atípicos, tales como fiebre alta, sudores nocturnos, escozor y pérdida de peso. Si la enfermedad de Hodking ha afectado a la médula de los huesos, pueden entonces aparecer sensibilidades o dolor en las zonas óseas afectadas.
Cómo se diagnostica: El método de diagnóstico se basa en la identificación de células de tipo Reed-Sternberg (un tipo de alteración de las células linfáticas indicativo de la enfermedad de Hodking) o también si se observan variaciones morfológicas (formas anormales o diferentes de la habitual) en las células de los ganglios linfáticos (esto se determina por medio de una biopsia de los ganglios linfáticos). Como en algunos casos la enfermedad de Hodking afecta a la médula de los huesos, otro método útil para el diagnóstico es hacer una biopsia de la médula ósea.
Tratamiento de la enfermedad de Hodking: La elección del tipo de tratamiento dependerá del estadío en el que se encuentre la evolución de la e. de Hodking. En los estados más avanzados de la e. de H. (III y IV) el tratamiento recomendado es fundamentalmente la quimioterapia. Se utilizan normalmente combinaciones de cuatro sustancias. Actualmente está siendo estudiada la combinación llamada ABVD (adriamicina, bleomicina, vinblastina y dacarbazina) (estudio ACTG-149).Hay que señalar que la respuesta a estas terapias es mucho menos intensa en las personas con VIH que en las personas sin VIH. En los estadios iniciales de la enfermedad de Hodking (I y II) el tratamiento más usual consiste en la radioterapia.
6-Alteraciones neurológicas:
Efectos iniciales del VIH sobre el sistema nervioso central:
A pesar de que el Sistema Nervioso Central se ve afectado desde un principio por el VIH, esto no quiere decir que se produzcan síntomas neurológicos desde un primer momento. De hecho, esto es muy poco frecuente. En general, los estudios han demostrado que el VIH, a pesar de causar alteraciones en el SNC consistentes en aumentar el número de anticuerpos locales, el número de leucocitos y el número de proteínas potencialmente tóxicas, no produce alteraciones palpables en su funcionamiento hasta que la infección por VIH está en un estado avanzado. En algunos casos, sí se produce una respuesta inicial a la infección por el VIH, debido a que el virus infecta de un modo precoz y rápidamente al SNC o bien debido a las consecuencias de la respuesta inmunitaria que se produce en el primer momento de la infección (aumento de la producción de anticuerpos, actividad neurotóxica de las células asesinas del sistema inmunitario, etc.) Así, algunas personas pueden desarrollar, dentro de la infección inicial por VIH, encefalitis, meningitis y varios tipos de neuropatías, que no se deben, como es habitual, a la acción de microorganismos, sino al propio VIH o a la respuesta inmunitaria frente a éste. Estas alteraciones son generalmente breves y remiten por sí solas, una vez que la infección por VIH se ha estabilizado en el organismo.
Los síntomas más comunes suelen ser rigidez en el cuello, dolor en la zona de la espalda, dolor de cabeza y, en pocas ocasiones, fiebre. Para diferenciar estas neuropatías debidas al VIH de las debidas a otros microorganismos (toxoplasmosis, meningitis por criptococos, etc.) se hace necesario un análisis del líquido cefalorraquídeo, en el cual no se encontrará rastros de bacterias o microorganismos, pero sí una alteración en el número de leucocitos y un elevado número de anticuerpos al VIH.
Es importante diferenciar estos síntomas puntuales, del dolor de cabeza persistente que es característico en muchos casos de VIH y cuyas causas no están aún del todo claras.
Complejo de demencia relacionado con el SIDA:
Descripción: La alteración más importante del Sistema Nervioso Central, que se atribuye a un efecto directo y primario del VIH, ha sido descrita utilizando diversos nombres: Complejo de Demencia Relacionada con el SIDA, Encefalitis Subaguda por VIH y Encefalitis por VIH. En realidad, este síndrome o complejo puede englobar a más de una enfermedad al mismo tiempo. Se caracteriza por una disminución de la capacidad de concentración y de la velocidad con la cual se piensa o se hacen cálculos sencillos mentalmente, acompañado de pérdida de interés por las actividades cotidianas y lentitud de los movimientos corporales. La relación concreta entre la infección por VIH y el modo en que ésta afecta al sistema nervioso y a otras partes del cuerpo al margen del sistema inmunitario, la piel y otras zonas características, es algo que aún no se conoce demasiado bien. A pesar de que está claro que las personas con este tipo de problema en el SNC, manifestado de forma aguda o grave, tienen afectados por el VIH los macrófagos del tejido nervioso, en el interior del cerebro, lo cierto es que también se ha observado que las personas que presentan un curso más leve de estas alteraciones neurológicas no muestran signos de afectación de dichos macrófagos, ni se han observado rastros del virus en el cerebro, lo que lleva a pensar que la forma en la que el VIH afecta al sistema nervioso es bastante compleja.
Tratamientos: Está demostrado que el AZT (Zidovudina, Retrovir) mejora y posiblemente previene la aparición de esta afectación del Sistema Nervioso Central por parte del VIH. No está claro el efecto de sustancias como ddI, ddC y d4t, aunque algunos estudios sugieren que el ddI podría ser moderadamente eficaz. Otras sustancias como el 3TC y la Nevirapina, tienen capacidad de atacar al VIH en el sistema nervioso central, por lo cual, al menos teóricamente, deberían actuar de un modo similar al AZT. No se han hecho suficientes estudios que permitan, no obstante, hablar de ello con certeza. En el caso de personas que llevan una larga historia tomando AZT y que se ven afectados por estas alteraciones del Sistema Nervioso Central, se recomienda aumentar transitoriamente la dosis de AZT hasta 1000 mg diarios o más.
Al menos tres clases de sustancias están siendo estudiadas actualmente en cuanto a su capacidad de mejorar el funcionamiento del SNC sin inhibir la actividad del VIH (esto es, que no se trata de sustancias antirretrovirales). En general, el estudio consiste en medir su eficacia en combinación con los antirretrovirales, se trata de los antagonistas de la citoquina, los antioxidantes y los agentes neuroprotectores.
Algunos estudios sugieren que la proteína GP-120 del VIH (que le permite unirse al receptor CD4 de las células e infectarlas de ese modo) puede ser tóxica para las neuronas ya que, al entrar en contacto con éstas, altera el ritmo al cual intercambian nutrientes e información con el exterior (alteran el funcionamiento de los canales de calcio).
Algunos psicoestimulantes, como el Ritalin (metilfenidato hidrocloroso), pueden ser eficaces en personas con problemas de motricidad. En las personas que presenten problemas de agitación o alteración, la administración de litio o de neurolépticos puede ayudar, aunque se debe iniciar siempre este tipo de terapias con dosis muy bajas.
Tratamiento en los niños: Un proceso similar puede ocurrir en los niños con VIH. En este caso, puede incidir negativamente en su desarrollo y crecimiento, así como causar los mismos síntomas que en los adultos. Se estima que hasta un 75% de los niños con VIH pueden verse afectados por este mal. Igual que para los adultos, la eficacia del AZT parece un hecho demostrado y hay evidencias de una eficacia, aunque moderada, del ddI.
Neuropatías periféricas:
Dos tipos de neuropatías son las más comunes en la infección por VIH. El primer tipo consiste en un padecimiento subagudo (leve y que dura poco tiempo) y se da fundamentalmente al principio de la infección por VIH, antes de que aparezcan infecciones oportunistas capaces de afectar directamente al SNC. El segundo tipo, que es una neuropatía sensorial (que afecta a la sensibilidad y en parte a la motricidad del cuerpo, fundamentalmente de las extremidades) se desarrolla en las fases intermedias o avanzadas de la infección por VIH y puede llegar a afectar hasta a un 30% de las personas. En este caso, algunos antirretrovirales que son neurotóxicos como los didanósidos: ddI, ddC y d4T, deben ser administrados con cuidado y bajo un seguimiento intensivo de la persona que los toma. Lo que está claro es que la neuropatía está causada fundamentalmente por el VIH y que estas sustancias intensifican los síntomas.
Algunas neuropatías pueden llegar a ser severas, dando sensación de escozor y de ardor tan intensas que la persona no pueda ponerse calcetines ni soportar el peso de las mantas en la cama. En estos casos severos es recomendable suspender el tratamiento con los antirretrovirales neurotóxicos.
Estas neuropatías pueden ser tratadas con fenitoína, carbamazepina y capsaicina aplicada sobre las zonas afectadas.
En personas asintomáticas con respecto a las neuropatías, los antirretrovirales ddI, ddC y d4T pueden inducir la aparición de las neuropatías periféricas, dependiendo de las dosis de ellos que se tomen. Este efecto es más característico del ddC que del ddI o del d4T. En general, cuando se presentan neuropatías relacionadas con estas sustancias, los síntomas pueden continuar durante unos días más después de haber suspendido la toma de las mismas, aunque, generalmente, tienden a desaparecer. Esto es importante, ya que permite distinguir entre una neuropatía producida directamente por el virus y agravada en sus síntomas por los antirretrovirales, en cuyo caso, los síntomas no desaparecen con la suspensión de la toma de dichas sustancias, lo cual indica, entonces, un grado importante de afectación del SNC por el virus; y una neuropatía inducida por la relativa toxicidad para el SNC de estas sustancias, cuyos síntomas desaparecen unos días después de suspender el tratamiento. En este último caso, el SNC está sólo moderadamente afectado por el VIH.
Finalmente, el tratamiento prolongado (muchos años) con AZT puede llevar a un desgaste y debilidad muscular generalizadas. Esto se debe tal vez a los efectos del AZT dentro del metabolismo de las proteínas en el interior de las células. Al suspender el tratamiento con el AZT se va recuperando paulatinamente la normalidad.
Otros desórdenes del sistema nervioso central relacionados con la infección por VIH:
Aparte de las complicaciones específicas en el SNC causadas por el VIH, también los efectos generales en todo el organismo (sistémicos) de una infección por VIH avanzada pueden afectar negativamente al funcionamiento del SNC. Entre éstos, se pueden contar las encefalopatías de origen metabólico, que se deben a la hipoxia (disminución de la cantidad de oxígeno que llega al cerebro como causa de la acción del VIH y de las infecciones oportunistas en el sistema inmunitario, en la sangre y en los pulmones), insuficiencia hepática (que provoca una acumulación de toxinas en la sangre que llegan al cerebro y afectan su funcionamiento) y problemas de coagulación dentro de los vasos sanguíneos que, en un momento dado, pueden afectar al flujo de sangre que llega al cerebro.
Igualmente, muchos de los medicamentos utilizados en el tratamiento del VIH y de las infecciones oportunistas pueden afectar la capacidad de atención y de comprensión de las personas tratadas con ellos.
La experiencia clínica indica que las personas con VIH son particularmente susceptibles a los efectos de determinados medicamentos utilizados para tratar alteraciones neurológicas: ansiolíticos, antipsicóticos, etc.
Dada la amplia gama de posibilidades por las cuales el SNC puede verse afectado directa o indirectamente por el VIH, es fundamental hacer siempre un diagnóstico claro y certero de las posibles anomalías para tratarlas a tiempo. Especialmente debido a que la claridad cognoscitiva y un buen funcionamiento de la percepción son fundamentales para la persona con VIH y ayudan a luchar en contra del resto de padecimientos relacionados con el SIDA.
7- Otras complicaciones:
Úlceras aftosas:
Descripción, desarrollo y características: Un tipo de úlceras en los genitales y en la boca que se asemejan a las úlceras aftosas son cada vez más frecuentes en las personas con VIH. Se presentan en dos tipos, unas más leves similares a las lesiones producidas por los herpes y otras más dolorosas y extendidas, que pueden presentar necrosis (destrucción de tejidos corporales). La causa concreta de este tipo de úlceras no se conoce. Aunque algunos indicios apuntan a la posibilidad de ciertos factores como el estrés, agentes infecciosos y los llamados factores de necrosis tumoral (TNF, muy conocidos por su influencia en el desarrollo de los tumores cancerosos). En algunos casos, el tratamiento con ddC parece estar implicado en la predisposición a este tipo de úlceras.
Lugares en los que se manifiesta: Las úlceras aftosas afectan fundamentalmente a la lengua y a las mucosas de la boca y del esófago. Igualmente, se dan casos de infecciones genitales, aunque con menor frecuencia.
Cómo se diagnostican: Debido a su semejanza con una infección por herpesvirus, el diagnóstico se vuelve, en ocasiones, difícil. Un elemento distintivo es que las úlceras aftosas suelen producirse en mucosas no protegidas por la piel, a diferencia del herpes, que afecta fundamentalmente a ésta.
Tratamiento de las úlceras aftosas: El tratamiento más usual es la aplicación de corticosteroides en las zonas afectadas (flucinonida y dexametasona). En concreto, la prednisona está indicada para los casos más graves. Algunos estudios recientes indican que la talidomida puede ser eficaz en el tratamiento de este padecimiento, en dosis de 200 mg por día.
Diarrea y mala absorción intestinal:
Descripción general: La mala absorción intestinal consiste en una absorción deficitaria de nutrientes a través del intestino, esto es, que la cantidad de proteínas, grasas, azúcares, vitaminas y minerales que llegan a la sangre en relación con la cantidad que se ha ingerido a través de los alimentos o de los medicamentos es mucho menor que la normal. Se cree que el VIH puede afectar, atrofiándolas, a las células intestinales responsables de los mecanismos de absorción de nutrientes.
La diarrea es un fenómeno frecuente en las personas con VIH, puede ser esporádica o continua y ocurrir tanto al principio como en fases intermedias o avanzadas de la infección por VIH. La diarrea es la mayor causa de mortalidad de los niños con SIDA en África, aumentando en algunos casos hasta en 11 veces su riesgo de mortalidad que en el caso de los niños con diarrea y sin VIH.
El tracto gastrointestinal (intestinos, estómago, esófago) puede verse afectado por muchos microorganismos, entre ellos parásitos, bacterias y virus que, junto con los efectos del VIH pueden desencadenar los problemas de diarreas y mala absorción que inciden negativamente en la salud general de las personas con VIH, concretamente:
Infecciones parasitarias:
Criptosporidiosis, Isosporiasis, Microsporidiasis, Amibiasis y Giardiasis.
Infecciones virales:
Citomegalovirus (que produce colitis: inflamación intestinal)
Infecciones por bacterias:
Complejo por Micobacterium Avium (MAC), Salmonelosis, e infecciones por Campyllobacter y Shighela (disenterías).
Tratamiento: Una sustancia que se ha demostrado efectiva en varios estudios en el caso de las diarreas crónicas en las que no se observa presencia de agentes infecciosos es la mesalamina, en cantidades de 6 gr por día.
Otra sustancia que ha dado resultados positivos es la sandostatina, en dosis superiores a 50 microgramos, en inyección subcutánea tres veces al día hasta que remitan o mejoren los síntomas.
En los casos de diarrea crónica que no responden a ningún tipo de tratamiento, se está estudiando en este momento la eficacia de la DEHSPM (dietilhomospermina).
Trombocitopenia:
Descripción: La trombocitopenia es un padecimiento muy frecuente en las personas con VIH. Consiste en una disminución importante del número de trombocitos o plaquetas, lo cual dificulta la coagulación de la sangre y aumenta el riesgo de producción de derrames y otros accidentes vasculares. La causa directa de la trombocitopenia es la infección de un tipo de célula, precursora o madre de los trombocitos (conocidas como megacariocitos) por parte del VIH.
Tratamientos: No existe un tratamiento estándar para la trombocitopenia o plaquetopenia. En general, esta disminuye con la disminución de la carga viral del VIH. También se ha demostrado que el AZT tiene efectos beneficiosos, logrando rápidos aumentos en el número de plaquetas. La combinación de antirretrovirales puede potenciar aún más este efecto.
En los casos en los que, a pesar del AZT o de una terapia combinada, persiste la plaquetopenia, el Interferón Alfa ha demostrado ser un tratamiento seguro y eficaz (en dosis de 3 millones de unidades o más por día).
Otro tratamiento eficaz es la aplicación de WinRho, esto es, gamma globulina desecada por ultracongelación. Este tratamiento se aplica por vía intravenosa, durante 3 a 5 minutos en períodos que dependen de la respuesta y del mantenimiento del aumento en el número de plaquetas.
Wasting Síndrome: Síndrome de Desgaste:
Descripción: Consiste en una pérdida involuntaria y continuada de peso y es una de las manifestaciones más comunes del VIH. Puede ocurrir en cualquier etapa de la infección. La pérdida de peso crónica está asociada con la malnutrición (debido a problemas de absorción intestinal o a otros factores, como dieta inadecuada o dificultades para alimentarse debido a infecciones en la boca, el esófago, etc. (cándidas, etc.)) y puede tener como consecuencia un aumento del déficit del sistema inmunitario, contribuyendo a disminuir el número de CD4 y disminuyendo la actividad de las células CD8 (citotóxicas o asesinas), así como causando alteraciones en la actividad de los macrófagos.
Tratamiento:
Estimulación del Apetito: El tratamiento estándar para la estimulación del apetito consiste en tomar acetato de megestrol (Maygace, Megace en algunos países) en suspensión oral, en dosis de 800 mg por día. Los resultados hablan de una ganancia media de peso de 3 a 4 kilos en 12 semanas (3 meses). Esta recuperación paulatina de peso es bastante estable. La ganancia de peso se traduce en su mayor parte en aumento de la masa muscular y ósea.
Otra sustancia estudiada con el mismo fin es el Dronabinol (Marinol en algunos países), un derivado del cannabis (marihuana). Esta sustancia ha sido aprobada para su uso en personas con VIH que presenten síndrome de desgaste. Los resultados han sido positivos, ya que contribuye a aumentar el apetito, aunque menos claramente al aumento de la masa corporal, como sí sucede con el acetato de megestrol. Al ser un derivado del cannabis, retiene algunos de sus efectos, tales como euforia, alteraciones cognitivas y pérdida de la capacidad de concentración. Por lo cual se aconseja a las personas que tomen este tratamiento que eviten actividades como la manipulación de herramientas y aparatos mecánicos o eléctricos, la conducción de coches y las actividades laborales o lúdicas que puedan implicar riesgo de accidentes o lesiones.
Complementos o Suplementos Nutricionales: Existen varios suplementos nutricionales que pueden ser utilizados, se presentan en forma de suspensiones con sabor a carne, pescado o frutas y se pueden tomar con las comidas o como sustituto en los casos en los que haya dificultades para ingerir alimentos sólidos. También, en casos graves, se recomienda la alimentación parenteral (directamente en la sangre) utilizando sueros específicos. Este sistema permite mejorar las condiciones generales en casos avanzados o graves de desnutrición pero no permite ganancias claras de masa muscular a medio plazo.
Agentes Anabólicos o Anabolizantes: Anabolismo es un proceso opuesto a metabolismo. El metabolismo consiste en disgregar los nutrientes hasta su expresión más simple para que puedan ser aprovechados por el cuerpo. El anabolismo consiste en la síntesis de proteínas y sustancias estructurales que fomenten el aumento de la masa corporal (músculos y huesos). Entre las sustancias utilizadas están el factor recombinante de la hormona del crecimiento humano, la testosterona aplicada subcutáneamente cerca del escroto (bolsa de piel que envuelve a los testículos), el cipionato de testosterona, la oxandrolona, el decanonato de nandrolona y otras. Estas sustancias son generalmente de carácter hormonal y no están recomendadas como estándar para el tratamiento del síndrome de desgaste. Sin embargo, en muchos casos, permiten lograr aumentos significativos de la masa muscular. Su administración debe hacerse bajo control médico y debe ir acompañada de ejercicios físicos suaves o moderados que aumenten su efectividad.
Inmunomoduladores: La pentoxifilina y la talidomida, al inhibir la actividad del TNF (factor de necrosis tumoral, que puede ayudar a producir el desgaste por VIH) pueden ser útiles en la recuperación de personas afectadas por el síndrome de desgaste, pero este supuesto está recién comenzando a ser investigado actualmente y no hay aún resultados claros o concluyentes.
3-Profilaxis contra las infecciones oportunistas:
Las recomendaciones que se recogen aquí están indicadas para aquellas personas a las que se les ha diagnosticado una infección de VIH y observan síntomas iniciales de cualquiera de las infecciones.
RECOMENDACIONES COMO ESTÁNDAR DE TRATAMIENTO
| Agente Causante | Circunstancias de inicio | Primera Elección | Opción alternativa |
| Pneumocistis carinii | <200 CD4. Fiebre sin motivo aparente por más de dos semanas. Candidiasis orofaríngea> | TMP/SMX | Dapsona + Pirimetamina + Leucorovina + Pentadimina en aerosol |
| Mycobacterium tuberculosis (Mtb) | Mantoux (TST) + (más de 5mm) o TST positivos anteriores sin síntomas ni tratamiento posterior | Isoniazida + piridoxina | Rifampin |
| Mycobacterium tuberculosis resistente a Isoniazida | Lo mismo que en el caso anterior + exposición comprobada a Mtb | Rifampicina | Rifabutin |
| Mtb con resistencias múltiples | Lo mismo que en el caso anterior | Consultar a otros equipos de salud pública o a grupos en investigación | Ninguna. |
| Toxoplasma gondii | Anticuerpo lgG al T. gondii<100 CD4> | TMP/SMX | Dapsona + pirimetamina + leucovorina |
RECOMENDACIONES PARA CONSIDERAR EN TODOS LOS CASOS
(No existe un estándar establecido)
| Agente causal | Circunstancias de inicio | Primera elección | Opción alternativa |
| Streptococcus pneumoniane | Todos los pacientes | Vacuna neumocóccica | Ninguna |
| Micobacterium avium | CD4<75 | Claritromicina | |
| Cándida | CD4<50 | Fluconazol | ketoconazol |
| Cryptococcus neofarmans | CD4<50 | Fluconazol | Itraconazol |
| Histoplama Capsulatum | CD4<50 zona geográfica endémica | Itraconazol | Fluconazol |
| Coccidioides immitis | CD4<50 zona geográfica endémica | Fluconazol e Itraconazol | |
| CMV | CD4< 200 | Ganciclovir Oral | Ninguna |
| Hepatitis B | Todas las personas en riesgo de infección (vacuna) | Energix-B Recombibax-B | Ninguna |
| Influenza (Gripe) | Todas las personas anualmente antes de la gripe estacional | Virus entero, Virus atenuado, (vacunas) | Rimantodina o Amantadina |
Epidemiología del SIDA y del VIH:
1-Epidemiología en el mundo:
En los quince años transcurridos desde que se detectaron los primeros casos de sida, las características y patrones de esta epidemia en el mundo han sufrido cambios muy importantes. Desde los primeros momentos se describieron casos en Norteamérica, el centro de África y Europa Occidental, y a partir de entonces, la epidemia de VIH se ha ido extendiendo a todos los continentes en mayor o menor medida. Las sucesivas revisiones del número de personas infectadas que ha publicado la Organización Mundial de la Salud (OMS) reflejan la rápida progresión de la epidemia de VIH en el mundo. Paralelamente, se observa una marcada tendencia a una mayor afectación de los países en desarrollo y de los grupos menos privilegiados dentro de los países industrializados. Aunque la transmisión parenteral del VIH ha tenido importancia en algunos lugares, globalmente la mayoría de los casos se han producido por transmisión sexual.
Según la OMS, hasta el 20 de noviembre de 1996 se habían notificado en el mundo 1.544.067 casos de sida. Sin embargo, esta cifra sólo supone una parte del número real de casos de sida, especialmente en los países en desarrollo donde la subnotificación es importante. Por ello, la OMS estima que para finales de 1996 se habrían producido en el mundo 8,4 millones de casos de sida, de ellos 6,7 millones habrían ocurrido en adultos y 1,7 millones en niños (figuras 1-1 y 1-2).
Figura 1. Número estimado de casos de sida en adultos desde comienzo de la epidemia hasta diciembre de 1996.
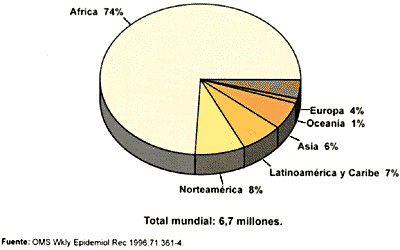
Figura 2. Número estimado de casos de sida en adultos desde comienzo de la epidemia hasta diciembre de 1996.
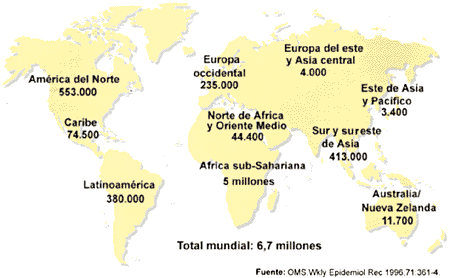
Las cifras de personas infectadas por el VIH aportan una visión más completa de la epidemia. La OMS estima que a finales de 1996 habría en el mundo 22,6 millones de personas vivas e infectadas por el VIH o con sida. En la figura 1-3 se presenta su distribución por grandes regiones. La mayoría (62%) estarían en África sub-Sahariana (14 millones), y le seguiría el sur y sudeste de Asia con 5,2 millones (23%). En varios países de África las tasas de seroprevalencia en adultos sexualmente activos superan el 5%. Por otra parte, el numero de niños infectados en todo el mundo sobrepasa el millón.
Figura 1-3. Número estimado de personas vivas con VIH/sida a diciembre de 1996.
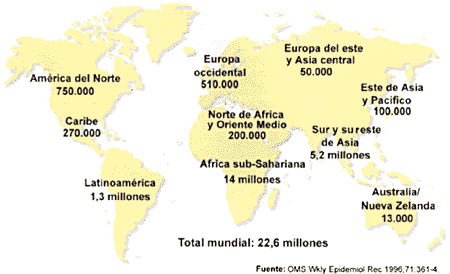
El ritmo de nuevas infecciones por el VIH que se producen anualmente en el mundo excede los dos millones, la mayor parte de las cuales ocurren en África sub-Sahariana, y en el sur y sudeste de Asia. La OMS estima que para el año 2000 habrá 26 millones de personas infectadas por el VIH y más del 90% de ellas se localizarán en países en desarrollo.
DISTINTAS REGIONES, DISTINTAS EPIDEMIAS: Las formas de transmisión del VIH son las mismas en todo el mundo. No obstante, las características sociales, culturales y económicas de cada lugar juegan un papel importante en el curso y en los patrones que adopta la epidemia. La introducción del VIH en cada lugar se ha podido producir en distintos momentos y su expansión más o menos rápida está en función de la prevalencia de prácticas de riesgo. La combinación de estos factores, determina la gran variedad de situaciones que configuran la pandemia de VIH/sida (figura 1-4). Seguidamente se presenta una breve descripción de la panorámica mundial por grandes regiones.
Figura 1-4. Incidencia anual de nuevas infecciones por VIH en adultos según región geográfica.
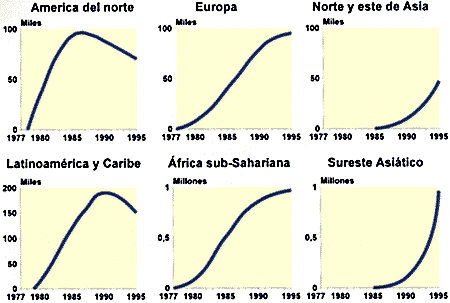
2-LA EPIDEMIA DEL SIDA EN LOS PAÍSES EN DESARROLLO
En estos países la pobreza, la desnutrición, y las deficiencias sanitarias, sociales y educativas se suman al sida y a otros muchos problemas de salud prevalentes. Ello hace más graves sus consecuencias y disminuye la capacidad de respuesta para frenar la progresión de la epidemia, y atender las necesidades sanitarias y humanitarias que genera.
África sub-sahariana: África sub-Sahariana es con diferencia la región más afectada por el sida. Más de 16 millones de personas, casi el 3% de la población, está infectada por el VIH. Además, los estudios de seroprevalencia seriados muestran que la propagación del VIH está todavía en expansión en muchos lugares.
El número de casos de sida declarados en África hasta noviembre de 1996 era de 553.291, pero teniendo en cuenta la importante subnotificación existente, las estimaciones de la OMS elevaban esta cifra hasta 5 millones. Según la misma fuente, a finales de 1996 habría más de 14 millones de personas vivas infectadas por el VIH. Tres países, Uganda, Nigeria y Kenia, tenían cada uno más de un millón de personas adultas infectadas por el VIH entre su población, y otros 7 países más del sur y este de África tenían más de 500.000 infectados. Las mayores tasas de seroprevalencia de VIH se localizan en países del este del continente, además de Costa de Marfil.
Hasta ahora, la afectación por el sida es mucho mayor en el medio urbano que en el rural, si bien, algunas zonas rurales, con comercio o atravesadas por vías de comunicación, pueden salirse de este esquema general. En algunas ciudades, como Kigali en Rwanda y Kampala en Uganda, están infectados un tercio de los adultos sexualmente activos. Las tasas de seroprevalencia mayores se encuentran en la población con conductas sexuales de alto riesgo, prostitutas y pacientes con enfermedades de transmisión sexual (ETS). Sin embargo, la epidemia no se limita a estos colectivos y se extiende por la población sexualmente activa, lo que se pone de manifiesto al estudiar mujeres embarazadas. La transmisión del VIH se mantiene a ritmos preocupantes; así, en cohortes representativas de la población general, la incidencia de infección se mantiene entre 0,3% y 5% al año.
La prevalencia de infección es por lo general similar en hombres y mujeres, aunque existen variaciones entre países. En algunas zonas del oeste de África el número de hombres infectados duplica al de mujeres.
Caribe y Latinoamérica: Latinoamérica y los países del Caribe sufrieron la entrada del VIH entre finales de los setenta y principios de los ochenta. Aunque el grado de afectación es muy desigual en toda la región, algunas zonas tienen tasas de seroprevalencia especialmente altas. Hasta finales de 1996 unos 380.000 adultos habían desarrollado sida en Latinoamérica y otros 74.500 más en el Caribe. El número de personas vivas infectadas por el VIH ascendía a 1,3 millones en Latinoamérica y a 270.000 en los países del Caribe.
En conjunto se han detectado cambios importantes en los patrones de transmisión en esta región. Inicialmente predominó la transmisión por prácticas homosexuales; pero en grandes zonas las prácticas bisexuales parecen haber tenido un papel importante en la posterior expansión del VIH por vía heterosexual.
Los patrones de transmisión y las tasas de incidencia varían mucho de unos lugares a otros. En el Caribe y Centroamérica predomina la vía heterosexual; así en Haití se han descrito tasas de seroprevalencia del 10% en las mujeres embarazadas y en Honduras del 4%. No obstante, algunos autores han descrito la situación en el Caribe como un "mosaico" de diferentes patrones epidemiológicos, ya que hay islas donde predomina la transmisión homosexual y en otras la transmisión entre usuarios de drogas inyectadas (UDI).
En México y el área andina son más frecuentes los casos debidos a prácticas homosexuales y bisexuales, pero se está produciendo un fuerte ascenso de la vía heterosexual. La epidemia en Brasil y en los países del cono sur se caracterizó por afectar en su inicio a homosexuales con una segunda onda en UDI y población heterosexual.
Asia: La entrada de la epidemia de sida en los países de Asia fue relativamente tardía. A finales de la década de los ochenta y principio de los noventa se produjo una propagación intensa del VIH en algunos lugares del sur y sudeste del continente. Hasta noviembre de 1996 se habían declarado tan solo 53.974 casos de sida, aunque el número real probablemente supera los 400.000. En 1992 la OMS estimaba en 1,5 millones el número de adultos vivos infectados por el VIH, y en los dos años siguientes esta cifra se duplicó, rebasando a finales de 1994 los 3 millones. A finales de 1996 la OMS estimaba que en el sur y sudeste de Asia habría 5,2 millones de personas vivas infectadas por el VIH.
La distribución de la epidemia por países es muy desigual. Los más afectados están en el sur y sudeste del continente, destacando la India con 1,8 millones de infectados, Tailandia con 700.000 y Myanmar con 350.000. Por el contrario, grandes zona del centro de Asia apenas están afectadas. Teniendo en cuenta que más de la mitad de la población mundial reside en Asia, la extensión que pueda alcanzar el VIH en este continente condicionará el futuro de la pandemia. El gran impacto del sida en Asia está aún por llegar, y lo hará conforme vayan desarrollando la enfermedad las personas que actualmente están infectadas.
La entrada del VIH en Asia se produjo probablemente de forma paralela en los UDI y a través de prácticas heterosexuales de riesgo. Desde finales de los ochenta y en apenas dos años se produjo una propagación rápida del VIH entre UDI de algunas zonas de Tailandia, Myanmar, Malasia, India y Vietnam, alcanzándose en este colectivo seroprevalencias próximas al 50%. Sin embargo, a la larga ha sido la transmisión heterosexual la que ha adquirido mayor importancia en Asia. La seroprevalencia en prostitutas aumentó drásticamente en áreas de la India y Tailandia, pasando en tres o cuatro años, de cero a tasas superiores al 20%. En adultos jóvenes también se detectan tasas crecientes de infección, como se confirma a través de estudios de reclutas en Tailandia o de donantes de sangre en la India.
La epidemia de VIH en Asia está todavía en pleno proceso de expansión. Hasta el momento su grado de penetración en las distintas regiones es muy desigual. Como se ha visto, hay zonas que están muy afectadas, mientras que otras están todavía en una fase muy inicial. En muchas otras regiones se reproducen situaciones similares en cuanto a la superpoblación, grandes concentraciones urbanas y deficiente desarrollo de la salud pública, lo que hace esperar que en los próximos años el VIH pueda extenderse también masivamente en otros países.
Norte de África y Oriente medio: La introducción del VIH en estos países ha sido más tardía y todavía no es muy bien conocida. La OMS estimaba que a finales de 1996 habría en esta región unas 200.000 personas infectadas por el VIH. Algunos países como Sudán están afectados por la misma epidemia sub-Sahariana y tienen seroprevalencias altas en prostitutas. En otros países la transmisión sexual y por consumo de drogas inyectadas parecen estar en aumento, constituyendo la amenaza de una próxima expansión de la epidemia en esta zona.
3-LA EPIDEMIA DE SIDA EN LOS PAÍSES DESARROLLADOS
Norteamérica: En Estados Unidos fue donde se detectaron los primeros casos de sida. Por ser el país desarrollado más temprana e intensamente afectado, se ha considerado de referencia para la comparación con otros lugares. Hasta la fecha los EE.UU. han notificado más de medio millón de casos, y se estima que tendrán más de 700.000 infectados vivos. La distribución de la epidemia de sida en EE.UU. muestra una clara preferencia por las grandes ciudades de las dos costas, con grandes zonas del interior que apenas se han visto afectadas. El mecanismo de transmisión que ha dado lugar a más casos de sida son las prácticas homosexuales masculinas (52%), el consumo de drogas inyectadas le sigue en importancia (25%) y la transmisión heterosexual ha ocasionado el 8%. Entre los afectados predominan los hombres sobre las mujeres en una proporción de 5 a 1.
La incidencia de sida aumentó a un fuerte ritmo durante la década de los 80, y ha seguido aumentando pero de forma más moderada en los 90. Los grupos de edad más afectados son los adultos jóvenes. Por ello, el sida se ha convertido en pocos años en una de las primeras causas de mortalidad en adultos de 25 a 44 años.
A lo largo del tiempo se han producido algunas modificaciones de interés en el patrón epidemiológico. La transmisión heterosexual y por drogas inyectadas han ido ganando terreno en términos relativos, en detrimento de la transmisión homosexual. Aunque inicialmente predominó la afectación de blancos, hoy día el número de casos de sida diagnosticados en blancos y en negros es similar y la incidencia en hispanos, aunque aún menor, muestra los mayores aumentos. Como consecuencia de todo ello, está ocurriendo un cambio profundo en las características de los afectados por esta enfermedad, que han pasado de ser preferentemente varones homosexuales de raza blanca y clase social media o alta, a predominar los negros o hispanos de clases sociales bajas o marginales, infectados por consumo de drogas o por transmisión sexual. Esta tendencia al progresivo establecimiento de la epidemia de VIH en las poblaciones marginales de las grandes ciudades está siendo un fenómeno generalizado en muchos países industrializados.
Europa: La detección de los primeros casos de sida en Europa fue relativamente temprana, aunque hoy día no se encuentra entre las regiones más afectadas por la pandemia. El número de personas infectadas por el VIH en la Europa occidental se estima en unas 510.000 y un total de 235.000 adultos han desarrollado sida. Entre la Europa del este y los países de la antigua Unión Soviética el número de infectados ascendería a 50.000 y hasta la fecha se han producido unos 4.000 casos de sida.
Hasta el 30 de septiembre de 1996, se han notificado un total de 179.955 casos de sida, de los cuales 6.693 fueron casos pediátricos (menores de 13 años).
Inicialmente, la categoría de transmisión que tuvo mayor importancia en Europa fue la homosexual, afectando preferentemente a países de la zona occidental del continente. En ese primer momento también tuvieron importancia los casos de transmisión heterosexual en personas procedentes de sus antiguas colonias en África sub-Sahariana.
A lo largo de los años 80 fue cobrando fuerza una segunda onda en UDI, que ha marcado las características actuales de la epidemia de sida en Europa. Los casos en UDI aumentaron de forma importante, superando a partir de 1990 a los registrados en homosexuales. De forma secundaria ha surgido un aumento en la incidencia de sida heterosexual, consecuencia de la transmisión de UDI infectados a sus parejas.
Globalmente la incidencia de sida es ascendente, aunque el ritmo de ascenso tiende a irse suavizando (figura 1-4). En algunos países de Europa occidental, especialmente aquellos que han sido más enérgicos en la puesta en marcha de programas de prevención, se ha logrado desde principios de los noventa, frenar el ritmo de ascenso.
La entrada del sida en los países del este de Europa ha sido relativamente reciente. Sus tasas de incidencia de sida y de prevalencia de VIH son todavía muy bajas. Sin embargo, los importantes cambios sociales registrados y la grave depresión económica que padecen muchos de estos países, constituyen un caldo de cultivo para la propagación del VIH. En algunas ciudades se han descrito tasas crecientes de infección en UDI y en prostitutas, datos que resultan preocupantes de cara a una posible expansión de la epidemia.
4-CONSECUENCIAS Y EXPECTATIVAS DE LA EPIDEMIA EN EL MUNDO
Países en desarrollo Los mecanismos por los que se transmite el VIH son similares en países desarrollados y en desarrollo; sin embargo las posibilidades de lucha contra la epidemia dependen mucho del nivel de desarrollo económico, social y educativo del país. La transmisión heterosexual es el principal mecanismo de propagación del VIH en estos países, aunque en algunos lugares tiene también importancia la transmisión nosocomial, por transfusiones y en UDI.
Las consecuencias del sida en la sociedad son muy graves, por su elevada letalidad y por afectar especialmente a adultos jóvenes, que constituyen el soporte económico y social de las poblaciones. El sida ha venido a sumarse a otros muchos problemas de salud (desnutrición, tuberculosis, enfermedades de transmisión sexual, etc.) que azotan a los países menos favorecidos, y con frecuencia interactúa con ellos produciendo un perjuicio aún mayor. Otra consecuencia social importante de la epidemia de sida en los países en desarrollo es el elevado número de hijos de padres con sida. Alrededor de un tercio de los hijos de madres infectadas en estos países nacen también infectados. En el resto de los casos su futuro es también incierto, porque muchos de ellos quedan huérfanos en edades tempranas. La OMS estima que entre 5 y 10 millones de niños quedarán huérfanos por causa del sida para finales de los 90. En el centro y este de África al menos 2 millones de niños han perdido a uno de sus padres por causa del sida.
En resumen, podemos decir que la epidemia de sida está muy extendida en África sub-Sahariana y el Caribe, está en rápida progresión en el sur y sudeste de Asia (figura 1-4), y existe incertidumbre sobre la evolución que pueda tener en el resto de los países. En todo caso, las expectativas generales para los próximos años son hacia un empeoramiento de la situación actual. El cambio en esta tendencia sólo se podrá lograr con la ayuda masiva por parte de los países desarrollados. Existen ejemplos recientes en países como Méjico, Tailandia, Nigeria y Zaire donde se demuestra la posibilidad de detener la progresión de la epidemia mediante intervenciones enérgicas en el campo de la prevención.
Países desarrollados: Estados Unidos y Europa occidental son las regiones del mundo desarrollado donde el VIH se introdujo de forma más temprana y ha adquirido una mayor extensión. Otros países, entre los que se incluyen Canadá, Australia, Nueva Zelanda y Japón, presentan características epidemiológicas similares, pero con un grado de penetración mucho menor.
En general la epidemia se desarrolló inicialmente en hombres homosexuales y en UDI, para posteriormente ampliar su espectro de riesgo a segmentos mucho más amplios de la población a través de la transmisión heterosexual. Este cambio de características supone un gran aumento en el número de personas potencialmente a riesgo, lo que dificulta la vigilancia de la transmisión del VIH e introduce un gran componente de incertidumbre sobre la evolución futura.
Todos estos países cuentan con recursos y medios suficientes para hacer frente a la epidemia, aunque para ello se requiera de un esfuerzo económico y la colaboración de toda la sociedad. Sin embargo, el sida está evidenciando la existencia de deficiencias organizativas y desigualdades internas. Globalmente estos países disponen de medios que permiten, en principio, dar tratamiento adecuado a todos los enfermos; pero la desigualdad económica y social se manifiesta a veces en la asistencia sanitaria recibida.
Aunque se reconoce la importancia de la prevención, el énfasis que se pone en ella en ocasiones no es suficiente para hacerla llegar a toda la población. En los países desarrollados el sida esta tendiendo a establecerse preferentemente entre los colectivos socialmente más desfavorecidos, contribuyendo a aumentar las desigualdades existentes.
A la vista del panorama mundial que se ha descrito, la solución de la epidemia internamente en un país nunca podrá considerarse definitiva mientras siga progresando en el resto del mundo. El flujo continuo de inmigrantes del tercer mundo hacia el mundo desarrollado es un argumento más que demuestra la ineficacia de cualquier barrera geográfica a la extensión del VIH.
4-Epidemiología del SIDA en Europa
Europa no está entre los continentes más afectados por la pandemia. Hasta el 30 de septiembre de 1997 se han notificado un total de 200.531 casos de sida en la Región Europea de la OMS (figura 1).
En Europa, las vías de transmisión más frecuentes en los casos de sida han sido las prácticas de riesgo en varones homosexuales/bisexuales, seguidas del uso compartido de material de inyección y, en tercer lugar, las prácticas de riesgo en relaciones heterosexuales. Sin embargo, en los últimos años, la incidencia de casos ha experimentado algunas variaciones. Desde 1990, el número de casos atribuidos al uso compartido del material de inyección supera a los debidos a prácticas homosexuales en hombres, experimentando los primeros una importante subida, consecuencia del impacto del sida en UDVP en los países del sur de Europa, especialmente España.
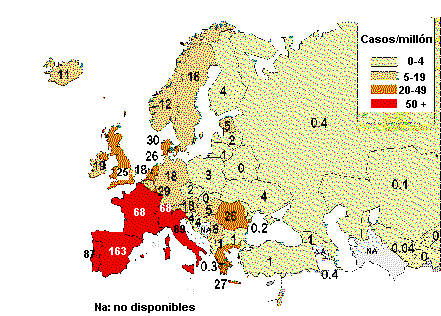
Figura 1
Sin embargo, es difícil valorar la evolución del conjunto europeo sin tener en cuenta las distintas subepidemias que la integran, resultado del inicio, localizaciones geográficas, colectivos afectados y factores de riesgo que favorecieron su expansión. Con relación al resto de los países, la epidemia tuvo un inicio más tardío en España, Italia y Portugal. Bastó tan sólo una década para que España escalara rápidamente posiciones, tanto en número de casos, como en tasas. En 1988 ya era el segundo país en número de casos (precedido por Francia) y en tasa de incidencia por millón de habitantes (precedido por Suiza).
Desde 1990, España es el primer país europeo en tasa de incidencia de sida por millón de habitantes, y desde 1994 ocupa también el primer lugar en número de casos nuevos diagnosticados.
El Centro Europeo para la Vigilancia Epidemiológica del Sida estima que en 1996 se diagnosticarán en España 163 casos nuevos por millón de habitantes. Como se observa en la figura 1, los países más afectados se encuentran en el sur de Europa. Así Italia tiene una tasa de 89 casos por millón de habitantes, Portugal 87 por millón y Francia al igual que Suiza 68 por millón de habitantes.
5-La epidemia del SIDA en España:
Desde que se produjo el primer caso de sida en España, en 1981, el número de casos nuevos ha ido aumentando de año en año, hasta convertirse en un problema de salud pública de primera magnitud. En mayo de 1983, ante la sospecha de la existencia de casos de sida en España, el Ministerio de Sanidad y Consumo creó la Comisión Nacional de Trabajo sobre el Sida, que confirmó su presencia en nuestro país y recogió los primeros casos.
Hasta el 30 de Septiembre de 1997 se había notificado en España un total acumulado de 47.698 casos de sida. Entre ellos, 832 (1,7%) fueron diagnosticados en menores de 13 años (casos pediátricos). La notificación de los casos diagnosticados en los últimos años, especialmente en 1996, no es completa debido al retraso que se produce desde el diagnóstico hasta que la notificación es recibida en el Registro Nacional de Casos. En este contexto, hasta la fecha señalada, se ha recibido información sobre 5.875 casos diagnosticados durante 1.996, y cuando se complete la notificación se espera que esta cifra se aproxime a los 6.500 casos (figura 2).
Distribución geográfica del sida en España: En 1986, todas las comunidades autónomas habían notificado ya algún caso de sida, lo que ponía de manifiesto la extensión de la epidemia a toda España. La prevalencia de las distintas conductas de riesgo, las características sociales y demográficas, y los diferentes momentos en que irrumpió la epidemia en cada lugar han ocasionado grandes diferencias geográficas en la incidencia de esta enfermedad, de forma que algunas comunidades autónomas han alcanzado tasas cinco veces mayores que otras, presentando las mayores tasas las comunidades de Madrid, Cataluña, País Vasco y Baleares (tabla 1).
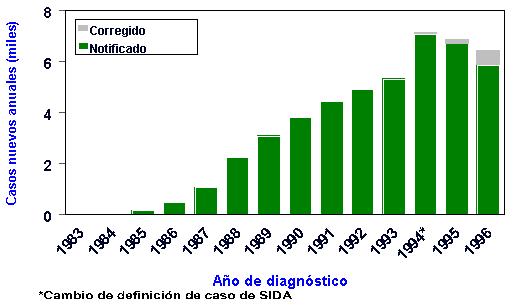
Figura 2
Tabla 1. TASAS DE SIDA POR MILLÓN DE HABITANTES SEGÚN CC.AA. DE RESIDENCIA. Casos diagnosticados durante 1996. (Actualización 30/09/97)
| CC.AA. | TASA | CC.AA. | TASA |
| Andalucía | 119,08 | Extremadura | 86,08 |
| Aragón | 79,57 | Galicia | 124,83 |
| Asturias | 97,68 | Madrid | 281,45 |
| Baleares | 224,85 | Murcia | 107,01 |
| Canarias | 98,39 | Navarra | 129,57 |
| Cantabria | 102,77 | País Vasco | 204,38 |
| Castilla y León | 102,82 | La Rioja | 170,72 |
| Cast-La Mancha | 69,22 | Ceuta | 356,73 |
| Cataluña | 200,48 | Melilla | 126,50 |
| Com. Valenciana | 104,49 | ||
| TOTAL | 151,63 |
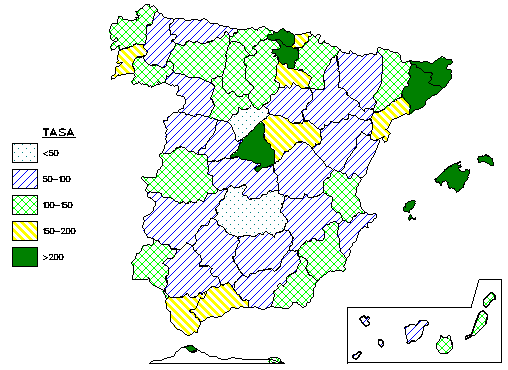
Figura 3
En la figura 3 se observan las importantes diferencias que existen en las tasas provinciales incluso dentro de la misma comunidad autónoma. Las provincias más afectadas son Ceuta, Madrid, Baleares, Álava, Vizcaya, Barcelona y Gerona; todas ellas sobrepasan los 200 casos nuevos por millón de habitantes.
Categorías de transmisión, edad y sexo: La definición de las categorías de transmisión ha estado condicionada por la escasez de conocimientos sobre la infección al inicio de la epidemia. En un primer momento se relacionaron los antecedentes personales con la presencia de infección y/o enfermedad, consensuándose estas categorías a escala internacional. Aunque los conocimientos actuales podrían permitir asociar la transmisión de la infección a determinadas prácticas de riesgo (generalmente uso compartido de material de inyección, relación sexual, anal o vaginal sin protección, u otras de menor frecuencia), se mantienen como categorías de transmisión las establecidas inicialmente.
Los primeros casos de sida en personas que habían recibido transfusiones con sangre infectada se diagnosticaron en 1983.
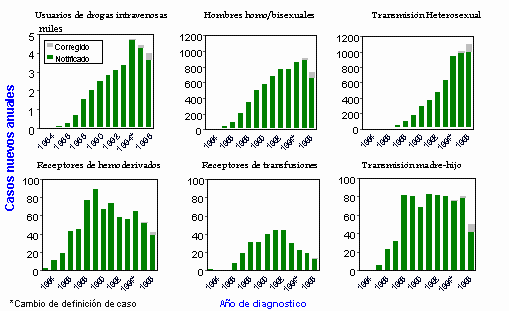
Figura 4
En el año 1984 apareció el primer caso de transmisión perinatal, mientras el primer caso por transmisión heterosexual no se detectó hasta 1985. Año tras año, el sida fue aumentando su incidencia en todas las categorías de transmisión (figura 4).
Desde muy pronto, el consumo de drogas por vía intravenosa fue el mecanismo de transmisión del VIH más frecuente de los casos de sida en España. Esto contrastaba inicialmente con la situación en el resto de Europa, donde predominaban los casos de varones con prácticas homosexuales. No obstante, Italia no tardó en presentar una distribución de casos por prácticas de riesgo similar a la nuestra.
La frecuencia y distribución de las principales categorías de transmisión del virus y su evolución en el tiempo es variable entre comunidades autónomas (tabla 2, al final del epígrafe). En general la mayor incidencia de casos se da en los grandes núcleos urbanos de las zonas más industrializadas. Los UDVP son la categoría de transmisión más frecuente en todas las CCAA salvo en Canarias, donde ocupan el segundo lugar, tras los hombres con prácticas homosexuales.
El predominio de casos de sida en usuarios o ex-usuarios de drogas por vía parenteral se ha mantenido en España desde el comienzo de la epidemia, protagonizando directa o indirectamente casi dos tercios de los casos que se han diagnosticado.
Los casos de sida en receptores de hemoderivados y transfusiones sanguíneas, aumentaron hasta alcanzar su techo en 1989 y 1991 respectivamente y, desde entonces, su número fue declinando. En los próximos años cabe esperar que acaben desapareciendo los casos debidos a ambas formas de transmisión, como consecuencia de la aplicación sistemática en España de controles sanitarios en donaciones de sangre y hemoderivados.
Los casos de sida en nacidos de madre infectada suponen una pequeña proporción (menos del 2% del total), en comparación con otras formas de transmisión. No obstante, esta cifra es alta si la comparamos con su frecuencia en otros países europeos. En España estos casos aumentaron hasta alcanzar las mayores cifras entre 1988 y 1991. Desde entonces, su número se ha estabilizado, e incluso ha comenzado a disminuir.
Los casos de sida debidos a transmisión por contactos heterosexuales, aunque aparecieron relativamente tarde en el tiempo, aumentan con mayor intensidad en los últimos años. En 1994 la transmisión heterosexual se convirtió en la segunda vía de transmisión que ha originado más casos de sida.
El sida en España afecta a una proporción mayor de hombres que de mujeres, fijándose una relación de 4,3 a 1 (figura 5). La explicación de esta situación radica en que el consumo de drogas por vía intravenosa es mucho más frecuente en hombres que en mujeres y las prácticas homosexuales conllevan riesgo cuando ocurren entre varones. Sin embargo cabe destacar, con diferencias poco importantes para ambos sexos, la juventud de las personas afectadas. Cuatro de cada cinco casos de sida se han producido en jóvenes entre los 20 y 39 años.
Mortalidad: El sida tiene un impacto importante y creciente en la mortalidad de adultos jóvenes. Desde 1993 es la primera causa de muerte en España en población entre 25 y 44 años, habiendo superado a los accidentes de circulación, al cáncer y a las enfermedades cardiovasculares. La tasa de años potenciales de vida perdidos (APVP) por sida y VIH por 100.000 hombres fue de 719 en 1994, y la de mujeres de 304, constituyendo respectivamente la primera y la segunda causa respecto al resto. Estos indicadores de mortalidad sitúan al sida entre los principales problemas de salud pública en España.
Figura 5
Vigilancia epidemiológica del VIH y conductas de riesgo: El conocimiento de la prevalencia de infección VIH en diferentes grupos de población y su evolución en el tiempo, es más importante que el número de personas infectadas en población general. Siendo el riesgo de infección por VIH universal, no se distribuye de forma homogénea en toda la población. Por estos motivos, la estrategia recomendada por la Organización Mundial de la Salud para la vigilancia epidemiológica de la infección por el VIH se basa en encuestas de seroprevalencia en poblaciones centinela.
En el contexto internacional se han desarrollado metodologías que permiten una aproximación al número y evolución de las infecciones por el VIH a partir de los datos sobre casos de sida. Aplicando estos métodos, se estima que en España hay unas 120.000 personas vivas e infectadas por el VIH.
El sistema de vigilancia epidemiológica del VIH aún no ha adquirido en nuestro país un nivel de implantación y desarrollo equiparable al de casos de sida, hecho por el que, en muchos casos, los datos que se conocen provienen de estudios regionales o locales. Lo mismo ocurre, aunque con un menor nivel de desarrollo e implantación territorial, con los sistemas de vigilancia de conductas de riesgo para el VIH. No obstante, los datos de que disponemos aportan suficiente información para conocer el grado de afectación y la tendencia en el tiempo de la infección en determinados colectivos vulnerables.
El impacto del sida entre los UDVP ha convertido a España en el país con mayor incidencia de sida de Europa. Las tasas de infección por VIH en UDVP están entre el 35 y el 40 %, de acuerdo con los datos más recientes, consecuencia de la elevada prevalencia de prácticas de inyección y sexuales poco seguras.
Al principio de la década de los ochenta, casi todos los consumidores de heroína utilizaban la vía inyectada. Además, la mayoría de los estudios coinciden en señalar que el inicio en el uso inyectado de las drogas se produce bastante precozmente (más del 60% se inicia entre los 15-19 años), que la frecuencia diaria de inyección es elevada y que también lo es la frecuencia de uso compartido de material de inyección (en el período 1990-1994 de un 15% a un 50% de los inyectores había compartido jeringuillas recientemente), siendo esta práctica más común entre las mujeres. En este contexto, el VIH ha encontrado la oportunidad de diseminarse fácilmente dentro de la comunidad de UDVP.
La alta prevalencia de conductas de riesgo entre los UDVP (de inyección, y sexuales) no solo aumenta la probabilidad de infección intragrupo, sino también en la población no usuaria, a través de las prácticas sexuales de riesgo. La mitad de las parejas de UDVP son personas no UDVP y según una encuesta recientemente analizada entre el 35 y el 45% de este colectivo no utiliza nunca el preservativo. La posible transmisión intragrupo se potencia si tenemos en cuenta que, el 20-45% de las mujeres UDVP han referido haber mantenido relaciones sexuales de tipo comercial.
Recientemente, como resultado de la información y de la educación sanitaria dirigida a este colectivo, de los distintos programas de prevención y, también, del miedo a la enfermedad, muchos UDVP han abandonado la vía inyectada o han modificado sus prácticas de inyección. La proporción de drogodependientes admitidos por primera vez a tratamiento que usaban la heroína preferentemente inyectada, ha pasado de un 50% en 1991 a un 27% en 1996. Por el contrario, los cambios en las conductas sexuales de riesgo y, en especial, el uso del preservativo, no son tan evidentes.
Por lo que se refiere a la transmisión heterosexual del VIH en población general, aunque hay pocos datos acerca de la frecuencia y diferentes tipos de conductas sexuales, diversos estudios señalan la baja utilización del condón durante las relaciones sexuales con penetración. La edad de inicio de las relaciones sexuales coitales en España se encuentra en torno a los 17-18 años, algo mayor en las mujeres. Según los resultados de la encuesta domiciliaria sobre población española mayor de 14 años realizada por el Plan Nacional sobre Drogas en 1996, únicamente el 37,7% de la población que había tenido contactos sexuales ocasionales en el año anterior refirieron haber utilizado el preservativo sistemáticamente en todas estas relaciones. Sólo el 6,1% (9,8% de los hombres y 2,6% de las mujeres) tuvo más de una pareja sexual durante los últimos doce meses. El 2,5% mantuvo conductas sexuales que implican riesgo de transmisión del VIH para él o su pareja, definiendo conducta sexual de riesgo el tener más de una pareja sexual y no utilizar siempre preservativo. Esta situación también fue más frecuente entre los hombres (4%) que entre las mujeres (1,1%). El porcentaje de población a riesgo fue más elevado entre los 20 y los 29 años.
En el caso de las relaciones homosexuales entre hombres, la transmisión se relaciona con el tipo de práctica y el número de parejas. El coito anal receptivo sin protección se muestra como la práctica asociada a mayores tasas de seroprevalencia de VIH. A pesar de la escasez de datos acerca de la frecuencia de esta práctica, estudios llevados a cabo en la ciudad de Barcelona ponen de manifiesto una disminución de su frecuencia.
La prevalencia de infección por VIH entre mujeres que practican la prostitución pero no consumen drogas inyectadas no supera el 5%. Sin embargo, actualmente existe una estrecha relación entre uso de drogas y prostitución, especialmente en el colectivo de mujeres. Muchas de las mujeres y algunos hombres UDVP recurren a la prostitución para financiar su consumo y ello incrementa el riesgo de infección por esta vía.
Evolución de la epidemia en España: El número de casos nuevos de sida diagnosticados anualmente ha disminuido por segundo año consecutivo. En 1995 se notificaron un 3% menos que en 1994 y esta cifra pasó al 6% si se compara el año 95 con el 96.
En resumen, aunque el nivel de incidencia es todavía elevado, 163 casos nuevos por millón de habitantes en 1996 (cifra esperada en función de la corrección del retraso en la notificación), la evolución de la epidemia es favorable para todas las categorías de transmisión con la excepción de la asociada a las prácticas heterosexuales de riesgo. En usuarios de drogas inyectadas el número de casos continúa el descenso iniciado en 1995; se mantiene el claro descenso de los casos atribuidos a la recepción de sangre y de hemoderivados y en 1996 se detecta un descenso del 20% en la incidencia de casos de hombres homo/bisexuales y de un 34% en los de transmisión madre - hijo.
De una forma más precisa, la evolución de la epidemia vendrá determinada por el número de nuevas infecciones por VIH que se estén produciendo y de las que se vayan a producir. El futuro de la epidemia VIH/sida en España dependerá, en suma, de la respuesta social y de la capacidad de las administraciones públicas sanitarias y sociales para responder a la información epidemiológica con intervenciones efectivas en materia de prevención.
Tabla 2. SIDA EN ESPAÑA. DATOS ACUMULADOS DESDE 1981. Fecha de actualización: 30 de Septiembre de 1997.
Número y porcentaje por categoría de transmisión, según la Comunidad Autónoma de residencia. Registro Nacional de SIDA.
| Homo + bise | UDVP | Homo+UDI | Hemoder. | Transfus. | HMR | Hetero. | Descon/N.C. | Otros | Total | |||||||||||||||
| CCAA | N | % | N | % | N | % | N | % | N | % | N | % | N | % | N | % | N | % | N | |||||
| Andalucía | 530 | 8,3 | 4606 | 72,0 | 178 | 2,8 | 132 | 2,1 | 38 | 0,6 | 73 | 1,1 | 647 | 10,1 | 173 | 2,7 | 18 | 0,3 | 6395 | |||||
| Aragón | 68 | 7,9 | 509 | 59,2 | 19 | 2,2 | 30 | 3,5 | 7 | 0,8 | 19 | 2,2 | 145 | 16,9 | 58 | 6,7 | 5 | 0,6 | 860 | |||||
| Asturias | 86 | 10,5 | 519 | 63,1 | 11 | 1,3 | 11 | 1,3 | 13 | 1,6 | 8 | 1,0 | 123 | 15,0 | 51 | 6,2 | 822 | |||||||
| Baleares | 301 | 23,4 | 649 | 50,4 | 23 | 1,8 | 21 | 1,6 | 12 | 0,9 | 25 | 1,9 | 195 | 15,1 | 60 | 4,7 | 2 | 0,2 | 1288 | |||||
| Canarias | 402 | 38,1 | 338 | 32,0 | 31 | 2,9 | 23 | 2,2 | 11 | 1,0 | 16 | 1,5 | 139 | 13,2 | 91 | 8,6 | 5 | 0,5 | 1056 | |||||
| Cantabria | 45 | 10,2 | 302 | 68,2 | 16 | 3,6 | 4 | 0,9 | 3 | 0,7 | 10 | 2,3 | 43 | 9,7 | 17 | 3,8 | 3 | 0,7 | 443 | |||||
| Castilla y León | 96 | 5,9 | 1145 | 70,5 | 19 | 1,2 | 50 | 3,1 | 21 | 1,3 | 32 | 2,0 | 208 | 12,8 | 50 | 3,1 | 3 | 0,2 | 1624 | |||||
| Cast-La Mancha | 65 | 8,0 | 541 | 66,5 | 15 | 1,8 | 19 | 2,3 | 8 | 1,0 | 6 | 0,7 | 116 | 14,3 | 40 | 4,9 | 3 | 0,4 | 813 | |||||
| Cataluña | 2165 | 20,2 | 6153 | 57,4 | 175 | 1,6 | 102 | 1,0 | 42 | 0,4 | 183 | 1,7 | 1362 | 12,7 | 518 | 4,8 | 22 | 0,2 | 10722 | |||||
| Com. Valenciana | 450 | 12,4 | 2290 | 62,9 | 67 | 1,8 | 47 | 1,3 | 33 | 0,9 | 57 | 1,6 | 377 | 10,4 | 204 | 5,6 | 114 | 3,1 | 3639 | |||||
| Extremadura | 26 | 5,0 | 404 | 77,1 | 9 | 1,7 | 15 | 2,9 | 3 | 0,6 | 12 | 2,3 | 39 | 7,4 | 14 | 2,7 | 2 | 0,4 | 524 | |||||
| Galicia | 188 | 8,1 | 1577 | 68,2 | 30 | 1,3 | 49 | 2,1 | 30 | 1,3 | 13 | 0,6 | 366 | 15,8 | 55 | 2,4 | 3 | 0,1 | 2311 | |||||
| Madrid | 1785 | 15,5 | 7620 | 66,4 | 124 | 1,1 | 133 | 1,2 | 67 | 0,6 | 209 | 1,8 | 1008 | 8,8 | 514 | 4,5 | 22 | 0,2 | 11482 | |||||
| Murcia | 135 | 17,8 | 421 | 55,6 | 21 | 2,8 | 13 | 1,7 | 5 | 0,7 | 15 | 2,0 | 110 | 14,5 | 33 | 4,4 | 4 | 0,5 | 757 | |||||
| Navarra | 36 | 6,6 | 399 | 73,5 | 3 | 0,6 | 8 | 1,5 | 2 | 0,4 | 5 | 0,9 | 66 | 12,2 | 22 | 4,1 | 2 | 0,4 | 543 | |||||
| País Vasco | 175 | 4,8 | 2819 | 76,9 | 46 | 1,3 | 55 | 1,5 | 20 | 0,5 | 56 | 1,5 | 396 | 10,8 | 96 | 2,6 | 4 | 0,1 | 3667 | |||||
| La Rioja | 13 | 4,3 | 203 | 67,7 | 7 | 2,3 | 3 | 1,0 | 1 | 0,3 | 8 | 2,7 | 53 | 17,7 | 12 | 4,0 | 300 | |||||||
| Ceuta | 1 | 1,1 | 71 | 81,6 | 2 | 2,3 | 1 | 1,1 | 4 | 4,6 | 8 | 9,2 | 87 | |||||||||||
| Melilla | 5 | 10,9 | 32 | 69,6 | 2 | 4,3 | 2 | 4,3 | 3 | 6,5 | 2 | 4,3 | 46 | |||||||||||
| Extranjero | 81 | 47,9 | 47 | 27,8 | 3 | 1,8 | 2 | 1,2 | 2 | 1,2 | 18 | 10,7 | 14 | 8,3 | 2 | 1,2 | 169 | |||||||
| Desconocida | 22 | 14,7 | 96 | 64,0 | 4 | 2,7 | 3 | 2,0 | 1 | 0,7 | 2 | 1,3 | 10 | 6,7 | 10 | 6,7 | 2 | 1,3 |
||||||
| Enviado por: | Ramón Francia |
| Idioma: | castellano |
| País: | España |