Química
Emisión atómica
EMISION ATOMICA EN FLAMA Y ESPECTROS
Objetivo:
Constatar los diferentes niveles energéticos en que puedan contraerse los electrones en un átomo, observando los diferentes colores, que emiten determinadas sustancias en una flama de metano.
INTRODUCCION:
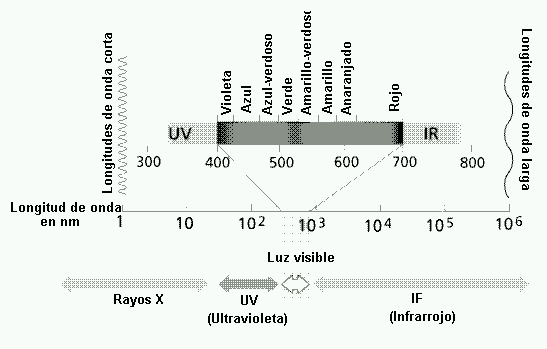
Un arco iris puede descomponerse en una gama de colores que constituyen desde el violeta hasta rojo, cada uno con la longitud de onda característica.
Cuando una mezcla de ondas electromagnéticas de diferente frecuencia atraviesa un medio, algunos llevan mayor velocidad que otras. Y la mezcla de radiaciones de estas frecuencias se dispersa o sea, se separa de sus frecuencias componentes al pasar . El resultado de estas dispersiones es llamado” ESPECTRO” .
Un átomo es capaz de absorber diferentes tipos de energía calorífica y luminosa que las conducen a una serie de estados excitados. La consecución de volver al equilibrio se puede realizar a través de choques moleculares de la emisión o radiación.
La luz blanca produce al descomponerse lo que llamamos espectro de emisión que contiene el conjunto de colores que corresponden a la gama de longitudes de onda. Los elementos químicos en estado gaseosos y sometidas temperaturas elevadas producen espectros discontinuos en los que se aprecia un conjunto de líneas que corresponden a emisiones de solo unas longitudes de onda. Al someter los reactivos al fuego emiten un color , a esto se le añade alcohol metilico.
MARCO TEORICO:
El tipo de radiación emitida dependerá de la diferencia entre los estados excitados y el fundamental, de acuerdo con la ley de máx. planck.
E= hv
Donde: E= diferencia de energías entre los estados excitados y fundamentales
h = 6,626 × 10-34 julios·segundo.
V= frecuencia
De esta manera un determinado elemento da lugar a una serie de radiaciones características que constituyen un “espectro de emisión” que puede considerarse como su huella dactilar y permite, por tanto su identificación.
MATERIALES Y EQUIPO:
2 capsulas de porcelana
1 varilla
1 vaso de precipitado de 50ml.
REACTIVOS:
cloruro de litio
cloruro de calcio
cloruro de vario
yoduro de sodio
yoduro de potasio
acido bórico
bromuro de cobre II
bromuro de cobre I
nitrato de estroncio
carbonato de litio
alcohol
DESARROLLO DE LA PRÁCTICA
1.- se pone una pizca (aprox. 5mg.) del reactivo a estudiar sobre la capsula, se añaden 4 o 5 ml. De metanol y se pende fuego.
2.- observar los colores de la llama al añadir cada uno de estos compuestos, agitar con la varilla al cabo de unos segundos de ignición.
3.- cuando la capsula de porcelana esta fría, lavar, secar, repetir el experimento, con cada uno de los reactivos propuestos (teniendo cuidado de no usar mas alcohol del requerido).
RESULTADOS
| COMPUESTO | COLOR |
| CLORURO DE LITIO | ROJO |
| YODURO DE SODIO | AMARILLO |
| YODURO DE POTASIO | PURPURA |
| CLORURO DE CALCIO | NARANJA |
| ACIDO BORICO | VERDE |
| BROMURO DE COBRE II | VERDE Y AZUL |
| CLORURO DE COBRE | VERDE |
| NITRATO DE ESTRONCIO | ROJO |
| CARBONATO DE LITIO | ROJO |
| CLORURO DE BARIO | AMARILLO CLARO |
GRAFICA DE LONGITUDES DE ONDA
CONCLUSIONES:
LOS COMPUESTOS QUE UTILIZAMOS SI FUERON COMPROBADOS DANDO ASI, SU RESPECTIVO COLOR.
Según las observaciones obtenidas y los datos tabulados pudimos identificar en este laboratorio los elementos Ba, Ca, Cu, Na, los cuales emitieron luces de colores idénticos a los dados en la tabla. La excepción fue en el yoduro de potasio presentó una luz de color anaranjado en vez de la luz de color violeta pálido esperada, este error se le atribuye a la contaminación de este elemento.
Con las experiencias realizadas pudimos lograr el objetivo propuesto, el cual es identificar los elementos en un compuesto determinado mediante el método de coloración de la luz que presento a la llama.
-
Conclusión : Para realizar exitosamente este método de identificación es necesario tener demasiado cuidado al manipular las sustancias y utensilios en cuestión, ya que fácilmente pueden ser contaminados.
.
Finalmente este método como identificación de elementos en una sustancia no es tan específico. Para tener mayor certeza o menor rango de error en los resultados, seria ideal hacer pasar los haces de luz obtenidos por las sustancias estudiadas, a través de un prisma, para luego realizar un minucioso estudio de su espectro de rayas.
CUESTIONARIO
1.-QUE SE CONOCE COMO ESTADO DE EXITACION?
R= CUANDO LAS CORRIENTES SE ENCIENDEN LOS ELECTRONES SE EXITAN.
2.-POR QUE HAY QUE AÑADIR EN ESTA EXPERIENCIA SUSTANCIAS QUE SEAN SOLUBLES?
R= PARA QUE SEA FACIL LA DISOLUCION DEL LOS REACTIVOS Y QUE LA MEZCLA LLEGUE MAS FACIL A SU PUNTO DE EXITACION.
3.- EN LA INTRODUCCION SE HA COMENTADO QUE UNA SUSTANCIA PUEDE TENER ESTADOS EXCITADOS ¿COMO EXPLICARIAS QUE UNA SUSTANCIA DETRMINADA PUEDE TENER VARIOS ESTADOS EXITADOS?
R= POR QUE ABSORVE DIFERENTES TIPOS DE ENERGIA CALORIFICA Y LUMINOSA.
4.- POR QUE CADA SUSTANCIA PRESENTA UN ESPECTRO CARACTERISTICO?
R= DEPENDE DEL REACTIVO Y DEL ESTADO DE EXCITACIÓN
5.- QUE DIFERENCIA EXISTE ENTRE EL ESPECTRO DE ABSORCION Y EL DE EMISION?
R= EMISION: CUANDO LA LUZ ES EMITIDA
ABSORCION: CUANDO EL ESPECTRO CHECA TODAS LAS LONGITUDES DE ONDA DE LA LUZ Y DETERMINA SU ABSORCION.
6.-QUE APLICACIÓN PODRIA DARLE A SUS OBSERVACIONES SOBRE LOS ESPECTROS EXPLICAR POR QUE?
R= La absorción espectrofotométrica en las gamas visible y ultravioleta del espectro electromagnético es un método espectral cuantitativo común para sustancias orgánicas e inorgánicas. Con esta técnica se mide la transparencia relativa de una disolución, antes y después de hacerla reaccionar con un reactivo colorante. La disminución que se produce en la transparencia de la disolución es proporcional a la concentración del compuesto analizado.
Descargar
| Enviado por: | Lagarto Ittla |
| Idioma: | castellano |
| País: | México |
