Química
Electrolisis
Electrolisis
Vamos realizar una electrolisis que consiste en llevar acabo una reaccion quimica de oxidacion reduccion utilizando corriente electrica. En la cual habra una especie quimica que se oxidara y otra que se reducira. Estas semireacciones se produciran en torno a un electrodo. Entorno al anodo (electrodo positivo) donde tendra lugar la oxidacion (perdida de electrones) y entorno el catodo (electrodo negativo) la reduccion (ganancia de electrones) .En anodo seria el reductor1 y el catodo el oxidante2. La particula que se oxida esta ademas oxidando a las particulas de su alrededor y la particula que se reduce esta ademas reduciendo a las de su alrededor por esto debemos saber que las particulas estan intercambiandose particulas con carga. Lo que significa que las particulas correspondientes estan formadas por cargas en forma de particulas, por lo cual, se obtiene que la materia tiene naturaleza electrica. Esto ya lo demostro Faraday en el siglo XIX.La electrolisis tiene que ser llevada acabo en un medio en el cual se transmita la corriente electrica. Utilizaremos una disolucion entre agua (H2O) y algun compuesto ionico que se disuelva en esta o algun compuesto que al disolverse en agua forme iones debido a que el agua por su bajo contenido en particulas con carga es mala conductora. Nosotros utilizaremos para esta ocasión acido sulfurico (H2SO4) como electrólito3 en la primera electrolisis y cloruro de sodio (Na Cl) en la segunda.
Experimento
Para llevar acabo la electrolisis utilizamos un voltametro de Hoffman4. Es un instrumento con dos tubos graduados de arriba a abajo y otro tubo comunicado con los graduados el cual tiene un ensanchamiento arriba. Los tubos graduados tienen una llave esmerilada. En cada uno de los tubos graduados hay un electrodo en este caso de platino.Los cuales alimentaremos con corriente continua. El alimentador que vamos a utilizar convierte la corriente alterna en continua que es la que necesitamos para realizar la electrolisis. Tiene dos salidas de corriente continua lo vemos porque tiene bornes de colores rojo y negro con simbologia = y las de corriente alterna son los dos negros y con diferente simbologia para ser exactos una onda. Conectaremos el rojo en el anodo y el negro al catodo. En el anodo estara la reaccion de oxidacion y en el catodo de reduccion. Necesitaremos una diferencia de potencial de unos dos voltios. Pero nosotros vamos a utilizar una diferencia d potencial de 28,5 V .Mediremos la diferencia de potencial con un voltimetro. En la electrolisis que vamos a realizar el comoponente que se oxidara sera el oxigeno y sera el hidrogeno el que se reducira.
Al probar el experimento solo con agua no funciona debido a que no se transmite la corriente electrica ( no se ven burbujas). Preparamos la disolucion entre agua (H2O) y acido sulfurico (H2SO4) en la cual por motivos de seguiridad preparamos la disolucion en un recipiente de vidrio donde primero hechamos el agua y despues el acido sulfurico para que la disolucion no pueda producir daños al manipulador. Al mezclar estos componentes observamos que el recipiente de virio esta caliente debido a la mezcla que acbamos de hacer. Introducimos la mezcla en el voltimetro junto con el agua que ya estaba dentro. Cerramos las llaves de los tubos graduados para que el gas que obtendremos en el experimento no escape por ahí. Aplicamos la diferencia de potencial de 28,5 V.
Observamos que: La electrolisis se esta produciendo debido a que observamos que se forman burbujas pero esta se produce muy lentamente y va variando no es estable.
Que en el tubo donde hemos situado el anodo se esta produciendo la oxidacion del oxigeno y en el otro tubo, donde esta el catodo se esta produciendo la reduccion del hidrogeno. Pero en el tubo donde se produce la reduccion hay mayor volumen de gas que en el que se produce la oxidacion y como el volumen que ocupa un gas a una determinada temperatura y a una determinada presion es directamente proporcional al numero de particulas que haya llegamos a la conclusion de que se producen mas particulas de hidrogeno (H2) que de oxigeno (O2). Comparando las medidas se puede decir que se produce aproximadamente el doble de particulas de hidrogeno que de oxigeno.
1ª medida: 1cm3 de H2 0,5 cm3 de O2
2ª medida: 1,3 cm3 de H2 0,6 cm3 de O2
3ª medida: 1,8 cm3 de H2 0,9 cm3 de O2
Tambien hay que añadir que a mayor diferencia de potencial mas rapidez en la electrolisis debido que en el segundo intento la diferencia de potencial fue mayor y se obtuvieron mayores resultados en menos tiempo. Pero se observo mas o menos lo mismo que habia ocurrido en el 1º. Probamos con la culminacion del experimento que nuestras hipotesis o conclusiones eran correctas. Ademas aprendimos que el hidrogeno es combustible dado a que al acercarleuna llama prende.
Ahora vamos a hacer la electrolisis con agua mezclada con cloruro de sodio. Hacemos la mezcla en un recipiente y luego lo vertemos en el voltimetro aplicamos la diferencia de potencial pertinente, sabemos que puede reducirse el H+ y el Na+ aunque es mas facil que se reduzca el H+ y puede oxidarse el O y el Cl- y observamos que:
Observaciones: Empiezan a surgir burbujas y el volumen de gas avanza rapido en el catodo mientras que en el anodo va muy despacio parece que las burbujas no llegan arriba como si se disolviesen en el agua y que las medidas de sustancia que se observaran el los diferentes tubos seran las siguientes:
Catodo Anodo
1ª medida 16 cm3 1 cm3
2ª medida 20 cm3 1,4 cm3
3ª medida 25 cm3 1,6 cm3
4ª medida 35 cm3 2 cm3
5ª medida 40 cm3 2,8 cm3
Tambien que el que se reduce realmente es el H del agua y que si se hubiera oxidado el oxigeno del agua habira pasado lo de antes pero no ha pasado, que el anodo tiene un ligero color amarillento prodicido por el cloro y que fijandonos en las semireacciones por cada molecula de Cl formada se desprenden 2 electrones y por cada molecula de H que se desprende se necesitan 2 electrones. Si realmente se oxida el cloruro deberiamos obtener el mismo volumen de cloro que de nitrogeno.
1 el que le da electrones a otro y el otro los gana por lo cual él se oxida
2 aquel que se oxida a otro, hace que el otro pierda electrones y él los gana y se reduce
3 aquella sustancia que al disolverse en agua da lugar a una disolucion conductora y se dividen en 2 tipos:
Electrolitos fuertes = que se disuelven muy bien en el caso de que se trate de una sustancia iónica. Cuando se trata de sustancias covalentes, son compuestos en los que la mayor parte de las partículas sufren la ruptura heterolítica.
Electrolitos debiles = en el caso de las sustancias iónicas, son compuestos que se disuelven muy mal y cuya conducción es de muy mala calidad. Si se trata de sustancias covalentes, se produce una ruptura heterolítica al disolverse, sólo en alguna de sus partículas
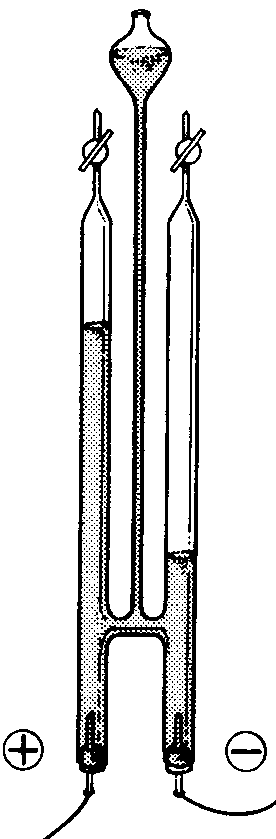
4 esto es un voltimetro de
Hoffman
Descargar
| Enviado por: | Ji-indur |
| Idioma: | castellano |
| País: | España |
