Química
Electrólisis del agua
LABORATORIO N# 1
ELECTROLISIS DEL AGUA
PRESENTADO A:
JIMMY BERNAL EN
EL ÁREA DE QUÍMICA
CURSO:
NOVENO C
9C
COLEGIO REYES CATÒLICOS
SANTIAGO DE CALI MARZO DEL 2OO4
INTRODUCCIÓN
ELECTROLISIS
APLICACIONES INDUSTRIALES
La descomposición por electrolisis es la base de un gran número de procesos de extracción y fabricación muy importantes en la industria moderna. El hidróxido de sodio o sosa cáustica (un producto químico importante para la fabricación de papel, rayón y película fotográfica) se produce por la electrólisis de una disolución de sal común en agua . La reacción produce cloro y sodio. El sodio reacciona a su vez con el agua de la pila electrolítica produciendo hidróxido de sodio. El cloro obtenido se utiliza en la fabricación de pasta de madera y papel. Una aplicación industrial importante de la electrólisis es el horno eléctrico, que se utiliza para fabricar aluminio, magnesio y sodio. En este horno, se calienta una carga de sales metálicas hasta que se funde y se ioniza. A continuación, se obtiene el metal electrolíticamente.
Los métodos electrolíticos se utilizan también para refinar el plomo, el estaño, el cobre, el oro y la plata. La ventaja de extraer o refinar metales por procesos electrolíticos es que el metal depositado es de gran pureza.
OBJETIVOS
-
Aprender sobre la electrolisis y su utilización para la producción de algunas materias primas.
-
Poner en practica este proceso, como se desarrolla y cuales son sus características.
-
Empezar a conocer algunos instrumentos básicos para la realización de un laboratorio
-
Investigar sobre el ácido sulfúrico y sus propiedades.
MATERIALES

-
bata
-
alambre de cobre(1/2 metro)
-
alambre de aluminio(1/2 metro)
-

tornillo de aluminio -
tornillo de cobre
-
1 pila de 9v
-
1 recipiente de vidrio
-
1 cronometro
-
matraz o erimeyer
-
probeta
-
bureta
-
ácido sulfúrico
-
agua
-
cinta
Los materiales los utilizamos de la siguiente forma.
La bata para protección de el uniforme, los alambres, los tornillos y la pila de 9v iban unidos creando una corriente eléctrica que llega hasta el recipiente de vidrio el cual contenía 400ml e agua y 7ml de ácido sulfúrico,
A los recipientes que encontramos en el laboratorio utilizamos,
La bureta(contenía el ácido sulfúrico) y el matraz ( para medir el agua )
EL ÀCIDO SULFÙRICO
Ácido sulfúrico, de fórmula H2SO4, es un líquido corrosivo, de gran viscosidad, incoloro y con una densidad relativa de 1,85. Tiene un punto de fusión de 10,36 °C, un punto de ebullición de 340 °C y es soluble en agua en cualquier proporción. Al mezclar ácido sulfúrico con agua se libera una considerable cantidad de calor. A menos que la mezcla se agite bien, el agua añadida se puede calentar más allá de su punto de ebullición y la formación repentina de calor puede hacer saltar el ácido fuera del recipiente El ácido concentrado destruye la piel y la carne, y puede causar ceguera si se introduce en los ojos. El mejor tratamiento en caso de accidente es eliminar el ácido con grandes cantidades de agua. A pesar del peligro potencial si se maneja sin cuidado, el ácido sulfúrico ha sido muy importante comercialmente durante muchos años. Los antiguos alquimistas lo preparaban en grandes cantidades calentando sulfatos existentes en la naturaleza a altas temperaturas y disolviendo en agua el trióxido de azufre obtenido de esta forma. En el siglo XV aproximadamente, se desarrolló un método para obtener el ácido, destilando sulfato ferroso hidratado (o vitriolo de hierro) con arena. En 1740 empezó a producirse el ácido a escala comercial quemando azufre y nitrato de potasio en un caldero suspendido en un gran globo de cristal, cubierto parcialmente de agua.
| PROPIEDADES |
El ácido sulfúrico es un ácido fuerte, es decir, en disolución acuosa se disocia fácilmente en iones hidrógeno (H+) e iones sulfato (SO42-). Cada molécula produce dos iones H+, o sea que el ácido sulfúrico es dibásico. Sus disoluciones diluidas muestran todas las características de los ácidos: tienen sabor amargo, conducen la electricidad, neutralizan los álcalis y corroen los metales activos desprendiéndose gas hidrógeno. A partir del ácido sulfúrico se pueden preparar sales que contienen el grupo sulfato SO4, y sales ácidas que contienen el grupo hidrogenosulfato, HSO4.
El ácido sulfúrico concentrado, llamado antiguamente aceite de vitriolo, es un importante agente desecante. Actúa tan vigorosamente en este aspecto que extrae el agua, y por lo tanto carboniza, la madera, el algodón, el azúcar y el papel. Debido a estas propiedades desecantes, se usa para fabricar éter, nitroglicerina y tintes. Cuando se calienta, el ácido sulfúrico concentrado se comporta como un agente oxidante capaz, por ejemplo, de disolver metales tan poco reactivos como el cobre, el mercurio y el plomo, produciendo el sulfato del metal, dióxido de azufre y agua.
Durante el siglo XIX, el químico alemán Justus von Liebig descubrió que el ácido sulfúrico, añadido al suelo, aumenta la cantidad de fósforo disponible para las plantas. Este descubrimiento dio lugar a un aumento de la producción comercial de este ácido, mejorándose por tanto los métodos de fabricación.
| FABRICACIÓN |
Actualmente se utilizan dos procesos para obtener ácido sulfúrico. En las etapas iniciales ambos requieren el uso de dióxido de azufre, que se obtiene quemando piritas de hierro, FeS2, o azufre, en aire (tostación). En el primer proceso, denominado método de las cámaras de plomo, la reacción se lleva a cabo en grandes torres de ladrillos recubiertas de plomo. En estas torres, reaccionan dióxido de azufre gaseoso, aire, vapor de agua y óxidos de nitrógeno, produciendo ácido sulfúrico en forma de gotas finas que caen al suelo de la cámara. Casi todos los óxidos de nitrógeno se recuperan del gas que sale y se vuelven a introducir en la cámara para ser utilizados de nuevo. El ácido sulfúrico producido de esta forma, y el ácido etiquetado, sólo contienen de un 62 a un 70% de H2SO4; el resto es agua. Actualmente, casi un 20% del ácido sulfúrico se produce por el método de las cámaras de plomo, pero este porcentaje está disminuyendo.
El segundo método de obtención, el método de contacto, que empezó a usarse comercialmente alrededor de 1900, se basa en la oxidación del dióxido de azufre a trióxido de azufre, SO3, bajo la influencia de un catalizador. El platino finamente dividido, que es el catalizador más eficaz, tiene dos desventajas: es muy caro y además, ciertas impurezas existentes en el dióxido de azufre ordinario lo “envenenan” y reducen su actividad. Muchos productores de ácido sulfúrico utilizan dos catalizadores: primero, uno más resistente aunque menos efectivo, como el óxido de hierro o el óxido de vanadio, que inician la reacción, y a continuación, una cantidad menor de platino para terminar el proceso. A 400 °C, la conversión de dióxido a trióxido de azufre es casi completa. El trióxido se disuelve en ácido sulfúrico concentrado, y al mismo tiempo un flujo de agua mantiene la concentración al nivel seleccionado, normalmente un 95%. Reduciendo el flujo de agua, se puede obtener un producto con más SO3 del que contiene la fórmula H2SO4. Este producto, llamado ácido sulfúrico fumante, óleum o ácido Nordhausen, es necesario para algunas reacciones de química orgánica.
| PRODUCCIÓN |
Los usos del ácido sulfúrico son tan variados que el volumen de su producción proporciona un índice aproximado de la actividad general industrial. Por ejemplo, a principios de la década de 1970, la producción anual de ácido sulfúrico en Estados Unidos, el mayor productor, sobrepasaba los 29 millones de toneladas, que corresponden a una producción diaria de 1/3 kg por persona al año. El ácido sulfúrico se utiliza principalmente para hacer fertilizantes, tanto superfosfato como sulfato de amonio. También se usa para fabricar productos orgánicos, pinturas y pigmentos, y rayón, así como para refinar petróleo y procesar metales. Uno de los pocos productos de consumo que contienen ácido sulfúrico como tal, es la batería de plomo, que se utiliza en los automóviles.
INSTRUMENTOS ESPECIALES DE LABORATORIO:
-

Bureta, instrumento de laboratorio que se utiliza en volumetría para medir con gran precisión el volumen de líquido vertido. Es un tubo largo de vidrio, abierto por su extremo superior y cuyo extremo inferior, terminado en punta, está provisto de una llave. Al cerrar o abrir la llave se impide o se permite, incluso gota a gota, el paso del líquido. El tubo está graduado, generalmente, en décimas de centímetro cúbico.
Los dos tipos principales de buretas son las buretas de Geissler y las de Mohr. En estas últimas la llave ha sido sustituida por un tubo de goma con una bola de vidrio en su interior, que actúa como una válvula. En las de Geissler, la llave es de vidrio esmerilado; se debe evitar que el líquido esté mucho tiempo en contacto con la bureta, pues determinados líquidos llegan a obstruir, e incluso inmovilizar, este tipo de llaves.
-

Matraz, instrumento de laboratorio que se utiliza sobre todo para contener y medir líquidos. Es un recipiente de vidrio de forma esférica o troncocónica con un cuello cilíndrico.
Los dos tipos de matraces que se emplean más comúnmente son el matraz erlenmeyer y el matraz aforado o volumétrico. El primero tiene forma troncocónica, con cuello corto, y suele llevar una escala graduada que permite medir distintos volúmenes de líquido. El matraz aforado tiene forma de pera y un cuello largo y estrecho con una raya o enrase que marca la capacidad exacta del matraz a una cierta temperatura; se utiliza sobre todo para preparar y conservar disoluciones de una concentración determinada.
-
Probeta, instrumento de laboratorio que se utiliza, sobre todo en análisis químico, para contener o medir volúmenes de líquidos de una forma aproximada. Es un recipiente cilíndrico de vidrio con una base ancha, que generalmente lleva en la parte superior un pico para verter el líquido con mayor facilidad.
Las probetas suelen ser graduadas, es decir, llevan grabada una escala (por la parte exterior) que permite medir un determinado volumen, aunque sin mucha exactitud. Cuando se requiere una mayor precisión se recurre a otros instrumentos, por ejemplo las pipetas.
PROCEDIMIENTO Y OBSERVACIONES
DE LA ELECTROLISIS
La electrólisis es un proceso para generar hidrógeno y oxígeno por medio de electricidad y agua. Dos átomos de hidrógeno y un átomo de oxígeno son eléctricamente atraídos en una molécula de agua. Cuando la corriente eléctrica pasa a través del agua se rompe el enlace químico con dos cargas positivas (iones positivos) y una carga negativa (ion negativo). Las cargas negativas o iones de oxígeno emigran al electrodo positivo (ánodo) Los iones de hidrógeno cargados positivamente son atraídos por el electrodo negativo(cátodo).La descomposición que se produce es la siguiente :
Energía eléctrica +2H 2 O ---------------------- 2H 2 + O 2
La resistencia del agua pura es de 100 ohms / cm. Y puede ser reducida drásticamente en una de las siguientes formas:
Calentando de 700 a 1000 ºC
Diluyendo cloruro sódico
Con un ácido como el ácido sulfúrico o con una base como el hidróxido potásico o hidróxido sódico. En nuestro caso trabajamos con ácido sulfúrico veamos:
Antes de todo, primero recopilamos los materiales, nos colocamos la bata y luego escuchamos lo que debíamos hacer durante el laboratorio.
Nosotros trabajamos con 400ml de agua y 7ml de ácido sulfúrico,
Luego de llenar el recipiente de vidrio con esto dos elementos, continuamos a realizar la unión tornillo alambre y pila ( cada tornillo con su correspondiente alambre) , el de aluminio lo unimos con el polo positivo de la pila, el de cobre con el negativo ( la pila la enrolamos con cinta para evitar que los cables se desprendieran).
Al introducir los tornillos al recipiente de vidrio, programamos el cronometro y empezamos a anotar todo lo que sucedía:
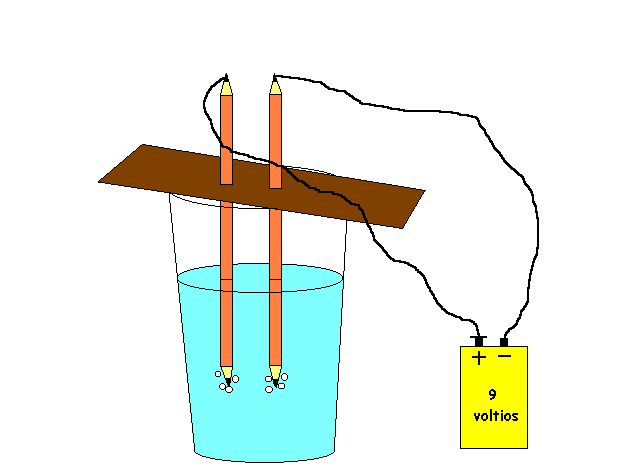
Casi de inmediato ( tal vez 10 segundos después o menos ) observamos que del tornillo de cobre levemente salían pequeñas burbujas, mientras que del de aluminio salían mas que el de cobre, esto quiere decir que el aluminio que esta unido al polo positivo es el que libera oxigeno, y el cobre el cual esta con el polo negativo libera hidrógeno. En lo que al olor se refiere, este es algo fuerte, hay una especie como de vapor, hay temperaturas un poco altas sobre el recipiente. Al ver en nuestro cronometro hasta los 5 minutos aproximadamente la producción de burbujas fue continua aunque siempre con menos proporción en el de cobre, luego las burbujas fueron mermando gradualmente con el tiempo. El tornillo de cobre fue perdiendo su color y cada vez se tornaba más oscuro.
Tras el paso del tiempo cerca de los 8 a 9 minutos la producción de burbujas había mermado demasiado en ambos tornillos en el de aluminio salían muy pocas burbujas y en el de cobre las burbujas eran casi nulas, ya su producción era lenta y salían con vario segundos de diferencia. Nuestro experimento se cerro cerca de los 10 minutos cuando las burbujas ya eran pocas y veíamos como el tornillo de cobre había perdido su color.
CONCLUSIONES
Al culminar este laboratorio, podemos concluir que pudimos colocar correctamente en practica este proceso, vimos cual es su desenlace y sus componentes. También aprendimos nuevas cosas como son lo que es al ácido sulfúrico y su gran utilidad; conocimos instrumentos nuevos para nosotros como son la bureta, matraz, de los cuales aprendimos que utilidad le podemos dar en un laboratorio de acuerdo a las distintas circunstancias.
De esta forma podemos definir de una forma sencilla y breve la electrolisis como el proceso que Al pasar una corriente eléctrica por el agua entre dos electrodos, el agua se divide en sus dos componentes: hidrógeno y oxígeno.
BIBLIOGRAFÍA
-
Enciclopedia Microsoft® Encarta® 2000. © 1993-1999 Microsoft Corporation. Reservados todos los derechos.
-
www.sener.gob.mx/secciones/imágenes/
-
www.larural.es/servagro/imágenes/probeta
Descargar
| Enviado por: | MonoCaLI |
| Idioma: | castellano |
| País: | Colombia |
