Química
Cristalización de sulfato de cobre
INDICE:
FORMULACION:
Página 2
--
CALCULOS QUÍMICOS
Página 4
--
CALCULOS REALES
Página 5
--
PROCEDIMIENTOS
Página 7
--
APARATOS DE LABORATORIO
Página 8
--
TABLA DE CRISTALIZACION
Página 11
--
Formulación:
Ejemplo Cu2SO4 [Tetraoxosulfato (VI) de cobre (I)]
Partiendo del soluto dado, tendremos que sacar un compuesto químico a partir de sus datos.
Los datos que nos dan son:
-
Los elementos
-
Las valencia de los elementos
Los elementos deberán leerse de derecha a izquierda y escribirse de izquierda a derecha. Primero analizamos el compuesto si sacamos su símbolo químico.
Tetraoxosulfato (VI) de cobre (1)
-
oxo = Oxígeno (O)
-
sulfato = Azufre (S)
-
cobre = Cobre (Cu)
El resultado sería este:
Cu S O
Luego tendremos que colocar el número de átomos de cada elemento encima de el para luego calcular la valencia que falta. El número de átomos es el número que se encuentra entre paréntesis al lado del elemento; el del oxígeno siempre es -2
Cu1 S6 O-2
Luego le añadiremos las valencias de cada elemento. La valencia del oxígeno se representa con el tetra (4), el azufre es 1 (ya que no tiene nada y se considera 1) y la del cobre no la sabemos y la sacaremos con una ecuación.
Cu1x S61 O-24
Para hallar el valor de X tendremos que multiplicar la suma del número de átomos de cada elemento por la valencia. Y el resultado será 0
1 · X + 6 · 1 + (-2) · 4 = 0
Y poco a poco vamos resolviendo la ecuación.
X + 6 - 8 = 0
X - 2 = 0
X = 2
Y finalmente sustituimos X por su valor:
Cu2 S O4
Para hallar el peso molecular multiplicaremos la valencia por el peso atómico del elemento que lo hallaremos en la tabla periódica.
-
Cobre = 63.5 gr/mol0
-
Azufre = 32.1gr/mol
-
Oxígeno = 16gr/mol
4 · 16gr/mol + 32.1gr/mol + 2 · 63.5gr/mol = 223.1gr/mol
Cálculos químicos:
Primero hay que calcular el número de moles que tiene el compuesto. La formula para hallar el numero de moles es la siguiente:
N = masa/ peso molecular
Como el problema nos dice que tenemos 2.8 gr del Cu2 SO4 con 2.5cm3 y ya tenemos el peso molecular hallado solo nos falta sacar el resultado:
N = 2.8gr / 223.1gr/mol
Los gramos se van con los gramos y se queda:
N = 2.8gr / 223.1gr/mol = 0.0125mol
N = 0.0125mol
Luego, deberemos hallar la molaridad, cuya formula es:
M = nº de moles / volumen
M = 0.0125mol / 0.0025ml
M = 5mol/l
Cálculos reales:
4 ml H2O + 1 gr Cu2 SO4 :
N = masa/ peso molecular
N = 1gr / 223.1gr/mol
N = 4.48 · 10-3 mol N = 0.00448mol
M = nº de moles / volumen
M = 0.00448mol / 0.004l
M = 1.12mol/l
4 ml H2O + 2 gr Cu2 SO2 :
N = masa/ peso molecular
N = 2gr / 223.1gr/mol
N = 8.96 · 10-3 mol N = 0.00896mol
M = nº de moles / volumen
M = 0.00896mol / 0.004l
M = 2.24mol/l
8 ml H2O + 4 gr Cu2 SO2 :
N = masa/ peso molecular
N = 4gr / 223.1gr/mol
N = 0.0179mol
M = nº de moles / volumen
M = 0.0179mol / 0.008l
M = 2.2375mol/l
2.5 ml H2O + 3.5 gr Cu2 SO2 :
N = masa/ peso molecular
N = 3.5gr / 223.1gr/mol
N = 0.0156mol
M = nº de moles / volumen
M = 0.0156mol / 0.0025l
M = 6.24mol/l
Procedimientos:
Después de hacer los cálculos químicos, pasamos a la práctica. Primero pesamos con las balanza los gramos de sulfato de cobre que deseamos cristalizar. Pondremos como ejemplo 4 gr.
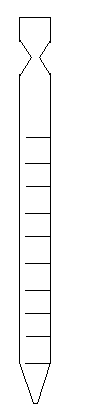
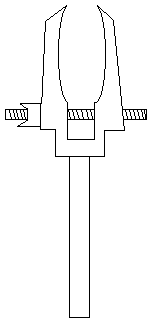
Seguidamente introducimos el sulfato de cobre dentro del tubo de ensayo. El tubo de ensayo lo deberemos sujetar con unas pinzas para tener más seguridad.
Después, con ayuda de una pipeta graduada introduciremos en el tubo de ensayo la cantidad de agua (H2O) deseada. Introduciremos 8ml (8cm3) de agua.
Luego con el mechero Bunsen calentamos el agua y el sulfato de cobre hasta notar que sea un disolución pura y no queden restos del sulfato de cobre en estado sólido.
Finalmente, debemos verter la disolución en una cápsula de porcelana para que se cristalice.
Cuando se cristalice, deberemos medir la diagonal mayor del cristal que obtengamos. Intentaremos seleccionar el cristal de mayor tamaño que se haya formado.
Aparatos de laboratorio:
|
| Pipeta graduada: Utensilio de laboratorio consistente en un tubo de cristal graduado abierto por ambos extremos, que sirve para traspasar pequeñas cantidades de líquido. Lleva grabada su capacidad en el cristal (ml), una línea indicadora sirve de señal. Se utiliza introduciendo la boca inferior dentro del líquido y tapando a boca superior, este se queda dentro de la pipeta. Después, se retira el dedo de la boca superior y el líquido sale de esta. |
|
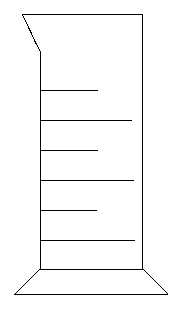
| Probeta: Recipiente de cristal alargado en forma de tubo, con un pie de soporte, utilizado en análisis químicos. Tiene señales para medir volúmenes. |
|
| Tubo de ensayo: Pequeño vaso tubular de vidrio que sirve para calentar las sustancias o efectuar reacciones químicas con ellas. |
|
| Pinza: Instrumento de diversas formas y materiales que por presión de las extremidades de sus dos brazos, permite coger las probetas y tubos de ensayo y sostenerlos sobre el mechero. |
|
| Vaso de precipitado: Vaso de vidrio, de forma más o menos cilíndrica, con un pico para vertido, que se destina a la formación de precipitados. Suele estar graduado. |
|
| Mechero Bunsen: Dispositivo que se utiliza mucho en los laboratorios debido a que proporciona una llama caliente, constante y sin humo. Debe su nombre al químico alemán Robert Wilhelm Bunsen, que adaptó el concepto de William Faraday del quemador de gas en 1855 y popularizó su uso. El quemador es un tubo de metal corto y vertical que se conecta a una fuente de gas y se perfora en la parte inferior para que entre aire. La corriente de aire se controla mediante un anillo situado en la parte superior del tubo. Cuando su temperatura es más alta, la llama tiene un cono azul en el centro y puede alcanzar los 1.500 ºC. Los mecheros Bunsen se han visto desplazados en muchos casos por camisas calentadoras eléctricas. |
|
| Cápsula de porcelana: Vasija en forma de casquete esférico achatado usada en los laboratorios, especial para evaporar líquidos. |
TABLA DE CRISTALIZACION:
| Tamaño cristal (mm) | Agua (ml) | Cu2 SO4 (gr) | Tiempo (horas) |
| NO HA CRECIDO | 4 ml | 1 gr | 72 Horas |
| 4 mm | 4 ml | 2 gr | 23 Horas |
| 5 mm | 8 ml | 4 gr | 23 Horas |
| NO HA CRECIDO | 2.5 ml | 3.5gr | 23 Horas |
11
Descargar
| Enviado por: | Cazón |
| Idioma: | castellano |
| País: | España |