Biología, Botánica, Genética y Zoología
Combustibles fósiles
ÍNDICE
1 - Introducción.......................................................................página 2
2 - Biodesulfurización de combustibles diesel..................páginas 3-5
3 - Desarrollo de biorreactores para desulfurización......páginas 5 y 6
4 - Microorganismos potencialmente útiles en desulfurización.................................................................páginas 6-9
5 - Conclusiones..........................................................páginas 9 y 10
Bibliografía.................................................................páginas 10 y 11
1 - Introducción
En la pasada década, decenas de millones de dólares se han invertido en el desarrollo de biotecnología para mejorar la calidad de los combustibles fósiles. La mayor parte de este esfuerzo se ha centrado en la biodesulfurización de dichos combustibles, un viejo concepto (originado hace 50 años) que recientemente ha recibido renovada atención como método “verde” para el procesamiento del petróleo. Esta reciente atención se debe también a las dificultades técnicas y económicas asociadas con los procedimientos convencionales de desulfurización.
Cada día, alrededor de 80 millones de barriles de petróleo (aproximadamente 10 millones de toneladas) son bombeados desde el interior de la tierra, y no hay indicios de que este ritmo se decrezca en un futuro cercano; recientes estimaciones auguran que las reservas de gas natural, crudo, turba y carbón son suficientes para continuar así al menos durante los próximos 70 años. La mayoría (el 90%) de los hidrocarburos extraídos de la tierra son quemados para la obtención de energía. Dado que las reservas, tanto sólidas como líquidas, suelen estar contaminadas por azufre, la combustión directa de este combustible conduciría a la liberación de grandes cantidades de óxidos de azufre a la atmósfera. Éstos óxidos son la principal fuente de lluvia ácida, por lo que la mayoría de los países han impuesto regulaciones para controlar esta liberación. Estas reglamentaciones se constituyen en forma de limitaciones en las emisiones de azufre en las plantas generadoras de energía (obligadas a usar combustibles de bajo azufre y a realizar depuraciones postcombustión) y en la imposición de cada vez mas duras restricciones en los niveles de azufre permitidos en los combustibles de transporte (aerocombustibles y gasóleo) y combustibles calefactores del hogar. Más recientemente, el azufre de la gasolina ha sido objeto también de estas medidas, ya que la combustión de la gasolina envenena el convertidor catalítico de los sistemas de escape automovilísticos. Estos convertidores son usados para quemar en el motor de escape los hidrocarburos que no han ardido, que contribuyen significativamente a la polución urbana.
Los niveles de azufre en el petróleo crudo oscilan entre 1.000 y 30.000 ppm (partes por millón), y en el combustible diesel corriente a veces excede las 5.000 ppm. En la pasada década, los niveles de azufre “aceptables” en este combustible han descendido desde las 2.000-5.000 ppm hasta las 500 ppm. Inminentes regulaciones conducirán a unos niveles de 350 ppm. En un futuro no muy lejano (2005-2007), las refinerías esperan alcanzar cantidades de azufre de entre 10-15 ppm. En los últimos diez años ha existido un considerable interés en el desarrollo de tecnologías para extraer el azufre de los combustibles de transporte; existen distintas operaciones de refinación convencionales que se han usado para esto, y han aparecido nuevos procedimientos respondiendo a la necesidad de una desulfurización con bajo coste. Un posible enfoque es aprovechar las ventajas de la especificidad de los enzimas y el relativamente bajo coste de las biotransformaciones para producir gasolinas y gasóleos de bajo azufre. La desulfurización catalítica (BDS) posee los potenciales beneficios de bajos costes de operación y capital y pueden producir gases substancialmente no invernadero.
2 - Biodesulfurización de combustibles diesel
Como ya se ha mencionado, se han identificado ciertos catalitos microbianos que puedan biotransformar los compuestos azufrados que se encuentran en los combustibles, incluyéndose algunos capaces de extraer selectivamente el azufre de componentes heterocíclicos del dibenzotiofeno.
Se están desarrollando para ello biosistemas de energía que implican la extracción de hidrocarburos que contienen azufre de corrientes de destilados o naphta. La corriente de destilado es mezclada primero con un medio acuoso que contiene sosa cáustica, bacterias y nutrientes para las mismas. Los enzimas bacterianos inicialmente oxidan los átomos de azufre para seguidamente romper algunos de los enlaces azufre-carbono. El azufre queda tras el proceso en forma de sulfonato de hidroxifenilbenceno, el cual tiene uso comercial como sustrato para la producción de surfactantes. Diseños basados en estudios en plantas piloto combinan biodesulfurización y métodos de hidrotratamiento convencionales para producir combustible diesel que contiene 50 ppm de azufre.
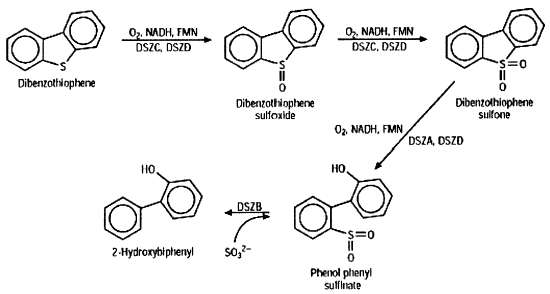
Fig. 1. La ruta de la desulfurización biológica del compuesto modelo dibenzotiofeno se basa en la biocatálisis por especificidad. DSZA, DSZB, DSZC y DSZD son los productos génicos catalíticos de los genes dszA, dszB, dszcC y dszD, respectivamente.
La figura 1 muestra los pasos generales en el sistema de biodesulfurización basado en estudios realizados en varias especies bacterianas. Esta ruta a veces recibe el nombre de ruta “4S” por la existencia de cuatro intermediarios azufrados. Resulta interesante que esta ruta química bacteriana es capaz de extraer el azufre de dibenzotiofenos sustituidos con grupos alquilo, que impiden la catálisis química y resisten la hidrodesulfurización. Esta actividad se ha observado en diferentes bacterias y, en la mayoría de los casos, bacterias emparentadas catalizan la misma reacción.
Los principales genes implicados en el metabolismo del dibenzotiofeno (DBT) han sido clonados, secuenciados y considerablemente analizados. Su denominación más extendida para ellos es dsz. Los genes dszA, dszB y dszC se localizan en un operón sencillo en un gran plásmido en Rhodococcus erythropolis IGTS8 y otras cepas relacionadas. El promotor ha sido caracterizado y parece ser afectado por la presencia de aminoácidos azufrados, y los resultados parecen confirmar un mecanismo de represión. La evidencia de una inducción por parte del DBT no resulta convincente.
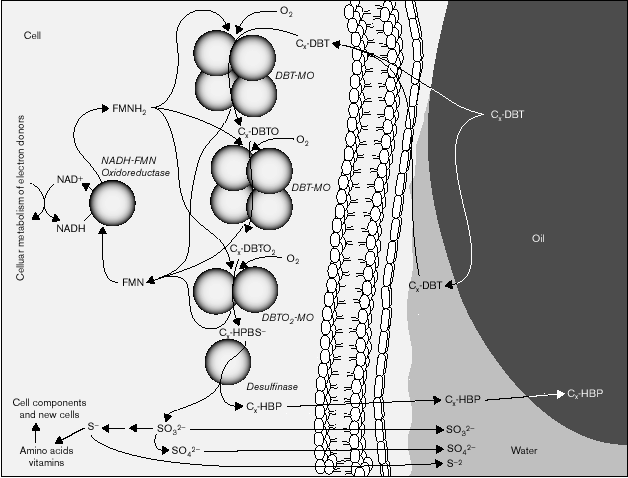
Fig. 2. Diagrama conceptual de algunos de los pasos de la desulfurización del combustible diesel. No está claro como los distintos pasos separados están implicados en la transferencia de las moléculas de Cx-DBT (dibenzotiofeno) desde el combustible hasta el primer enzima. Resultados experimentales sugieren que la transferencia de masa no está limitada por un paso intermedio combustible-agua o agua-célula. Tampoco está claro cómo Cx-HPB o Cx-HPBS salen de la célula. DBTO = sulfóxido de dibenzotiofeno, DBTO2 = dibenzotiofenil sulfona, DBT-MO = dibenzotiofeno monooxigenasa.
Ahora bien, la enzimática no es el único factor importante en la biodesulfurización; existen otros pasos potencialmente limitantes en este proceso, como ilustra la figura 2:
El primer paso (y algunas veces el que limita la tasa) de la metabolización del Cx-DBT es la transferencia de los heterociclos poliaromáticos azufrados desde el combustible hasta la célula. No hay evidencias de que se produzca un transporte activo al interior celular.
Una vez dentro de la célula, las moléculas de Cx-DBT son sujeto de una serie de oxidaciones, las primeras dos de las cuales son catalizadas por la misma enzima, la DBT monooxigenasa, que requiere FMN reducido para su actividad. Esta actividad la provee la enzima NADH:FMN oxidorreductasa. Ambas actividades no están fuertemente relacionadas ni parece haber necesidad de su contacto físico, e incluso se ha descrito el uso con éxito de otro enzima regenerador de FMNH2 para mantener la actividad tanto in vivo como in vitro.
La oxidación de la dibenzofenil sulfona (DBTO2) hasta sulfonato de hidroxifenil benceno (HPBS) por parte de la siguiente monooxigenasa es una reacción mucho más inusual e interesante. También requiere FMN reducido y oxígeno molecular.
El paso final en el metabolismo específico de los Cx-DBTs es la liberación del azufre inorgánico por parte de una enzima desulfinasa. Ésta es también una reacción inusual y genera una molécula aromática e hidrofóbica, el hidroxibifenil (HBP), y sulfito. El HBP encuentra la forma de volver a la fracción de petróleo, conservándose así el valor combustible del mismo. No está claro si existe algún sistema de transporte activo desde la célula, pero esta idea no sería descabellada dado que el HBP es un potente biocida industrial.
3 - Desarrollo de biorreactores para desulfurización
Como es fácil deducir, es necesario el contacto y mezcla de combustible, células y agua para una buena transferencia de masa. Desafortunadamente, esto conduce a la formación de una fuerte emulsión que debe romperse para recuperar el combustible desulfurizado, reciclar las células y separar los subproductos. Un método económico y efectivo para esto implica el uso de hidrociclones, tubos cónicos que al girar separan la emulsión en distintas fases.
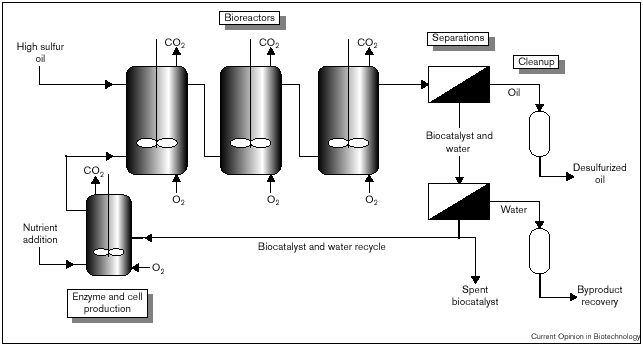
Fig. 3. Diagrama conceptual de flujo del proceso de biodesulfurización.
Como se observa en la figura 3, son necesarios tres biorreactores para alcanzar muy bajas concentraciones de azufre en el combustible producto, debido a la relativamente alta KM del sistema enzimático Dsz. En este trasfondo ,las células crecen y son revitalizadas durante el proceso, lo que constituye un paso necesario para alcanzar los amplios tiempos de residencia catalítica que requiere un proceso comercial. Los pasos de separación pueden llevarse a cabo mediante el uso de hidrociclones o mediante una combinación de éstos con otros métodos de centrifugación de bajo coste.
Como ya se ha comentado, el sulfonato de hidroxifenil benceno (HPBS), penúltimo producto de la ruta “4S”, para producir biopetroquímicos. Usando una biocatalisis especialmente desarrollada en la que el gen dszB (responsable de la última transformación de la ruta “4S”, ver Fig. 1) ha sido eliminado, pueden obtenerse grandes cantidades de Cx-HPBS como subproducto de la biodesulfurización o, usando un combustible sustrato adecuado, como un producto en sí mismo.
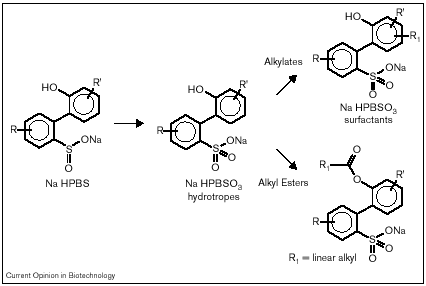
Fig. 4. Conversión del intermediario de la desulfurización Cx-HPBS a surfactantes. Los anillos pueden ser alquilados directamente o varios ésteres pueden sintetizarse en el grupo hidroxilo. La longitud de la cadena lateral puede variar para producir detergentes solubles o no en agua.
4 - Microorganismos potencialmente útiles en desulfurización
Rhodococcus
Sin duda el género más estudiado en relación con este tema es Rhodococcus. Se han realizado multitud de estudios con distintas especies y estirpes del mismo (como por ejemplo las estirpes de Rhodococcus erythropolis D-1, KA2-5-1, IMP-SO2, H-2, SY1 y P32C1). De hecho, la ruta de desulfurización anteriormente descrita se caracterizó en dicho género (Rhodococcus sp. IGTS8).
Una importante ventaja que posee este género frente a otros es su naturaleza hidrofóbica, que hace que, en un sistema aceite-agua, la bacteria se adhiera a la interfase aceite agua, no apareciendo suspendida en la fase acuosa. Esto hace que las cepas de Rhodococcus puedan captar las muy hidrofóbicas moléculas de Cx-DBTs directamente del aceite, lo que aumenta la eficacia del sistema.
Pseudomonas
Se han realizado algunos estudios con cepas de Pseudomonas delafieldii (por ejemplo con la estirpe R-8). Las bacterias de este género emplean una ruta de desulfurización distinta de la llamada “4S”, basada en la ruptura de los anillos aromáticos por parte de enzimas similares a la naftaleno dioxigenasa. Esta ruta se denomina “Ruta Kodama”.
Frente a Rhodococcus, este género permanece suspendido en el agua en los sistemas aceite-agua, lo que hace más inaccesible para la bacteria las moléculas de Cx-DBTs; aún así, las tasas de desulfurización que muestra lo hacen un género interesante para su utilización en los procesos de biodesulfurización.
Bacillus
Los estudios realizados con representantes de este género (por ejemplo con Bacillus subtilis WU-S2B) demuestran cierta ventaja por parte de estas bacterias moderadamente termofílicas, consistente precisamente en la capacidad de realizar desulfurización a alta temperatura (alrededor de los 50º C) con una gran eficacia.
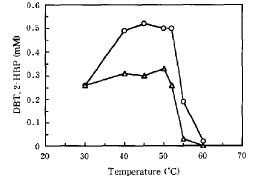
Fig.5. Efecto de la temperatura en la desulfurización del DBT por parte de células de B. Subtilis WU-S2B en crecimiento durante 120 horas; , DBT consumido; , 2-HBP producido.
Dado que los procesos de hidrodesulfurización de combustibles diesel se producen a alta temperatura, su naturaleza termofílica representa una ventaja para este género, al poder acoplar mejor ambos procesos; además, el hecho de realizar la desulfurización a alta temperatura reduce las probabilidades de contaminación por parte de bacterias indeseables.
Gordona sp. CYKS1 y Nocardia sp. CYKS2
Se han realizado estudios usando suspensiones de células inmovilizadas de ambas estirpes obteniéndose resultados esperanzadores, aunque no concluyentes, sobre la posible futura aplicación industrial de estas cepas.
Paenibacillus
Se han purificado al menos dos de los enzimas que participan en la desulfurización del DBT (TdsA y TdsB) en la bacteria Paenibacillus sp. A11-2. Esta bacteria termofílica muestra mayor actividad en estos enzimas a temperaturas altas, como puede verse en la figura 6. Esto representa las ventajas enumeradas anteriormente.
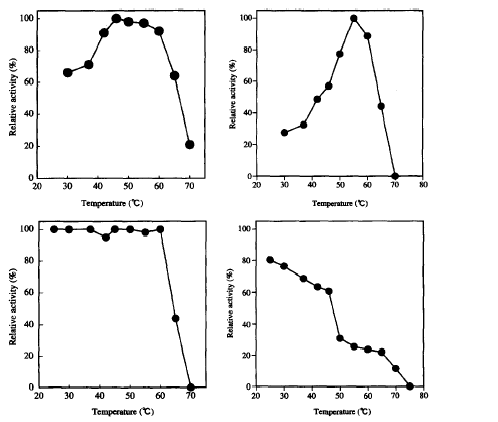
Fig. 6. Efecto de la temperatura sobre la actividad (A y B) y la estabilidad (C y D) de TdsA y TdsB
Corynebacterium
Estudios con la cepa Corynebacterium sp. P32C1 muestran que esta bacteria presenta mayor capacidad en la biodesulfurización que la conocida cepa Rhodococcus erythropolis IGTS8, como se observa en la figura 7.
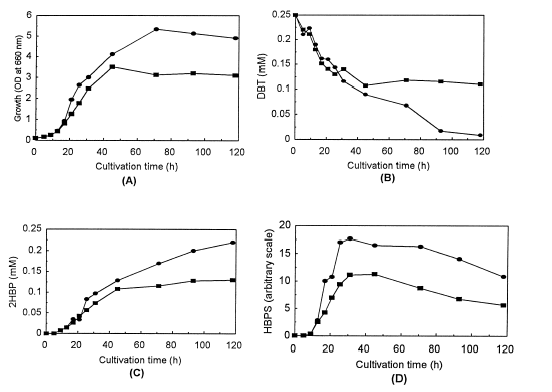
Fig. 7. Crecimiento (A), degradación de DBT (B), formación de 2-HBP (C) y cambio de HBPS (D).
Mycobacterium
Se han realizado estudios con la cepa Mycobacterium phlei WU-F1.
La principal ventaja de esta bacteria consiste en que muestra actividad en un amplio intervalo de temperatura, lo que la hace muy versátil a la hora del acoplamiento industrial de la biodesulfurización con otros procedimientos de desulfurización convencionales.
Sphingomonas
Se ha patentado alguna estirpe de este género para su uso industrial en biodesulfurización.
5 - Conclusiones
Nuestro conocimiento de cómo las bacterias metabolizan los heterociclos azufrados esta lejos de ser completo. Es necesaria una mejor comprensión de sus aspectos fundamentales para transformar esta interesante ruta microbiana en un auténtico proceso industrial. Hemos aprendido cómo Rhodococcus trata con estos compuestos disueltos en combustible y cómo esto podría engranarse tecnológicamente. Trabajos recientes han aportado una serie de conocimientos que podrían resultar útiles en este proceso de adaptación a la industria:
Los enzimas y genes del sistema pueden ser manipulados fructíferamente. Los genes que codifican enzimas similares a dsz se han encontrado en bacterias tanto Gram+ como Gram-. Aunque solo muestran un 70% de homología, las proteínas catalizan reacciones similares.La especificidad y la preferencia por el sustrato varía incluso entre cepas cercanamente emparentadas.Los genes pueden ser “barajados” para crear genes híbridos con mejores tasas de desulfurización.
Las propiedades físicas de las células son importantes para una transferencia de masa óptima, separación efectiva y recuperación del producto.
La ruta puede ser truncada para producir moléculas valiosas. Este proceso resulta rentable en este momento y podría ser la primera aplicación de esta tecnología.
La comercialización de esta tecnología para la desulfurización de combustibles diesel u otros combustibles de transporte y para la obtención de surfactantes basados en el HPBS requiere la resolución de una serie de problemas críticos. Esto incluye resolver el inconveniente de la transferencia de masa a través de cambios en el proceso y los aspectos enzimáticos mediante un programa de evolución directa dirigida teniendo como objetivo los pasos enzimáticos específicos. Si se quiere tener lista la tecnología de cara a las nuevas normas reguladoras, continúa siendo necesario trabajar para superar los obstáculos tanto biológicos como referentes al proceso industrial.
BIBLIOGRAFÍA
Cunshan Song, Xiaoliang Ma (2002) “New design approaches to ultra-clean diesel fuels by deep desulfurization and deep dearomatization” Applied Catalysis B: Environmental, 1267:1-32. Extensa y rigurosa revisión que trata ampliamente todos los métodos de desulfurización tanto convencionales y de desarrollo reciente.
Monticello, Daniel J. (2000) “Biodesulfurization and the upgrading of petroleum distillates” Current Opinion in Biotechnology, 11:540-546.Revisión sencilla y concisa que describe los últimos estudios en biodesulfurización y su posible aplicación industrial. Muy buenas ilustraciones.
Toshimitsu Onaka, Morio Kobayashi, Yoshitaka Ishii, Koichi Okumura, Masanori Suzuki (2000) “Application of solid-phase extraction to the analysis of the isomers generated in biodesulfurization against methylated dibenzothiophenes” Journal of Chromatography A, 903:193-202. Interesante artículo que describe un método de separación de los productos de la biodesulfurización y esboza el mecanismo de degradación de compuestos azufrados por parte de Rhodococcus erythropolis.
Maghsoudi, S. , Vossoughi, M. , Kheirolomoom, A. , Emiko Tanaka, Shigeo Katoh (2001) “Biodesulfurization of hydrocarbons and diesel fuels by Rhodococcus sp. Strain P32C1” Biochemical Engineering Journal, 8:151-156. Artículo que analiza la capacidad de desulfurización de una cepa de Rhodococcus. Interesante aunque algo farragoso.
Samir Abbad-Andaloussi, Claire Lagnel, Michel Warzywoda, Frédéric Monot (2003) “Multi-criteria comparison of resting cell activities of bacterial strains selected for biodesulfurization of petroleum compounds” Enzyme and Microbial Technology, 32:446-454. En este artículo se evalúa la actividad desulfurizadora de cinco cepas distintas de Rhodococcus en distintas condiciones. Claro pero algo escaso de figuras.
Gladys Castorena, Claudia Suárez, Idania Valdez, Guadalupe Amador, Luis Fernández, Sylvie Le Borgne (2002) “Sulfur-selective desulfurization of dibenzothiophene and diesel oil by newly isolated Rhodococcus sp. Strains” FEMS Microbiology Letters, 215:157-161. Este estudio constata la eficacia en desulfurización de una cepa de Rhodococcus aislada recientemente.
Luo, M.F. , Xing, J.M. , Gou, Z.X. , Li, S. , Liu, H.Z. , Chen, J.Y. (2003) “Desulfurization of dibenzothiopheno by lyophilized cells of Pseudomonas delafieldii R-8 in the presence of dodecane” Biochemical Engineering Journal, 13:1-6. Artículo sobre las condiciones y capacidades para la desulfurización por parte de Pseudomonas delafieldii. Buenas gráficas.
Je Hwan Chang, Yong Keun Chang, Hee Wook Ryu, Ho Nam Chang (2000) “Desulfurization of light gas oil in inmobiliced-cell systems of Gordona sp. CYKS1 and Nocardia sp. CYKS2” FEMS Microbiology Letters, 182:309-312. Trabajo sobre la desulfurización llevada a cabo por ambas estirpes. Breve pero un poco complejo; gráficas de difícil comprensión.
Toshiki Furuya, Tohkaro Kirimura, Kuniki Kuno, Shoji Usami (2001) “Thermophilic biodesulfurization of dibenzothiophene and its derivated by Mycobacterium phlei WU-F1” FEMS Microbiology Letters, 204:129-133. Artículo sobre la biodesulfurización de este organismo. Claro y conciso.
Tohkaro Kirimura, Toshiki Furuya, Yasuhiro Nishii, Yoshitaka Ishii, Kuniki Kino, Shoji Usami (2001) “Biodesulfurization of dibenzothiophene and its derivated through the selective cleavage of carbon-sulfur bonds by a moderately thermophilic bacterium Bacillus subtilis WU-S2B” Journal of Bioscience and Bioengineering, 92,3:262-266. Analiza el proceso de desulfurización en un organismo tan caracterizado como Bacillus subtilis. Algo escaso en gráficas.
Toshimitsu Onaka, Jin Konishi, Yoshitaka Ishii, Kenji Maruhashi (2001) “Desulfurization characteristics of thermophilic Paenibacillus sp. Strain A11-2 against asymmetrically alkylated dibenzothiophenes” Journal of Bioscience and Bioengineering, 92,2:193-196. En este caso se estudia la actividad en desulfurización por parte del organismo termófilo Paenibacillus. Interesante.
Jin Konishi, Yoshitaka Ishii, Toshimitsu Onaka, Yoshinori Ohta, Masanori Suzuki, Kenji Maruhashi (2000) “Purification and characterization of dibenzothiophene sulfone monooxygenase and FMN-dependent NADH oxidoreductase from the thermophilic bacterium Paenibacillus sp. strain A11-2” Journal of Bioscience and Bioengineering, 90,6:607-613. Artículo en el que se estudian enzimas fundamentaales en el proceso de biodesulfurización. Bastante claro y con magníficas imágenes.
Maghsoudi, S. , Kheirolomoom, A. , Vossoughi, M. , Tanaka, E. , Katoh, S. (2000) “Selective desulfurization of dibenzothiophene by newly isolated Corynebacterium sp. strain P32C1” Biochemical Engineering Journal, 5:11-16. Trata el proceso en otro organismo más. Breve y claro.
Descargar
| Enviado por: | McArra |
| Idioma: | castellano |
| País: | España |
