Química
Coloración de la llama
![]()
Corporación educacional
Colegio Coya
INFORME DE LABORATORIO
“Ensayos cualitativos a la llama”
Índice
Introducción .........................................................Pág. nº 3
Materiales y métodos..............................................Pág. nº 4
Desarrollo .............................................................Pág. nº 5-6
Análisis de los resultados y conclusiones................Pág. nº 7
Aporte personal .....................................................Pág. nº 8-9
Bibliografía ..........................................................Pág. nº 10
Introducción
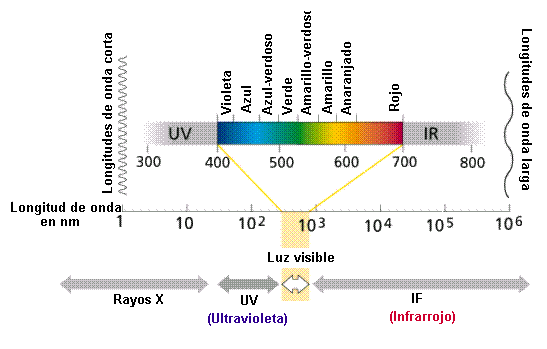
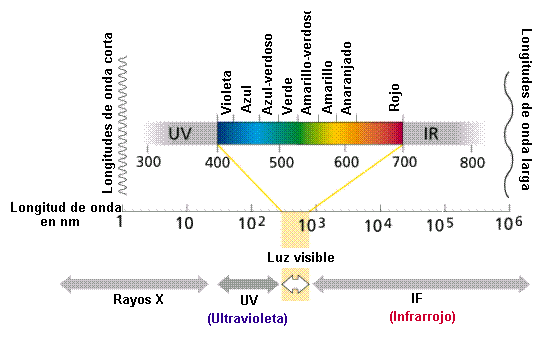
El objetivo del laboratorio es identificar y diferenciar elementos ó compuestos químicos, mediante la observación del espectro de luz emitido por sus átomos a la llama.
La identificación de un gran número de sustancias tales como :
-
Sales
-
Metales
-
Aleaciones
-
Minerales
-
Cerámicas
-
Etc.
Hay un gran numero de sustancias químicas en el mundo, y para poder identificar cada una de ellas existen diversos métodos. Algunos de estos métodos consisten en disolver la sustancia, transformándola en iones, y hacerla reaccionar frente a diversos experimentos. En nuestro caso podremos identificar sustancias en estado sólido mediante un método que consiste en combustionar la sustancia y dependiendo del color de la luz que emitirá reconocerla. Esta luz será de un color definido por una longitud de onda característica de la sustancia, y mediante ella sabremos con que sustancia estamos tratando.
Puede hacerse transformándolas en iones, que a su vez pueden identificarse con reacciones características. Si las sustancias que se quiere analizar está en estado sólido, deben disolverse previamente. Antes de disolver, pueden realizarse algunos ensayos que permiten obtener información relevante sobre la naturaleza de las sustancias, que a veces bastan para su identificación. Uno de éstos ensayos es la coloración a la llama.
Materiales y Métodos
Los materiales que se utilizaron para los experimentos fueron:
-
Mechero Bunsen
-
Matraz de erlenmeyer
-
Agua
-
Varilla de fierro (hierro)
Reactivos utilizados:
-
Cloruro de bario (BaCl2)
-
Cloruro de sodio (NaCl)
-
Cloruro de calcio (CaCl2)
-
Cloruro de cobre I o cuproso (CuCl)
-
Cloruro de potasio (KCl)
Método utilizado:
El ensayo a la llama es un método de laboratorio bien establecido para identificar la presencia de un elemento químico determinado en una muestra. Primero se ajusta la llama de un mechero Bunsen hasta que sea incolora, después se coloca una pequeña cantidad de la sustancia que se desea analizar en la punta de una varilla limpia, y se introduce la varilla en la llama. Los elementos mostrados dan un color característico a la llama.
Desarrollo
Primero que nada, utilizamos el “espectro de la luz blanca”, para notar y darnos cuenta de las variedad de colores que podíamos obtener de la llama al comenzar con el experimento y notar las magnitudes de ondas que alcanza cada sompuesto.
Luego de esto, se nos dieron 5 muestras diferentes y desconocidas para nosotras, de las que sacamos una pequeña cantidad. Posteriormente en una barilla de hierro húmeda, pusimos una pequeña muestra de la sustancia y notamos los siguientes resultados:
Sustancia 1:
El resultado fue una llama de color naranjo intenso, lo que nos indico que había presencia de Sodio (Na).
Sustancia 2:
El resultado fue una llama de color amarillo verdoso, lo que significa la presencia de Bario (Ba).
Sustancia 3:
El resultado fue una llama de color “verde-limón”, lo que nos indicó nuevamente la presencia de Bario (Ba).
Sustancia 4:
El resultado fue una llama de color naranjo, lo que indicó la presencia de Sodio (Na).
Sustancia 5:
El resultado fue una llama de color Rojo ladrillo, lo que significó la presencia de Calcio (Ca).
La tabla que utilizamos para detectar la presencia de los compuestos ya mencionados fue la siguiente:
Elemento
-Na
-Ca
-Sr, Li
-Ba
-Cu, Tl, Te, B
-Se
-As, Sb, Sn, Se
-K
-Rb
-Sc
-Ga
Observaciónes:
1-) Todos los compuestos descubiertos fueron cloruros(que es un componente neutro), ya que los compuestos “puros”, son difíciles de obtener y son utilizados por científicos especializados en el tema.
2-) Los resultados se estos compuestos pueden ser alterados debido a la contaminación o grado de impureza que pueden tener.
Análisis de los resultados y Conclusiones
Según las observaciones obtenidas y los datos tabulados pudimos identificar en este laboratorio los elementos Ba, Ca, Cu, Na, los cuales emitieron luces de colores idénticos a los dados en la tabla. La excepción fue en el cloruro de potasio, ya que el potasio presentó una luz de color anaranjado en vez de la luz de color violeta pálido esperada, este error se le atribuye a la contaminación de este elemento.
Con las experiencias realizadas pudimos lograr el objetivo propuesto, el cual es identificar los elementos en un compuesto determinado mediante el método de coloración de la luz que presento a la llama.
-
Conclusión 1: Para realizar exitosamente este método de identificación es necesario tener demasiado cuidado al manipular las sustancias y utensilios en cuestión, ya que fácilmente pueden ser contaminados.
-
Conclusión 2: Al utilizar una solución de HCl concentrado, concluyo también que las sales dadas se disociaron en sus iones correspondientes identificando así solo el catión.
Finalmente debo agregar que este método como identificación de elementos en una sustancia no es tan especifico. Para tener mayor certeza o menor rango de error en los resultados, seria ideal hacer pasar los haces de luz obtenidos por las sustancias estudiadas, a través de un prisma, para luego realizar un minucioso estudio de su espectro de rayas.
Aporte Personal
Técnicas Espectroscópicas
La espectroscopia, o estudio de las interacciones de la radiación electromagnética con la materia, es el mayor y más exacto grupo de métodos instrumentales utilizados en los análisis químicos y en toda la ciencia química. El espectro electromagnético se divide en la siguiente gama de longitudes de onda: rayos gamma, rayos X, ultravioletas, visibles, infrarrojos, microondas y ondas radioeléctricas. Las interacciones electromagnéticas con la materia provocan la absorción o emisión de energía a través de la transición de los electrones entre niveles cuánticos o discretos de energía, vibraciones de enlaces, rotaciones moleculares y transición de electrones entre orbitales de átomos y moléculas. Todas estas interacciones tienen lugar en instrumentos denominados espectrómetros, espectrofotómetros o espectroscopios. Los espectros generados en esos equipos se graban gráfica o fotográficamente en espectrogramas o espectrógrafos, que permiten el estudio de la longitud de onda y la intensidad de la radiación absorbida o emitida por la muestra analizada.
La absorción espectrofotométrica en las gamas visible y ultravioleta del espectro electromagnético es un método espectral cuantitativo común para sustancias orgánicas e inorgánicas. Con esta técnica se mide la transparencia relativa de una disolución, antes y después de hacerla reaccionar con un reactivo colorante. La disminución que se produce en la transparencia de la disolución es proporcional a la concentración del compuesto analizado.
La espectrofotometría de absorción de infrarrojos es adecuada para análisis orgánicos, pues los enlaces en alquenos, ésteres, alcoholes y otros grupos funcionales tienen fuerzas muy diferentes y absorben la radiación de infrarrojos en una gran variedad de frecuencias o energías. Esta absorción se refleja en el espectrógrafo en forma de picos.
La espectroscopia por resonancia magnética nuclear (RMN) depende de la transición entre estados de energía de rotación nuclear por absorción de energía de radiofrecuencia electromagnética. Por ejemplo, en el espectro de RMN del hidrógeno, los diferentes estados químicos del hidrógeno absorben radiación electromagnética a distintas energías. Así, los grupos orgánicos -CH3 y -CH2Cl dan picos muy diferentes y con una excelente resolución. Por todo ello, los espectros de RMN son una herramienta insustituible en el análisis cualitativo para determinar la estructura de las moléculas orgánicas.
La espectroscopia de fluorescencia es lo contrario de la espectrofotometría por absorción. Con esta técnica se consigue que las moléculas emitan luz, según las características energéticas de su estructura, con una intensidad proporcional a la concentración de la muestra. Este método proporciona resultados cuantitativos muy sensibles en algunas moléculas.
En la espectrofotometría de emisión y absorción atómica se calienta la muestra a alta temperatura, y se descompone en átomos e iones que absorben o emiten radiación visible o ultravioleta, con niveles de energías característicos de los elementos implicados. El tono amarillento que presenta una llama cuando se añade sal, se debe a la presencia de sodio en la misma, que emite con fuerza en la zona amarilla del espectro de luz visible. Estos métodos son sobre todo útiles para bajas concentraciones de elementos metálicos, tanto en análisis cualitativos como cuantitativos.
Bibliografía
-
Enciclopedia Microsoft Encarta 2002 ®, buscar por: espectroscopia, angstrom, análisis químico.
-
Enciclopedia Sintesoft 2.0, ¿cómo descubrir compuestos?, tecnicas.
3
Color de la llama
-
Amarillo persistente
-
Rojo ladrillo
-
Rojo carmín
-
Verde amarillento
-
Verde
-
Azul pálido
-
Azul pálido plateado
-
Violeta pálido
-
Violáceo rojizo
-
Violeta azulado
-
Violeta
Descargar
| Enviado por: | Iv4nk4 Cr!st! |
| Idioma: | castellano |
| País: | Chile |
