Ingeniero Químico
Coeficient de repartiment
COEFICIENT DE REPARTIMENT.
CONSTANT D'EQUILIBRI.
Objectiu:
A aquesta pràctica volem obtenir el coeficient de repartiment d'un solut (iode) entre dos líquids inmiscibles ( aigua i tetraclorur de carboni ). A partir d'aquest coeficient podem trobar la constant d'equilibri de la reacció en dissolució aquosa entre iodur i iode per formar el ió triiodur.
Introducció teòrica:
El iode és més solubre en tetraclorur de carboni que en aigua. A més el CCl4 és insolubre en aigua (és més dens que aquesta), per tant es formen dues fases.
Al afegir iode a aquesta mescla, quan arribem a l'equilibri s'ha de complir que les fugacitats del iode a ambdues fases han de ser iguals. Però tenint en compte que la concentració de iode a les dues fases són baixes suposarem que compleix la Llei de Henry, és a dir, es complirà:
A partir d'aquesta expressió obtenim la constant de repartimentKD:
En dissolució aquosa el iode forma un ió complex triiodur:
On la constant d'equilibri:
Material i reactius:
-
Balança - Tetraclorur de carboni
-
2 matrassos de 250ml - Solució de iode en CCl4
-
1 matràs de 500ml - Iodat potàssic
-
1 matràs de 100ml - Ioudr potàssic
-
1 proveta de 250ml -Tiosulfat sòdic pentahidratat
-
1 proveta de 100ml - Carbonat sòdic
-
1 proveta de 25ml - Àcid clorhídric concentrat
-
2 pipetes de 100ml - Cloroform
-
1 bureta de 25ml - Solució de midó a l'1%
-
1 pipeta de 2ml
-
1 pipeta de 5ml
-
1 pipeta de 10ml
-
1 erlenmeyer de 250ml
-
1 erlenmeyer de 100ml
-
1 vas de precipitats de 2l
Procediment experimental:
Preparació d'una solució de tiosulfat sòdic 0.01 M
La preparació ja està feta, però la valorarem per assegurar-nosde la seva concentració.
Per tal de realitzar la valoració, vem preparar dues dissolucions:
-
una dissolució de 0.17 g de iodat potàssic en un matràs aforat de 250ml.
-
Una dissolució 1M de HCl a partir de l'àcid concentrat al 37%.
La quantitat d'àcid necessari serà:
Per tant diluïm aquesta quantitat d'àcid concentrat en un matràs de 100ml.
En un erlenmeyer de 250ml s'afegeix 10ml de la solució de iodat potàssic, 5 ml de la solució HCl 1M i 0.1g de iodur potàssic. Comencem a realitzar la valoració fins que prengui un color groc clar, en aquest moment afegim 0.6ml de midó. La dissolució canvia de color a blau fosc. Seguim valorant fins el punt de viratge (en el moment en que es torni transparent). Els volums afegits de la solució valorant són:
V1=18ml V2=19ml
Tenint en compte l'estequeometria podem saber la molaritat de tiosulfat:
Primer hem de saber quina molaritat té la solució de KIO3 que hem introduït a la dissolució:
Com hem introduït 10ml de la solució,hem de neutralitzar 3.20·10-5 mols, fixant-nos en la relació estequiomètrica (1/6) necessitem:
3.20·10-5 mols ·
Fem el quocient entre el mols necessaris i el volum afegit tenim la concentració de tiosulfat:
1.- V1=18ml
2.- V2=19ml
Fem la mitjana de les dues valoracions:
[S2O3-2]=1.03·10-2 M
Determinació de la constant de repartiment
Per a poder mesurar la constant de repartiment hem de saber la concentració de la substància en cada una de les seves fases.
En aquest cas realitzarem una mescla d'aigua, iode i tetraclorur de carboni. Vam afegir 20ml de tetraclorur, 20ml més de tetraclorur saturat amb iode i 200ml d'aigua, tot això en un matràs de 250ml. La mescla s'agita durant 40 minuts i passat aquest temps es deixa reposar 10 minuts.
Es veuen dues fases ben diferenciades: la fase més densa és la orgànica i la superior és l'aquosa. Hem d'analitzar les concentracions de iode a cadascuna de les dues fases per trobar la seva constant de repartiment.
-
Primer vem pipetejar 100ml de la solució aquosa i li vàrem afegir 0.2g de iodur potàssic. Comencem a valorar amb la dissolució de tiosulfat de concentració coneguda, quan pren un color groc suau, afegim uns 0.6ml de midó. Valorem fins el viratge. El volum gastat és:
V = 10.7ml
-
Després vam pipetejar ( amb molt de compte) 2ml de la fase orgànica del fons de l'erlenmeyer. A un erlenmeyer introduïm els 2ml de fase orgànica, 30 ml d'aigua i uns 0.4 grams de iodur potàssic. Realitzem la valoració idènticament a l'nterior i el volum gastat és:
V = 18.2ml
Com sabem el volum gastat de l'espècie valorant i tenim l'estequeometria de la reacció trobarem la constant buscada.
-
Primer trobem els mols de tiosulfat gastat.
-
Després passem aquests mols de tiosulfat a mols de I2 que hi ha a solució valorada.
-
Trobem la concentració d'aquest iode.
Fase aquosa
%
%
%
Fase orgànica
%
%
%
Ara que ja coneixem les concentracions de iode en les dues fases, la constant de repartiment serà:
Determinació de la constant d'equilibri
E l primer que cal fer es preparar una solució de 500ml de iodur potàssic 0.05M, per aconseguir aquesta concentració és necessari diluïr:
![]()
Ara, en un martas de 250 ml afegirem 40ml de tetraclorur de carboni saturat amb iode i 200ml de la solució d'iodur potàssic. Com a la determinació anterior es torna a agitar durant 40 minuts i passat aquest temps es deixa reposar 10 minuts.
Tornem a repetir el procediment de la determinació de la constant de repartiment. Prenem primer 10ml de la fase aquosa i 2ml de la fase orgànica després. Realitzem les valoracionsamb tiosulfat de forma idèntica. El volum gastat és:
Vfase aquosa=24.6ml
Vfase orgànica=18.6ml
A partir de les relacions estequeomètriques i els volums gastats obtenim les concentracions de I2 i I![]()
:
![]()
![]()
-
Primer trobem els mols de tiosulfat gastat.
-
Després passem aquests mols de tiosulfat a mols de I2 i I
que hi ha a solució valorada. -
Trobem la concentració de I2 i I
.
Fase aquosa
% ![]()
% 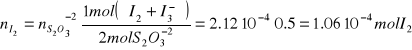
% ![]()
Fase orgànica
% ![]()
% ![]()
% ![]()
A partir de la constant de repartiment i la concentració de iode coneguda a la fase orgànica podem saber la concentració de iode a la fase aquosa

A partir de la concentració de iode a la fase aquosa podem obtenir la concentració de l'ió complex:
![]()
Tenint en compte que la concentració inicial de iodur potàssic és la suma de concentracions de ![]()
,tenim:
![]()
![]()
![]()
Ara ja podem trobar la constant d'equilibri de la reacció, Keq:
![]()

![]()
Determinació del percentatge de iode extret de la fase aquosa
-
En la detreminació de la constant de repartiment:
%I2,H2O=
%I2,H2O = 5.52%
-
En la detreminació de la constant de repartiment:
% I2,H2O = 
% I2,H2O = ![]()
% I2,H2O = 52.67%
El percentatge de iode extret al segon cas és molt més elevat, a causa de la reacció d'equilibri.
Equilibri químic
Descargar
| Enviado por: | Carlos Martinez |
| Idioma: | catalán |
| País: | España |
