Química
Ciencias
Investigue el concepto de:
-
Atomicidad:
Es el número de átomos que tiene una molécula, por ejemplo, H2, O2, N2, F2, Cl2, Br2, I2, P2, S8 etcétera.
-
Reacción endotérmica:
Se denomina reacción endotérmica a cualquier reacción química que absorbe calor.
-
Reacción exotérmica:
Se denomina reacción exotérmica a cualquier reacción química que desprende calor. Se da principalmente en las reacciones de oxidación. Cuando esta es intensa puede dar lugar al fuego. Cuando reaccionan entre sí dos átomos de hidrógeno para formar una molécula, el proceso es exotérmico.
Investigue la importancia biológica e industrial para los procesos de:
-
Fotosíntesis:
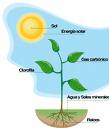
Por su gran importancia en los ciclos de intercambio de materia y energía en los seres vivos ha sido motivo de estudio durante largo tiempo para poder proporcionar conocimientos científicos sobre una de las reacciones bioquímicas naturales de las plantas, que transforma la energía lumínica en energía química almacenada en la molécula de azúcar o almidón.
En forma natural las plantas verdes captan la luz solar y junto con la clorofila, el dióxido de carbón y agua que toman del aire y del suelo producen azucares y almidones. La fotosíntesis es una reacción química endotérmica que en la naturaleza se encuentra en equilibrio con la respiración celular.
-
Respiración Celular:
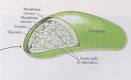
A grandes rasgos es un proceso inverso a la fotosíntesis.
La respiración es un proceso de oxidación ya que los azucares son oxidados a dióxido de carbono y agua mediante un proceso químico que libera energía en forma de ATP (adenosina trotosfato)
La oxidación celular o respiración tiene lugar en la mitocondria que distribuye las moléculas de ATP (energía) por todo el organismo para que este pueda realizar el trabajo de crecimiento para mantener la temperatura.
-
Fermentación:
Proceso químico muy parecido a la respiración, solo que se da sin presencia del oxigeno, la degradación de sustancias orgánicas complejas como el azúcar ocurre por la acción de microorganismos que descomponen las grandes moléculas en productos mas sencillos.
Según el tipo de microorganismo el alcohol se puede transformar en acido acético, láctico y amoniaco.
La fermentación de la célula en el intestino de los animales herbívoros produce glucosas y en la celulosa atacada por hongos y descompuesta produce minerales que pasan a formar el humus del suelo.
-
Quimiosíntesis:
Proceso especial de oxidación de sustancias inorgánicas, para que grupos de bacterias obtengan la energía para realizar sus funciones vitales. E s un proceso exotérmico. Entre las bacterias quimiosintéticas están las sulfobacterias que oxidan el acido sulfúrico en azufre; las q oxidan el metano: las que degradan los productos finales del metabolismo entre otras.
-
Digestión:
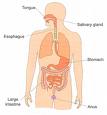
El sistema digestivo es un conjunto de órganos que tiene las siguientes funciones: digerir, absorber y eliminar sustancias.
En la digestión la primera reacción química que se da es cuando los alimentos se combinan con la saliva y se transforman los almidones en azúcares. Los productos pasan al estómago donde encuentran el jugo gástrico y reaccionan para descomponer los almidones y azúcares en sustancias más simples las cuales continúan sufriendo cambios químicos con otros jugos digestivos hasta que los azúcares, proteínas y grasas en el intestino se transforman en sustancias simples que puedan entrar al torrente sanguíneo y luego a las células para que éstas formen huesos, dientes, nervios, músculos y otras estructuras y sustancias necesarias para los seres vivos. Los residuos pasan al intestino grueso donde los esperan los microorganismos que los descomponen para eliminarlos en forma de eces.
-
Metabolismo:
Es el conjunto de reacciones químicas a las que son sometidas las sustancias ingeridas o absorbidas por los seres vivos hasta que suministran energía o hasta que pasan a formar parte de la propia arquitectura estructural. Las reacciones que ocurren en la digestión forman parte del metabolismo y a ellas se suman numerosas y complejas reacciones químicas que se dan en los organismos vivientes.
Además de las reacciones bioquímicas que son numerosas y complejas a tal punto que conforman una rama de la Química especializada llamada bioquímica y de las que se dan en la naturaleza como la de la formación y destrucción del ozono, la de la lluvia ácida, el hombre realiza y controla una gran cantidad de reacciones químicas en el laboratorio para obtener productos que le serán útiles en la industria y en la vida cotidiana.
-
Combustión:
La oxidación de una sustancia se produce cuando ésta reacciona químicamente con el oxígeno. Cuando la oxidación es rápida como el caso del carbón se le llama combustión.
La sustancia que reacciona con el oxígeno para arder o quemarse se llama combustible
y puede ser sólida como la madera, el papel y la leña, líquidos como la gasolina y el petróleo o gaseosos como el metano.
La utilidad de este proceso químico se remonta a la prehistoria cuando el hombre de las cavernas aprendió a encender, a mantener el fuego a darle muchas utilidades que le permitieron el desarrollo y una mejor calidad de vida hasta el día de hoy.
Actualmente la combustión es la base del funcionamiento de la maquinaria, de la industria, de la calefacción, de los medios de transporte, de cohetes, hornos y cocinas de leña.
La calidad de los combustibles se mejora cada día para evitar que los productos no deseados, eleven los niveles de contaminación del medio ambiente.
3) Investiga sobre algunos efectos negativos de las reacciones químicas.
-
La oxidación del hierro que al reaccionar con el oxigeno del aire forma el oxido de hierro o herrumbre que corroe las estructuras metálicas.
-
La fusión nuclear es una reacción que pone al alcance productos que se utilizan para fabricar armas nucleares.
-
La combustión tiene en sus productos los óxidos no metálicos que en exceso se convierten agentes contaminantes que ponen en peligro la salud de los seres vivos.
-
Las reacciones que suceden en los volcanes y que producen óxidos de azufre también contaminan la atmósfera y reaccionan con el agua, produciendo ácidos que son dañinos.
4) Explica el enunciado de la primera ley de termodinámica, quien la propuso.
La primera ley de la termodinámica o primer principio de la termodinámica es una aplicación de la ley universal de conservación de la energía a la termodinámica y a su vez identifica el calor como una transferencia de energía. Uno de los enunciados de la primera ley de la termodinámica es el siguiente:
El incremento de la energía interna de un sistema termodinámico es igual a la diferencia entre la cantidad de calor añadida a un sistema y el trabajo cedido por el sistema a sus alrededores. Y fue postulada por Antoine Lavoisier.
Introducción
El fin de este y de todos los trabajos es aprender y ampliar más nuestros conocimientos; pero este trabajo se encargo de expandir nuestros conocimientos en el ámbito de la química y de sus conocidas reacciones químicas. Con este trabajo ansío tener un conocimiento mas amplio sobre el tema y ayudarme a comprender mejor a la hora de estudiar.
Conclusión
En síntesis podemos decir que las reacciones químicas son de suma importancia ya que son fenómenos que vemos a diario en nuestra vida y son la base de la realización de las funciones vitales y las demás actividades del hombre o cualquier otro ser vivo, como por ejemplo la respiración es una reacción química, ya que al organismo entra O2 y sale CO2. Además todas las sustancias que usamos o usan los demás seres vivos fueron producto de reacciones químicas.
Bibliografía
Para la creación de este trabajo se tuvo como base la teoría encontrada en los siguientes libros y sitios Web:
-
www.wikipedia.com (Enciclopedia Libre).
-
www.monografias.com.
-
Enciclopedia Microsoft Encarta 2005.
-
Diccionario enciclopédico Larousse.
-
Libro ciencias 8°.
Anexos
-
Reacciones químicas:
-
Fotosíntesis:
-
Respiración Celular:
-
Fermentación:

-
Quimiosintesis:

-
Digestión:
-
Metabolismo:
-
Combustión:

Descargar
| Enviado por: | El remitente no desea revelar su nombre |
| Idioma: | castellano |
| País: | Costa Rica |
