Agronomía, Recursos Forestales y Montes
Chalariosis
INDICE DE LA REVISION:
NOMBRE Y CLASIFICACION.
PLANTAS SUSCEPTIBLES.
HISTORIA Y DISTRIBUCION GEOGRAFICA.
IMPORTANCIA ECONOMICA Y ECOLOGICA.
DIAGNOSIS: SINTOMAS Y SIGNOS.
SINTOMATOLOGIA EN ROBLES ROJOS.
SINTOMATOLOGIA EN ROBLES BLANCOS
ETIOLOGIA:
NOMENCLATURA Y TAXONOMIA DEL AGENTE.
PATOGENECIDAD Y ESPECIACION PATOGENICA.
PATOGENESIS Y EPIDEMIOLOGIA.
ESTRATEGIAS DE CONTROL.
RECOMENDACIONES ESPECÍFICAS DE CONTROL.
INTRODUCCION.
ESTRATEGIAS ESPECÍFICAS DE CONTROL.
COMENTARIOS Y OBSERVACIONES PERSONALES.
a. ANALISIS DE MUESTRAS AFECTADAS POR CERATOCYSTIS F.
1. TOMA DE MUESTRAS
2. ANALISIS DE LABORATORIO
b. CONTROL DE VEGETACION USANDO CERATOCYSTIS F.
c. EMPLEO DE LA FOTOGRAFIA AEREA PARA LA DETECCION DE CERATOCYSTIS FAGACEARUM.
d. SENSIBILIDAD DEL CERATOCYSTIS FRENTE A FUNGICIDAS
e. NORMATIVA EUROPEA
f. COMENTARIOS PERSONALES
BIBLIOGRAFIA Y PAGINAS WEB CONSULTADAS.
NOMBRE Y CLASIFICACION
La chalariosis es una enfermedad causada por un hongo, Ceratocystis Fagacearum, cuyos principales hospedantes son especies del género Quercus, normalmente causa la muerte del árbol semanas después de su infección.
La chalariosis es una enfermedad causada por el Ceratocystis Fagacearum, este hongo se desarrolla en el sistema vascular del árbol. El árbol infectado reacciona desarrollando tilosas y gomas que consecuentemente restringen el fluir del agua y de los nutrientes en los tejidos vasculares afectados con el resultado de marchitez y muerte. (French & Stienstra, 1980).
Recibe el nombre de chalariosis por el estado conidia del hongo chalara.
Figura1 Figura 2
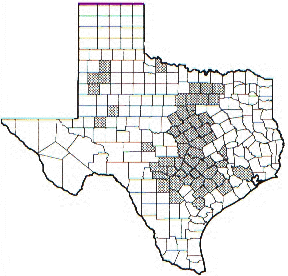
FIGURA 1.DISTRIBUCION DE LA ENFERMEDAD EN TEXAS.
FIGURA 2. FOTOGRAFIA AL MICROSCOPIO DEL HONGO (ESTROMA)
IDENTIFICACION:
NOMBRE: Ceratocystis fagacearum (Bretz) Hunt
Sinónimos: Chalara quercina Henry
Estado Anamorfo: Endoconidiophora fagacearum Bretz
Posición Taxonómica: Fungi: Ascomycetes: Ophiostomatales
Nombres comunes: Ok Wilt, Flétrissement du chêne, Marchitez del roble americano
PLANTAS SUSCEPTIBLES
En la actualidad, su presencia está aparentemente confinada a los Estados Unidos, donde alrededor de veinte especies de los géneros Quercus y Castanea, están afectados por la enfermedad. También ha quedado demostrado mediante inoculaciones artificiales que algunas especies del género Pyrus son susceptibles de contraer la chalariosis.
La Organización de Protección Fitosanitaria de Europa y el Mediterráneo estima que no se conocen Quercus nativos con indicios de inmunidad y considera que son alrededor de cincuenta las especies, tanto nativas como exóticas, amenazadas por la infección, además de algunas especies del género Castanea, Lithocarpus y Castanopsis.
Los síntomas observados en Estados Unidos varían en función de las condiciones ecológicas del lugar donde se desarrollan los robles.
Las especies inoculadas artificialmente han mostrado una gran susceptibilidad a contraer la enfermedad siendo mayor esta tendencia en los robles rojos (Erythrobalanus), que normalmente mueren a las pocas semanas de iniciada la infección.
En cambio, los miembros de los robles blancos (Leucobalanus) una categoría a la cual pertenecen todos los Quercus europeos salvo Q. suber, que pertenece al subgénero Cerris, y Q. ilex y Q. coccifera, que pertenecen al subgénero Scleropfyllodrys, presentan una mayor resistencia y se pueden considerar medianamente susceptibles.
HISTORIA Y DISTRIBUCION GEOGRÁFICA
Actualmente presente en el sudoeste de los Estados Unidos, en Texas donde esta alcanzando proporciones epidemiológicas importantes.
Con respecto a la presencia de la enfermedad en Europa, existen dos posibilidades: o bien está ausente, o bien se encuentra, por lo menos, en Europa del Este.
El primer caso significaría un éxito de las normas comunitarias y de su programa para impedir que la enfermedad alcance el viejo continente.
El segundo caso constituiría un rotundo fracaso, ya que debería haberse previsto el peligro de infección dado que los controles fitosanitarios entre Estados Unidos y los países de Europa oriental son muy escasos.
Una vez implantada en el continente es más fácil que ingrese en los países comunitarios a través del vuelo de los escolítidos.
Por otro lado, el hallazgo de esta enfermedad en algunos países del Este podría deberse a un efecto de ping-pong, ya que es posible que la enfermedad se encontrara presente en los países comunitarios y, desde ellos, haya colonizado Europa Oriental. En cualquier caso, la experiencia de la grafiosis no ha servido de mucho, se está utilizando una estrategia equivocada, igualmente pasiva, que ya arrojó funestos resultados con los olmos.
IMPORTANCIA ECONOMICA Y ECOLOGICA.
Muchos países europeos adquieren importantes cantidades de madera de roble procedente de Estados Unidos, por lo que se teme que sea esta la vía de entrada más probable.
No debemos olvidar que la cepa agresiva de la grafiosis se introdujo en Inglaterra desde Canadá durante la década de los setenta y, desde allí, alcanzó España a través de Portugal y Francia en pocos años.
Aparentemente, esta forma de introducción parece algo difícil, ya que algunos de los bosques comerciales de robles en los Estados Unidos están libres de la enfermedad y el grado de infección es muy bajo en las demás áreas.
Alrededor del 90% de los árboles que enferman lo hacen durante el inicio del verano y luego mueren y se biodeterioran muy rápidamente. El problema se presenta cuando los árboles seleccionados padecen la enfermedad en estado muy incipiente.
La madera de Quercus procedente de Norteamérica debe venir acompañada de un certificado donde se establezca que:
1. El contenido de humedad de la madera no excede del 20%.
2. La madera ha sido desinfectada con agua o aire caliente.
3. En el dimensionado se han quitado todas las superficies naturales.
Algunos países europeos con importantes industrias de enchapados que se abastecen de madera procedente de robles norteamericanos no pueden aplicar tratamientos enérgicos debido a que provocan serias pérdidas en la calidad estética del producto final. En este caso, la Comunidad Europea ha derogado la aplicación de dichas normas.
Además, la CEE establece un estricto control sobre el comercio de esta madera y obliga a que las trozas sean fumigadas con bromuro de metilo antes de importarlas desde Estados Unidos. Siempre y cuando la madera no proceda de un área afectada por la enfermedad. Aun así, Inglaterra, Irlanda y Grecia han optado por mantenerse excluidas de la norma comunitaria.
Ceratocystis Fagacearum no se localiza en las bellotas, por lo que no se requiere ningún control sobre la importación de este producto. Tampoco se ha detectado la enfermedad en plántulas o arbolitos de vivero, de manera que la importación de estos ejemplares tampoco se encuentra prohibida, si bien se evita ya que pueden ser portadores de otras enfermedades.
DIAGNOSTICO: SINTOMAS, SIGNOS, CCAS. DIAGNOSTICAS.
La chalariosis toma su nombre del estado conidias del hongo, conocido vulgarmente con el nombre de "chalara". En la naturaleza, esta fase de su ciclo vital se produce sobre una masa estromatica de color gris que se halla en la superficie de la madera y en el interior de la corteza de los árboles muertos.
MASA ESTROMATICA EN TRONCO DE ROBLE
En términos generales, la sintomatología clásica corresponde a una marchitez. Esta se produce por un taponamiento de los elementos conductores por donde transcurre la savia, debido a la acción de las enzimas del hongo.
CORTE TRANSVERSAL DEL TRONCO DONDE SE APRECIA COMO EL HONGO INTERFIERE CON LOS ELEMENTOS VASCULARES
Los síntomas observados en Estados Unidos varían en función de las condiciones ecológicas del lugar donde se desarrollen los árboles afectados.
A continuación procederemos a estudiar la sintomatología sobre robles rojos (plantas altamente susceptibles) y sobre robles blancos (plantas algo susceptibles pero no del todo tolerantes).
a. SINTOMATOLOGIA SOBRE ROBLES ROJOS.
En los individuos del grupo de los Quercus rojos, la marchitez se manifiesta en primer lugar en la cima del árbol.
DEFOLIACION DE LA COPA.
Las hojas situadas en las ramas terminales comienzan a caer tan pronto se inician los primeros síntomas y algunas hojas se desprenden aunque estén verdes.
La decoloración y defoliación avanza a través de la copa y tarda entre algunos días y varias semanas en presentar finalmente ramas y ramitas muertas.
En los robles caducifolios muertos por la enfermedad es posible observar algunas pocas hojas de color marrón aun en invierno.
A menudo, las hojas de las robles perennes enfermos desarrollan venas cloróticas (amarillentas) que con el tiempo cambian a necróticas (parduscas). Este síntoma es conocido como necrosis venal.

SINTOMATOLOGIA FOLIAR DEL CERATOCYSTIS FAGACEARUM
a. necrosis marginal en roble blanco
b. necrosis foliar en roble rojo
c. necrosis venial
Al hacer un corte transversal en una ramita afectada o al separar la corteza, se observa que en la parte exterior de la albura se forman franjas de color café coincidiendo con la época en que se presentan los síntomas foliares. Estas manchas corresponden al tejido conductor (vasos) colonizados por el hongo.
CORTE TRANSVERSAL DE RAMA MOSTRANDO TEJIDO FUNGICO INVASOR.
Al igual que la grafiosis, las conidias se mueven pasivamente, en la savia, alojándose en las punteaduras y en las paredes terminales de los vasos.
b. SINTOMATOLOGIA SOBRE ROBLES BLANCOS
Los síntomas que padecen los individuos del grupo de los robles blancos son similares al de los robles rojos, pero menos severos.
El avance de la enfermedad en el árbol es relativamente más lento y algunas veces se encuentra confinado a las ramas pequeñas.
La sintomatología general es similar al cambio de coloración provocado por la llegada del otoño. Es decir, semejante al daño producido por la cepa no agresiva de la grafiosis del olmo.
En la franja sur del área de distribución de la chalariosis en Estados Unidos, los síntomas y conducta epidémica difieren de la descripción dada anteriormente. Los árboles enfermos pueden defoliarse y morir rápidamente, aunque es común que sobrevivan algunos años. En estos árboles se produce una muerte regresiva de las ramas apareciendo luego brotes adventicios con hojas pequeñas en el fuste.
Una vez que las hojas mueren, el hongo puede también morir en las ramas que reciben una radiación solar directa.
En condiciones favorables, el patógeno puede permanecer vivo en el tronco hasta el año siguiente, e incluso cuatro años en las raíces.
En ambos grupos, Erythrobalanus y Leucobalanus, existe una cima de susceptibilidad que coincide con la formación de la madera en primavera.
En los robles rojos infectados, el hongo se establece en los vasos del xilema del anillo anual desde las raíces hasta las ramillas. Una vez que el árbol empieza a morirse, el patógeno avanza hacia el centro del árbol y también cruza el cambium hacia el floema, es decir hacia el exterior del árbol. Su supervivencia en estas partes dependerá de la temperatura, la humedad y el antagonismo microbial.
Los robles blancos expresan su mayor resistencia a la enfermedad aislando el anillo infectado del cambium.
ETIOLOGIA.
a. NOMENCLATURA Y TAXONOMIA DEL AGENTE.
Esta a grandes rasgos es la clasificación taxonómica del agente.
-
ASCOMICETOS
-
PLECTOMYCETIDE
-
MICROASCACEAE/OPHISTOMATACEAE
-
CERATOCYSTIDAE
-
C. FAGACEARUM
A continuación presento las características más importantes de la clasificación taxonómica desde lo general hasta lo particular.
Los ascomicetos presentan las propiedades siguientes:
Características generales
-
presentan una fase dicariótica de corta duración entre la plasmogamia y la cariogamia (en los Basidiomyceteses de larga duración)
-
asca: célula saciforme con número, en general definido de ocho, ascosporas.
-
ascosporas originadas por formación de células libres tras la cariogamia y la meiosis.
-
micelio septado.
-
la mayoría producen un cuerpo fructífero o ascocarpo que rodea las ascas.
-
no hay células flageladas.
-
en general presentan dos fases:
-
fase ascógena (fase perfecta), sexual (teleomorfo).
-
fase conídica (fase imperfecta), asexual (anamorfo).
Nuestro hongo pertenece a la subclase plectomycetidae cuyas propiedades son:
Ascas típicamente de pared delgada, esféricas o piriformes, evanescentes.
Ascas desordenadas, situadas varios niveles, no hay himenio, parten de hifas ascógenas de varias longitudes, que se ramifican a través del centro (centrum) del ascocarpo.
Ascosporas unicelulares
Ascoma o ascocarpo, típicamente, un cleistotecio, a veces con un ostíolo.
Perídio que puede faltar, cuando las ascas están ubicadas en grupos desnudos e irregulares, varía desde una estructura aracnoide hasta una pared bien definida pseudoparenquimática o escleroide.
Así pues podemos decir que pertenece a la clase microascaeae con las características siguientes:
Ascosporas dextrinoides con poros germinales.
Fase asexual de aneloconidios o aleurioconidios
Ascocarpos peludos, con o sin ostiolos
Ascas sin uncínulos
Ascosporas unicelulares de color oscuro
Dentro de la clase hallamos dos familias, Microascaceae y Ophiostomataceae con las características siguientes (algunos autores dicen que solo hay una familia).
Peritecios superficiales o sólo parcialmente hundidos, con la base esférica, cuello alargado, ápice deshilachado.
Pared del ascocarpo que se gelatiniza y las ascosporas son exudadas por el cuello en un mucus.
Se pueden formar sinemas (haz de hifas conidióforos), haces de conidióforos, o conidias, directamente del micelio.
Conidias que pueden germinar dando nuevos micelios o comportarse como espermacias.
b. PATOGENECIDAD Y ESPECIACION PATOGENICA
La fase patogénica de C. Fagacearum sufre en el xilema de los árboles afectados una constante recombinación a través de la formación de peritecios y ascosporas, dando origen de esta forma a la siguiente fase de infección. Este sencillo mecanismo provoca una presión de selección muy diferente a la de C. Ulmi.
Por otra parte se sabe que la fase saprofítica del hongo de la grafiosis ocupa aproximadamente ocho meses al año, período en él se produce la selección de los genotipos más virulentos del patógeno, se cree que en chalariosis puede suceder lo mismo ya que el hongo también presenta fase saprofítica. Debido a la existencia de este punto crítico, es necesario destruir la madera y evitar que los escolítidos se reproduzcan y dispersen la enfermedad.
PATOGENESIS Y EPIDEMIOLOGIA.
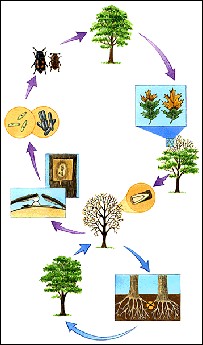
CICLO BIOLOGICO DEL CERATOCYSTIS FAGACEARUM
A continuación procedo a explicar la imagen anterior.
El insecto vector perfora el árbol sano para comerse la madera, dejando allí las esporas sexuales o las conidias del hongo, el cual germina dentro de los elementos vasculares y comienza a interferir con el transporte de agua, manifestándose así los síntomas de necrosis foliar desde el ápice a la base y la necrosis venial, una vez el árbol muere, el hongo crea el tejido estromático mucilaginoso que atrae al insecto vector, al sintetizar un reclamo similar a la feromona producida por la hembra, y propaga de nuevo la enfermedad.
O bien el árbol muerto ha establecido conexiones radiculares con otros árboles entonces las conidias del hongo llegan a estos pies sanos desarrollándose la enfermedad.
La difusión de la enfermedad es lenta y errática.
La transmisión a través de injertos radiculares o de raíces puente ha sido el primer método de propagación la que se ha descrito. Su avance es de un aproximadamente diez metros por año a de partir del centro de infección.
INJERTOS RADICULARES DE ROBLES
Sin embargo, y debido a que Ceratocystis Fagacearum, al igual que Ceratocystis ulmi presenta sus esporas cubiertas por un mucícas lago pegajoso, es fácil suponer que este de patógeno debe encontrarse muy adaptado a la dispersión por medio de insectos.
El interés por los coleópteros nitidúlidos ha cobrado un nuevo interés después de que en 1952 se descubriera que el hongo produce un manto miceliar de aroma dulce entre la corteza y la madera de los árboles muertos entre los dos y tres meses posteriores a la defoliación que ejerce un poderoso atractivo sobre los nitidúlidos, al sintetizar una molécula muy similar a la feromona sintetizada por la hembra.

INSECTOS VECTORES
Después de la transmisión mediante injertos radiculares o raíces puente, los escolítidos son los principales agentes de difusión de la epidemia, al menos, en la parte norte del área de distribución de la enfermedad en Estados Unidos. Sin embargo, más hacia el Sur esta forma de esporulación es infrecuente debido a que la estructuras estromáticas son menos comunes en los Quercus del grupo Leucobalanus. El interés por el papel que juegan lo vectores se centra en los escolítidos de la corteza de los Quercus. Sin embargo, lo hábitos alimentarios de los escolítidos en árboles sanos sólo inducen de forma ocasional a la infección. La causa de tan baja incidencia se debe, probablemente, a que muy pocos de estos insectos son capaces de transportar las esporas de Ceratocystis Fagacearum.
En cuanto a los posibles agentes transmisores, cabe citar a los insectos de la albura, coleópteros nitidúlidos de los géneros Carpophilus Colopterus, Cryptarcha, Epuraea y Glischrochilus, que transportan el hongo hasta las heridas del árbol, tanto naturales como provocadas por el hombre a través de las podas. Y a los escarabajos de la corteza de los Quercus, Pseudopityophthorus minutissimus y P. Pruinosus, que introducen el patógeno a través de las heridas que ellos mismos realizan durante su actividad de alimentación o avituallamiento.
La situación descrita es algo diferente a la que protagonizan los escolítidos del olmo, que colonizan todo el material disponible desde los tocones hasta las ramas principales y el interior de la corteza. Además, C. Ulmi esporula en forma abundante durante la época en que emergen los escolítidos. Por el contrario, los pequeños escolítidos de la corteza de los Quercus muy raramente se alimentan de ramas que superen los 10 cm. de diámetro y también es infrecuente que C. Fagacearum colonice la corteza de las ramas pequeñas.
Si partimos del supuesto de una introducción accidental de S. Intricatus en Norteamérica o de C. Fagacearum en Europa, la estrategia de la chalariosis cambia radicalmente, ya que en vez de disponer de los nitidúlidos como vectores tendría a uno más eficiente, S. Intricatus.
En este caso, el desenlace es un violento proceso de selección natural hacia los Quercus, ya que al igual que S. Multistriatus, Intricatus realiza la alimentación de avituallamiento en las horcaduras de las ramillas de los Quercus sanos. Por este motivo, la unión entre C. Fagacearum y S. Intricatus permite al hongo desarrollar un ciclo saprofítico de corteza a corteza similar al de la grafiosis y producir explosiones epidémicas violentas.
ESTRATEGIAS DE CONTROL.
Es muy frecuente inyectar fungicidas sistémicos en árboles durante el verano, cuando es la primavera la época más conveniente debido a que existe un gran movimiento de savia. Esta actividad interna contribuye a una mayor difusión de los productos químicos dentro del árbol y, por ende, se consigue una mayor protección, porque el flujo de savia durante el verano es significativamente menor.
Es probable que el mecanismo de transmisión de la chalariosis sea similar al de la grafiosis, por lo que la prioridad deberá recaer también en la eliminación de las fuentes de alimentación y reproducción del escolítido S. Intricatus, en Europa.
La presencia del estroma afelpado con aroma dulce podría atraer a otros insectos y esta complicación extra habría que estudiarla detenidamente en el caso de España.
Existen antecedentes de que el anillado puede provocar el secado y la muerte rápida del árbol enfermo.
Es recomendable cortar los árboles infectados y los que lo rodean.
La poda no debe realizarse durante la estación de crecimiento, ya que las heridas atraen a numerosos insectos que pueden transportar el patógeno. En cualquier caso, las heridas deben protegerse con un producto químico repelente.
Se deben destruir de forma mecánica o química los injertos radiculares o las raíces puente. Y, por último, se debe evitar la formación del fieltro estromático entre la corteza y la madera.
La mejora genética surge como una medida clásica para enfrentarse a este tipo de problemas en los que resulta imprescindible acumular la resistencia dispersa en muchos genotipos.
Desde este punto de vista, el grupo Leucobalanus presenta ya un nivel apreciable de resistencia, lo que sin duda constituye una ventaja inicial. Pero, debido a la formación de una fase saprofítica de corteza a corteza a causa de S. Intricatus, es de esperar que, al igual que C. Ulmi se produzca una criba genética que aumente la virulencia original de C. Fagacearum. Luego, al igual que en el género Ulmus, los robles necesitarán ser cada vez más resistentes para soportar a un patógeno en constante cambio.
También es necesario comenzar desde ahora con la formación de bancos clonales, preferentemente a niveles regionales, en donde se estudien las técnicas de reproducción más convenientes para los distintos genotipos. El banco clonal debe estar localizado en un área totalmente excluida y protegida.
Quizás sea aconsejable tener presente durante el diseño de dichos bancos clonales las zonas de riesgo anteriormente delimitadas.
Las pruebas de patogenicidad, además de realizarse en el extranjero, lo que puede traer complicaciones debido al movimiento de genotipos del hospedante hacia otros países, podrían emprenderse en España bajo rigurosas medidas de vigilancia en invernadero.
IX. RECOMENDACIONES ESPECÍFICAS DE CONTROL
a. INTRODUCCION
Se pueden tomar ciertas medidas para romper las conexiones de raíces entre los robles perennifolios o grupos densos de robles rojos para reducir o detener la transmisión del hongo del marchitamiento.
Los robles rojos infectados que mueren a fines del verano o en el otoño, se deben derribar y quemar. Esto previene que los insectos transmitan esporas de los mantos fungosos que se pueden formar sobre estos árboles en el otoño o la primavera siguiente.
Si esto no es posible, se deberá inyectar en los árboles un herbicida o anillarlos en profundidad, cortando el flujo al realizar el corte con un hacha, de manera que se inhiba el flujo de elementos.
El secado de la madera antes del otoño puede evitar la formación de los mantos fungosos y por ende la dispersión de esporas.
Todas las heridas (incluyendo las de poda) en los robles y demás quercinias perennes se deben de evitar de febrero a julio. Las épocas de menor riesgo para podar son durante los días más fríos de mediados del invierno y los de calor prolongado de mediados a finales del verano. No importa la época del año, todos los cortes de poda o cualquier otra herida en los robles y quercinias perennes susceptibles, incluyendo en los tocones y las raíces superficiales dañadas, se deben tratar de inmediato con pintura para heridas (o pintura tipo “látex”) para prevenir la exposición a insectos vectores contaminados.
El transporte de leña verde de robles rojos enfermos es un método potencial para propagar el hongo del marchitamiento. Éste no se puede transmitir al quemar leña infectada, pero los mantos fungosos se pueden formar sobre leña almacenada.
La madera infectada nunca se deberá guardar cerca de árboles hospedantes sanos sin antes tomar precauciones. Es mejor comprar leña que se ha secado bien por lo menos por un año. Si hay que almacenar leña de árboles infectados cerca de otros sanos, se debe de cubrir con plástico transparente y enterrar las orillas de éste para prevenir el escape de los insectos vectores.
b. ESTRATEGIAS ESPECÍFICAS DE CONTROL.
1. Interrupción de la propagación por raíces
La técnica más común es cortar las raíces haciendo una zanja o trinchera de por lo menos 1.2 metros de profundidad con zanjadoras, sierras cortapiedras, o con barras desgarradoras. En los suelos muy profundos, a veces es necesario excavar las zanjas a más de 1.2 metros de profundidad para asegurar un buen control.
La colocación correcta de la zanja es crítica para proteger con éxito los árboles no infectados. Hay un retraso entre la colonización de las raíces por el hongo y en la aparición de los síntomas en la copa.
Por lo tanto, primero se deben identificar con cuidado todos los árboles con síntomas. Luego, se hace la zanja a un mínimo de 30 metros más allá de estos árboles sintomáticos, aunque haya árboles “sanos” en alto riesgo de infección dentro de la misma.
Los árboles dentro de esta barrera de 30 metros incluso aquellos sin síntomas, pueden ser destoconados y eliminados para mejorar la eficacia de la barrera contra la transmisión por raíces. La eliminación de árboles se debe de iniciar después de hacer la zanja, empezando con aquellos sanos adyacentes a ésta y trabajando gradualmente hacia dentro para incluir los sintomáticos.
Los centros de infección del marchitamiento se pueden controlar fácilmente cuando se tratan temprano, antes de que se hagan muy grandes. Los árboles no tratados justo afuera de la zanja se deben de observar con mucho cuidado por varios años. Si pareciera que el patógeno ha cruzado una barrera, las mismas medidas (zanja nueva y tratamiento de los árboles de adentro) se deben de repetir mientras el centro de infección todavía es pequeño.
ZANJA PARA EVITAR INJERTOS RADICALES
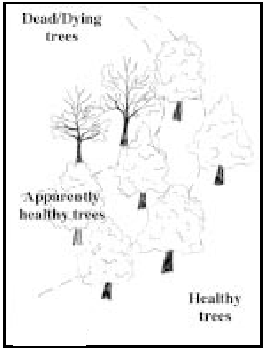
CREACION DE ZANJA DE SEGURIDAD (LINEAS DISCONTINUAS)
2. Tratamiento con fungicida
Se puede usar el fungicida propiconazol como tratamiento preventivo para reducir los síntomas del marchitamiento en las especies susceptibles cuando se aplica antes de que se infecten o de forma terapéutica una vez esté infectado.
Formulación de la sustancia activa Propiconazol:
1[[2-(2,4-dichlorophenyl)-4-propyl-1,3-dioxolan-2-yl]methyl]-1H-1,2,4-triazole
El fungicida se inyecta en el sistema vascular conductor de agua del árbol a través de pequeños agujeros perforados en los ensanchamientos de las raíces en la base del árbol.
La mezcla de la solución del fungicida, la exposición y perforación de agujeros en los ensanchamientos de las raíces, las conexiones del aparato de inyección al árbol y el monitoreo de la velocidad de absorción del fungicida tienen que hacerse de acuerdo a las especificaciones y direcciones de la etiqueta.
También se puede tener éxito limitado al tratar árboles con inyecciones terapéuticas durante las primeras fases de la infección, dependiendo de la condición de salud del árbol seleccionado, la proporción aplicada, y la técnica de inyección.
Si se observan los síntomas en más del 30 % de la copa, es improbable que una inyección de fungicida sea efectiva. Los mejores resultados de los tratamientos preventivos se obtendrán inyectando los árboles sin síntomas a mayor distancia de los sintomáticos (por ejemplo, de 23 a 46 metros).
La inyección del fungicida no detiene la transmisión del hongo por las raíces. Este tratamiento, por lo tanto, es mejor usarlo en conjunto con zanjas o para proteger árboles individuales de alto valor en situaciones donde el hacer zanjas no es práctico.
Algunos investigadores afirman que la sustancia activa propiconazol es cancerígena, a continuación reseño sus formulaciones mas usuales en España.
-
BIFENTRIN 0,01% + PROPICONAZOL 0,01% [AE] P/P
-
PROCLORAZ 40% + PROPICONAZOL 9% [EC] P/V
-
PROPICONAZOL 10% [EC] P/V
3. Manejo integrado del marchitamiento del roble.
La detección temprana y la acción rápida son esenciales para el control efectivo del marchitamiento del roble. A grandes rasgos recomendamos seguir los puntos siguientes.
1. Prevenir infecciones nuevas.
Derribe y deseche de inmediato todos los robles rojos infectados.
Evite herir los robles y demás especies, incluyendo la poda, de febrero a julio, y pinte todas las heridas y tocones frescos sin importar la estación del año.
CARTEL INFORMATIVO PARA PREVENIR LA PODA EN MESES DE RIESGO
Manipule la leña con cuidado, quémela antes de la primavera y nunca guarde fuera de época madera de roble o encino de árboles infectados cerca de los que están sanos.
Cubra toda la leña verde (tanto la proveniente de centros de infección y de origen desconocido) con plástico transparente y entierre los bordes del plástico.
2. Detener la propagación por raíces.
Haga una zanja de por lo menos 1.2 metros de profundidad y 30 metros más allá del perímetro de los centros de infección para romper las conexiones de raíces.
Derribe o desarraigue todos los árboles encontrados dentro de la barrera de 30 metros menos aquellos tratados con fungicida.

ZANJADORA FORESTAL
3. Inyectar fungicidas en árboles de alto valor ecológico.
Identifique los árboles susceptibles de alto valor en la proximidad de los centros de infección de marchitamiento que se están expandiendo, y consulte a un especialista sobre el tratamiento de árboles con inyecciones de propiconazol.
4. Plantar árboles resistentes.
Plante especies resistentes al hongo, evite el uso de las especies susceptibles que se puedan convertir en fuente de inóculo, diversifique las especies presentes en su jardín, use genotipos resistentes al hongo o material forestal certificado libre del hongo.
X. COMENTARIOS Y OBSERVACIONES PERSONALES.
a. ANALISIS DE MUESTRAS AFECTADAS POR CERATOCYSTIS F.
1. TOMA DE MUESTRAS
La calidad de las muestras es fundamental para el éxito de las pruebas del laboratorio, ya que si son de mala calidad ello conduce a falsos negativos que derivan en que un árbol infectado no se trate.
1. Seleccione las ramas marchitas parcialmente con síntomas foliares desde el exterior al interior, asegurándose que las ramas no estén totalmente muertas o secas.
2. Recoja las hojas de las ramas seleccionadas.
3. Busque la decoloración el la albura de las ramas parcialmente marchitas realizando un corte transversal en esas ramas.
4. Tome muestras de esas ramas de entre 13 y 17 cm. de largo sin corteza ya que esta puede sufrir degradación por contaminantes muestrales que podrían arruinar nuestra muestra, por ello hemos de retirar la corteza totalmente, observando que el interior de la rama presente zonas vivas. No se recogerán muestras del extremo de las ramas porque a menudo estos tejidos están totalmente muertos y el hongo ya no esta allí.


5. Refrigere las muestras, no use hielo seco o cubitos de hielo para ello, no las exponga a luz solar directa y tampoco las deje sin refrigerar, consérvelas aproximadamente a 25ºC.

6. Recopile información sobre el árbol, edad, momento de aparición de los primeros síntomas, otros árboles susceptibles cercanos….
7. Envíelas cuanto antes al laboratorio para su estudio, cultivo y análisis posterior.
8. No recolecte muestras en los momentos álgidos de probabilidad de infección.
2. ANALISIS DE MUESTRAS EN LABORATORIO
Los procedimientos siguientes se usan de modo rutinario para el análisis clínico de muestras presuntamente afectadas por Ceratocystis Fagacearum por todo el medio oeste de Estados Unidos.
-
Cuando las muestras lleguen al laboratorio, mantenerlas en sus bolsitas, refrigeradas, usando solo las necesarias y guardando las otras por si pasara algo.
-
Esterilizar la superficie del tallo y de la rama rociando con alcohol de 95º y flameándola posteriormente.

-
Quitar la corteza con un cuchillo previamente esterilizado.
-
Observar si en la albura aparecen estrías decoloradas, cortar cachitos de 0.5 a 1 cm. de grosor de esas estrías, sumergirlas en lejía durante aproximadamente un minuto, a continuación lavarlas con agua destilada y secarlas con un papel filtro estéril.

-
Colocar las muestras en una placa de petri con el medio de cultivo APDA.

-
Incubarlas a temperatura ambiente y en condiciones de luz durante aproximadamente catorce días, sellar la placa con adhesivos de parafina que eviten la entrada de posibles contaminantes
-
El resultado será que en el cultivo la colonia aparece y se expande se observa como el color de la misma va del verde hacia el gris. Reconoceremos a nuestro hongo por la observación al microscopio de las endoconidias rectangulares (a), y unas estructuras hifáticas largas llamadas fialidas (b).


b. CONTROL DE VEGETACION USANDO CERATOCYSTIS FAGACEARUM
Con el cultivo intensivo de los bosques, es importante la remoción de árboles indeseables y el control de las malezas arbóreas ha sido un constante dolor de cabeza en estas situaciones.
La conversión de una zona boscosa de una especie dominante a otra especie ocasiona que árboles ya establecidos se conviertan, por definición, en malezas; esto ocurre repetidamente en los lugares donde los bosques de maderas duras se están convirtiendo en bosques de pinos.
El hongo Ceratocystis Fagacearum, que ocasiona la marchitez del roble, ha sido usado con eficacia en Minnesota para convertir bosques marginales de roble en bosques de pinos. La inoculación de los robles con C. Fagacearum se comparó con métodos químicos convencionales de control como el selvicida 2, 4, 5-T.
El control biológico fue decididamente más eficiente a causa de su costo inferior, su mayor facilidad de aplicación, un mayor porcentaje de mortalidad con poco o ningún rebrote de los árboles y ausencia total de daño a las otras especies arbóreas, además de que se hace innecesario volver a usar el tratamiento como es el caso con el 2, 4, 5-T. También se encontró muy poca difusión del hongo de las áreas tratadas a otras áreas de roble adyacentes.
El uso de la marchitez del roble como un erradicante de árboles encontrará naturalmente violentas reacciones.
Hay una controversia sobre si en el momento actual la marchitez del roble es una enfermedad epidémica; algunos investigadores afirman que 50 por ciento de la población de roble estará afectada con dicha marchitez en 40 años, mientras que otros creen que la enfermedad permanece estacionaria.
Sin embargo, existe la posibilidad real de que se puedan usar de un modo seguro y efectivo patógenos tales como Ceratocystis Fagacearum para controlar las malezas.
c. EMPLEO DE FOTOGRAFIA AEREA PARA DETECCION DE CERATOCYSTIS FAGACEARUM.
La Teledetección espacial y la fotografía aérea son unas tecnologías relativamente recientes que poseen un enorme potencial en la vigilancia y seguimiento de los impactos producidos por los grandes desastres ambientales, ya sean naturales o provocados por el hombre, así por ejemplo se emplean para desde el seguimiento de incendios forestales hasta para como es el caso para el hongo Ceratocystis Fagacearum, también cabe decir que se usa para analizar y evaluar los desastres ambientales causados por el hombre.
Actualmente se emplea la ortofotografia para la detección y seguimiento del hongo Ceratocystis Fagacearum, la epidemia forestal que tiene sobre todo importancia en el suroeste de los EEUU, al no hallarse en Europa (según algunos si esta presente).
Se basa en el empleo de cámaras Infrarrojas que detectan una variación en el coeficiente de respiración foliar conforme el hongo va infectando las distintas partes del árbol y muestra como éste hongo se va extendiendo de forma progresiva por el rodal.
Ello nos facilitaría la detección, el seguimiento y la evolución de los trabajos de tratamiento en rodales afectados por la enfermedad.
En lo que respecta a la evaluación de las superficies afectadas, se puede pensar en evaluaciones de carácter rápido realizadas en base a satélites de baja resolución espacial, tal y como es el caso de las imágenes NOAA-AVHRR y ERS2-ATSR con resolución aproximada de 1 Km. en ambos casos, o en evaluaciones más precisas en base a imágenes de alta resolución espacial, como es el caso de las imágenes SPOT-HRV (20 m), Landsat-TM (30 m), IRS-LISSIII (25 m).
En los próximos años, además de los actuales AVHRR y ATSR, serán varios los sensores provistos con canales espectrales situados en la región del infrarrojo térmico
(AATSR, MSG, GOES, MODIS, FOCUS, MUST…) con lo cual la posibilidad de detectar en tiempo real los focos infecciosos y de realizar una vigilancia operacional, se incrementará notablemente.
d. SENSIBILIDAD DEL CERATOCYSTIS F. A FUNGICIDAS USUALES.
El experimento se basó en probar diez muestras procedentes de diversos bosques de Tejas afectados por Ceratocystis Fagacearum, en el se quería medir la sensibilidad de este hongo frente a cinco herbicidas de sustancia activa triazol, obteniendo datos de crecimiento lineal acumulado, tasas de crecimiento lineal y peso seco acumulativo como respuesta a concentraciones de fungicida desde 0.1 hasta 600 ppb.
Ningún herbicida inhibió el crecimiento con la mínima concentración pero cuatro de los cinco fueron tremendamente efectivos inhibiendo totalmente el crecimiento del hongo en un medio de cultivo compuesto de dextrosa de patata y en otros compuestos por neopeptona.
La sensibilidad de las cepas de Tejas a los triazoles es diez veces superior en cultivos acuosos que en cultivos sólidos, requiriendo para inhibir el crecimiento dosis de hasta 500 ppb o superiores.
Los triazoles ketal, el propiconazol y el difenoconazol con el dioxolano poseen el efecto más grande sobre los tasas de crecimiento de las cepas procedentes de Tejas.
El myclobutanil y terbuconazolbutílicos con efectos intermedios en tarifas de crecimiento, mientras que el triadimefon con un grupo dimetilo del butanone posee el menor efecto en los índices de crecimiento del hongo.
f. OBSERVACIONES PERSONALES.
A mi parecer las medidas solo legales que se están tomando no son suficientes ya que Dada la importancia que tienen las especies de género Quercus en nuestro país, seria recomendable no escatimar esfuerzos técnicos ni financieros para impedir la acción del hongo que es una gran amenaza para los bosques ibéricos.
Se observa que de introducirse en Europa contaría con un insecto vector aun mas feroz que el existente en USA por lo que hay que empezar a controlar esas poblaciones.
Las medidas de control por separado no suelen ser eficaces, además debido a la constante producción de conidias es posible que dentro de poco tengamos nuevas cepas aun más virulentas y resistentes a los tratamientos fúngicos terapéuticos
La investigación de nuevas medidas de control y la certificación del material forestal de repoblación libre de inoculo, parecen ser el futuro para controlar un posible brote epidémico en Europa.
Algunas consideraciones sobre la enfermedad causada por Ceratocystis Fagacearum sobre las especies del género Quercus. Un problema potencial para España (Boletín de Sanidad Vegetal y Plagas), Ipinza R, Gil L, Soria S. (1989).
La chalariosis de los Quercus, Ipinza R, García ME. (1989)
Descargar
| Enviado por: | Rey Gudu |
| Idioma: | castellano |
| País: | España |
