Salud
Carcinogénesis
ONCOGENESIS VIRICA
Se ha demostrado que existe un gran número de virus oncogénicos para una amplia variedad de animales que oscilan entre los anfibios y los primates, y cada vez existen mas pruebas de que algunas formas de cáncer humano tienen un origen viral. Los virus oncogénicos son de ambos tipos: ADN y ARN.
** Virus ADN oncogénicos:
De los distintos tipos de virus ADN, tres tienen un interés especial debido a que pueden estar implicados en el cáncer humano (virus del papiloma, virus de Epstein-Barr y virus de la Hepatitis B). Se esta estudiando intensamente si tienen una acción oncogénica directa o bien si actúan de manera indirecta, facilitando la acción de otros carcinógenos.
Virus del Papiloma Humano (hpv):
Los virus del papiloma fueron de los primeros en ser relacionados con la neoplasia humana. Ya en 1907 Giuffo demostró que las verrugas humanas (tumores epiteliales benignos, papilomas cutáneos) estaban causados por agentes transmisibles libres de células. En 1933 Shope descubrió que los virus del papiloma eran el agente etiológico de los papilomas en los conejos. Y desde entonces se ha establecido firmemente el papel que desempeñan los virus de papiloma en la aparición de las verrugas epiteliales benignas y existen cada vez mas datos a favor de que también pueden causar determinados cánceres humanos.
Aunque aún no es posible propagar al HPV un cultivo hístico (lo que supone un serio inconveniente para su estudio), la clonación molecular de su genoma ha mostrado que existen alrededor de cincuenta tipos genéticamente distintos de HPV. Cada uno de ellos suele asociarse a un grupo determinado de entidades patológicas. Los primeros datos sobre la posible relación entre HPV y el cáncer se obtuvieron al estudiar la Epidermodisplasia Verruciforme (ev), una rara enfermedad que se caracteriza por múltiples verrugas cutáneas y un defecto de la inmunidad celular. En el 30% de estos pacientes, algunas de las verrugas de las zonas expuestas al sol sufren una transformación cancerosa. Aunque en las verrugas benignas de la EV se han identificado varios tipos de HPV en las lesiones cancerosas solo se ha encontrado ADN de unos pocos tipos de HPV, en general los tipos 5, 8 o 14. Estos datos sugieren que algunos virus del papiloma pueden actuar al unísono con la deficiencia inmunológica y con la exposición a los rayos UV y producir transformaciones malignas. Esta hipótesis se apoya en la observación de que los cánceres cutáneos que aparecen en las zonas expuestas al sol de algunos receptores de transplantes renales inmunodeprimidos también contienen ADN del HPV 5. Además de estos raros cánceres, están comenzando a surgir pruebas de que los virus del papiloma podrían desempeñar un papel en la génesis de los cánceres anogenitales en especial en el cuello uterino.
Se deben destacar:
-
Carcinomas epidermoides del cérvix contienen HPV en un 90-95 % de los casos. El más frecuente es el HPV 16 (50 %) seguido por el HPV 18 (20 %).
-
Los probables precursores del carcinoma epidermoide (incluido el carcinoma in situ) contienen HPV 16 ó 18 de manera constante.
-
Las verrugas genitales benignas se asocian a distintos tipos de HPV, entre los que predominan los tipos 6 y 11. Las lesiones que contienen este virus pueden evolucionar a carcinomas verrugosos que, aunque infiltren localmente, no metastatizan
-
Los fragmentos de ciertos tipos de HPV clonados molecularmente y los cercanos virus del papiloma bovino pueden inducir transformación in vitro de líneas celulares de ratón, lo que indica que estos virus contienen secuencias oncogénicas.
En resumen, se ha demostrado claramente que el HPV es el agente etiológico de papilomas escamosos benignos. En algunos casos (como en el EV) las lesiones benignas inducidas por el HPV progresan a la formación de carcinomas epidermoides. Se ha establecido, por tanto, de manera clara el potencial oncogénico de determinados tipos de HPV. La presencia mas o menos regular de huellas víricas en las células cancerosas de los tumores anogenitales sugiere que éste desempeña un papel etiológico de su aparición. El HPV puede actuar sólo o, lo que es más probable, en unión de otros factores de riesgo.
Virus de Epstein- Barr (ebv)
Este virus, un miembro de la familia Herpes, se ha visto implicado en la patogenia de dos tipos de tumores humanos, el linfoma de Burkitt y los carcinomas nasofaríngeos indiferenciados. El linfoma de Burkitt es una neoplasia de linfocitos B, la más frecuente en los niños de África Central y Nueva Guinea. Un linfoma morfológicamente idéntico aparece de forma esporádica en el resto del mundo. La asociación entre el linfoma de Burkitt africano y el EBV se basa en los siguientes hechos:
-
Alrededor del 98 % de los tumores africanos tienen el genoma del EBV y el antígeno nuclear determinado del EBV (ebna)
-
El 100 % de los pacientes presenta elevados títulos de anticuerpos frente al antígeno de la cápside vírica.
-
Los títulos séricos de anticuerpos frente al antígeno de la cápside viral son proporcionales al riesgo de desarrollar el tumor
-
El EBV muestra un fuerte tropismo por las células B humanas. Las infecta uniéndose a receptores específicos para el tercer componente del complemento. Las células B infectadas se inmortalizan y pueden propagarse in vitro de forma indefinida.
Aunque estos datos respaldan la idea de que el EBV participa muy directamente en el desarrollo del linfoma de Burkitt, existen otras observaciones que sugieren la probable existencia de otros factores adicionales. En primer lugar, la infección por el EBV no se limita a las zonas geográficas en las que aparece el linfoma de Burkitt. De hecho, el EBV es un virus ubicuo que infecta de manera asintomática a casi todos los adultos del mundo entero. En segundo lugar, se sabe que el EBV es el agente etiológico de la mononucleosis infecciosa, una enfermedad autolimitada en la que se produce la infección de las células B. En tercer lugar, puede encontrarse el genoma de EBV sólo en un 15-20 % de los casos de linfoma de Burkitt fuera de Africa, pero tanto la forma endémica (africana ) como la esporádica de este linfoma presentan una translocación t(8 ;14) que influya en la activación del oncogen c-myc. Por ultimo, aunque la infección por el EBV inmortaliza a las células B in vitro, estas células no adquieren el fenotipo transformado ni forman tumores cuando se inyectan en condiciones adecuadas a ratones vivos. Por tanto, parece que el EBV es sólo un factor dentro del desarrollo escalonado del linfoma de Burkitt. En personas normales, la infección por el EBV es controlada fácilmente gracias a las eficaces respuestas inmunológicas, por lo que la gran mayoría de los infectados permanecen asintomáticos o desarrollan mononucleosis infecciosas autolimitadas. En las regiones de Africa en las que el linfoma de Burkitt es endémico, el paludismo concomitante (también endémico en las mismas zonas) altera la competencia inmunológica, lo que permite que las células B incontroladas portadoras de EBV proliferen. La población B en división activa supone un mayor riesgo de desarrollo de mutaciones del tipo de la translocación t(8; 14). El hecho de que en zonas no endémicas el 80% de los tumores no muestran el genoma del EBV pero sí la translocación especifica sugiere que debe existir más de un mecanismo para el desarrollo del linfoma de Burkitt.
El carcinoma nasofaríngeo es el otro tumor que se asocia a la infección por EBV. Se trata de un tumor endémico en el Sur de China, en algunas partes de Africa y entre los esquimales árticos. A diferencia del linfoma de Burkitt, el 100 % de los carcinomas nasofaríngeos de cualquier parte del mundo contienen ADN del EBV. Además los anticuerpos frente al antígeno de la cápside del virus están muy elevados y, en las zonas endémicas, los pacientes desarrollan anticuerpos IgA antes de la aparición del tumor.
La correlación del 100 % entre el EBV y el carcinoma nasofaríngeo respalda la hipótesis de que el virus desempeña un papel en la génesis del tumor, pero (como ocurre en el linfoma de Burkitt) su restringida distribución geográfica indica que a su etiología deben contribuir también otros factores genéticos o ambientales.
Virus de la Hepatitis B
Los estudios epidemiológicos son muy sugestivos de la existencia de una íntima asociación entre el virus de la hepatitis B (hbv) y la aparición de cáncer hepático (carcinoma hepatocelular). El HBV es endémico en países del Lejano Oriente y Africa, por lo que en estas áreas existe mayor incidencia de carcinoma hepatocelular. Los estudios realizados en Taiwan indican que las personas infectadas por el HBV tienen mayor riesgo de sufrir cáncer hepático que las personas procedentes de la misma zona pero no infectadas por el virus. Se ha encontrado ADN del virus en varias líneas celulares derivadas de cánceres hepáticos humanos. Sin embargo, como sucede en el EBV, las pruebas no son suficientes como para que pueda achacarse un papel causal directo al HBV. Es probable que la infección por este agente actúe en conjunto con la actividad regenerativa de la cirrosis hepática o de otros factores ambientales (por ejemplo, nutritivos) o que predisponga al efecto de otros carcinógenos.
Mecanismos de acción de los virus ADN
Los mecanismos por los que los virus ADN producen una transformacion neoplásica son tan variados como los propios virus. Algunos, como el HPV, contienen secuencias transformadoras (oncogenes) y pueden transformar a las células in vitro, mientras que a otros, como el de la hepatitis B, no codifican ningún gen transformador conocido, por lo que parecen actuar directamente. Con independencia del mecanismo preciso, muchos virus oncogénicos ADN comparten determinadas características.
-
Para que la célula sea transformada por el virus, debe sobrevivir en buenas condiciones a la infección. Las células en que puede llevarse a cabo la replicación viral reciben el nombre de permisivas: estas células no pueden ser transformadas porque mueren al liberarse de los virus neoformados. Por el contrario, las células no permisivas, que no permiten que el virus complete su ciclo vital son las que pueden ser transformadas en células neoplásicas.
-
En la mayoría de los virus ADN oncogénicos, sólo las porciones del genoma que se transcriben en los primeros momentos del ciclo vital del virus (antes de la replicación del ADN y de la síntesis de las proteínas de la cápside) son esenciales para la transformación. Los fragmentos clonados del ADN viral en los que se encuentra la primera región del genoma pueden inducir transformación cuando son transferidas a células adecuadas in vitro.
-
En las células no permisivas, los virus ADN oncogénicos suelen formar asociaciones estables con el genoma de la célula huésped, lo que se produce en general mediante la integración del ADN viral en los cromosomas. Sin embargo, sólo los acontecimientos de la integración que interrumpen genes víricos tardíos pueden producir células transformadas.
Se han identificado los productos proteicos de varios “ primeros genes “ transformadores y estudios recientes han empezado a desentrañar la base molecular de su acción. La mayor parte de los trabajos se han llevado a cabo con papovavirus (sv40 y virus del polioma) y en adenovirus que no se asocian a tumores humanos. Sin embargo, como se trata de estudios que proporcionan importantes perspectivas sobre los mecanismos de la carcinogénesis, serán brevemente descritos.
Las primeras regiones de los virus del polioma y SV40 codifican varias proteínas a las que se denomina proteínas T (o antígenos T ). Existen tres proteínas T del polioma (grande, mediana y pequeña) y dos del SV40 (grande y pequeña). Cuando se transfiere ADNc que codifica la proteína T grande del polioma a un cultivo primario de células de roedor, se hacen inmortales reduciéndose sus necesidades de factor de crecimiento en el medio, aunque no asumen el fenotipo totalmente transformado ni forman tumores in vivo. La introducción de la proteína T media del polioma en estas células da lugar a la aparición del fenotipo maligno (es decir, pérdida de la dependencia de la densidad). Estos estudios proporcionan firmes pruebas de que el cáncer, incluso cuando está causado por virus altamente oncogénicos, es un proceso de pasos múltiples.
Aunque no se conoce cuál es la función de la proteína T grande del virus del polioma, sí se sabe que se localiza en el núcleo y se cree que regula la síntesis del ADN. Es muy interesante el hecho de que la proteína T media del polioma se asocie a una proteína normal de la membrana celular a la que se llama src (pronunciado sarc). La proteína src es una tirosinquinasa cuya actividad aumenta 50 veces cuando se produce la asociación comentada. Como se verá más adelante, la transformación inducida por el virus del sarcoma de Rous (un retrovirus) también se asocia a un gran aumento en las actividades enzimáticas de una proteína src mutante. Esta observación ilustra otro aspecto fundamental de la carcinogénesis. Diversos carcinógenos pueden afectar a vías reguladoras comunes a través de mecanismos diferentes.
Otro ejemplo que ilustra este punto procede de los estudios relativos a las proteínas transformadoras del SV40 y de los adenovirus. Estos dos virus pertenecen a dos familias distintas y transforman in vitro a células de tipos diferentes. Sin embargo, las proteínas transformadoras de ambos virus (T grande del SV40 y E1B del adenovirus) se unen a una proteína nuclear común (p53) en el núcleo. En las células normales, los niveles de p53 son muy bajos, a causa de su corta vida media, pero en las células transformadas por el SV40 o el adenovirus, los niveles de p53 aumentan mucho, posiblemente como consecuencia de su unión a la proteína T grande del SV40 o a la E1B del adenovirus. Por tanto, parece que estas dos proteínas víricas efectúan la transformación subvirtiendo los mecanismos fisiológicos que regulan los niveles de una proteína nuclear normal. No se conocen cuales son las funciones normales de la proteína p53, pero varios datos experimentales apuntan a que regula la síntesis del ADN.
Estudios recientes indican que, además de estimular las funciones de proteínas estimuladoras del crecimiento como la p53, los virus ADN oncogénicos pueden actuar “neutralizando“ la acción de las moléculas inhibidoras del crecimiento producidas por los genes supresores del cáncer.
En la exposición precedente nos hemos centrado en los virus ADN que codifican genes de transformación. A este grupo pertenecen los virus del papiloma humano que intervienen en la génesis de cánceres en el hombre. Aunque no existen estudios detallados, es probable que las primeras proteínas del HPV transformen a las células mediante mecanismos similares a los que intervienen en la carcinogénesis provocada por el SV40, el polioma y los adenovirus. El EBV, el otro virus potencialmente oncogénico para el hombre parece contener genes que pueden inmortalizar a las células B pero no transformarlas por completo sin que ocurran además otras mutaciones inducidas, por ejemplo, por una translocación cromosómica. El potencial transformador del virus B de la hepatitis humana es el peor conocido.
** Virus ARN oncogénicos:
Todos los virus ARN oncogénicos son retrovirus, es decir, contienen transcriptasa inversa que permite la transcripción inversa del ARN vírico a un ADN especifico del virus. Aunque sólo uno de los miembros de esta familia (HTLV-I ) se asocia a una neoplasia humana.
El estudio de los retrovirus oncógenos para animales ha posibilitado la adquisición de espectaculares perspectivas de la base genética del cáncer. Para comprender este problema revisaremos brevemente el ciclo vital, la estructura y la oncogenicidad de los retrovirus animales. El genoma de los retrovirus contiene tres grupos de genes: gag, pol y env unidos por ambos lados a secuencias repetidas no traducidas y a las que se denominan repeticiones terminales largas (ltr, long terminal repeats). Las LTR contienen secuencias promotoras y facilitadoras en la síntesis del ARN viral adyacente. La región gag codifica secuencias de las proteínas del núcleo del virión, la región pol codifica la transcriptasa inversa y la env a glucoproteinas de la envoltura.
Puede agruparse aproximadamente a los retrovirus oncogénicos en tres clases según su actividad transformadora y su estructura genómica:
Virus transformadores agudos
Virus transformadores lentos
Virus de la leucemia humana de células T
Virus Transformadores Agudos.
Entre ellos se encuentran muchos virus de tipo C de animales que se caracterizan por la rápida inducción de tumores en animales infectados. Una parte importante de los mismos pueden también transformar a las células in vitro. La disección molecular de sus genomas ha mostrado que todos excepto uno (el virus del sarcoma de Rous), los miembros de este grupo han perdido la información genética que codifica sus genes replicativos (es decir, son defectivos en cuanto a la replicación). En el lugar del material perdido se inserta una nueva información y mediante distintas técnicas moleculares puede demostrarse que estas nuevas secuencias son las responsables de su capacidad transformadora; como estros genes productores del cáncer forman parte del genoma viral reciben el nombre de oncogenes virales o v-oncs. En la década pasada se identificaron alrededor de 20 v-oncs, cada uno de los cuales recibió un nombre mediante una palabra de tres letras que relaciona el oncogen con el virus en el que fue aislado. Por ejemplo, el v-onc contenido en el virus del sarcoma felino recibe el nombre de fes, mientras que el del virus del sarcoma del simio se llama sis. Inmediatamente después del descubrimiento de los v-oncs se plantearon dos importantes cuestiones:
1) ¿ De dónde provienen las secuencias v-oncs?
2) ¿ Cómo producen la transformación v-oncs?
Las respuestas a la primera cuestión llegaron a través de los estudios de hibridación del ADN en los que se indicaba que las secuencias v-oncs son casi idénticas a las que se encuentran en el ADN celular normal de casi todas las especies del reino animal. A estos genes normales se les llama protooncogenes como reconocimiento de su potencial de transformación. Son muchas las pruebas que sugieren que los v-oncs no son en absoluto genes víricos, sino que representan copias anómalas de protooncogenes que han sido incorporadas (transducidas)al genoma viral durante el proceso de replicación del virus en el interior de una célula normal. Por tanto, puede considerarse los v-oncs como simples pasajeros en el genoma viral que confieren al virus la capacidad de transformar células a expensas de la perdida de la capacidad de replicación (estos virus con deficiencia de replicación y capacidad de transformación aguda suelen asociarse a “virus colaboradores”, con capacidad de replicación que les proporcionan los genes necesarios para completar su ciclo vital). La conservación de los protooncogenes a lo largo de la evolución de especies tan diversas como las levaduras y el hombre sugieren que desempeñan papeles esenciales, probablemente, en la diferenciación celular y en la regulación de la proliferación de las células. Debemos aclarar la distinción entre los términos de oncogen y protooncogen celular que a menudo se utilizan como sinónimos. Y sin embargo, debe entenderse que el termino protooncogen se refiere a secuencias celulares que no son oncogénicas en estado fisiológico pero que son capaces de dar lugar a/o comportarse como genes causales del cáncer. Ello puede suceder cuando estos genes se encuentran en retrovirus transformadores agudos en los que dan origen a v-oncs o cuando se alteran su estructura o su expresión in situ de tal forma que adquieren propiedades transformadoras y se convierten en oncogenes celulares (c-oncs).
La otra cuestión es cómo los v-oncs, derivados como son de secuencias normales y no peligrosas de ADN (protooncogenes), producen la transformación maligna. Existen dos posibilidades, ambas apoyadas en datos experimentales:
Durante la transducción (protooncogen v-oncs), se producen mutaciones que hacen a los v-oncs estructuralmente distintos de sus precursores celulares normales. Aunque existen homologias significativas entre varios v-oncs y sus correspondientes protooncogenes, en la mayor parte de los casos no son idénticos. Estas alteraciones genéticas pueden alterar de manera suficiente a los productos del gen como para que induzcan una alteración en la regulación del crecimiento.
Como la transducción lleva a los protooncogenes a la proximidad de potentes promotores retrovíricos, su expresión alcanza un nivel muy elevado. Una expresión continua y abundante de un gen por lo demás normal puede dar lugar a un crecimiento incontrolado.
Parece, pues, que tanto las alteraciones cualitativas como las cuantitativas permiten explicar la causa de que los oncogenes transducidos a los retrovirus provoque cáncer, pese a derivar de genes celulares normales.
Retrovirus de transformación lenta.
Estos virus no poseen oncogenes, son capaces de replicarse y muestran la típica organización del genoma de los retrovirus ya expuesta. Como muchos de estos virus provocan leucemias en roedores, también han sido llamados virus de la leucemia crónica. El mecanismo por el que provocan la transformación neoplásica ha recibido el nombre de mutagénesis de inserción, ya que el ADN proviral se encuentra siempre insertado (integrado) cerca de un protooncogen. La presencia de fuertes promotores retrovirales en la vecindad (en general, corriente arriba) del protooncogen da lugar a una mayor transcripción y a la conversión en un c-oncs. Otra consecuencia de la inserción proviral cerca del protooncogen puede ser la provocación de una alteración estructural en el gen celular. Es decir, tanto la lesión genética como el aumento de expresión del protooncogen pueden ser los responsables de la transformación neoplásica causada por este tipo de virus. Varios de los oncogenes que se encuentran como v-oncs en los virus de transformación aguda (por ejemplo c-oms, c-myc, c-myb, c-H-ras) también intervienen en la carcinogénesis por mutagénesis de inserción. Sin embargo, algunos protooncogenes no han sido nunca encontrados en los virus y sólo pudieron descubrirse examinando los lugares de integración de los virus oncogénicos. Por ejemplo, el virus del tumor mamario del ratón (MMTV) es un retrovirus capaz de replicarse cuyo ciclo vital y su genoma son parecidos a los de los virus de transformación lenta que producen leucemias. El análisis de los tumores provocados por el MMTV ha demostrado que el ADN proviral se integra en una de dos regiones llamadas int-1 o int-2. Se cree que estas regiones contienen dos protooncogenes no identificados previamente.
Virus de la Leucemia Humana de Células T.
Este virus representa un tercer grupo de retrovirus oncogénicos y es el único implicado en la producción de cáncer en el hombre. Se asocia a una forma de leucemia / linfoma de células T endémica en algunas zonas de Japón y en las Indias Occidentales pero puede encontrarse de forma esporádica en cualquier otro lugar. Como el VIH, el HTLV-I tiene un fuerte tropismo por las células CD4 por lo que parece que esta subpoblación de células T la única diana de la transformación neoplásica. Las pruebas que relacionan al HTLV-I con la aparición con la leucemia / linfoma de células T del adulto ( LTA ) pueden resumirse en lo siguiente:
-
Se ha aislado repetidamente el HLTV-I en las células neoplásicas de los pacientes con LTA
-
Pueden detectarse secuencias proviricas del HTLV-I en el ADN de células leucémicas pero no en el ADN de cualquier otra célula linfoide del mismo paciente, lo que indica que el virus se adquiere por infección y no se transmite por la línea germinal.
-
Las células tumorales contienen las dos copias del provirus HTLV-I en la misma localización cromosómica en cada célula (es decir, la integración muestra un patrón clonal). Ello significa que el tumor deriva de la expansión clonal de una sola célula transformada que ha debido ser infectada antes de la transformación y descarta la posibilidad de que el HTLV-I sea un virus transportado.
-
Las células T neoplásicas cultivadas liberan HTLV-I que puede inmortalizar in vitro a células T.
-
En más del 90% de los pacientes con LTA se encuentran anticuerpos frente a HTLV-I.
A pesar de la cantidad de datos que relacionan al HTLV-I con la LTA, permanecen en la oscuridad los mecanismos moleculares de la transformación. A diferencia de los virus de transformación aguda, el HTLV-I no contiene v-oncs alguno y, como el análisis de las células T leucémicas de distintos pacientes no revela ningún lugar constante de integración, puede descartarse una activación por mutación de inserción de un c-onc. La estructura genómica del HTLV-I muestra regiones gag, pol, env y LTR típicas de otros retrovirus pero, a diferencia de estos, contiene una cuarta región (entre el gen env y el 3' LRT ) llamada tat ( en el VIH-1 se ha encontrado una región similar). Se cree que el secreto de su actividad transformadora está encerrado en la región tat, conclusión que parecen respaldar datos recientes obtenidos en ratones transgénicos. En estos animales se ha introducido un gen tat clonado en la línea germinal con la ayuda de microinyeccion en óvulos fertilizados. En los músculos esqueléticos de estos ratones transgénicos se expresa el gen tat a un nivel muy elevado y todos los ratones desarrollan tumores múltiples hacia las diecisiete semanas de edad. La región tat codifica las tres ultimas proteínas, una de las cuales estimula la transcripción del HTLV-I a través de una acción sobre 5' LTR .Más importante en relación a la transformación es el hecho de que el producto del gen tat induce una activación de los genes IL-2 y IL-2R en células T infectadas. Por tanto parece que las células T infectadas por el HTLV-I producen un factor de crecimiento de las células T (IL-2) y su receptor (IL-2R), lo que pone en marcha un sistema autocrino de crecimiento y proliferación que da lugar a la producción policlonal de células T (ya que el virus infecta varias células T), lo que debe ser un acontecimiento temprano en la transformación. A continuación han de suceder algunos otros cambios genéticos aún no identificados, ya que las células leucémicas completamente desarrolladas continúan expresando IL-2R pero no necesitan IL-2 para proliferar.
* FACTORES GEOGRÁFICOS Y AMBIENTALES
Se calcula que el cáncer produce 4,3 millones de muertes en el mundo por año. Esta enfermedad en el año 1980 produjo el 8,4% de todas las muertes. Sin embargo, la proporción de muertes producidas por cáncer varía considerablemente según las regiones del mundo, dependiendo de la estructura de edades de la población y la importancia de otras causas de mortalidad que compiten con ella (tabla 1). La mortalidad producida por dos tipos de cáncer : cérvix y mama, se puede reducir mediante programas masivos de rastreo. Las intervenciones terapéuticas, entre las cuales la cirugía es definitivamente la más eficaz, tienen también muchas limitaciones. La limitación fundamental de la cirugía radica en el hecho de que para que sea realmente eficaz debe de ser llevada a cabo en los estadios iniciales de la enfermedad.
La contribución de otros tipos de tratamientos, principalmente la irradiación y quimioterapia, es más fácil de evaluar. Mientras que los progresos recientes en biología y genética molecular hacen prever que en un futuro no distante se pueda disponer de intervenciones terapéuticas más eficaces, más específicas y menos tóxicas, la quimioterapia es hoy eficaz solamente en un número reducido de casos, tales como los cánceres en personas jóvenes, el linfoma de Hodgkin y tumores testiculares. Por otro lado, la quimioterapia no tiene efecto o su efecto es muy reducido en un gran número de tumores comunes. Se ha estimado que los tipos de tratamientos adicionales a la cirugía tales como rayos X y la quimioterapia pueden reducir el número de muertes debido al cáncer cada año en no mas del 5%.
Tabla 1
TANTO POR CIENTO DE MUERTES (todas EDADES)
DEBIDAS A DIFERENTES CAUSAS
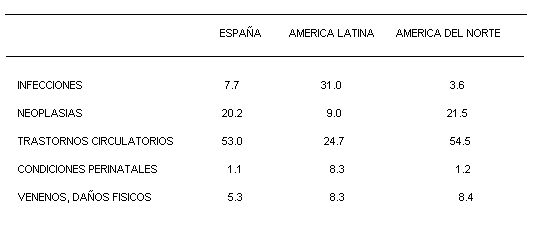
El cáncer en el mundo; variaciones geográficas y tendencias futuras.
Con objeto de reducir la mortalidad debida al cáncer se deben formular prioridades, teniendo en cuenta las frecuencias de cáncer no sólo en áreas industrializadas sino también a nivel mundial.
Así pues es importante tener información sobre la importancia relativa de la incidencia de cánceres diferentes en cada región o país del mundo. Esta información no puede ser reemplazada por extrapolaciones de una ciudad a otra, y, en particular, en una nación altamente industrializada a otra. En el hombre los cánceres de pulmón y estómago son los más frecuentes, seguidos de colon y recto, boca y faringe, próstata y esófago; en la mujer, los más frecuentes son los de mama y cervix seguidos de estomago, colon/recto, pulmón, boca faringe y esófago. Se debe notar que el cáncer de pecho es el más frecuente en uno de los sexos. Estas estimaciones están basadas en el tamaño y estructura de edades de la población en 1975 y cambiará ciertamente, dado el aumento rápido de la población mundial y, en muchas áreas, por el aumento en la proporción de personas de edad avanzada. Estas personas tienen un riesgo más alto de desarrollar enfermedades cancerígenas. Estimaciones preliminares llevadas a cabo en 1980 sugieren la existencia global de 6,4 millones de casos nuevos. Aunque no hubiera cambios sustanciales en la velocidad de aparición de nuevos caso, el número anticipado de cánceres para el año 2000 sería de 10 millones.
Un gran numero de evidencias sugieren la importancia relativa de factores ambientales mas que determinantes genéticos, en la etiología del cáncer. Estudios epidemiológicos descriptivos, han indicado que existen variaciones considerables en la incidencia de cánceres comunes es diferentes partes del mundo. Por ejemplo, el índice de variación en la incidencia de cáncer de esófago entre el nordeste de Irán y Nigeria es aproximadamente de 300, mientras que la variación del cáncer de hígado entre Mozambique y Noruega es aproximadamente de 70.
Estudios de poblaciones migrantes indican que los patrones de cáncer que en estas poblaciones se desarrollan tienden a ser similares a los patrones de los habitantes del ambiente en que establece. L a velocidad con la cual esto ocurre, varia considerablemente - para algunos tipos de cáncer el riesgo aparece relativamente rápido (por ejemplo el cáncer de colon), mientras que para otros tipos de cáncer se requieren dos o más generaciones.
Estas consideraciones no excluyen sin embargo la importancia del genotipo como determinante de la aparición de un numero determinado de cánceres comunes como se demuestra para algunos cánceres raros de tipo hereditario. De hecho es razonable pensar que los estadios de la carcinogenesis, desde su comienzo a su aparición clínica, están influenciados por factores genéticos y que la importancia de este componente depende de la fuerza de los componentes ambientales. La identificación de determinantes genéticos en cánceres de tipo común puede conducir a la identificación de individuos de alto riesgo y puede facilitar también la identificación de determinantes ambientales que conducen al desarrollo del cáncer. Tales variaciones en la tasa de producción de cáncer en las diferentes parte de mundo, junto a estudios de tipo ambiental, que se discutirán mas adelante, ponen de manifiesto que el cáncer en humanos es, en gran parte debido a factores ambientales y que, por lo mismo, esta enfermedad, al menos desde un punto de vista teórico, se puede prevenir.
La tarea fundamental se centra en la identificación de las causas responsables de las extremas variaciones detectadas en la tasa de producción de cáncer.
Estudios epidemiológicos han identificado y definido que la exposición ambiental a determinados agentes tales como el humo del tabaco, alcohol, radiaciones ionizantes, y algunos carcinogenos ocupacionales aumentan el riesgo de producción de ciertos tipos comunes de cáncer, así como de algunos tipos de cáncer más raros. No solamente es muy complejo el papel que desempeñan en el proceso de carcinogenesis los hábitos alimentarios o nutrientes, sino que tampoco es fácil determinar el papel que desempeñan en los procesos de carcinogenesis por causa de la falta de sensibilidad y especificidad de los métodos epidemiológicos actuales.
Carcinogenos ocupacionales
La aparición de procesos cancerígenos entre trabajadores expuestos a sustancias carcinogenicas ha sido ya reconocido históricamente desde que Percival Pott indico en 1775 que el hollín podía producir cáncer de escroto en los deshollinadores. Aunque parece que el cáncer de piel, pulmón y vejiga son los que más frecuentemente están asociados con exposiciones asociadas al trabajo, tales cánceres pueden de hecho ocurrir en una gran variedad de lugares. En los primeros años de este siglo el cáncer de piel se describió como el más común en hilanderos que trabajaban en molinos de algodón por causa de su exposición a aceites minerales. En los comienzos de este siglo también se describió la incidencia de cáncer de pulmón en mineros de Schneeberg y Jachvmow en Europa y en colorado (USA) debido a la exposición a radiaciones. De hecho 300 años antes se había descrito por Paracelsus y Agrícola la existencia de una enfermedad de pulmón en mineros de Schneeberg por inhalación de polvo.
Rehn fue el primero en demostrar el riesgo de producción de cáncer de vejiga entre trabajadores que producían magenta. La Oficina internacional del Trabajo indicó en 1921 que la 2-Naftilamina y la benzidina eran los carcinogenos responsables. El resultado más satisfactorio de los estudios de carcinogénesis asociada al trabajo es el de que, una vez que ha sido identificado el carcinógeno o carcinogénos, pueden tomarse medidas precisas para evitar o controlar la exposición al mismo. Sin embargo, no se puede ignorar el hecho de que productos tales como la 2-Naftilamina y Benzidina estaban todavía en uso en Italia y Francia (p.e. hasta los años l.970-l.980) y que aún es probable que estén en uso en varios países en vías de desarrollo.
Muchos carcinógenos de tipo ocupacional se identificaron a través de estudios epidemiológicos; sin embargo, en algunos casos las evidencias de que tales agentes podrían producir cáncer en animales de experimentación fueron anteriores a tener tal evidencia en seres humanos.
También se conoce desde hace mucho tiempo que muchas fibras minerales y el amianto son de naturaleza carcinogénica. Los resultados llevados a cabo en animales de experimentación han indicado que la inhalación y la administración intrapleural, intratraqueal e intraperitoneal de estas fibras producen tumores (mesoteliomas y cánceres de pulmón) idénticos a los observados en la mayoría de las exposiciones a agentes carcinogenicos de tipo ocupacional. Además se han podido observar también mesoteliomas en personas que viven en las cercanías de factorías que producen fibras minerales y minas y aún en personas que habitan la misma casa que una persona que trabaja con amianto. Probablemente la reducción en el uso y exposición a tales fibras ha sido un proceso lento dadas las propiedades importantes de estas fibras para aislamiento y el uso extenso de este producto en el pasado.
Se ha estimado que la proporción de cáncer que se puede atribuir a agentes carcinogénicos asociados al trabajo en USA puede ser del orden del 4% con una variación del 2 al 8% sobre la población; otros autores han calculado porcentajes más altos con respecto a tejidos específicos y para diferentes áreas del mundo. La proporción de casos de cáncer que pueden ser atribuidos a exposición a agentes de tipo ocupacional obviamente cambian si se refieren a la fracción de la población total que está, o puede estar de hecho expuesta a los mismos. Esta fracción puede variar entre el 18 y el 25% de la población total.
Así pues, se pone de manifiesto que dentro de esta fracción la importancia del cáncer relacionado con agentes asociados al tipo de trabajo es mucho más alta y que probablemente más del 20% de los cánceres pueden ser atribuidos a exposiciones en el lugar de trabajo. La puesta en marcha de mecanismos primarios y eficientes de prevención, mediante la identificación de cuales son los agentes carcinogenicos, seguidos de prohibición completa o reducción a la exposición mediante medidas regulatorias, es un fenómeno relativamente reciente que no comenzó hasta hace dos o tres décadas aún en los países más industrializados.
La situación es aún menos satisfactoria en los países en vías de desarrollo.
Carcinógenos yatrogénicos
La mayoría de las drogas carcinogénicas en humanos o al menos que se sospecha que están fuertemente asociadas con el desarrollo del cáncer, son agentes quimioterapeúticos utilizados como terapia o como tratamiento posterior a la cirugía. El cáncer que más frecuentemente se ha observado como efecto secundario del uso de drogas citostáticas en la quimioterapia del cáncer es la leucemia no linfocítica. Desde que la asociación entre la leucemia no linfocítica y la quimioterapia con agentes alquilantes fue demostrada por Reimer y col. En 1987, diversos estudios epidemiológicos han indicado una asociación similar en pacientes con otros tipos de cáncer.
El mecanismo de acción de hormonas carcinogénicas está muy poco conocido, aunque se sabe que pueden dañar directamente el DNA. La administración de estrógenos a mujeres menopaúsicas/terapia de reemplazamiento) es una causa importante de producción de cáncer de endometrio; las evidencias existentes de aumento de tumores de mama y ovarios son mucho menos convincentes. El dietil-etil-bestrol produce carcinoma de vejiga y cervix en mujeres que han sido expuestas a este producto de útero; existe además evidencia de un aumento del riesgo de tumores de testículos en niños que han sido expuestos en útero a este tipo de tratamientos y de cáncer de mama en madres expuestas durante el embarazo. Contraceptivos orales combinados son responsables también de un aumento de tumores de hígado mientras que por otro lado parecen proteger contra el cáncer de ovario y endometrio. Este ultimo tipo de cáncer aumenta después de la utilización secuencial de contraceptivos orales.
** Magnitud del problema ambiental:
No es exagerado decir que el actual crecimiento demográfico y el deterioro ambiental global amenazan la supervivencia de la especie humana en este planeta. El crecimiento demográfico ha alcanzado ya el punto en que el consumo de grano supera la producción. Se estima que más de 500 millones de personas consumen calorías insuficientes para mantener el crecimiento y la salud adecuados. El número y las actividades crecientes de los humanos han producido una contaminación importante del aire y de los recursos del agua; pérdida de grandes cantidades de tierra de labor; disminución de los bosques; extinción de muchas especies biológicas; acumulación de basuras, algunas de ellas radiactivas, para las que no se han desarrollado aún métodos de destrucción adecuados; y destrucción del ozono atmosférico, exponiéndonos a niveles potencialmente peligrosos de radiación ultravioleta ( UV ), con la consiguiente amenaza de calentamiento global y contaminación del espacio externo.
Los problemas de la perdida del ozono y del calentamiento global, relacionados entre sí, son paradigmas de las cuestiones ambientales que constituyen una amenaza clara y actual. El ozono (O3 ) se produce por la combinación del oxígeno molecular y atómico, este último producido por la acción de la radiación solar sobre las escasas moléculas de oxígeno y dióxido de nitrógeno ( NO2 ) presentes en el espacio exterior. Una capa de ozono en el espacio exterior es esencial para nuestra supervivencia porque impide que la luz solar UV, en particular las regiones UVC y UVB del espectro de la luz UV, penetren en nuestro medio ambiente. Lamentablemente, un gran número de de productos quimicos utilizados por los humanos destruye el ozono. Todos ellos aportan básicamente, radicales libres que convierten el ozono en oxígeno. Los principales culpables son los clorofluorcarbonos ( CFC ), que se usan como aerosoles y refrigerantes, y el NO2 producido por motores de combustión interna, muchos procesos industriales y actividad microbiana. En la actualidad, los CFC están prohibidos en Estados Unidos, pero la producción global de estos productos químicos continúa aumentado. Igual de destructivos son los radicales bromo, que estan presentes, sobre todo, en en los gases halógenos que se utilizan en los extintores de incendios. La disminución de la capa de ozono atrajo por primera vez la atención mundial en el decenio actual, cuando se descubrió que una zona situada sobre el Antártico presentaba una pérdida mantenida del 40 al 50 % del ozono. El “agujero” en la capa de ozono se ha expandido durante los últimos años, y ha adquirido el tamaño de un continente. En la actualidad se ha registrado una disminución similar de la capa de ozono sobre el Polo Norte.
Las propiedades mutagénicas y carcinogénicas de las radiaciones ionizantes se han conocido desde hace muchas décadas. El interés mayor de este tema proviene en la actualidad del hecho de que pequeñas dosis de radiación pueden incidir en gran parte de la población (por ejemplo como consecuencia de la profesión o exposición a productos de industrias nucleares y a radiaciones obtenidas en procesos sobre los mecanismos de carcinogénesis en cánceres inducidos por radiación.
Dado que la radiación es un carcinogénico relativamente débil e induce cánceres que no son distinguibles de aquellos que resultan de exposiciones a otros tipos de agentes, aun si se estudiaran grandes muestras de población expuestas a dosis pequeñas la posibilidad de detectar el exceso de nuevos casos de cáncer que sean consistentes con estimaciones de riesgo es pequeña. Las estimaciones de riesgo se han derivado de estudios de grupos especiales expuestos a dosis de radiación bastante altas (por ejemplo, sobrevivientes de bombas atómicas, personas irradiadas en investigaciones médicas o tratamientos médicos).
Los datos epidemiológicos sugieren que la forma por la cual las radiaciones ionizantes operan en la producción de cáncer pueden ser muy diferentes según sea el órgano afectado. Así, aunque se acepta generalmente que lo más importante, a nivel celular, es la producción de una mutación en las células somáticas, parece ser que la radiación actúa en un periodo relativamente largo en la carcinogénesis tal como se deduce de tumores sólidos de pacientes expuestos a la bomba atómica. Por otro lado, los estudios deducidos del exceso de riesgo de producción de cáncer de mama en mujeres que habían sido irradiadas indican que el riesgo disminuye con la edad del paciente en el momento de la exposición, lo cual es consistente con un efecto en estadios tempranos de la carcinogénesis. Se debe recordar también que el efecto de la radiación es probablemente multiplicativo con el de otros carcinogenos (por ejemplo, el humo del tabaco).
La importancia de la radiación ultravioleta, especialmente de la luz solar, en la génesis del cáncer de piel se ha descrito desde hace tiempo. El riesgo de producción de cáncer de piel varía de individuo a individuo según sea el nivel de pigmentación de la piel. Individuos de antecedencia céltica están particularmente ligados a alto riesgo. El riesgo está también asociado a áreas geográficas y a situaciones asociadas al trabajo, estando en función de la exposición a la luz solar. Este riesgo se modifica según sea la pigmentación de la piel de la población en estudio. La moda de tener una piel coloreada por el sol es sin duda alguna responsable del aumento de la incidencia del cáncer de piel. Esta incidencia es particularmente evidente con respecto al desarrollo de melanomas malignos. La incidencia de estos melanomas aumenta rápidamente y de forma progresiva en generaciones jóvenes en América del Norte, Europa y Australia. Además, el cambio progresivo en la distribución de subtipos, con un aumento progresivo de tumores de piernas y tronco, está de acuerdo con un aumento a la exposición solar por hábitos recreacionales. A pesar de todo las dosis de exposición a la luz solar no explican de forma enteramente satisfactoria el aumento de cánceres observados.
Tabaquismo
El humo del tabaco es el mayor carcinógeno.
Mas de la mitad de las muertes por cáncer en USA , casi el 60%, pueden ser atribuidas al humo del tabaco y a la dieta. Fumar causa el 30% de las muertes por cáncer, haciendo al humo del tabaco el más letal carcinógeno en USA. Aparte de fumar y de los hábitos alimenticios, otros factores medioambientales contribuyen por separado sólo en un pequeño porcentaje del total de las muertes.
Fumar, principalmente los cigarrillos, causa cáncer de pulmón, vía respiratoria alta, esófago, vejiga y páncreas y probablemente del estómago, hígado y riñón. Fumar está implicado en la Leucemia Mieloide Crónica y puede también provocar cáncer de colon y recto y otros órganos. Para que adquiera carácter de malignidad depende de varios factores, incluyendo la frecuencia con la que se fuma, el alquitrán de los cigarrillos y sobre todo la duración del hábito. Empezar a fumar mientras se es muy joven aumenta sustancialmente el riesgo. Los riesgos varían de un tipo de cáncer a otro; así, por regla general los fumadores son dos veces más propensos a padecer cáncer de vejiga pero ocho veces más propensos a contraer cáncer de pulmón.
Las tasas de mortalidad de cáncer de pulmón en hombres y mujeres están relacionadas con el consumo de tabaco. Este hecho ha sido puesto de manifiesto de forma evidente desde 1930 en el Reino Unido y Finlandia, donde la tasa de mortalidad por cáncer de pulmón ha disminuido en hombres, en años recientes, probablemente como resultado de la reducción del consumo de tabaco en las generaciones jóvenes. Sin embargo, en otros países la incidencia de cáncer de pulmón continúa en aumento.
Los fumadores pasivos, o la inhalación de humo de tabaco en el ambiente, tiene mucha menor incidencia en el cáncer de pulmón que en el caso de fumadores "activos". Sin embargo, miles de personas mueren cada año en USA debido a cánceres atribuidos al humo. Así, los fumadores "pasivos" tienen tanto riesgo de padecer cáncer como en la exposición a aire poluto o en la exposición familiar a gas Radón (que es emitido de forma natural por la Tierra en algunas áreas).
La evidencia de que el humo del tabaco es responsable de la inducción de cáncer en seres humanos es absolutamente manifiesta. Esto se debe a la presencia de varios carcinógenos (por ejemplo hidrocarburos aromáticos o policiclicos, nitrosoaminas, etc.). Datos epidemiológicos demuestran que la duración del hábito de fumar es particularmente importante, dado que un retraso en el comienzo de fumar en poblaciones jóvenes da como resultado una disminución considerable del riesgo de producción de cáncer de pulmón en estadios posteriores de la vida.
Dejar de fumar tiene un efecto inmediato en el riesgo de producción de cáncer de pulmón; en este caso la razón entre las tasas de ex-fumadores en contraposición a no fumadores permanecen constantes, mientras que esta razón aumenta entre fumadores que no dejan tal hábito. En resumen, el consumo de tabaco, la duración y el dejar de fumar son factores que determinan de forma relevante el riesgo de producción de cáncer de pulmón que ocurrirá en años tardíos. Además, el riesgo de producción de cáncer de pulmón en trabajadores en minas de uranio o fibras minerales aumenta sustancialmente cuando se fuma tabaco. El tabaco produce también un efecto multiplicativo con el alcohol sobre el riesgo de producción de cáncer oral y esófago.
La dieta hace frente al tabaco
Sólo la dieta es un apropiado rival contra el tabaco como causa de cáncer en Estados Unidos, dando cuenta de un número comparable de muertes cada año. La grasa saturada (animal) en general y la carne roja en particular están asociadas con distintos tipos de cáncer; ambas están fuertemente unidas a los cánceres de colon y recto; las grasas saturadas están también implicadas en el cáncer de próstata.
Unas cuantas cuestiones acerca de la grasa en la dieta todavía trae de cabeza a los investigadores. Los estudios en animales han indicado que bajo determinadas condiciones algunos tipos de grasas poliinsaturadas incrementan el riesgo de cáncer en algunas partes del cuerpo, pero en humanos tenemos muy pocas pruebas.
También, rigurosos estudios epidemiológicos no han apurado algunas de las primeras y todavía populares hipótesis sobre la grasa en la dieta y el cáncer. Por ejemplo, un alto contenido de grasas (normalmente saturadas) en adultos no ha puesto de manifiesto un aumento del riesgo de cáncer de mama en las investigaciones de grandes grupos de mujeres durante más de doce años.
Entre los aditivos de las comidas, la sal común parece ser un carcinógeno. Estudios sobre poblaciones de fuera de los Estados Unidos sugieren que un abuso de ingesta puede declinar en cáncer de estómago. También, en el sureste asiático, los niños, que comen gran cantidad de pescado salado tienden a tener unos altos porcentajes de cáncer de nasofaringe. Similarmente, tomar bebidas mientras están muy calientes, como por ejemplo "maté", una bebida sudamericana, se ha demostrado que incrementa el riesgo de cáncer de esófago.
En contraste, muchas investigaciones sobre el café (con o sin cafeína) no se han relacionado con el cáncer en humanos. Por otra parte, tampoco parece ser un problema los edulcorantes de las bebidas: está ampliamente probado que los edulcorantes artificiales, en cantidad razonable, no causan cáncer.
La relación dieta-cáncer, sin embargo, tiene mucho que ver con lo que está en la dieta y lo que no está. Si la dieta es escasa en vegetales y frutas, puede contribuir de manera significativa en distintos tipos de cáncer, por razones que no son completamente conocidas. Deben poseer componentes específicos que bloquean las actividades carcinogénicas de sustancias endógenas, y esto es lo que les confiere a estas comidas un efecto protector. Por ejemplo, los antioxidantes en las comidas, que se cree que neutralizan a los radicales libres.
Otros elementos químicos y comidas saludables, que han sido sugeridas, bloquean las señales que esteroides y estrógenos mandan y provocan en la mama (preferentemente) y en otras partes del cuerpo un aumento en la proliferación celular. A pesar de todo las comidas contienen miles de sustancias químicas, y los investigadores permanecen inseguros de cuáles, y qué combinaciones, son las más potentes como bloqueadoras del cáncer.
La dieta puede ejercer su efecto no sólo por el número de calorías consumidas sino también por su cantidad. Los investigadores creen que asimilar más energía de la que se gasta puede ser perjudicial a lo largo del tiempo, probablemente a través de distintos mecanismos a diferentes edades. Niños con sobrepeso y poco activos a menudo crecen más (tanto a lo largo como a lo ancho) y parece ser un factor de riesgo para adquirir ciertos tipos de cánceres.
Estos hallazgos han sido muy importantes en el estudio del cáncer de mama. Un excesivo crecimiento en la infancia, tanto en altura como en peso, parece ocasionar en las niñas menstruaciones cuando son todavía relativamente jóvenes, y una menstruación temprana predispone para el cáncer de mama (así como para otros tipos de cáncer). Factores tempranos como el excesivo crecimiento causado por sobrealimentación y poco ejercicio puede ser una causa de cáncer en aproximadamente el 5% de cánceres de mama y próstata, que normalmente llegan a ser mortales.
La obesidad en la vida adulta es una causa importante de cáncer de endometrio y un establecido peso de carcinógeno en el cáncer de mama postmenopáusico. Por razones desconocidas, la obesidad también parece incrementar el riesgo de cánceres de colon, riñón y vesícula biliar.
La consumición abundante de bebidas alcohólicas, particularmente por fumadores, incrementa el riesgo de cáncer de porción alta de tractos digestivo y respiratorio, y la cirrosis alcohólica frecuentemente da lugar a cáncer de hígado. Aunque la ingesta moderada de alcohol parece reducir el riesgo de enfermedades cardíacas, hay estudios que sugieren que la ingesta de una o dos bebidas al día puede contribuir a cánceres de mama y posiblemente colon y recto.
Las bebidas alcohólicas contribuyen aproximadamente en un 3% a la mortalidad por cáncer en el mundo desarrollado. Un tipo de vida sedentaria contribuye en otro adicional 3%. Y los condimentos o aditivos en las comidas, como la sal, pueden contribuir en otro 1%.
Asbestosis
La sobreexposición al polvo de asbesto se ha definido como “ una de las peores de la historia “. La inhalación del asbesto causa no sólo la neumoconiosis (asbestosis), sino también derrames pleurales, adherencias pleurales, placas fibrocalcificadas en la pleura parietal y un aumento en la incidencia de mesotelioma, carcinoma broncogénico y otras formas de cáncer. Estas consecuencias aparecen solas o combinadas, décadas después de cesar la exposición al asbesto.
El asbesto es un contaminante del aire y el agua muy difundido. Las mayores exposiciones se dan en industrias de extracción, transformación e instalación de asbesto y de los más de tres mil productos que lo contienen (como materiales de techos, suelos y tejados; de aislamiento; conducciones de agua y alcantarillado; materiales de revestimiento; revestimiento de frenos y embragues). La asbestosis afecta casi exclusivamente a sujetos sometidos a una exposición laboral intensa. Incluso en trabajos peligrosos, la asbestosis es muy infrecuente en personas con una exposición inferior a diez años. Sin embargo, exposiciones significativamente menores pueden ser responsables de otras posibles consecuencias de este contaminante. Las secretarias de las fábricas, habitantes de zonas próximas a ellas y las familias de los trabajadores del asbesto han sufrido un aumento de la incidencia de mesotelioma, un tipo de neoplasia raro en personas no expuestas. Se sabe poco sobre la susceptibilidad variable, pero la leve contaminación del aire en las grandes ciudades ha despertado una considerable preocupación en naciones industrializadas, especialmente en escuelas y edificios en que se ha utilizado el asbesto en techos y aislamientos. De hecho, con métodos apropiados se puede descubrir en autopsias una siembra de fibras de asbesto en la mayor parte de los pulmones de habitantes de ciudades. Incluso, en sujetos con exposiciones leves, como cónyuges de trabajadores del asbesto y residentes en proximidades de minas o fábricas pueden aparecer placas pleurales, aunque no se desarrolle una asbestosis. Análogamente, han aparecido cánceres potencialmente relacionados con el asbesto en sujetos sin asbestosis pero con algún familiar con exposición laboral. La extracción de aislamientos y de techos de asbesto de edificios antiguos también supone un riesgo.
Se denomina asbesto a una familia de silicatos fibrosos divididos en 1) serpentinas, flexibles, muy finas y en espiral y, 2) anfíbolos, rectos y frágiles. Más del 90% del asbesto comercializado es la serpentina crisólito y dos anfíbolos (crocidolita y amosita) completan el resto. Todos los tipos de asbesto son fibrogénicos, pero la crocidolita es claramente el más carcinógeno.
La patogenia del asbesto en lo que se refiere a la oncogenicidad es mal conocida y es especialmente preocupante por lo que implica. Los riesgos relativos de carcinoma broncogénico son:
· no fumadores no expuestos 1
· no fumadores expuestos al asbesto 5
· fumadores no expuestos al asbesto 11
· fumadores expuestos al asbesto 55
Está claro que tanto en fumadores como en no fumadores, el asbesto aumenta la probabilidad de cáncer de pulmón cinco veces y también queda claro que el consumo de cigarrillos eleva el riesgo de cáncer producido por el asbesto diez veces. El mesotelioma es una forma muy rara de cáncer incluso entre trabajadores del asbesto.. Por tanto ha sido dificil determinar el nivel preciso de riesgo que supone la exposción a estas fibras. Pero podemos decir que en la gran mayoría de los casos existen antecedentes de algun tipo de ocupación peligrosa.
Se han propesto dos teorías, parcialmente contrapuestas sobre el papel del asbesto en el desarrollo de carcinomas broncogénicos. La primera sugiere que las fibras sirven como promotores de tumores, preparando el terreno a otros carcinógenos. Se ha demostrado que las fibras (especialmente la crocidolita, la más carcinógena) son citotóxicas in vitro para células de mamífero. Se piensa por tanto que las fibras producen muerte de las células de vías aéreas, estimulan la replicación celular y dejan al epitelio en proliferación especialmente vulnerable a otros carcinógenos ambientales especialmente el humo del cigarrillo. La segunda teoría sugiere que carcinógenos como los hidrocarburos policíclicos y el humo de tabaco se adsorben a las fibras y de esta manera se concentran en los puntos de retención de asbesto.
Las bases del desrrollo de los mesoteliomas son igualmente misteriosas. Puede sugerirse que los linfáticos transportan las partículas al mesotelio subpleural pero ¿ cómo expolicar los mesoteliomas que aparecen ocasionalmente en el peritoneo ? ; ¿ podría estar implicada la deglución de la fibra ?. A diferencia de los carcinomas broncogénicos, en los mesoteliomas no parece influir el consumo de cigarrillos.
En conclusión, es evidente que todavía estamos lejos de comprender por qué el asbesto es tan peligroso para el ser humano y por qué el asbesto, pero no la sílice, es un carcinógeno tan potente.
Diversos tipos de cáncer se han relacionado con el polvo de asbesto. En primer lugar, debe señalarse que no hay una correlción entre la gravedad de la asbestosis y la aparición de tumores malignos. De hecho, se han observado cáncers de pulmón en ausencia de fibrosis pulmonar intersticial y, significativamente, la correlación es escasa entre la intensdad de la exposicion y la predisposición al cáncer. La forma más frecuente de neoplasia maligna relacionada con el asbesto es el carcinoma broncogénico, como ya se ha señalado. A diferencia de los que se observan en la población general, en los sujetos expuestos al asbesto predominan los adenocarcinomas con un número relativamente menor de carcinomas epidermoides. Los mesoteliomas malignos, son mucho menos frecuentes que los carcinomas broncogénicos, pero su relación con la exposición al asbesto es evidente. Aunque la mayor parte aparecen en la pleura, a veces se localizan en el peritoneo sin afectación pleural. Como estas lesiones no contienen cuerpos de asbesto y pueden aparecer en personas no expuestas al asbesto, la implicación del asbesto como agente causal requiere la identificación de fibras de asbesto en cantidad superior a la habitual en el parénquima pulmonar. También se ha atribuído a la exposición al asbesto, aunque con menor seguridad, la predisposición a carcinomas de esófago, estómago, colon, laringe y diversas neoplasias malignas linfoides.
Trabajo, Medicación y Microbios
Un número de sustancias ahora conocidas por ser cancerígenas, incluyendo asbesto, benceno, formaldehído y radón se revelaron peligrosas por primera vez en desafortunados “experimentos naturales” incluyendo exposiciones a concentraciones muy altas en el lugar de trabajo. En años recientes, sin embargo, el control de estos carcinógenos ocupacionales, al menos en el mundo desarrollado ha ocasionado pequeños éxitos en relación a la salud publica.
Medidas de control estrictas en el lugar de trabajo durante los últimos cincuenta años han disminuido la proporción de casos de cánceres mortales causados por exposiciones ocupacionales a quizás menos del 5%. Antes de 1950 la proporción podría haber sido el doble. Desafortunadamente, sin embargo, los cánceres asociados a la profesión, que ocurren mayormente en el pulmón, piel, vejiga, y sistema hematopoyético, es probable que se incrementen en países en vías de desarrollo en la medida en que se industrialicen.
El tratamiento medico, como la exposición en el lugar de trabajo, ha generado revelaciones no deseadas dentro de la causalidad del cáncer, como algunos procedimientos o medicaciones han resultado tener efectos carcinogénicos. Irónico como pudiera parecer, los procedimientos y productos médicos pueden ser responsables de aproximadamente el 1% de todos los cánceres. Todavía, su utilidad clínica global tiene mas peso que sus riesgos. Esto es cierto en muchas terapias de cáncer incluyendo radio y quimioterapia. Algunos fármacos o combinaciones de ellos para tratar cánceres como la Enfermedad de Hodgkin puede causar leucemia aguda en aproximadamente el 5% de los supervivientes y, en casos raros cáncer de vejiga.
Los fármacos inmunosupresores pueden ser cancerígenos causando ciertos tipos de linfomas; la administración exógena de estrógenos tomados para contrarrestar los síntomas menopáusicos han sido enlazados a cánceres de mama y endometrio.
Informes recientes han indicado que Tamoxifen, un medicamento experimental para el cáncer de mama, puede causar ocasionalmente cáncer de endometrio, aunque estudios recientes son mas ambiguos. Los fármacos de fertilidad que imitan los efectos de gonadotropinas, incluyendo PERGONAL, se sospecha que incrementan el riesgo de cáncer de ovario. La administración de hormona de crecimiento (GH) a niños puede elevar sus riesgos de leucemia. Algunos diuréticos podrían incrementar el riesgo de cáncer de riñón, y algunos medicamentos para disminuir la tasa de colesterol pueden aumentar el riesgo de cánceres de colon y recto, pero para éstos, también, la evidencia es muy tenue.
Los anticonceptivos orales incrementan el riesgo de algunos tipos de cáncer de hígado y, bajo ciertas condiciones, de cáncer de mama premenopáusico. A pesar de todo las píldoras para el control de la natalidad reducen el riesgo de cáncer de ovario y endometrio y puede que también los de colon y recto.
Virus y otros agentes infecciosos, olvidados como causas de cáncer sólo hace treinta años, pueden contribuir a aproximadamente el 5% de todos los casos mortales en los países desarrollados.
Tasa de Polución
La contaminación del aire, agua y suelo juega un infrecuente y difícil de documentar papel en el cáncer humano. Los efectos nocivos son difíciles de verificar porque son normalmente el resultado de exposiciones a diversos carcinógenos a muy bajos niveles. Sin embargo, es razonable asumir que los agentes contaminantes podrían contribuir a aproximadamente el 2% de cánceres mortales, principalmente de pulmón y vejiga.
Estudios ecológicos, que son similares a los epidemiológicos pero con menos especificidad y detalle, indican que la proporción de cáncer de pulmón en ciudades contaminadas excede a la de áreas rurales. Y, de hecho, los datos sugieren que los fumadores “urbanos” son mas propensos a desarrollar cáncer de pulmón que los fumadores “rurales”.
Conjuntamente, estos estudios, inventarios de emisión y análisis químicos de muestras de aire procedentes de áreas urbanas sugieren que largas exposiciones a niveles altos de aire poluto podrían incrementar el riesgo de cáncer de pulmón en aproximadamente el 50% especialmente entre fumadores.
Algunos investigadores mantienen que los compuestos orgánicos cuyas moléculas contienen cloro y componentes cíclicos incrementan el riesgo de cáncer de mama y, quizás, otras malignidades relacionadas con los estrógenos. Entre estos componentes están unos producidos cuando ciertos pesticidas, como el DDT, son alterados en el interior del organismo. La hipótesis subyacente es que estas sustancias, llamadas xenoestrógenos, imitan los propios estrógenos del cuerpo y de este modo estimulan la división celular en la mama y en otros órganos reproductores. La evidencia empírica en los humanos es escasa, sin embargo, la potencia estrogénica de xenoestrógenos es mucho mas débil que las de estrógenos endógenos.
Algunos estudios han sugerido (sin demostrarlos convincentemente) una tenue asociación positiva entre la cloración del agua y el cáncer de vejiga. Por todo el mundo, pero especialmente en países desarrollados, el tratamiento con cloro se usa para matar gérmenes en el agua potable. Incluso si el tratamiento con cloro presentara un riesgo muy pequeño de cáncer (que no es de ningún modo cierto) el peligro seria mas que tenido en cuenta por la capacidad del cloro de prevenir la propagación de enfermedades hídricas como la cólera, la disentería y la fiebre tifoidea. Investigaciones acerca de la fluorización del agua han sido alentadoras.
Factores reproductivos y ginecológicos
Entre los procesos naturales del cuerpo, aquellos relacionados con la reproducción están mas fielmente unidos, epidemiológicamente, al cáncer. Para las mujeres, una edad temprana en la menarquia, una edad tardía en el primer embarazo y edad tardía en la menopausia tienden a incrementar el riesgo de cáncer de mama, cuanta mas descendencia ha tenido una mujer menos probable es que desarrolle cáncer de endometrio, ovario o mama.
Bases lógicas fisiológicas para estas observaciones son difíciles de encontrar en la mayor parte. Nadie sabe con exactitud por qué, por ejemplo, una menarquia temprana y menopausia tardía están asociadas con el cáncer de mama. Ambas pueden simplemente extender el periodo en la vida de una mujer cuando está expuesta a sus propias hormonas sexuales, especialmente los estrógenos.
Los efectos protectores de tener un niño a una edad temprana, por otra parte, pueden incrementarse provocando que las células de la mama adquieran una mayor diferenciación. La diferenciación restringe la habilidad de una célula de crecer anormalmente, cambia su tipo y sobrevive en otros tipos de tejido. Un primer embarazo a una edad temprana puede provocar diferenciación celular en la mama de una forma temprana en la vida, después de lo cual serian mucho menos susceptibles a agentes carcinógenos.
En países desarrollados el comportamiento reproductivo es determinado principalmente por fuerzas sociales y económicas. De este modo, por razones educativas relacionadas con la profesión y otros aspectos, millones de mujeres en estos países están posponiendo la natalidad y también están teniendo menos niños, en general, que sus madres y abuelos. Desafortunadamente, estas decisiones de vida conducirán a mayores tasas de cáncer de ovario y de mama. La posposición de los primeros embarazos por las mujeres jóvenes en EE.UU que ya ha ocurrido incrementará sus tasas de cáncer de mama en aproximadamente del 5 al 10 % dentro de los próximos veinticinco años.
Los abortos inducidos han sido asociados en algunos estudios con un ligero incremento en el riesgo de cáncer de mama, pero los datos no son concluyentes. Otras asociaciones entre cánceres del aparato reproductor y ciertas condiciones o comportamientos han sido tomados en cuenta, pero tampoco son concluyentes, son de una importancia marginal o se piensa que son sustitutos de causas actuales. Por ejemplo, tener múltiples parejas sexuales se creía que incrementaba el riesgo de una mujer de adquirir cáncer de cérvix. En cambio, este riesgo elevado es probablemente debido a una mayor exposición a virus transmitidos sexualmente y que son potencialmente carcinógenos.
Teniendo en cuenta todas estas consideraciones, podríamos atribuir alrededor del 4% de las muertes por cáncer a factores relacionados con la reproducción.
Diferencias socioeconómicas
Las diferencias en las tasas de cáncer entre distintos grupos socioeconómicos pueden ser atribuidos a diferencias en el estilo de vida. La gente de bajo status social tienen mayores tasas de cáncer de boca, estomago, pulmón, cérvix y riñón y de un tipo de cáncer de esófago (squamous cell cancer). La pobreza parece ser la causa subyacente, porque esta casi universalmente asociada con mayores tasas de consumo de tabaco, alcohol, nutrición deficiente y exposición a ciertos agentes infecciosos (que conjuntamente pueden explicar la mayor parte de los cánceres).
En contraste, por razones que permanecen desconocidas, los cánceres de mama, próstata y algunos otros lugares del cuerpo son mas comunes entre los grupos socioeconómicos más altos. Algunos científicos han especulado que el excesivo crecimiento a una edad temprana, presumiblemente debido a una actividad física reducida y una abundante alimentación puede de alguna manera incrementar el riesgo de estos cánceres. Pero esta hipótesis no ha sido evaluada rigurosamente.
La mayoría de las diferencias de la incidencia del cáncer entre razas también pueden ser atribuidas a factores socioeconómicos. Algunas de las diferencias entre razas podrían tener una base genética, pero la variabilidad genética es mayor intra que interracial. En general, la mayoría de las diferencias entre negros, blancos y asiáticos puede ser achacado a la dieta, forma de vida y exposición medioambiental. Por ejemplo, las mujeres japonesas en Japón tienen la cuarta parte de riesgo de cáncer de mama que las mujeres blancas en EE.UU. Sin embargo, la tercera generación de mujeres japonesas residentes en EE.UU, contraen cáncer de mama casi tan frecuentemente como las mujeres americanas.
MECANISMO DE LA CARCINOGENESIS
La neoplasia puede definirse como una proliferación celular persistente, anormal y relativamente autónoma, resultante de la alteración permanente de ciertas células, y que se transmite a la progenie celular.
El modelo actual de la génesis del cáncer humano establece que la mayoría de neoplasias se originan a partir de una célula (origen clonal) y se desarrollan en distintas etapas (iniciación, promoción y progresión), que ocupan una parte importante de la vida del individuo.
Iniciación
Los agentes físicos (radiaciones), químicos o biológicos (virus), implicados en la carcinogénesis inducen una alteración de la información genética de las células mediante lesiones del ADN. Los estudios de biología molecular han permitido identificar dos grandes grupos de genes relacionados con el desarrollo de células tumorales: los oncogenes y los genes supresores de tumores o antioncogenes.
Oncogenes. Estudios experimentales con virus tumorales ARN mostraron que, al infectar células animales normales, éstas se convertían en células tumorales por la acción de genes transformadores relacionados con el virus (v-oncogenes). La pequeña cantidad de información genética incorporada en estos oncogenes podía actuar en forma pleiotrópica para inducir diversas alteraciones en el fenotipo celular. Este descubrimiento se siguió del hallazgo en el genoma humano de estructuras génicas idénticas, denominadas protooncogenes, que con toda probabilidad codifican componentes que intervienen en la transmisión de señales que desempeñan un papel fisiológico en el control de la proliferación y diferenciación celular.
Se acepta que los carcinógenos iniciadores (químicos radiaciones) pueden actuar produciendo oncogenes “activados” mediante una mutación de los protooncogenes, introduciendo así una alteración en el control del crecimiento y proliferación celular. Se conocen otros mecanismos de activación de los oncogenes, como la amplificación, translocación y reordenamiento del ADN. Los oncogenes se clasifican por el tumor que producen en animales. Si bien la mayor parte de oncogenes derivan de genes presentes en el genoma normal, ciertos virus tienen una relación causal clara en un pequeño número de neoplasias humanas (Epstein-Barr en linfoma de Burkitt y papilomavirus en carcinoma cervical). Aparentemente, los oncogenes virales son incorporados por la célula huésped y transmitidos a las células hijas y en ciento modo, la transformación tumoral comparte mecanismos comunes con la inducida por carcinogenos químicos y radiaciones.
Función de los protooncogenes en las células normales y transformadas
Los protooncogenes codifican proteínas cuya función normal es regular la respuesta celular a las señales externas que promueven el crecimiento y diferenciación celular. La alteración estructural o hiperexpresion de dichas proteínas, que ocurre frecuentemente como consecuencia de mutaciones oncogénicas, desencadena la activación de las vías bioquímicas intracelulares que estimulan la proliferación celular. Las proteínas producto de los protooncogenes y sus variantes responsables de la transformación celular, se agrupan en cinco clases distintas:
Factores de crecimiento. El oncogen sis (virus del sarcoma de simios) es homólogo del gen que codifica la cadena beta del factor de crecimiento derivado de las plaquetas (PDGF), necesario para el crecimiento en cultivo de los fibroblastos. La estimulación anómala de este gen, cuando se acompaña de una expresión continua del receptor para el PDGF, induce la transformación maligna de la célula. De igual modo, una expresión excesiva de factores de crecimiento hemopoyético, o la alteración estructural de su receptor, pueden ser responsables de la transformación celular.
b)Receptores de membrana con actividad protein-cinasa. Incluye diversos receptores, como el del factor de crecimiento epidérmico (EGFR), CODIFICADO POR EL ONCOGÉN erb-B, el del factor derivado de las plaquetas (PDGFR), el receptor de insulina, el fms o receptor del factor estimulador de colonias (CFS-1), etc. En las células normales, la activación del receptor se sigue de una rápida internalización de su componente extracelular, con lo que se inhibe su actividad enzimática. Esta inhibición asegura una proliferación transitoria. En caso de alteración estructural del receptor, el dominio tirosín-cinasa puede quedar permanentemente activado, determinando el crecimiento autónomo tumoral.
Proteínas citoplasmáticas con actividad tirosín-cinasa. Observaciones recientes sugieren que las tirosín-cinasas intervienen en la transducción de señales en las células normales. Ejemplos de estas cinasas son las proteínas codificadas por los genes c-src, c-lck y c-fgr. El oncogén abl, aislado en un virus de sarcoma de ratón, codifica proteínas asociadas a la superficie interna de la membrana celular con actividad cinasa (introducción de un grupo fosfato) sobre proteínas (tirosina, serina y treonina). La actividad oncogénica estaría ligada a la modificación de respuesta del receptor de membrana.
Traductores de señal intracelular. Existe un numero importante de proteínas capaces de unirse a los nucleótidos de guanina y actuar como traductores de señales estableciendo un puente intermediario entre el receptor del factor de crecimiento y el núcleo. Así parecen actuar los productos del oncogén ras activado, implicados en la transformación maligna.
Proteínas nucleares y factores de transcripción. Diversas familias de oncogenes celulares y retrovirus codifican proteínas nucleares, conocidas como factores de transcripción, que modifican o regulan la transcripción de un ARNm desde el ADN. Estas proteínas actúan en tejidos normales, que se renuevan estableciendo un balance entre la proliferación y diferenciación.
Genes supresores o antioncogenes. Los antioncogenes actúan en las células normales restringiendo o suprimiendo la proliferación celular. Cuando se produce una mutación que afecta a ambas copias de un antioncogen, este pierde su función, con lo que desapar4ecen las barreras normales que controlan el crecimiento celual4, favoreciendo así la proliferación clonal. La mayor parte de las proteínas codificadas por genes supresores se localizan en el núcleo. El mejor ejemplo conocido es el producto del gen que predispone al retinoblastoma. Esta proteína restringe la proliferación, al detener la progresión del ciclo celular neutralizando factores de transcripción que facilitan el crecimiento. El producto proteico del gen p53 se localiza también en el núcleo, donde actúa como un factor de transcripción. De igual modo actuaría la proteína WT-1, ausente en las células tumorales del nefroblastoma.
Promoción
La promoción tumoral es un estadio más prolongado, que aparece como consecuencia de la exposición a un agente no necesariamente carcinogenético. El crecimiento efectivo de las células tumorales depende de la adquisición de una serie de rasgos distintivos, que van ligados probablemente a la activación de varios oncogenes de forma independiente, y que van a configurar el fenotipo neoplásico. Existen datos que sugieren que el cáncer es el resultado de una progresión de alteraciones genéticas. Un ejemplo notable es el carcinoma de colon. Este evoluciona a través de formas histopatologicas previas de displasia y pólipos adenomatosos. En él se han demostrado alteraciones genéticas progresivas (activación del c-ras en el adenoma y alteración de genes supresores p53 y DDC en el carcinoma avanzado). Las alteraciones genéticas no son los únicos fenómenos que ocurren en la carcinogenesis. Las células malignas deben evadir el sistema de vigilancia inmunitaria del huésped. La mayor oncogenicidad se relaciona con un menor despliegue de antígenos de histocompatibilidad.
1.3 Progresión
Más allá de la fase de promoción, las células malignas van adquiriendo de forma irreversible nuevas características, que singularizan la fase de progresión. Uno de los hechos más significativos es la adquisición de la capacidad metastásica, rasgo tal vez conferido por genes diferentes de los oncogenes. El conjunto de procesos que suceden desde el origen de la transformación celular hasta el fin de la evolución clínica del paciente, si no se modifican por el tratamiento, define la historia natural del cáncer. Esta es muy variable de un tumor a otro y está representada, fundamentalmente, con las características del crecimiento tumoral y la capacidad metastásica.
Incidencia
El cáncer es la segunda causa de muerte en los adultos en el mundo occidental, y es la principal causa de muerte por enfermedad en niños de 1 a 14 años. Existe una gran variación de incidencia según el área geográfica. La mortalidad por cualquier tipo de cáncer en varones ajustada a la edad es de 310,9 por cien mil en Luxemburgo (la más alta) y de 37,5 en El Salvador (la más baja). En las mujeres, es de 175,2 en Dinamarca, y 48,7 en El Salvador. Para algunos tipos de cáncer, la incidencia en diferentes países puede variar en un factor de hasta 40. Estudios sobre poblaciones que han emigrado de un área geográfica a otra diferente sugieren que tales variaciones se deben más a diferencias en estilo de vida que al origen étnico. Esto es comprensible, si se considera que la mayor parte de los cánceres se relacionan con factores ambientales más que con la herencia, pese a que ambos inciden.
Los cánceres que producen mayor mortalidad en Estados Unidos y en Europa son el cáncer de pulmón (primero en los dos sexos), el cáncer colorectal (segundo si se suman ambos sexos), el cáncer de mama y de útero en las mujeres, y el cáncer de próstata en los varones. Los mencionados son responsables de más del 55% de todas las muertes por cáncer. Las diferentes formas de cáncer cutáneo son la forma más frecuente de cáncer con más de medio millón de casos al año que, salvo en el caso del melanoma maligno, no figuran en las estadísticas. Globalmente, en España, los cánceres más frecuentes son los del sistema respiratorio seguidos por los del estómago, próstata, colon y mama. Dentro de los tumores femeninos, los de mama son los más frecuentes.
Detección y diagnóstico
Cuanto más temprano sea el diagnóstico y el tratamiento, mayores posibilidades de curación habrá. Las pruebas de screening (detección precoz en pacientes aparentemente sanos) permiten realizar el diagnóstico antes del desarrollo de los síntomas, en una fase en la que el cáncer es más curable. Algunos de los cánceres más mortíferos, como el de mama, colon y recto, cuello uterino y próstata, pueden ser puestos en evidencia mediante pruebas de screening.
El diagnóstico precoz de las formas de cáncer para las que no existe una prueba práctica de screening depende de la identificación por parte del paciente de los signos tempranos de la enfermedad. Los síntomas enumerados en la siguiente lista pueden señalar la existencia de un cáncer:
Cambios en el ritmo intestinal o urinario
Heridas que no cicatrizan
Hemorragias inhabituales
Bultos en las mamas o en otras regiones del organismo
Dificultad para tragar alimentos
Cambios repentinos en el aspecto de verrugas cutáneas
Tos persistente o ronquera
Pérdida de peso
Pérdida de apetito
El diagnóstico del cáncer comienza por una exhaustiva historia clínica y examen físico, que incluye la inspección y palpación de todas las localizaciones corporales accesibles, en especial la piel, cuello, mamas, abdomen, testículos y ganglios linfáticos accesibles. Debe realizarse el examen de los orificios corporales, en particular el examen rectal para los cánceres de recto y próstata, y el examen pélvico para los cánceres de cuello y matriz uterina.
Termografía
La temperatura de la piel varía en respuesta a trastornos del tejido subyacente del tipo de un defecto de perfusión, un proceso inflamatorio y un cáncer, lo que hace posible que estas afecciones sean visibles mediante cámaras sensibles a calor infrarrojo. En esta termografía, el tejido canceroso (amarillo) contrasta con la coloración azul y verde del resto del cuerpo.
Biopsia
La biopsia sigue siendo el único método definitivo para el diagnóstico del cáncer. En una biopsia, se toma para estudio una sección del tejido tumoral o de una metástasis. Diversas técnicas recientes han reducido la necesidad de realizar biopsias quirúrgicas abiertas. La mayor parte de los tumores en cualquier localización corporal son accesibles a la biopsia a través de una fina aguja flexible dirigida por palpación o tomografía axial computerizada (TAC). Con el diagnóstico previo a la cirugía, el médico y el paciente pueden realizar una mejor planificación del tratamiento y de la cirugía, si es preciso.
Estadio de la enfermedad
Una vez establecido el diagnóstico definitivo de cáncer, la extensión o estadio de la enfermedad deben ser evaluados puesto que de ellos dependen el pronóstico y tratamiento adecuado. Para cada tipo específico de tumor (I, II, III, IV) el estadio se define en función del hallazgo de ciertos datos con significación pronóstica: tumor localizado de pequeño tamaño, tumor localizado más extenso, afectación de los ganglios linfáticos regionales y metástasis a distancia. El estadio clínico se deduce de los datos obtenidos antes de la exploración quirúrgica, y condiciona la elección del tratamiento inicial. El estadio quirúrgico depende de los hallazgos exploratorios durante la intervención y puede diferir del estadio clínico; el tratamiento posterior y el pronóstico se establecen en función de éste. También permite analizar los efectos de diferentes tratamientos.
· Tratamiento
Las medidas terapéuticas tradicionales incluyen la cirugía, la radiación y la quimioterapia. En la actualidad se estudia la utilidad de la inmunoterapia y la modulación de la respuesta biológica.
Cirugía
La principal estrategia para el tratamiento curativo del cáncer es la excisión de todas las células malignas mediante una intervención quirúrgica. En el pasado, esto implicaba la excisión de todo el tejido afectado y de la mayor cantidad posible de tejido potencialmente afectado, incluidos los tejidos vecinos y los ganglios linfáticos. Para algunos tumores, y en especial el cáncer de mama, no es precisa una cirugía tan ablativa (mastectomía) en la mayor parte de los casos. Las mejoras en las técnicas quirúrgicas, los conocimientos en fisiología, en anestesia y la disponibilidad de potentes antibióticos y hemoderivados, han permitido realizar cirugías más limitadas, con menos secuelas y más pronta recuperación. Sin embargo, muchos cánceres están demasiado extendidos en el momento del diagnóstico para que la cirugía curativa sea posible. Si la extensión local del tumor afecta a tejidos vecinos que no pueden ser resecados, o si existen metástasis a distancia, la cirugía no será un tratamiento curativo. Sin embargo, puede ser beneficiosa para el alivio sintomático de ciertas situaciones como la obstrucción, o puede tener el objetivo de disminuir la masa tumoral para permitir una mejor respuesta al tratamiento quimioterapéutico o radioterapéutico sucesivo.
Radioterapia
Las radiaciones ionizantes pueden ser electromagnéticas o por partículas y producen una destrucción tisular.
La radiación electromagnética incluye los rayos gamma, una forma de emisión radioactiva, y los rayos X, que se producen cuando un haz de electrones impacta en un metal pesado. La radiación de partículas incluye haces de electrones, protones, neutrones, partículas alfa (núcleos de helio) y piones.
La sensibilidad de los tumores a las radiaciones es muy variable. Son tumores sensibles aquellos cuya sensibilidad es superior a la de los tejidos vecinos normales. Cuando tales tumores son además accesibles —los tumores superficiales o los tumores en órganos como el útero en el que se puede introducir una fuente de radiación— pueden ser curados mediante radioterapia. La propiedad de la radiación de respetar hasta cierto punto los tejidos normales permite el tratamiento de tumores en localizaciones donde no es posible la cirugía por la proximidad de tejidos vitales o porque el tumor ha empezado a infiltrar estructuras adyacentes que no pueden ser sacrificadas. La radioterapia también se emplea con frecuencia como tratamiento paliativo, sobre todo en las metástasis.
La radioterapia puede ser útil como coadyuvante a la cirugía. La radiación preoperatoria puede esterilizar las células tumorales con rapidez, impidiendo su diseminación en el acto quirúrgico. También puede disminuir la masa tumoral facilitando la cirugía, o transformando un tumor inoperable en otro operable. En otros casos la radioterapia se emplea en el postoperatorio.
Quimioterapia
Consiste en la utilización de fármacos para el tratamiento del cáncer. Puesto que los fármacos se distribuyen en el organismo a través del sistema circulatorio, la quimioterapia es útil para aquellos tumores cuya diseminación los hace inaccesibles a la cirugía o a la radioterapia. Existen multitud de fármacos anticancerosos, la mayor parte de los cuales actúan interfiriendo la síntesis o función del ADN. Por tanto las células en división son más sensibles a la quimioterapia. El tejido canceroso tiene una mayor proporción de células en división que los tejidos normales (en los que las células de soporte o de relleno están en una fase quiescente y son por tanto resistentes a los efectos del fármaco). Dentro de los tejidos normales, los que tienen una tasa de proliferación más rápida son la médula ósea y las células de recubrimiento del tracto gastrointestinal. Son los dos tejidos más sensibles al efecto de la quimioterapia y de la lesión de éstos depende la toxicidad, que limitará la máxima dosis tolerable de los fármacos anticancerosos. Para que el tratamiento sea efectivo, la sensibilidad del tumor debe ser superior a la del tejido normal más sensible. Mientras algunos tumores son varias veces más sensibles, otros sólo son ligeramente más sensibles. Por fortuna, las células de la médula ósea pueden dividirse a mayor velocidad que las células malignas y por tanto se recuperan con mayor rapidez. Si se repite un ciclo del fármaco en este momento, el tumor no ha tenido tiempo de crecer demasiado. Los ciclos repetidos reducen de forma paulatina el tumor antes de la aparición de resistencias. La sensibilidad de ciertos tumores a la quimioterapia es tal que es posible la curación en un alto porcentaje: esto sucede en el cáncer uterino, las leucemias agudas (sobre todo en los niños); la enfermedad de Hodgkin y los linfomas difusos de células grandes; el carcinoma de testículo; el carcinoma de ovario; los carcinomas de células pequeñas del pulmón, y gran parte de los cánceres infantiles. Muchas veces estos procesos cancerosos se han diseminado en el momento del diagnóstico y no existe otra opción terapéutica. Otros cánceres avanzados tienen buena respuesta a la quimioterapia y pueden ser controlados durante periodos prolongados, por lo que se utiliza con frecuencia como tratamiento paliativo.
Los dos principales problemas que limitan la utilización de la quimioterapia son la toxicidad y la resistencia. Las técnicas que evitan o controlan la toxicidad y disminuyen el riesgo de resistencias se han ido perfeccionando. Es importante la instauración precoz del tratamiento, la utilización de dosis óptimas del fármaco, la repetición de los ciclos con intervalos cortos si es posible, siempre que se permita la recuperación del paciente de los efectos tóxicos.
Es eficaz la utilización de múltiples fármacos. Los protocolos de quimioterapia utilizan diferentes fármacos (a menudo 3 a 6 al mismo tiempo), cada uno de los cuales es eficaz de forma aislada. Se combinan fármacos con diferentes mecanismos de acción para evitar la aparición de resistencias cruzadas, y con diferentes tipos de toxicidad para poder emplear la dosis óptima de cada fármaco, sin producir toxicidad aditiva que puede resultar fatal.
Se puede utilizar la quimioterapia junto a la cirugía o a las radiaciones en la denominada terapia combinada. Muchas veces se utiliza como tratamiento coadyuvante cuando la cirugía es la principal modalidad terapéutica. Suele administrarse tras la cirugía. Esta terapia es muy eficaz en el cáncer de mama. El objetivo principal de la quimioterapia como coadyuvante es la eliminación de las micrometástasis que pudieran existir previamente a la cirugía. Es más reciente la utilización de la quimioterapia previa a la cirugía como tratamiento coadyuvante, que puede además reducir la masa del tumor y facilitar su operabilidad.
Terapia hormonal
Muchos cánceres procedentes de tejidos que son sensibles a la acción hormonal, como la mama, la próstata, el endometrio y el tiroides, responden al tratamiento hormonal. Consiste en la administración de diferentes hormonas o antihormonas o la eliminación del origen de la hormona estimulante.
Otras estrategias
Se están empezando a emplear nuevas estrategias, algunas de ellas prometedoras, en el tratamiento del cáncer. Se pueden utilizar agentes biológicos denominados moduladores de la respuesta biológica, para modificar la respuesta del organismo (y en especial del sistema inmunológico) al cáncer. Otro planteamiento es utilizar agentes biológicos para estimular a determinadas células para que ataquen a las células malignas. El mejor ejemplo es la utilización de la interleuquina 2 para estimular a los linfocitos Killer sensibles a linfoquinas (células LAK). Se ha investigado en profundidad la existencia de antígenos específicos de algunos tumores que permitan la elaboración de anticuerpos antitumorales: éstos atacarían el cáncer de manera directa o constituyendo el vehículo para un fármaco quimioterapéutico. Así, el anticuerpo identificaría la célula maligna a la que se adheriría permitiendo al fármaco ejercer su acción.
Incluso en el caso de conseguirse la curación, el cáncer puede haber producido serias secuelas. Se debe intentar ofrecer al paciente la mejor calidad de vida posible, mediante técnicas de rehabilitación que pueden incluir cirugía reconstructiva. Cuando no es posible la curación, el tratamiento paliativo tiene por objetivo brindar al paciente la mejor calidad de vida y función durante los siguientes meses o años. El dolor puede controlarse en la actualidad de manera mucho más eficaz que en otras épocas.
Curabilidad del cáncer
En las últimas décadas, el número de muertes debidas al cáncer ha aumentado de manera rápida y progresiva: desde 1965 hasta 1989 el número de casos se duplicó. Este dato no representa una marcha atrás sino que refleja el aumento y envejecimiento de la población (la incidencia de cáncer aumenta con la edad). También refleja el fracaso hasta épocas recientes de las campañas antitabaco. Esto ha permitido que la incidencia de cáncer de pulmón (la principal causa de muerte por cáncer) continúe aumentando. La incidencia de cáncer de pulmón se ha multiplicado por diez en los últimos cincuenta años. El descenso espectacular en el consumo de tabaco en los últimos años debería traducirse en un descenso de la mortalidad por cáncer de pulmón. Si se excluye este último, la mortalidad por cáncer ajustada a la edad ha dejado de aumentar. Otros tipos de cáncer continúan aumentando en incidencia, pero en muchos casos las mejoras en la tasa de curación han sobrepasado este aumento.
La mortalidad por cáncer ha disminuido progresivamente en todos los grupos de edad por debajo de 55 años. Este hecho se puede relacionar con una menor exposición a los agentes cancerígenos gracias a la mejora de los hábitos de salud y del ambiente, así como a un diagnóstico más precoz. Se espera que este descenso se extienda a los grupos de mayor edad.
El riesgo de cáncer de pulmón disminuye de forma espectacular en pocos años después de dejar de fumar. Los esfuerzos en el diagnóstico precoz en el cáncer de pulmón han tenido poca repercusión en la tasa de curación. La mayor parte de los cánceres cutáneos son curables. Son prevenibles, si se disminuye la exposición a las radiaciones solares, el principal factor relacionado con su aparición.
Control del cáncer
La medida más eficaz en la prevención del cáncer es la eliminación del consumo de tabaco, ya que el 30% de las muertes por cáncer son producidas por su consumo. El control de la dieta también reduce la mortalidad: disminuir la ingesta calórica para evitar la obesidad, reducción de las calorías procedentes de la grasa a un 20% de la dieta, reducción del consumo de carnes rojas, aumento de la ingesta de fibra (cereales, frutas y verduras) y alimentos protectores (con contenido en vitaminas C y A, verduras como el repollo, la coliflor, el brócoli o las coles de Bruselas). Debe limitarse el consumo de alimentos ahumados, en salazón o ricos en nitritos, así como el consumo de alcohol. Se debe limitar la exposición solar o utilizar cremas protectoras para prevenir el cáncer de la piel.
El control sobre los factores ambientales incluye la eliminación de productos carcinógenos en el lugar de trabajo y en el hogar, como por ejemplo la eliminación de la exposición a las fibras de asbestos o la reducción del gas radón en el hogar.
Las técnicas de detección precoz o screening pueden realizarse para el cáncer de cérvix (cuello uterino), mama, colon, recto y próstata. Es recomendable la realización de un chequeo anual a partir de los 40 años incluso en la ausencia de síntomas; los países con sistema público de salud no siempre ofrecen este servicio y el paciente debe sufragar el gasto. Las mujeres de más de 20 años deben realizar una autoexploración mamaria de manera mensual. El cáncer de mama se considera uno de los principales problemas de salud en los países desarrollados y muchas mujeres mueren cada año por esta causa. Las mujeres mayores de 50 años son las que tienen mayor riesgo de desarrollar cáncer de mama y el riesgo máximo lo presentan las pacientes con una edad superior a 75 años. Los médicos recomiendan realizar un examen anual o bianual, mediante mamografía y exploración física, a las mujeres de 50 o más años de edad. En general, no se recomienda realizar mamografías por debajo de los 35 años de edad. En cuanto al grupo de mujeres entre 40 y 49 años de edad existen controversias sobre la utilidad o no de las mamografías. El cáncer de endometrio supera en frecuencia, en España, al de cérvix, pero no se dispone de ningún estudio que evalúe los beneficios de biopsias en parientes asintomáticas. La citología ha demostrado ser un método eficaz para la detección precoz de cáncer de cérvix. Se recomienda la realización de una citología cada 3 años siempre que se hayan detectado 2 tinciones negativas en intervalos anuales. En muchos países desarrollados el aumento en el número de personas que disfrutan sus vacaciones en países de clima cálido ha producido un aumento en el cáncer de piel. Se recomiendan las medidas preventivas, como el uso de cremas o pantallas protectoras frente a la acción potencialmente lesiva de los rayos ultravioletas solares.
La adopción generalizada de las medidas de detección precoz podría eliminar el cáncer de pulmón, reducir la incidencia de cáncer de mama y colon, e incrementar la tasa de curación del cáncer de mama, colon, recto, cuello uterino y próstata.
40
Descargar
| Enviado por: | Vituko |
| Idioma: | castellano |
| País: | España |
