Química
Cambios físicos y químicos en diferentes sustancias
UNIVERSIDAD ANTONIO NARIÑO
FACULTAD DE MEDICINA
ASIGNATURA: QUIMICA
PRIMER SEMESTRE
LABORATORIO 2: CAMBIOS FISICOS Y QUIMICOS
BOGOTA D.C.
FEBRERO 27 DE 2007
OBJETIVOS
OBJETIVO GENERAL
Estudiar las propiedades de algunas sustancias antes y después del cambio.
OBJETIVOS ESPECIFICOS
-
Diferenciar los físicos de los cambios químicos
-
Estudiar procesos donde ocurren cambios químicos
-
Estudiar procesos donde ocurren cambios físicos
MARCO TEORICO
Las sustancias que experimentan un cambio físico permanecen químicamente idénticas al final del cambio, su composición no se altera y sus moléculas no cambian. Por ejemplo cambios como la fusión, la congelación, la evaporación, la sublimación y la condensación.
La evaporación
La evaporación es el proceso físico por el cual átomos o moléculas en estado líquido pasa al estado gaseoso, por haber tomado energía suficiente para vencer la tensión superficial.
La sublimación
Es el proceso físico que consiste en el cambio de estado de la materia sólida al estado gaseoso, sin pasar por el estado líquido
La Condensación
Se denomina condensación al proceso físico que consiste en el paso de una sustancia en forma gaseosa a forma líquida
Por el contrario, los productos de un cambio químico son diferentes a los reaccionantes, su composición es diferente. En las moléculas de los productos se encuentran los mismos átomos con la diferencia que han sido reorganizadas. Puesto que se han formado sustancias diferentes, aparecen nuevas propiedades. La mayoría de las reacciones químicas van acompañadas por cambios visibles, como cambio de color, formación de precipitado, desprendimiento de un gas, cambio de temperatura etc.
MATERIALES Y METODOS
1. MATERIALES
| Tubo de ensayo |
|
| Puntilla |
|
| Cinta de magnesio |
|
| Pinzas |
|
| Mechero |
|
| Papel tornasol |
|
| Sulfato de cobre |
|
| Vidrio de reloj |
|
| Capilar de vidrio |
|
| Granalla de zinc |
|
| Espátula |
|
| Soporte universal |
|
| Rejilla |
|
| Gradilla |
|
2. METODOLOGIA

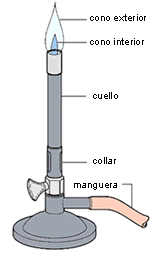
Figura 1. Montaje utilizado en la práctica
2.1. Combustión del magnesio
Se observo la apariencia de un fragmento de cinta de magnesio y se ensayo la solubilidad en el agua. Sujetando por un extremo las pinzas y calentando el otro extremo directamente en la llama del mechero, finalmente se recogió el producto de la combustión en una capsula de porcelana. Posteriormente se agregaron unas pocas gotas de agua al producto y se tomo el pH con papel tornasol rojo.

Figura 2. Combustión del magnesio
2.2. Reacción de desplazamiento
Se ubico un tubo de ensayo de unos 5 ml de sulfato de cobre, inclinado el tubo y se dejo caer deslizando con cuidado la puntilla de hierro sobre el tubo de ensayo, hasta que esta se encontrara en contacto con el sulfato de cobre. La puntilla se dejo en reposo por espacio de 10 minutos y se retiro pasado este tiempo para examinarla. En forma posterior se tomaron unas pocas gotas de agua sobre el vidrio de reloj y se examino dicho residuo sobre una porción de papel blanco.
2.3. Calentamiento del vidrio
Se tomo un tubo capilar de vidrio, sujetándolo con las pinzas por un extremo y calentándolo al mechero.
2.4. Reacción de Zn con HCL
Se introdujo dentro de un tubo de ensayo una granalla de zinc con la ayuda de una espátula, posteriormente se agregaron unas gotas de acido clorhídrico.
RESULTADOS
| Procedimiento | Resultado |
| Combustión del magnesio | Después de calentar la cinta de magnesio se produjo un polvo negruzco a manera de ceniza. |
| Reacción de desplazamiento | Al sumergir la puntilla en sulfato de cobre, esta cambio de coloración, tornándose oxidada y la solución que se encontraba con sulfato de cobre al inicio presentaba un color azul, después de pasados los 20 minutos, la solución se torno de color gris. Posteriormente al producirse el calentamiento de la solución de sulfato de cobre, al final se formo un precipitado de color café. |
| Calentamiento del vidrio | Al calentar el tubo capilar, este se deformo, doblándose y perdiendo su forma inicial. |
| Reacción de Zn con HCL | Al agregar el acido clorhídrico sobre la granalla de zinc se produjo un calentamiento, una ebullición y posterior evaporación. |
PREGUNTAS
Combustión del magnesio
a) Describir el cambio del producto en la combustión del magnesio
Lo sucedido en la cinta de magnesio al calentarla, fue una transformación energética produciendo destellos luminosos y a la vez una serie de gases, que termino en la formación de una ceniza.
b) Fue un cambio exotérmico. ¿Por qué?
Un proceso es exotérmico cuando la energía de calor es liberada, disminuyendo la energía térmica del sistema. El porque es que el Magnesio reacciona con el Oxígeno en una reacción extremadamente exotérmica de acuerdo a: 2Mg + O2 > 2 MgO. Las temperaturas durante el quemado pueden ser tan altas como 2400 °C. Esto provoca que el Óxido de Magnesio se caliente a un punto de brillo blanco. La flama es tan brillante que objetos bañados en luz de Magnesio arrojan profundas sombras inclusive cuando están en la luz solar.
c) ¿Se formo un nuevo compuesto?
Al calentar la cinta de magnesio se produce una reordenación de átomos dando origen a sustancias nuevas. Que origina el compuesto oxido de magnesio: 2Mg + O2 > 2 MgO
Reacción de desplazamiento
a) ¿Es el residuo sulfato de cobre?
El residuo no es sulfato de cobre, puesto que se produce la siguiente reacción SO4 Cu + Fe ------> SO4 Fe + Cu lo cual genera, sulfato ferroso mas cobre, el hierro que contiene la puntilla desplaza al cobre, y se forma sulfato ferroso.
b) ¿Que evidencia tiene para asegurar que ha ocurrido un cambio químico?
Existen metales que pueden desplazar a otros de sus compuestos, por ejemplo al sumergir la puntilla en la solución de sulfato de cobre, se observa que el color de la solución cambia y que sobre el clavo se depositan pequeñas partículas rojizas, generando como una especie de oxidación. Como la mayoría de las reacciones químicas van acompañadas de un cambio de color o formación de un pequeño precipitado como en este caso, en este caso se esta produciendo una reacción de una sal con un metal, es decir la puntilla desplaza al cobre de la solución de sulfato de cobre.
Calentamiento del vidrio
a) ¿Qué clase de cambio ha ocurrido?
En el caso del calentamiento del capilar ha ocurrido un cambio de tipo físico, ya que se ha producido una deformación del capilar, siempre que tengamos un cambio de forma habláremos de un cambio físico. El cambio físico por ende es aquél que ocurre externamente, no existe un cambio interno en la estructura de la materia, ya que no existe una reordenación de átomos; no se forman sustancias nuevas.
Reacción de Zn con HCL
a) ¿Qué observa?
Al agregar el acido clorhídrico sobre la granalla de zinc se produjo un calentamiento, una ebullición y posterior evaporación, se observaba la evaporación de la sustancia hasta quedar totalmente seca.
b) ¿Qué tipo de cambio ha ocurrido?
Ha ocurrido un cambio de tipo químico, puesto que se han producido Cloruro de zinc (ZnCl2), a partir de la reacción entre el Zinc (Zn) y el Acido Clorhídrico (HCL), aparte de ello se observaron reacciones tales como calentamiento de la sustancia, evaporación, en este caso del hidrogeno. La reacción del zinc y el acido clorhídrico creo un gas, el gas que se produjo en dicha reacción fue el Hidrogeno, el cual vino del Hidrogeno presente en el acido Clorhídrico.
c) ¿Que sustancias se obtuvieron?
El zinc (Zn) reacciona con el acido clorhídrico (HCL), y se produce Cloruro de zinc (Zn Cl2) e Hidrogeno, es decir: Zn + HCL H2 + ZnCl2, al balancear la ecuación tenemos: Zn + Hcl2 H2 + ZnCl2
CONCLUSIONES
* Los cambios físicos implican un cambio de forma o de estado
* Los cambios químicos conllevan la transformación de sustancias en otras sustancias deferentes a las iniciales.
* Hablamos de cambio físico siempre que no cambia la naturaleza de las sustancias y de cambio químico cuando cambia
* En todo cambio químico se desprende o se necesita energía
BIBLIOGRAFIA
* Brown, T.L. Lemay. H.E. & Bursten, B.E. 1999. Quimica: La ciencia central. Pearson-Prentice may, septima edición, México.
* Chang, R. 2002. Quimica, editorial McGraw-Hill, Septima Edición, Colombia.
Descargar
| Enviado por: | Fxstar2007 |
| Idioma: | castellano |
| País: | Colombia |