Química
Átomo
Estructura del átomo.

el átomo se imagina como un sistema planetario cuyo centro esta ocupado por el núcleo atómico, y alrededor del cual giran unos corpúsculos (electrones) en orbitas distintas.
El tamaño del átomo es extraordinariamente pequeño: su diámetro total es el del orden de 10 centímetros, cifrándose el del núcleo, en los 10 centímetros. El átomo consta de:
Un cuerpo central o núcleo donde radica prácticamente toda la masa atómica.
De uno o varios electrones cargas elementales de electricidad negativa y de masa infinitesimal, que se mueven en derredor del núcleo, distribuidos en capas o pisos (en realidad, en niveles de energía).
El núcleo esta a su ves compuesto esencialmente de dos clases de partículas: protones con carga de electricidad positiva equivalente a 1.6 x 10 culombios; y neutrones sin carga eléctrica.
Materia y Electricidad.
la materia también puede resultar afectada de diversas formas. Consideremos, por ejemplo, el efecto fotoeléctrico antes mencionado: cuando el metal es irradiado con luz, absorbe parte de ella. En cada acto elemental de absorción, toda la energía de un fotón es absorbida por un átomo. Como resultado de este proceso, el fotón es aniquilado —deja de existir—, en tanto que el electrón se escapa del metal; por cada fotón absorbido se libera un electrón. (Este electrón liberado puede a su vez enviarse a otra placa metálica para producir una emisión de electrones en cascada, y así sucesivamente; éste es el principio de funcionamiento de los tubos foto multiplicadores, que convierten la llegada de un fotón en señal eléctrica.)
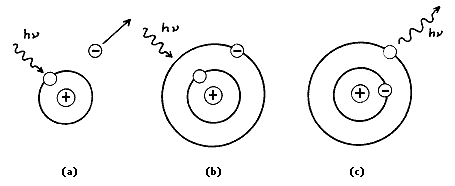
otra forma de ver la relación de la materia con la energía se demuestra con la explosión de una bomba de hidrógeno, donde la conversión de diminutas cantidades de materia producen cantidades grandes de energía, demostradas matemáticamente con la ecuación de Albert Einstein (E=mc2)
Él puso dentro del tubo, que lleva su nombre, molinillos ligerísimos, que los rayos catódicos hicieron girar, como el viento hace girar las aspas de un molino.
Él afirmó, precisamente fundado en este último experimento, que los rayos catódicos no eran otra cosa que un extremo y sutilísimo estado de la materia, á que llamó materia radian te. Como el vacío es tan grande, suponía Crookes que el gas contenido en el tubo llegaba á un inconcebible estado de división, y que sus átomos eran los que rechazados por el cátodo engendraban los rayos catódicos, chocaban con el cristal opuesto, engendraban con su bombardeo archí microscópico la fluorescencia, y si encontraban en su camino uno de esos sutilísimos aparatos, de que antes hablábamos, lo hacían girar y aun correr sobre pequeños carriles.
Muchos físicos Ingleses, algunos de primer orden, aceptaron esta hipótesis de la materia radiante y de los rayos catódicos, que no vendrían á ser otra cosa que un vientecillo sutilísimo como aliento de hada; entre otros Thomson y FitzGeralt. Pero los físicos alemanes, como el ilustre Hertz, su discípulo Lenard, y Goldstein, Wiedemann y Sbert, se opusieron á la hipótesis inglesa, y atribuyeron los rayos catódicos á un origen vibratorio.- no es la materia que corre, decían, es el éter que vibra.
-Descubrió
No dependen del tipo de gas encerrado en el tubo
Se desvían hacía el polo positivo cuando se someten a la acción de un campo eléctrico.
Pueden desviarse por la acción de un campo magnético
Provocan la aparición de sombras
Pueden poner al rojo una barra de mica que se interponga en su camino
La relación carga / masa es independiente de la naturaleza del gas
De estas y otras experiencias se llegó a la conclusión de que los rayos catódicos estaban constituidos por partículas cargadas negativamente y que todas esas partículas eran idénticas, independientemente del gas que hubiera en el tubo o del material que estuvieran hechos los electrodos.
A estas partículas se les llamo electrones y fueron identificados por Joseph Thomson (1.856-1.940), posteriormente se pudo determinar la carga y la masa del electrón.
Los estudios realizados por Thomson señalaban que los electrones son partículas universales, pero con su descubrimiento de los rayos positivos concluye que existen también partículas positivas llamadas protones (p+ ) en la materia.
El descubrimiento del protón se llevó a cabo en el tubo de Crookes, bajo las mismas condiciones en las cuáles se descubrió el electrón; es decir, el tubo estaba casi al vacío, contenía en su interior gas hidrógeno, un cátodo perforado y un ánodo.
Cuando el tubo de Crookes era sometido a altas descargas eléctricas, se observaba la formación de los rayos catódicos que se dirigían al ánodo; pero también se observaba un reflujo de rayos que se dirigían al cátodo, a los cuáles Thomson llamó rayos canales o rayos positivos.
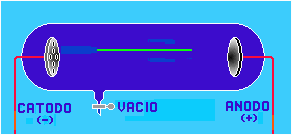
La explicación del fenómeno anterior fundamenta de la forma siguiente:
Si las partículas de hidrógeno dentro del tubo son ionizadas al paso del haz de electrones provenientes del cátodo, esas partículas de hidrógeno que han perdido un electrón, sienten la atracción del electrodo negativo y se dirigen a él, produciendo un flujo de rayos positivos.
Cada partícula positiva representa un protón ó sea es el átomo de hidrógeno ionizado.
Thomson calculó la relación de la carga y la masa de los protones obteniendo un valor de: e/m = 1 u.e.m.
Thomson realizó este mismo experimento colocando en el tubo de Crookes diferentes gases, por lo que calculó diferentes relaciones de la carga y la masa y observó que todas ellas eran menor que uno, es decir, la masa aumenta y la carga sigue siendo la misma, y encontró lo siguiente:
| Masa del Hidrógeno | 1.67 X 10-24 g. |
| Masa del Electrón | 9.1 X 10-28 g. |
Descargar
| Enviado por: | Choperz |
| Idioma: | castellano |
| País: | Colombia |
