Química
Aspartamo
DESCOMPOSICIÓN DEL ASPARTAMO
UN EXPERIMENTO DE CINÉTICA PARA LABORATORIOS DE NIVEL SUPERIOR
Universidad Privada Boliviana
R. Aguilar
Introducción.
El edulcorante artificial α-L aspatil-L-fenilalanina-Lmetil éster, ha sido objeto de una numerosa cantidad de experimentos incluyendo varios análisis, una síntesis y un estudio en respuesta al dulzor. Este estudio describe un estudio cinético del Aspartamo en una solución acuosa. El experimento es aplicable para laboratorios de fisicoquímica o Biofísico química, también puede ser utilizado como un estudio de seguimiento para los análisis ya referidos. Considerando la gran cantidad de aplicaciones de este componente en bebidas de dieta, yogurt y helados, hay un gran interés en el proceso de descomposición.
El aspartamo es totalmente metabolizado por el organismo, su hidrolización produce ácido aspártico, metanol y fenilalanina.
Se usa como edulcorante de bajas calorías y no produce caries. Se utiliza para endulzar diferentes alimentos y bebidas, y también como "azúcar" de mesa. La ingesta máxima diaria es de 40 mg/kg.
Es el más importante de los nuevos edulcorantes artificiales. Descubierto en 1965, se autorizó su uso inicialmente en Estados Unidos como edulcorante de mesa, aunque desde 1983 se autorizó en ese país como aditivo en una amplia serie de productos. Químicamente es un producto genéticamente modificado, su molécula está formada por tres elementos (dos aminoácidos y un alcohol): la fenilalanina (50%), el ácido aspártico (40%) y el metanol (10%). La fenilalanina se descompone en una sustancia llamada diketopiperazina (DKP) que produce tumores cerebrales.
Descripción del experimento.
El aspartamo en solución acuosa se descompone en una variedad de productos dependiendo del pH. A un pH neutro o básico predomina la perdida de metanol para formar 3-carboximetil-6-benzil-2,5-dioxopiperazina, usualmente acortada a 2,5-diketopiperazina o DKP y algo de α-L-aspatil-L-fenilalanina. En el experimento estudiado, el pH se mantienen en 7.0 donde el principal producto es el DKP, y el aspartamo existe aproximadamente en un 50:50 de mezclas de Zwiterion y formas aniónicas. La presencia del grupo amino Terminal en forma deprotonada es necesario para el ataque nucleofilico sobre el carbón carboxilo como se muestra en el esquema I. A parte de la dependencia con el pH, el rango también es afectado por la identidad y la concentración del sistema buffer. En particular hay un mejoramiento de mayor grado cuando hay fosfato presente, probablemente por tener la capacidad de donar y aceptar un protón simultáneamente, como se muestra en el esquema I. En este experimento el efecto buffer es investigado al medir los rangos de 0.20 M de fosfato y 0.20 M de citrato, donde ambos se los puede encontrar en bebidas de dieta, pero a concentraciones mucho menores en productos comerciales. El fosfato también contiene cloruro de sodio para elevar la fuerza total iónica a 1.0 M.
Los estudios también determinan los rangos a dos temperaturas, 40º C y 55º C, para evaluar la energía de activación, que se usa para calcular la constante de grado a temperatura ambiente. Estos parámetros (pH neutro, mayor concentración del buffer, temperatura elevada) fueron escogidos para permitir la realización del experimento dentro de un periodo de cinco horas de laboratorio. Los tres sistemas 0.20 M de citrato a 40º C, 0.20 M de fosfato a 40º C y 0.20 M de fosfato 55º C tienen una vida media de aproximadamente 248 min. , 38 min, y 11 min respectivamente. Al contrario, a una concentración de fosfato 0.01 M., un pH 7.0 y 25º C la vida media es de 49 h., que es todavía tres veces la concentración de una bebida de dieta. Al final de los reportes se deben considerar si los resultados fueron útiles para predecir las duraciones del almacenado de las bebidas de dieta actuales. (De seguro, la concentración y el pH del fosfato en una bebida comercial típicas esta muy por debajo de aquellas en el experimento. ¿Pero que pasa cuando existe el efecto de calentamiento en el verano y las bebidas están todo el día en los camiones repartidores?). Cada reacción es iniciada al adicionar aspartamo solidó a 10 ml. de la deseada solución buffer. Después de mezclarla la solución es rápidamente filtrada en un tubo y colocada en un baño de temperatura constante.
A intervalos de tiempo constante, alícuotas de 100 μ L. son retiradas y transferidas a tubos que contienen 200 μ L. de solución buffer de fosfato a 0.025 M y un pH 3.0. Los efectos combinados de dilución, enfriamiento y decrecimiento en la concentración y el pH de la solución buffer detienen la reacción. Tan pronto como es posible, las alícuotas diluidas son separadas en una columna de fase reversa C18 (fase reversa unida químicamente formada por cadenas de hidrocarburo lineal de 18 átomos de carbono)
y, como fase móvil, una mezcla formada por 45% de metanol y 55% de buffer fosfato (acuoso) 0,025M de pH=3. Los primeros argumentos son obtenidos al graficar ln(At-A∞) contra el tiempo, donde At-A∞ son áreas pico del aspartamo a tiempos t e infinito, respectivamente.
Riesgos.
El metanol en la solución buffer HPLC puede causar problemas visuales y posible ceguera, si este fue inhalado o ingerido. Al contacto con la piel puede resultar una irritación menor o sequedad.
La diketopiperazina (DKP) produce tumores cerebrales; es por esto que la Administración de Alimentos y Fármacos (FDA) ordenó que todos los productos que tuvieran aspartame llevaran la leyenda `Fenilcetonúricos: contiene fenilalanina'. El ácido aspártico es otro cancerígeno en esta mezcla.
El tercer componente es el metanol, o alcohol de madera. Este alcohol es el que deja ciegos -o mata- a los bebedores que llegan a consumir bebidas alcohólicas adulteradas o producidas de manera clandestina.
Una vez dentro del cuerpo, el metanol ya descompuesto en formaldehído, para tratar de eliminarlo es almacenado en el tejido adiposo, y el resto es convertido en ácido fórmico, otro cancerígeno. Esto quiere decir que con cada sorbo que se da a una soda `light' o `diet' o cualquier otro producto que contenga aspartamo (goma de mascar, yogurt, cereales, alimentos, golosinas y hasta `medicinas'!), se esta consumiendo tres cancerígenos: el ácido fórmico, el formaldehído y el DKP de la fenilalanina, entre otros muchos productos que son el resultado de la descomposición del aspartamo dentro del cuerpo.
Resultados.
Los argumentos de primer orden para el sistema de las tres reacciones obtenidos se muestran en la figura 2 . La tabla 1 contiene los rangos de la constante ( Kobs) y energías de activación (Ea). El promedio de la energía de activación es de 71.9 +- 8.5 Kj/moll que se compara favorablemente con el resultado de 58+- 9 Kj/moll obtenido por Tsoubeli y Labufa usando 0.10 M de fosfato y pH 7. Bell y Wetzel obtuvieron una constante de rango de 0.00352 +- 0.00005 1/min utilizando 0.20 M de fosfato pH 7.0 a 25º C. Para este experimento se utilizo la energia de activacion observada y la constante de rango a 40º C para calcular el valor a 25º C . Con los datos en la tabla 1 el resultado es 0.00461 +- 0.00061 1/min que es un resultado razonablemente acorde con el de Bell y Wetzel.
Conclusiones
5.1. Conclusiones del Laboratorio.
La descomposición del aspartamo es un experimento popular para estudiantes de fisicoquímica y biofísico química el cual produce buenos resultados. Con un uso eficiente del tiempo un simple grupo de estudiantes puede completar el experimento en un laboratorio de 5h. Asumiendo que el curso es operado en un sistema rotatorio. Con un solo grupo de estudiantes realizando el experimento cada semana, la única instrumentación mayor requerida es un cromatógrafo liquido con una longitud de onda variable detector UV los estudiantes pueden aprender los conceptos de la cinética química y la relación con el consumo de productos de almacenado
Conclusiones personales.
Luego de realizada la investigación y aprendido acerca de la reacción del aspartamo al descomponerse, es importante resaltar que este no es tan dañino como se lo cree, ya que en los productos comerciales se lo encuentra en concentraciones mucho menores a las consideradas en el laboratorio, pero de todas maneras sigue siendo un enemigo mortal para el ser humano que debe ser controlado.
También mediante esta investigación se aprendió acerca de los cromatógrafos y su funcionamiento en el análisis de las sustancias, en este caso el aspartamo.
Y para finalizar es importante conocer el tiempo de vida medio de los compuestos para asi tomar las debidas precauciones en el consumo de ciertos compuestos químicos
Bibliografía.
-
Journal of Chemical Education - vol. 82 - No. 6 june 2005
-
“Dulce promesa o amarga realidad” - El Nuevo Diario - Domingo 13 de nov.
-
Wikipedia.com
-
“Cromatografía líquida de alta presión”. H. M. McNair y B. Esquivel. monografía científica de la OEA.
Anexos
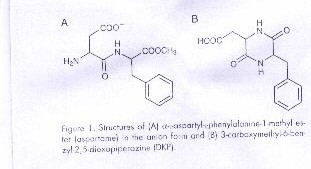
Figura 1
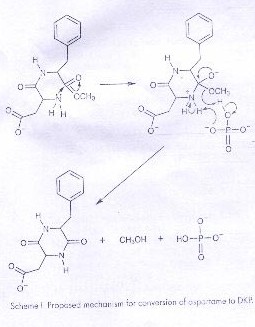
Esquema I

Tabla 1
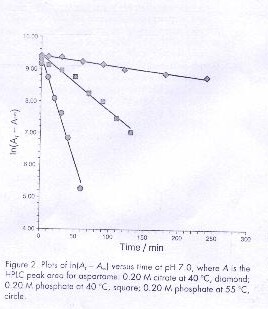
Grafica
Datos Importantes.
Sinónimos : Éster metilico de aspartil-fenilalanina
Denominación quimica : α-L aspatil-L-fenilalanina-Lmetil éster
Einecs : 245-261-3
Numero E : E 951
Formula quimica : C14H18N2O5
Masa molecular relativa : 294.31
Descripción : Polvo blanco, inodoro, cristalino, de sabor dulce, aproximadamente 200 veces mas dulce que la sacarosa.
Solubilidad : Ligeramente soluble en agua y etanol.
Perdida por desecacion : No mas del 4.5% (105º C, 4 horas).
Cenizas sulfatadas : No mas del 0.2% en peso seco.
pH :Entre 4.5 y 6.0 (solucional 1 por 125).
Arsénico : No mas de 3 mg/Kg en peso seco.
Plomo : No mas de 1 mg/Kg en peso seco.
Metales pesados : No mas de 10 mg/Kg expresados en Pb en peso seco.
Acido 5-bencil-3,6-dioxo-2-piperazina-cetico : No mas de 1.5% en peso seco.
1
Descargar
| Enviado por: | Rodrigo |
| Idioma: | castellano |
| País: | Bolivia |
