Análisis y control
Análisis de vino
INTRODUCCIÓN:
Se podría definir el vino como el producto obtenido del mosto o zumo de uva mediante un proceso de fermentación total o parcial, producido por las levaduras, y en el que se transforman los azucares en alcohol.
El vino es una bebida cargada de sustancias beneficiosas, todas obtenidas de la uva sin ningún tipo de adulteración o adición. Tanto es así, que determinados estudios han llegado a afirmar que una cantidad de vino moderada al día seria capaz de prevenir enfermedades coronarias, pudiendo llegar a reducirlas en un 50%. Este tipo de cualidades se las proporciona al vino una serie de ácidos, sales, antioxidante, etc. Que componen el vino, son las siguientes:
-
Agua: Es el componente mayoritario y es biológicamente pura, esto es, totalmente potable, ya que actúa como tampón (de 3 a 3.5 de pH) como de factor imitante de microorganismos y es donde se encuentran disueltos la mayor parte de componentes. Representa el 85% de su composición.
-
Alcohol etílico: es el segundo componente más importante, se origina en la fermentación de la glucosa y la lactosa y representa entre el 10 y el 14% de su composición.
-
Glicerina y glicerol: es el tercer componente más importante y le da cuerpo, consistencia y suavidad al vino y generalmente, su concentración es de entre 5 y 15 g/L.
-
Otras sustancias: también se encuentran otros alcoholes y ácidos, que se describirán mas adelante, así como compuestos fenólicos, vitaminas, sales, pectinas y algunas sustancias aromáticas.
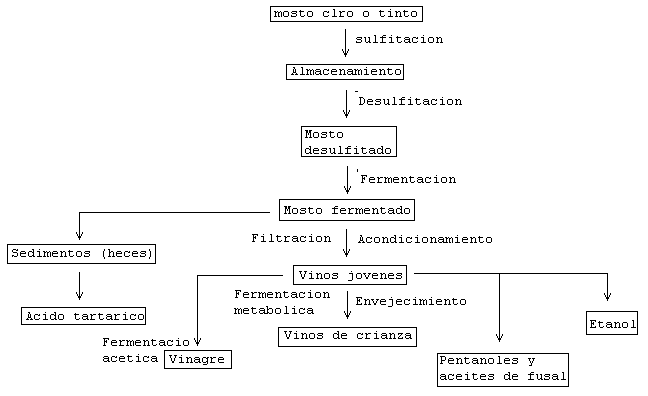
La obtención del vino se efectúa en varios procesos. Primero se prensa la uva la conseguir su zumo o mosto, que si no se trata con conservantes, el mosto fermenta, dando consigo, la producción de vino como producto final. Y este proceso se resume en los siguientes pasos: Prensado de la uva, fermentación y envejecimiento. El rendimiento del proceso se puede aumentar con una encima peptolítica.
La fermentación es la fase más importante del proceso; es un fenómeno catalítico que, como la respiración, degrada las moléculas de azucares sintetizados por fotosíntesis y convirtiéndose en etanol. El grado alcohólico dependerá de la concentración de azucares del mosto.
-
Fase inicial:
-
Primer paso: Se desarrollan las levaduras a expensas de los azucares en presencia de oxigeno.
-
Segundo paso:
-
Condiciones anaerobias
-
Poco crecimiento de levaduras
-
Los azucares se convierten en alcoholes y en gas carbónico
Los azucares y la acidez del mosto, provocan un desarrollo selectivo de los microorganismos más aptos para la fermentación alcohólica, como la levadura Sacha romyces cerevisial var. Elipsoideas. Este segundo paso es una glicólisis, que transcurre como una respiración celular, produciendo ácido piruvico. Se produce su descarboxilización y se convierte en etanol.
C6H12O6 2CH3CHOH + 2CO2 + 3Kcal
C6H12O6 + 6O2 6CO2 + 6H2O + 673Kcal
LEGISLACIÓN:
-
ORDEN de 31 de enero de 1977 (B.O. de 14 de julio). Métodos oficiales de análisis de productos derivados de la uva.
-
ORDEN de 31 de julio de 1979 (B.O. de 30 de agosto). Métodos oficiales de productos derivados de la uva.
-
ORDEN de 17 de Septiembre de 1981 (B.O. de 14 de octubre). Métodos oficiales de productos derivados de la uva.
-
ORDEN de 1 de diciembre de 1981 (B.O. de 20 de enero de 1982). Métodos oficiales de productos derivados de la uva.
DETERMINACIONES:
Hierro en Vinos (espectroscopia de absorción atómica (muestra sin tratar))
Fundamento teorico
El hierro y el cobre son los dos metales más importantes que se pueden entrar en el vino. En el vino tinto, el hierro puede generar un tanato férrico azul en condiciones de oxidación, la procedencia del vino puede ser la contaminación por diversos motivos y su limite máximo se encuentra en 6 ppm.
El hierro que contiene el vino (suelen ser aproximadamente 3 ppm) se encuentra en dos formas, como Fe2+ o como Fe3+.
principio del metodo
El método consiste en una espectroscopia de absorción atómica con distintos tratamientos sobre las muestras. Usando en ellas dos métodos distintos: método ordinario y patrones emparejados.
material y aparatos
-
Pipetas de 5, 10 y 20ml
-
Matracez de 50ml
-
Espectrómetro de absorción atómica
-
Material general de laboratorio
reactivos
-
Cloruro de calcio
-
Ácido fosfórico
-
Alcohol etílico 96º
-
Disolución de hierro 1000ppm
procedimiento operatorio
-
Preparar una disolución de madre de Fe, partiendo de una disolución patrón de 1000 ppm
Método ordinario:
-
Se deben preparar tres patrones de hierro con 2, 4 y 6
-
Después se toma 5, 10 y 20ml de vino y se enrasan a 50ml
-
Medir los patrones y las muestras
Patrones emparejados:
-
El método es similar al ordinario, con la diferencia de que en este método se añade alcohol y cloruro de calcio y ácido fosfórico para la eliminación de interferencias
-
Se harán, patrones y muestras con CaCl2 y H3PO4, con etanol CaCl2 y H3PO4 y con H3PO4 y etanol.
expresion de los resultados: Muestra Nº 8
Datos de la practica:
Cálculos
ppm = ppm0 · V0/V1
ppm = concentración en mg/L de la muestra
ppm0 = concentración de la dilución en mg/L
V0 = Volumen de la dilución
V1 = Volumen de alícuota
Resultados
Vm = volumen de muestra
ppm0 = mg/L obtenida en la medida
ppm = mg/L de la muestra
ppm = 0.2ppm · 50ml/5ml = 2mg/L
Observaciones:
-
Se utiliza cloruro de calcio y ácido fosfórico para eliminar las sustancias contenidas en la muestra que pueden interferir en la medida.
-
El alcohol se usa para que los patrones tengan unas condiciones parecidas a las de la muestra.
referencias bibliograficas
-
Apuntes de clase
-
Métodos oficiales de análisis (panreac)
Acidez total:
fundamento teorico
El principal ácido del es el ácido tartárico, que es el que le da la acidez al vino. El ácido tartárico es un ácido carboxílico. Su fórmula es: HOOC-CHOH-CHOH-COOH. Es el más abundante en el vino y también el más estable, pudiendo llegar a suponer más de dos tercios del total. Su aportación al vino es la de añadir características de fruta madura, sabores frescos y agradables, lo que se conoce como notas "vinosas". El ácido tartárico precipita de manera natural en forma de sales (tartrato cálcico o bitartrato potásico) como consecuencia de la acción insolubilizante conjunta del alcohol y el frío, formando los famosos cristales o posos del vino.
Su presencia en vinos de calidad se acepta cada vez más, pues simplemente indica una menor manipulación del vino en bodega, como es una menor estabilización en frío. Hay otros dos ácidos presentes en el proceso, el ácido cítrico, que se destruye al inicio de la fermentación y el ácido málico que se destruye al final de esta. Pero al final de este proceso se generan mas ácidos, que son, ácido láctico, acético y succínico.
La acidez total del vino se mide con el carácter ácido de la suma de todos los ácidos que contiene, expresada como ácido tartárico.
La acidez tiene su origen en las reacciones metabólicas producidas en la fermentación, producido por la ruptura de las moléculas de azúcar y su posterior transformación en ácidos orgánicos.
principio del metodo
Consiste en una valoración con sosa de una muestra vino con un pHmetro
material y aparatos
-
Material general del laboratorio
-
pHmetro
-
Desgasificador
-
Electrodo K+ 3M
-
Bureta de 25ml
reactivos
-
NaOH 0.1N (Factorización, ANEXO II)
procedimiento operatorio
-
Se toma una alícuota de 50ml en un matraz erlenmeyer de 100 y se desgasifica mediante ultrasonidos.
-
Se toman 20ml del vino desgasificado y se ponen en un vaso de 100 ml
-
Se valora con electrodo de pH hasta y valor próximo a 7. A partir de aquí se valora de 0.1 en 0.1 ml hasta anotar los valores inmediatamente inferior y superior de 7. Se anota el volumen y se continua valorando igual hasta pH=8,1
expresion de los resultados: Muestra Nº8
Datos de la practica (ANEXO III)
| Vm = | 50ml | Vm = Volumen de muestra | ||
| Va = | 20ml | Va = Volumen de alícuota | ||
| Concentración de NaOH = | 0.1N | |||
Cálculos
V1 = volumen de sosa gastado en la valoración
N1 = normalidad de sosa
Resultados
observaciones
No hay incidencias reseñables para esta determinación
referencias bibliograficas
-
Apuntes de clase
-
Métodos oficiales de análisis (panreac)
Acidez volátil:
fundamento teorico
La acidez volátil se identifica como la proporción de acético contenida en el vino y acidez fija Es la acidez de un vino relativa a la suma de la cantidad de ácidos fijos, tanto orgánicos como minerales, que se encuentran en su composición y es la diferencia entre la acidez total y la acidez volátil.
La acidez volátil está constituida por la parte de ácidos grasos pertenecientes a la serie acética que se encuentra en los vinos, ya sea en estado libre o de sal. Se determina mediante la separación de los ácidos volátiles por arrastre con vapor de agua y rectificación de los vapores. Se debe evitar con precaución la presencia de gas carbónico en el destilado. La acidez del anhídrido sulfuroso libre y combinado arrastrados con el destilado no deben comprenderse en la acidez volátil, por lo que hay que restar la equivalencia de su acidez de la del destilado, así como la del ácido sórbico eventualmente presente.
La acidez tiene su origen en las reacciones metabólicas producidas en la fermentación, producido por la ruptura de las moléculas de azúcar y su posterior transformación en ácidos orgánicos. Uno de estos ácidos, el acético, es uno de los que se usan como medida de calidad del vino, y su cantidad no podrá ser superior a 0.5g/L. Este ácido se forma a partir de ácido piruvico y coenzima A. La producción de este ácido continua hasta consumirse la mitad del azúcar. El azúcar sobrante se transforma en etanal y en etanol; Este etanal también se puede convertir en acético.
principio del metodo
Consiste en la destilación de los ácidos más volátiles por arrastre de vapor y su posterior valoración
material y aparatos
-
Tubos Kjeldahl
-
Desgasificador
-
Equipo de destilación
-
Material general de laboratorio
-
Bureta de 25ml
reactivos
-
Ac. Tartárico
-
NaOH 0.1N
-
Fenolftaleina
procedimiento operatorio
-
Se echan 50ml de vino en un erlenmeyer de 100ml
-
Se eliminan los restos de gases con el aparato de ultrasonidos
-
En un matraz kjeldahl se echan 20ml y 0.5g de tartárico de alícuota y se destilan, sin arrastre de vapor, en un destilador kjeldahl
-
Recoger 250ml de destilado y valorar con sosa en presencia de fenolftaleina
expresion de resultados
Datos de la practica
Cálculos
Acidez volátil (g/L de acético)
Ac = V1(L) · N1 · Peq Hac · 100/20
Acidez volátil (g/L de tartárico)
Ac = V1(L) · N1 · Peq Tart. · 1000/20
V1 = Volumen de sosa gastado
N1 = normalidad de la sosa
Resultados
observaciones
No hay ninguna incidencia reseñable para esta determinación
referencias bibliograficas
-
Apuntes de clase
-
Métodos oficiales de análisis (panreac)
Acidez fija:
fundamento teorico
La acidez fija es la proporcionada por ácidos no volátiles y que se podría definir como la diferencia entre la acidez total y la acidez volátil.
expresion de los resultados
Datos de la practica
Acidez total (g/L de tartárico) = 5.1g/L
Acidez volátil (g/L de tartárico) = 0.82
Cálculos
Acidez fija = acidez total - acidez volátil
Resultados
Acidez fija = 4.28 g/L
Cloruros
fundamento teorico
El contenido en cloruros de un vino, fundamentalmente depende de la concentración de este Ion en el suelo en el que ha crecido la vid. Su limite se encuentra en 1g/L expresado en NaCl.
Uno de los inconvenientes relacionados con el cloruro, se encuentra en el uso de determinadas proteínas floculantes. No obstante este Ion también se usa de manera controlada para que el vino adquiera cuerpo, consistencia y sabor.
principio del metodo
Esta es una determinación que se realiza por dos métodos distintos, uno utilizando un titrador automático, que dos da el resultado de la medida de forma directa y rápida. El otro es con un potenciómetro y utilizando una curva de calibrado. En ambos se debe utilizar un patrón.
material y aparatos
-
Titrador.
-
Electrodo de Ag/AgCl.
-
PH-metro con escala que permita apreciar 2mV.
-
Electrodo Ag/AgCl, con una solución saturada de potasio nitrato como electrolito.
-
Material general de laboratorio.
-
Bureta de 25ml
reactivos
-
Disolución de cloruros 0.01N
-
HNO3 concentrado
-
AgNO3
procedimiento operatorio
Titrador
-
Se echan 10ml de disolución de Cl-, en un vaso y se añade 1ml de HNO3.
-
Se sumerge el electrodo y se añade agua al vaso hasta cubrir el diafragma del electrodo.
-
Se selecciona el modo EQ y se valora automáticamente con AgNO3
-
Seguidamente se toman 50ml exactamente medidos de muestra y sin añadir nítrico y se realizan los mismos pasos que con el patrón.
Potenciometria
-
El tratamiento del patrón y la nuestra es similar al del método del titrador. En este la medida es con un potenciómetro.
-
Se realizara una curva de calibrado con el patrón de la siguiente forma: Se añade volumen a al vaso de 1 en 1mlhasta 8ml, de 8 a 12ml de 0,5 en 0,5ml y de 12 a 15ml, de nuevo de uno en uno.
-
Se dibuja la recta de calibrado y se anota los milivoltios a los que se encuentra el punto final
-
Después se mide muestra añadiendo AgNO3 hasta que el potencial sea el del punto de equivalencia y se anota el volumen.
expresion de resultados
Datos de la practica
Cálculos
Resultados
La recta de calibrado esta en el ANEXO III
observaciones
No existen incidencias reseñables en esta determinación
REFERENCIAS BIBLIOGRAFICAS:
-
Apuntes de clase
-
Métodos oficiales de análisis (panreac)
Nitrógeno
fundamento teorico
Los compuestos nitrogenados se encuentran de diversas formas, en uvas, mostos y vinos. El motivo es su capacidad para agrupar moléculas nitrogenadas.
El agrupamiento de estas sustancias se puede encontrar, ordenada de mayor a menor en función del tamaño de su molécula, en: catión amonio, correspondiente a sales amónicas disociadas o a nitrógeno elemental. El nitrógeno de ciertos aminoácidos esenciales y diversos polímetros, que van desde dipéptido hasta proteínas sencillas.
Estos compuestos nitrogenados se dividen en dos grupos:
-
El primero formado por amonios, aminoácidos libres y polipéptidos de bajo peso molecular. Cumplen una función biológica en la fermentación del vino, se denomina materia nitrogenada asimilable y es imprescindible para el desarrollo metabólico de los microorganismos.
-
El segundo, formado principalmente por polipéptidos polimerizados y proteína de baja masa molecular. Estas no son asimilables por los microorganismos. No obstante se manifiestan por ser coloidales y por tener una carga electrostática que depende del pH.
principio del metodo
Esta determinación consiste en la digestión y posterior destilación de una muestra, por el método de kjeldahl
material y aparatos
-
Unidad de digestión “bloc-digest” de selecta
-
Destilador “pro-nitro I” de selecta
-
Tubos para digestión y destilación macro
-
Bureta de 25ml
-
Material general de laboratorio
reactivos
-
Catalizador
-
H2SO4 96%
-
H2O2 110 v
-
NaOH 35% (p/v)
-
HBO3 4%
-
HCl 0.05N
-
Indicador mixto
procedimiento operatorio
Digestión
-
Poner en un tubo para digestión 10ml de vino exactos, después una pastilla de catalizador, 10ml de sulfúrico y 6ml de agua oxigenada. El blanco se prepara igual pero con 10ml de agua.
-
Calentar en el digestor 5 minutos a 250º, si se forman espumas, sacar el tubo del digestor. Hacerlo tantas veces como sea necesario, hasta que desaparezcan las espumas.
-
Transcurrido este tiempo calentar 20 minutos a 425º. Actuar con las espumas como en el apartado anterior.
-
Si quedan restos no trasparentes en el tubo, calentar otros 10 o 15 minutos mas.
Destilación
-
En un Erlenmeyer de 250ml pon 50ml de ácido bórico y añade dos o tres gotas de indicador mixto. Introduce hasta el fondo del Erlenmeyer la alargadera del aparato de destilación.
-
Coloca el tubo para digestión de la prueba en blanco en el aparato de destilación, asegurándote que queda perfectamente adaptada la boca del matraz a la goma para que no se produzcan pérdidas.
-
Pulsa el botón de dosificación de NaOH dos veces y observa que el contenido del tubo de digestión vira a color azul oscuro, si no es así vuelve a pulsar una vez más el botón de dosificación.
-
Conecta el interruptor de formación de vapor y destila el contenido del matraz hasta que en el Erlenmeyer se hayan recogido unos 200ml de destilado. Comprueba que con las primeras gotas de destilado el contenido del Erlenmeyer vira a color verde, si no fuera así se debe parar el suministro de vapor, dejar enfriar el matraz y volver a añadir una dosis más de NaOH
-
Terminada la destilación, baja el Erlenmeyer a la bandeja inferior de manera que la alargadera del aparato destilador no quede sumergida en el destilado. Quita el tubo de su posición y deja escurrir sobre el Erlenmeyer, los restos de destilado que han quedado en el refrigerante.
-
Valora el contenido del Erlenmeyer con HCL 0,05N hasta el viraje del indicador a rojo claro o rosa.
-
Repite todos los pasos anteriores con la muestra de vino. Después se mide muestra añadiendo AgNO3 hasta que el potencial sea el del punto de equivalencia y se anota el volumen.
expresion de resultados
Datos de la practica
Cálculos
gN/L = 14 · (V1-V0) · N / Vm
V1 = Volumen de HCl gastados (ml)
V2 = Volumen de HCl para el blanco (ml)
Resultados
gN/L = 14 · (4.9-01) · 0.05 / 10
| g de N/L de vino | 0.34g/L |
observaciones
No existen incidencias reseñables en esta determinación
REFERENCIAS BIBLIOGRAFICAS:
-
Apuntes de clase
-
Métodos oficiales de análisis (panreac)
Hierro en vino (Adición estándar)
Fundamento teorico
El fundamento teórico de esta determinación es exactamente el mismo que el de la otra determinación del hierro
principio del metodo
El método consiste en una espectroscopia de absorción atómica con distintos tratamientos sobre las muestras. Usando en ellas el método de adición estándar.
material y aparatos
-
Pipetas de 5ml graduadas y aforada de 25ml y 10ml
-
Matracez aforados de 25ml y 100ml
-
Espectrómetro de absorción atómica
-
Material general de laboratorio
-
Filtro
reactivos
-
HNO3 cc
-
Solución patrón de hierro 1000ppm
-
Solución madre de hierro 25ppm
procedimiento operatorio
-
Poner en cuatro matraces de 25ml, 10ml de vino en cada y añadir a cada matraz, 0, 1, 2, y 4ml de disolución madre de hierro.
-
Enrasar todos los matraces con agua destilada.
-
Medir , para construir la recta de calibrado e interpolar el valor obtenido con el hierro.
-
Realizar el mismo procedimiento pero añadiendo a la muestra 5ml de CaCl2 y 0.5ml de H3PO4.
-
Realizar la medida de las cenizas obtenidas de la mineralización
expresion de los resultados: Muestra Nº 8
Datos de la practica:
Cálculos
ppm = ppm0 · V0/V1
ppm = 1.7 · 25/10
ppm = concentración en mg/L de la muestra
ppm0 = concentración de la dilución en mg/L
V0 = Volumen de la dilución
V1 = Volumen de alícuota
Resultados
Observaciones:
-
Se utiliza cloruro de calcio y ácido fosfórico para eliminar las sustancias contenidas en la muestra que pueden interferir en la medida.
-
Se produjo un error en la preparación de los patrones. En el 3º patrón usado en el vino sin tratar, se echo el mismo volumen de patrón de hierro que en el segundo patrón.
referencias bibliograficas
-
Apuntes de clase
-
Métodos oficiales de análisis (panreac)
Sodio y potasio por espectroscopia de absorción atómica
Fundamento teorico
El sodio y el potasio son dos iones que se encuentran el vino, generalmente por la absorción de sales formadas por estos iones, del suelo en el que se cultiva la uva de la proviene el vino. Estos son metales que se encuentran en disolución en pequeñas concentraciones.
El sodio es un ion que se encuentra en una concentración de entre 20 y 200 ppm. Su presencia en el vino, puede pertenecer a dos, la primera, de forma narural. La segunda es su adición. Esta ultima se puede utilizar de forma ilegal, con fines enotécnicos.
El ion potasio es el más abundante de los cationes y su origen es, principalmente, vegetal y su concentración esta alrededor de 1g/l. Este ion destaca por su gran movilidad fisiológica y es fundamental en la osmosis celular.
principio del metodo
Esta determinación consiste en la determinación de los iones Na+ y K+ por espectroscopia de emisión atómica.
material y aparatos
-
Pipeta aforada de 5ml y 25ml
-
Matracez aforados de 50ml y 100ml
-
Espectrómetro de absorción atómica
-
Material general de laboratorio
reactivos
-
Lantano
-
Solución patrón de hierro 1000ppm
-
Solución madre de hierro 25ppm
procedimiento operatorio
-
Hacer una disolución madre de la mineralización y de la muestra de echando 5ml y diluyéndolo en 50ml
-
Poner 5ml de la disolución de la mineralización y de la muestra de vino, una en cada matraz de 50 y 100ml con 1ml y 2ml de lantano respectivamente.
-
Medir en el espectrómetro, por el método de emisión atómica.
expresion de los resultados: Muestra Nº 8
Datos de la practica:
Cálculos
ppm Na+ = ppm0 · 50/5 · 50/5
ppm Na+ = ppm0 · 100/5 · 50/5
ppm = concentración en mg/L de la muestra
ppm0 = Concentración obtenida en la determinación
Resultados
Observaciones:
-
Se utiliza el lantano para la eliminación de interferencias
referencias bibliograficas
-
Apuntes de clase
-
Métodos oficiales de análisis (panreac)
Azucares reductores
Fundamento teorico
Los azucares reductores pertenecen al grupo de los monosacáridos. El sabor lo pueden dar solo aquellas sustancias capaces de disolverse (no aquellas que se agrupan formando coloides), y el sabor dulce no es una cualidad exclusiva de los azucares. Su principal propiedad es la de ser una base, es materia prima en las reacciones metabólicas que tienen lugar en la fermentación.
Los vinos se clasifican, en cuanto a contenido en azucares, en: vinos secos (< 5g/L), abocados (entre 5 y 15 g/L), semisecos (entre 15 y 30g/L), semidulces (entre 30 y 50g/L) y dulces (> 50g/L).
Se llaman azucares reductores por el fundamento de la técnica utilizada para su análisis; Por la presencia de la función carbonilo, siempre en monosacáridos y, cuando se halle libre en policaridos, tienen propiedades reductora de características concretas. Estos azucares son las hexosas y pentosas.
principio del metodo
Este método consiste en la defecación plúmbica de una muestra para eliminar interferencias y la posterior valoración de sus azucares.
material y aparatos
-
Matraz aforado de 125ml
-
Filtro de pliegues
-
Embudo
-
Matraz de destilación de 250ml con fondo plano
-
Manta calefactora
-
Equipo de filtración a vació
-
Bureta
-
Material general de laboratorio
-
Refrigerador de bolas
reactivos
-
KMnO4 0.1N
-
Carbonato de calcio
-
Solución cúprica
-
Solución de Plomo II Acetato (aproximadamente saturada). Añadir a 250 g de Plomo II Acetato 3-hidrato caliente hasta 0,5 l y agitar hasta disolución completa.
-
Solución Cúprica A. Mezclar 40 g de Cobre II Sulfato 5-hidrato con 2 ml de Ácido Sulfúrico 96% y añadir Agua hasta 1 l.
-
Solución Tartrato-Alcalina B. Mezclar 200 g de Potasio Sodio Tartrato 4-hidrato con 150 g de Sodio Hidróxido lentejas 97% y añadir Agua hasta 1
-
Solución de F3+
-
H2SO4 6N
-
HOOC-COOH
-
Sosa 1N
procedimiento operatorio
-
En un matraz de 125ml echar 100ml de vino junto con (V-0.5)ml de NaOH 1N; siendo V el volumen de NaOH N/10 utilizado para valorar la acidez total de 10ml de vino.
-
Añadir 5ml de solución saturada de PbAc y 1g de CaCO3. Dejar 15 minutos reposar, y enrasar. Filtrar sobre un Erlenmeyer.
-
En matraz de destilación de fondo plano añadir 20ml de solución cúprica A, 20ml de solución de tartrato alcalina B, 20ml de filtrado. Calentar a reflujo durante 3 minutos y enfriar rápidamente evitando el choque térmico.
-
Filtrara a vacío con un filtro G3 y lavar el precipitado con agua hirviendo.
-
Disolver el oxido de cobre que queda en el matraz con 10ml de solución C de sulfato de hierro III y filtra. Repetir esta operación 3 veces.
-
Disolver los restos del precipitado del filtro con ayuda de una varilla
-
Lavar Erlenmeyer y filtro cinco veces con 20 ml de agua destilada
-
Valorar el liquido obtenido de la filtración con KMNO4 0.01N en presencia de ferroina hasta cambio de color de verde anaranjado a verde.
expresion de los resultados: Muestra Nº 8
Datos de la practica:
Cálculos
V · NKMnO4 = V1 · 0.1163
V · 0.1 = 7.1 · 0.1163
Resultados (Datos de la tabla del ANEXOI)
V = 8.25
Azúcar inv. (mg/L) = 26.1
Observaciones:
-
No hay incidencias reseñables
referencias bibliograficas
-
Apuntes de clase
-
Métodos oficiales de análisis (panreac
Grado alcohólico
Fundamento teorico (Titulo aerometrico)
El etanol es el segundo componente mas importante del vino. Se encuentra en una proporción de entre el 10 y el 15% en volumen o entre 80 y 120 g/L. Gran parte de su importancia proviene tanto de sus cualidades fisiológicas, como químicas y fisicoquímicas, y su imprescindible aportación microstatica en el desarrollo de microorganismos.
El etanol es, biológicamente, fruto del metabolismo de levaduras. Pero químicamente, proviene del etanal; este es un aldehído, producto intermedio de la fermentación.
Por cada 17 g/l. de azúcar se viene a formar, aproximadamente, un grado de alcohol. Además una de las funciones mas importante de este componentes es antiséptica, permitiendo la conservación del vino.
principio del metodo
Consiste en determinar el contenido den litro en alcohol contenido en 100L de vino mediante una destilación.
material y aparatos
-
Equipo de destilación
-
Probeta
-
Areómetro
reactivos
-
Ca(OH)2
procedimiento operatorio
-
Se miden 250ml de vino con un matraz aforado y se le añaden 20ml de lechada de Ca(OH)2
-
Se comienza a destilar por arrastre de vapor y se recogen en el mimo matraz limpio y seco aproximadamente 200ml de destilado
-
Se vierte el destilado en una probeta de 100ml y se mide con un areómetro.
expresion de los resultados: Muestra Nº 8
Datos de la practica:
Practica no realizada
Cálculos
Practica no realizada
Resultados (Datos de la tabla del ANEXO III)
Practica no realizada
Observaciones:
-
Practica no realizada
referencias bibliograficas
-
Apuntes de clase
-
Métodos oficiales de análisis (panreac)
-
http://www.infoagro.com/viticultura/vino/analisis_vinos.asp
Masa volumétrica y densidad relativa (método picnométrico)
Fundamento teorico (Titulo aerometrico)
La masa voletrica es el cociente de la masa de un cierto volumen de vino o de mosto por este volumen, Se expresa en g por ml y su símbolo es "20. La densidad relativa es el cociente de la masa voletrica del vino por la masa voletrica del agua. Su símbolo es d20 ó simplemente d, cuando no haya posibilidad de confusión. La masa voletrica y la densidad relativa de un vino se determinan a 20°C. El método picnométrico consiste en la determinación ponderal del contenido en alcohol de un destilado por medio de un picnómetro.
principio del metodo
Consiste en el calculo de la densidad relativa del vino con un picnómetro.
material y aparatos
-
Picnómetro
-
Balanza analítica
-
Material general de laboratorio
reactivos
-
No hay reactivos
procedimiento operatorio
-
Tomar una muestra de vino y desgasificarla.
-
Tarar un picnómetro perfectamente limpio y seco.
-
Llenar de agua y sumergir en agua a 20ºC
-
Dejarlo estabilizar 20 minutos y enrasar
-
Se tapa el picnómetro, se seca y se pesa
-
Se limpia bien y llena de vino, se deja estabilizar su temperatura 15 minutos
-
Se enrasa y se pesa
expresion de los resultados: Muestra Nº 8
Datos de la practica:
Practica no realizada
Cálculos
-
Densidad relativa
d20 = (P2 - P1)/ (P3 - P1)
d20= densidad relativa a 20 ºC.
P1= masa picnómetro vacío.
P2= masa picnómetro con agua.
P3= masa picnómetro con muestra
-
Masa volumétrica
"20 = 0.998203 x d20
Resultados (Datos de la tabla del ANEXO III)
Practica no realizada
Observaciones:
-
Practica no realizada
referencias bibliograficas
-
Apuntes de clase
-
Métodos oficiales de análisis (panreac)
-
http://www.infoagro.com/viticultura/vino/analisis_vinos.asp
Fluoruros
Fundamento teorico
El fluor es un ion que se encuentra en el vino forma de trazas formando sales. Al igual que todas las sales de este tipo, su concentración en el vino dependen de la concentración en esta sal que tiene el suelo en el que se crió la uva.
principio del metodo
Consiste en una determinación directa del contenido en fluor de una muestra de vino
material y aparatos
-
Material y aparatos.
-
pH-metro con escala que permita apreciar 0,1 mV.
-
Electrodo selectivo de flúor.
-
Electrodo de referencia de calomelanos.
-
Microbureta graduada en 1/100 de ml.
-
Pipetas de precisión graduadas
reactivos
-
Solución patrón de fluoruros
-
TISAB
procedimiento operatorio
-
Medir la conductividad del patrón de fluor y realizar una grafica. Con disoluciones de 19, 1.9 y 0.9ppm
-
En tres vaso poner 25ml de cada patrón y 5ml de tampón H3PO4 y medir. La diferencia entre el primer y segundo patrón es la pendiente
-
Tomar 25 ml de vino, adicionar 5 ml de la solución Tampón y determinar su potencial (E1).
-
Después, añadir 1 ml de disolución 0.9ppm de F - y determinar su potencial (E2). Si el salto de potencial es pequeño, indica que la concentración de F- es muy alta y hay que diluir la muestra hasta que el salto alcanzado esté se encuentre entre 20-40 mV. En función de estos factores se determinara el volumen de muestra y su dilución.
expresion de los resultados: Muestra NC 8
Datos de la practica:
Practica no realizada
Cálculos
CF mg/L = (V x C)/ 25 [(antilog " E/S) - 1
-
CF = Concentración en mg/L de F- en el medio.
-
V = Volumen en mL de la solución patrón de fluoruros añadida.
-
C = Concentración en mg/L de la solución patrón adicionada.
-
S = Pendiente del electrodo.
-
" E = Diferencia de los potenciales E1 y E2.
Resultados (Datos de la tabla del ANEXO III)
Practica no realizada
Observaciones:
-
Practica no realizada
referencias bibliograficas
-
Apuntes de clase
-
Métodos oficiales de análisis (panreac)
-
http://www.infoagro.com/viticultura/vino/analisis_vinos.asp
Mineralización
Fundamento teorico
El vino, debido a su componentes, al evaporarse el agua y todos sus componentes líquidos, se obtienen todos los compuestos, que en estado natural se encuentran en estado sólido y disueltos en vino.
Para conseguir esto, la muestra de vino se debe calentar a una temperatura tal, que lo que obtengamos, únicamente sean las cenizas de las sustancias que forman el extracto seco. Con esto lo que se consigue es que todas las sustancias en estado lico que son impurezas, se eliminen obteniéndose cenizas de compuestos, iones o elementos prácticamente puros.
principio del metodo
Esta determinación consiste en la evaporación y calcinación del vino en varias etapas para obtener el extracto seco.
material y aparatos
-
Pipeta aforada de 25ml
-
Cápsula de porcelana
-
Mufla
-
Baño de agua
-
Baño de arena
-
Estufa
-
Balanza analítica
reactivos
-
No se utilizan reactivos
procedimiento operatorio
-
Poner en una cápsula de porcelana, previamente tarada, 50 ml de muestra.
-
Calentar hasta sequedad en baño de agua entre 70 y 100ºC.
-
Calentar en la mufla a 500ºC durante 5 horas.
-
Añadir 10ml de agua. Se formaran dos fases bien diferenciadas.
-
Calentar en baño de arena hasta sequedad.
-
Poner la cápsula en la mufla a 400ºC hasta que las cenizas se vuelvan blancas. Dejar enfriar.
-
Pesar las cenizas.
-
Añadir 2ml de HNO3
-
Filtrar y lavar el precipitado
-
Enrasar en un matraz de 50ml
expresion de los resultados: Muestra Nº 8
Datos de la practica:
Cálculos
MC = M1 - M0
Resultados
MC = 50.9139 - 51.0569
MC = 0.1430g
Observaciones:
-
Durante la primera evaporación hubo que cambiar de cápsula, debido a que la primera tenia una fisura y se perdió parte de la muestra
referencias bibliograficas
-
Apuntes de clase
-
Métodos oficiales de análisis (panreac)
Cobre
Fundamento teorico
Junto con el hierro, el cobre es el mas comun de los componentes del cino que se agrupan en su composición mineral. Este metal suele presentarse en una proporción de unos 0.5ppm.
En el vino se produce un fenómeno llamado quiebra. Este fenómeno consiste en enturbiamientos de formación lenta, persistente y en forma de coloides. Asi es como se produce la quiebra cúprica, por la concentración de cobre superior a 0.5ppm y la existencia de sulfuroso libre.
principio del metodo
Este método consiste en la determinación de cobre por absorción atómica.
material y aparatos
-
Espectrómetro de absorción y emisión atómica
-
Material general de laboratorio
reactivos
-
No se utilizan reactivos
procedimiento operatorio
-
Medir los patrones de cobre de 1 3 y 4ppm
-
Se introduce finalmente la disolución de las cenizas en el espectrómetro y mide
expresion de los resultados: Muestra Nº 8
Datos de la practica:
Cálculos
Resultados
Ppm de Cu en cenizas = 0.1ppm
Observaciones:
-
No hay ninguna incidencia que resaltar en esta practica
referencias bibliograficas
-
Apuntes de clase
-
Métodos oficiales de análisis (panreac)
tabla general de resultados
| determinacion | resultado | limite minimo | limite MÁXIMO |
| Hierro (vino) | ppm | ppm | |
| Vino diluido | 4.5 | 6 | |
| Vino + Ca + P | 3.85 | ||
| Vino + Ca + P + etanol | 3 | ||
| Vino + P + etanol | 4 | ||
| Acidez total | g/L | g/L | |
| 5.1 | 5.6 | ||
| 5.3 | |||
| Acidez volátil | g/L | g/L | |
| Ácido acético | 0.06 | 1.20 | |
| Ácido tartárico | 0.82 | 0.4 | |
| Acidez fija | 4.28g/L | ||
| Cloruros | ppm Cl- | G/L | |
| Titrador | 45.2 | 1 | |
| Potenciometro | 43.8 | ||
| Nitrógeno | 0.34 g/L | ||
| Vino (adición estándar) | ppm | ppm | |
| Vino (SI) | 4.25 | 6 | |
| Vino | 4.00 | ||
| Vino (cenizas) | 4.50 | ||
| Na | ppm | ppm | |
| Vino | 20 | 200 | |
| Cenizas | 40 | 200 | |
| K | Ppm | Ppm | |
| Vino | 1200 | ||
| cenizas | 1100 | ||
| Azucares reductores | 26.1 mg | 15 mg | 30 mg |
| Grado alcohólico | No realizada | ||
| Masa volumétrica | No realizada | ||
| Fluoruros | No realizada | ||
| Mineralización | 0.1430g | <1g | |
| Cobre | 0.1ppm | 1ppm |
conclusiones
Tras el análisis de este vino se podría decir que en general, tiene una calidad aceptable; es un vino que en todos los parámetros medidos entra dentro de los parámetros esperados a excepcion de la acidez total, que se desvia del resulado esperado.
Este parámetro puede depender del tiempo que la muestra halla permanecido abierta. El vino es un producto propenso a coger acidez por la oxidación de sus azucares y esto convierte al parámetro correspondiente a la acidez, en un valor bastante voluble.
En función de los resultados, se considera la muestra apta para el consumo y con una calidad, que convierte este vino apto para ser dedicado para este fin
Anexo I (Tablas)
| KMn04 N/10ml | Azúcar invertido mg | KMn04 N/10ml | Azúcar invertido mg | KMn04 N/10ml | Azúcar invertido mg |
| 4,0 | 12,4 | 12,0 | 39,1 | 20,0 | 68,7 |
| 4,2 | 13,0 | 12,2 | 39,7 | 20,2 | 69,3 |
| 4,4 | 13,6 | 12,4 | 40,5 | 20,4 | 70,1 |
| 4,6 | 14,3 | 12,6 | 41,2 | 20,6 | 70,9 |
| 4,8 | 14,9 | 12,8 | 42,0 | 20,8 | 71,6 |
| 5,0 | 15,5 | 13,0 | 42,6 | 21,0 | 72,4 |
| 5,2 | 16,2 | 13,2 | 43,3 | 21,2 | 73,2 |
| 5,4 | 16,8 | 13,4 | 44,1 | 21,4 | 74,1 |
| 5,6 | 17,5 | 13,6 | 44,7 | 21,6 | 74,9 |
| 5,8 | 18,1 | 13,8 | 45,5 | 21,8 | 75,6 |
| 6,0 | 18,8 | 14,0 | 46,3 | 22,0 | 76,4 |
| 6,2 | 19,4 | 14,2 | 47,0 | 22,2 | 77,2 |
| 6,4 | 20,1 | 14,4 | 47,6 | 22,4 | 78,0 |
| 6,6 | 20,7 | 14,6 | 48,4 | 22,6 | 78,7 |
| 6,8 | 21,4 | 14,8 | 49,1 | 22,8 | 79,5 |
| 7,0 | 22,0 | 15,0 | 49,8 | 23,0 | 80,3 |
| 7,2 | 22,7 | 15,2 | 50,5 | 23,2 | 81,1 |
| 7,4 | 23,4 | 15,4 | 51,3 | 23,4 | 81,9 |
| 7,6 | 24,1 | 15,6 | 52,1 | 23,6 | 82,7 |
| 7,8 | 24,7 | 15,8 | 52,7 | 23,8 | 83,5 |
| 8,0 | 25,5 | 16,0 | 53,5 | 24,0 | 84,4 |
| 8,2 | 26,1 | 16,2 | 54,2 | 24,2 | 85,2 |
| 8,4 | 26,8 | 16,4 | 55,0 | 24,4 | 86,0 |
| 8,6 | 27,5 | 16,6 | 55,7 | 24,6 | 86,7 |
| 8,8 | 28,1 | 16,8 | 56,4 | 24,8 | 87,5 |
| 9,0 | 28,8 | 17,0 | 57,2 | 25,0 | 88,4 |
| 9,2 | 29,5 | 17,2 | 57,9 | 25,2 | 89,2 |
| 9,4 | 30,1 | 17,4 | 58,7 | 25,4 | 90,0 |
| 9,6 | 30,8 | 17,6 | 59,4 | 25,6 | 90,9 |
| 9,8 | 31,5 | 17,8 | 60,1 | 25,8 | 91,6 |
| 10,0 | 32,2 | 18,0 | 61,0 | 26,0 | 92,5 |
| 10,2 | 32,9 | 18,2 | 61,6 | 26,2 | 93,3 |
| 10,4 | 33,6 | 18,4 | 62,4 | 26,4 | 94,1 |
| 10,6 | 34,3 | 18,6 | 63,2 | 26,6 | 95,0 |
| 10,8 | 35,0 | 18,8 | 64,0 | 26,8 | 95,8 |
| 11,0 | 35,6 | 19,0 | 64,8 | 27,0 | 96,6 |
| 11,2 | 36,4 | 19,2 | 65,4 | 27,2 | 97,3 |
| 11,4 | 37,0 | 19,4 | 66,2 | 27,4 | 98,2 |
| 11,6 | 37,7 | 19,6 | 67,1 | 27,6 | 99,1 |
| 11,8 | 38,4 | 19,8 | 67,8 | 27,8 | 99,9 |
Anexo II (Factorización de disoluciones patrón)
Normalización de la sosa
-
Echar en un erlenmeyer 20ml de ftalato 0.1N
-
Valorar con la sosa 0.1N que queremos factorizar en presencia de unas gotas de fenolftaleina hasta viraje
| V1 | V2 | V3 | Vm |
| 20.2ml |
(V " N )sosa = (V " N )ftalato
20.1 " N = 20 " 0.1; N = 0.0990N; f=0.9900
Anexo III (Rectas de calibrado)
Cloruros:
Hierro:
Acidez:
BIBLIOGRAFÍA
-
http://www.enoforum.com/articulos/ver-articulo.asp?id=6
-
http://www.arrakis.es/~mruizh/l19.htm
-
http://www.librys.com/vino/
-
http://www.vegetarismus.ch/info/s17.htm
-
http://www.verema.com/opinamos/tribuna/articulos/acidos.asp
-
http://www.bodegasferca.com/acido_tartarico.html
-
http://www.aulafacil.com/Vino/Lecc-6.htm
-
Origen, Composición y evolución del vino (Ildefonso Mareca Cortes) (Alambra)
-
Química de los alimentos
Disolver 2,1027 g de Potasio Cloruro previamente desecado en 1L de agua.
Pesar 105mg de rojo de metilo y 150mg de verde de bromocresol y disolver a 100ml con etanol
Descargar
| Enviado por: | Víctor Manuel García Julián |
| Idioma: | castellano |
| País: | España |
