Química
Análisis de suelo y agua
Universidad Nacional de Río Cuarto
Facultad de Ciencias Exactas, Físico-Químicas y Naturales
Departamento de Química
Materia: Práctica Profesional
INFORME FINAL
ANÁLISIS DE SUELO Y AGUA
Río Cuarto, Años 2008-2009
Índice
Introducción ------------------------------------------------------------------------------------------------------- Pág. 3
Análisis de Suelo ---------------------------------------------------------------------------------------------- Pág. 4
Suelo --------------------------------------------------------------------------------------------------------------- Pág. 5
Toma de Muestras para Análisis de Suelo---------------------------------------------------------------- Pág. 6
¿Qué es un Análisis de Suelo?------------------------------------------------------------------------------ Pág. 9
Nitrógeno---------------------------------------------------------------------------------------------------------- Pág. 10
pH-----------------------------------------------------------------------------------------------Pág.13
Conductividad Eléctrica--------------------------------------------------------------------------------------- Pág. 16
Materia Orgánica----------------------------------------------------------------------------------------------- Pág. 18
Fósforo------------------------------------------------------------------------------------------------------------ Pág. 20
Azufre------------------------------------------------------------------------------------------------------------- Pág. 23
Resultados obtenidos en las muestras analizadas de Suelo--------------------------------------- Pág. 25
Análisis de Agua--------------------------------------------------------------------------------------------- Pág. 27
Agua-------------------------------------------------------------------------------------------------------------- Pág. 28
Toma de Muestra para Análisis de Agua--------------------------------------------------------------- Pág. 30
pH----------------------------------------------------------------------------------------------------------------- Pág. 31
Conductividad Eléctrica------------------------------------------------------------------------------------- Pág. 32
Alcalinidad------------------------------------------------------------------------------------------------------ Pág. 33
Dureza----------------------------------------------------------------------------------------------------------- Pág. 34
Cloruros--------------------------------------------------------------------------------------------------------- Pág. 36
Arsénico--------------------------------------------------------------------------------------------------------- Pág. 37
Sulfato----------------------------------------------------------------------------------------------------------- Pág. 38
Sodio y Potasio----------------------------------------------------------------------------------------------- Pág. 40
Resultados obtenidos en las muestras analizadas de Agua-------------------------------------- Pág. 41
Conclusión----------------------------------------------------------------------------------------------------- Pág. 42
Introducción
En el presente informe, se podrán observar los pasos que deben seguirse y los requerimientos necesarios para la toma de muestras a analizar, como así también el tratamiento que a estas se les provee cuando ingresan al laboratorio. Podrán apreciarse, técnicas, funcionamiento de los instrumentos que se utilizan para las determinaciones y los resultados obtenidos.
Con respecto a los objetivos propuestos son:
• Obtener experiencia en la determinación de análisis químicos de suelo y agua.
• Realizar determinaciones químicas, cuyos resultados orienten sobre la fertilidad química de los suelos y que sea una herramienta básica para Ingeniero/a Agrónomo/a. Ya que permite fijar pautas sobre la producción de los distintos cultivos.
ANÁLISIS DE SUELO

Suelo
Los suelos se forman por la combinación de cinco factores interactivos: material parental, clima, topografía, organismos vivos y tiempo.
Los suelos constan de cuatro grandes componentes: materia mineral, materia orgánica, agua y aire; la composición volumétrica aproximada es de 45, 5, 25 y 25%, respectivamente.
Los constituyentes minerales (inorgánicos) de los suelos normalmente están compuestos de pequeños fragmentos de roca y minerales de varias clases. Las cuatro clases más importantes de partículas inorgánicas son: grava, arena, limo y arcilla.
La materia orgánica del suelo representa la acumulación de las plantas destruidas y presintetizadas parcialmente y de los residuos animales. La materia orgánica del suelo se divide en dos grandes grupos:
Los tejidos originales y sus equivalentes más o menos descompuestos.
El humus, que es considerado como el producto final de descomposición de la materia orgánica.
Para darse una idea general de la importancia que tiene el agua para el suelo es necesario resaltar los siguientes conceptos:
El agua es retenida dentro de los poros con grados variables de intensidad, según la cantidad de agua presente.
Junto con sus sales disueltas, el agua del suelo forma la llamada solución del suelo; ésta es esencial para abastecer de nutrimentos a las plantas que en él se desarrollan.
El aire del suelo no es continuo y está localizado en los poros separados por los sólidos. Este aire tiene generalmente una humedad más alta que la de la atmósfera. Cuando es óptima, su humedad relativa está próxima a 100%. El contenido de CO2 es por lo general más alto y el del O2 más bajo que los hallados en la atmósfera.
La arcilla y el humus son el sostén de la actividad del suelo; estos constituyentes existen en el llamado estado coloidal. Las propiedades químicas y físicas de los suelos son controladas, en gran parte, por la arcilla y el humus, las que actúan como centros de actividad a cuyo alrededor ocurren reacciones químicas y cambios nutritivos.
El suelo es considerado como uno de los recursos naturales más importantes, de ahí la necesidad de mantener su productividad, para que a través de él y las prácticas agrícolas adecuadas se establezca un equilibrio entre la producción de alimentos y el acelerado incremento del índice demográfico.
El suelo es esencial para la vida, como lo es el aire y el agua, y cuando es utilizado de manera prudente puede ser considerado como un recurso renovable. Es un elemento de enlace entre los factores bióticos y abióticos y se le considera un hábitat para el desarrollo de las plantas.
El suelo ofrece un soporte para la producción vegetal y proporciona indirectamente la energía térmica necesaria para el cumplimiento de los procesos vegetales, lo mismo que el agua y la atmósfera necesaria para la respiración mediante la provisión de O2. Además provee los nutrientes indispensables para el crecimiento vegetal. La mayor parte del tejido vegetal se origina de compuestos simples, como CO2 de la atmósfera y agua del suelo.
Gracias al soporte que constituye el suelo es posible la producción de los recursos naturales, por lo cual es necesario comprender las características físicas y químicas para propiciar la productividad y el equilibrio ambiental (sustentabilidad).
Toma de Muestras para Análisis de Suelo
El muestreo del suelo, es un aspecto de suma importancia, ya que de él depende que los resultados del análisis posterior sean confiables y esto dependerá de cómo haya sido tomada la muestra. En la medida que más representativa sea la muestra, más exactos serán los resultados.
Algunas recomendaciones para la toma de muestras:
-
Dividir el lote en áreas homogéneas en cuanto a posición en el relieve, color, uso anterior, tipo de suelo.
-
Evitar hacer un muestreo cerca de alambrados, caminos, aguadas u otros lugares donde se agrupe la hacienda, galpones, monte, zonas donde se fertilizó recientemente y áreas de mal drenaje.
-
Cuanto más chicas las superficies de muestreo, mayor representatividad (25-50 has.).
-
Utilizar muestras simples, es decir una sola extracción por suelo, en el caso de suelos muy homogéneos.
-
Utilizar muestras compuestas, obtenidas por la extracción de varias submuestras (15 a 20), lo ideal son 30 o 40, las cuales se juntan en un recipiente de plástico, se mezclan y se extraen 500 gr a 1 Kg de suelo.
-
Utilizar para la extracción pala o barreno.
-
Tomar las muestras lo más cerca posible de la época de siembra.
-
La frecuencia de muestreo es anual en el caso de los nutrientes móviles y cada 2 o 3 años en el caso de los no móviles.
-
Colocar la muestra en una bolsa de plástico limpia y cerrada, rotulada con nombre del propietario, ubicación, profundidad, fecha, establecimiento.
-
Se recomienda trabajar siempre con el mismo laboratorio, para poder comparar los resultados a lo largo del tiempo.
Toma de muestra:
Existen diferentes formas de recorrer un lote con el objetivo de obtener una muestra representativa. La más sencilla consiste en recorrer un lote al azar (Figura 1.a), recolectando submuestras que luego son mezcladas para formar una muestra compuesta que es enviada al laboratorio. El inconveniente de este tipo de muestreo es que frecuentemente no se tiene en cuenta la variabilidad existente en cabeceras y sectores no homogéneos del lote. Otro plan de muestre consiste en dividir el campo en subunidades homogéneas ( loma, bajo), dentro de las cuales se toman muestras compuestas al azar, evitando cabeceras y cualquier desuniformidad que pueda aparecer en el lote como sectores engramonados o rodeos de suelo de menor calidad “suelos overos”. Este tipo de muestreo es conocido como muestreo al azar estratificado (Figura 1.b). Una variante es el muestreo en áreas de referencia (Figura 1.c), que consiste en hacer un muestreo intenso en un sector homogéneo del lote, que se asume representativo del lote completo. Estos dos últimos tipos de muestreos son los más recomendables para hacer recomendaciones de fertilización a campo, cuando no se realizara una aplicación variable de fertilizantes. El tipo más intensivo de muestreo es el muestreo en grilla (Figura1.d). En él, las muestras son tomadas a intervalos regulares en todas las direcciones, analizándose por separado. Es muy preciso y refleja la variabilidad del lote, pero no siempre el retorno económico derivado de una mejor fertilización alcanza para justificar el costo de este tipo de muestreo.
Una vez determinada la forma de recorrer el lote, se procede a tomar las submuestras, limpiando la superficie de las mismas y depositándolas en un balde. Luego de tener todas las submuestras (de 15 a 20 por ha), en el balde se mezclan homogéneamente y se toma 0,5 - 1 Kg aproximadamente. Esta es la muestra compuesta requerida para el análisis.
En cuanto a la profundidad de muestreo, queda determinada por el nutriente o propiedad del suelo que se pretende cuantificar. Así, la materia orgánica (MO), fósforo (P) y pH se miden habitualmente en la capa superficial (0 - 20 cm) ya que es la profundidad donde ejercen mayor influencia.
Para el caso de los nutrientes móviles se extiende a los 30 o 40 cm. (Azufre, Nitratos).
El proceso de muestreo se ilustra en las figuras siguientes.
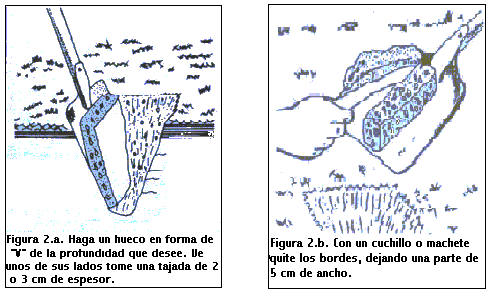
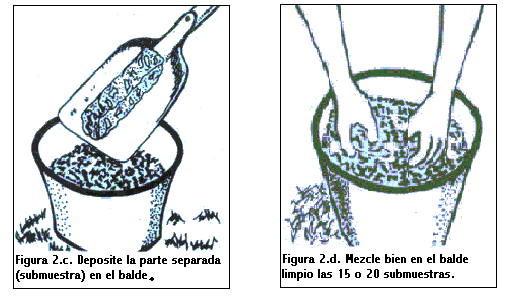
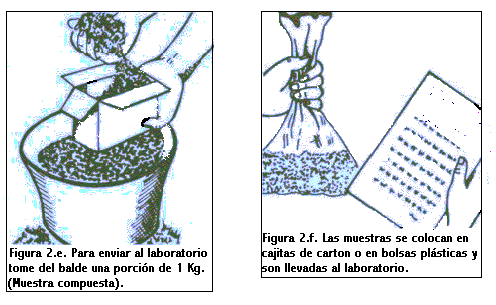
¿Qué es un Análisis de Suelo?
El análisis de suelo, es un conjunto de medidas químicas y físicas realizadas sobre una muestra de suelo. Realizado antes de la siembra, nos permite conocer con que nivel de nutrientes contara el cultivo; una vez sembrado, nos habla de la reserva de nutrientes. Un análisis de suelo, es una herramienta básica, pero de un gran valor a la hora de realizar la fertilización. También permite al agricultor o Ingeniero/a Agrónomo/a:
-
Determinar el nivel de nutrientes del suelo (deficiencia, buena o mala provisión).
-
Seguir el estado de fertilidad del suelo a través de los años.
-
Disminuir las deficiencias de fertilidad del suelo.
-
Conocer la aptitud del suelo, determinando limitantes y potenciales.
Manejo de la muestra en el Laboratorio
Llegada la muestra con su humedad al laboratorio, si los análisis que requiere son los antes mencionados, el primer análisis a realizar es el de nitratos ya que se realiza sobre la muestra húmeda. Luego se pesa una porción de suelo húmedo (20 o 30 gr) y se la coloca en la estufa a 105 °C a secar, para determinar la humedad. Otra porción de la muestra es colocada en bandeja de plástico, con sus datos y nombre de cliente y se deja secar. Esta será utilizada para determinar: materia orgánica, fósforo, sulfato, pH y conductividad eléctrica.
Nitrógeno
Las plantas obtienen el nitrógeno principalmente del suelo, donde se encuentra bajo la forma orgánica, la que no es disponible inmediatamente para la planta, sino después de un proceso de mineralización llevada a cabo por los microorganismos del suelo, el cual procede en la dirección siguiente: nitrógeno orgánico, amonio, nitrito, nitrato; la cantidad de nitrato producida finalmente depende de la disponibilidad del material en descomposición. Si la relación carbono: nitrógeno (C/N) es alta aparece muy poco o casi nada de nitrógeno como nitrato.
El nitrógeno disponible en el suelo se encuentra principalmente como nitrato. La capa arable del suelo puede tener un contenido de nitrógeno bajo la forma de nitrato entre 2 a 60 ppm. Este contenido de nitrato varía con la estación, ya que es muy soluble en agua y las aguas de lluvia o riego lo pueden arrastrar hacia el subsuelo. Las plantas pueden absorber el nitrógeno también bajo la forma de ión amonio. El nitrógeno absorbido como nitrato es rápidamente reducido a ión nitrito mediante la acción de la enzima nitrato reductasa que contiene molibdeno (Mo). La transformación del nitrato a ión amonio es catalizada por la enzima nitrito reductasa.
La principal diferencia entre el nitrógeno en forma de nitrato y amonio, es que todo el nitrato del suelo se encuentra disuelto en la solución del suelo, mientras que si el suelo contiene mucha arcilla y humus, gran parte del ión amonio se encuentra como catión intercambiable y no en solución. Quizás por esta razón un fertilizante en forma de nitrato actúa mucho más rápido que uno en forma de amonio.
Ciertas plantas pertenecientes a la familia de las leguminosas tienen la capacidad de asimilar el nitrógeno atmosférico, por las raíces al formar una asociación simbiótica con bacterias del género Rhizobium.
Es un importante elemento constituyente de la clorofila, protoplasma, proteínas y ácidos nucleicos. Tiene un papel importante en el proceso de fotosíntesis. La falta de nitrógeno y clorofila significa que el cultivo no utilizará la luz del sol como fuente de energía para llevar a cabo funciones esenciales como la absorción de nutrientes. El nitrógeno es también un componente de las vitaminas. Aumenta el crecimiento y desarrollo de todos los tejidos vivos, mejorando la calidad de los vegetales y forrajes de mucha hoja, así como el contenido proteico de los cereales.
Técnica para la determinación de nitratos (NO3-)
El cadmio metálico reduce a nitritos los nitratos de la muestra. El ion nitrito reacciona en medio ácido con el ácido sulfanílico para formar una sal intermedia de diazonio. Esta sal se une al ácido gentísico para formar un producto de color ámbar, al que se le medirá la absorbancia con un espectrofotómetro.
Espectrofotómetro utilizado
Es un espectrofotómetro marca HACH modelo DR / 2000. Tiene la particularidad de que todas las determinaciones que se realicen en este instrumento, se debe utilizar un volumen de 25 ml. A demás, cuenta con una memoria donde se graban las curvas de calibración para las distintas determinaciones, lo cual no hace falta de cálculos manuales, ni del uso de otros programas para obtener la concentración del analito que se esta determinando.
Este espectrofotómetro fue utilizado para las determinaciones de: nitratos en suelo, sulfatos en agua y suelo y fósforo en suelo.
Esquema de un Espectrofotómetro
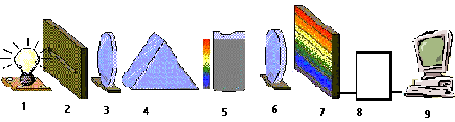
1) Lámpara, 2) Rejilla, 3) Lentes, 4) Prisma, 5) Celda, 6) Lente de enfoque, 7) Detector, 8) Amplificador, 9) Lectura.
Procedimiento:
La determinación se realiza sobre la muestra de suelo húmeda (humedad propia).
Pesar 20 gr de suelo húmedo en un erlenmeyer de 125 ml, adicionar 1 gr de sulfato de calcio di hidratado (CaSO4.2H2O), 40 ml de agua destilada y agitar durante 1 min. Luego filtrar con un papel de filtro adecuado (Double Rings 102 cualitativo), tomar 25 ml del filtrado y colocarlo en la celda de medición. Si se presenta turbidez en el filtrado, filtrar nuevamente hasta que desaparezca.
En el fotómetro:
Ingresar el número de programa para nitrógeno de nitrato (N-NO3-). Presionar: 355. La pantalla mostrará: fijar a 500 nm.
Girar la perilla de longitud de onda hasta que la pantalla pequeña muestre 500 nm. Fijada la longitud de onda, la pantalla mostrará: muestra cero luego mg/L N-NO3-.
Tomar los 25 ml de filtrado que se encuentran en la celda de medición y agregar el contenido de una bolsa de reactivo en polvo de nitrato (Nitra Ver 5) y tapar. Nota: Si la muestra es única, el paso 3 deberá omitirse. El reactivo en polvo contiene cadmio metálico, Ácido Gentisico, Sulfato de Magnesio, Ácido Sulfanilico y fosfato Monobásico de Potasio.
Presionar: SHIFT TIMER. Agitar la celda hasta que el cronómetro suene en un minuto. Nota: Si la muestra es única deje pasar el tiempo y haga lo mismo en 5.
Cuando suene el cronómetro, presionar: SHIFT TIMER comenzará un periodo de reacción de 5 minutos sin agitación. Nota: si hay nitratos, se desarrollara un color ámbar.
Llenar otra celda de medición con 25 ml de muestra (blanco). Nota: Si la muestra es única, este paso se realizara con la muestra misma.
Cuando suene el cronómetro, la pantalla mostrará: mg/L N-NO3-. Colocar el blanco en el soporte de la celda. Cerrar el escudo para la luz.
Presione ZERO la pantalla mostrará: Puesta en cero luego: 0,0 mg/L N-NO3-. Nota: Si la muestra es única, realizar el paso 3 luego agite 1 min y dejar reaccionar 5 min después del paso 8.
Quitar el tapón. Colocar la muestra preparada en el soporte de la celda. Cerrar el escudo para la luz. Nota: Quedara un deposito de cadmio después de disolver el polvo de reactivo Nitra Ver 5 y no afectará el resultado.
Presionar: READ. La pantalla mostrara: Leyendo..., luego se visualizará el resultado en mg/L de nitrógeno de nitrato (N-NO3-).
Cálculos:
ppm N-NO3- = mg/L N-NO3- x [40 / (20 - gr agua)]
gr agua son los evaporados a 105 °C (humedad del suelo), mg/L N-NO3- son los ppm medidos, 40 es el volumen del filtrado, 20 son los gramos de suelo húmedo y ppm N-NO3- son los mg de nitrógeno de nitrato en 1000 gr de suelo seco.
ppm NO3- = ppm N-NO3- x 4,428
ppm N-NO3- son los mg de nitrógeno de nitrato en 1000 gr de suelo seco, 4,428 es un factor que surge de dividir los pesos moleculares en gramos del ion nitrato sobre el de nitrógeno. Y ppm NO3- son los mg de nitratos en 1000 gr de suelo seco.
pH
El pH típicamente va de 0 (ácido) a 14 (básico) en disolución acuosa, e indica la acidez o la alcalinidad de una solución.
Las letras pH son una abreviación de "pondus hydrogenii", traducido como potencial de hidrógeno, y fueron propuestas por Sorensen en 1909, que las introdujo para referirse a concentraciones muy pequeñas de iones hidrógeno. Sorensen, por tanto, fue el creador del concepto de pH, que se define como el logaritmo negativo de la actividad de los iones hidrógeno en una solución:
pH = -log [H+]
A 25 ºC, el producto iónico del agua pura es K w = [H+][OH-] = 10-14, por lo tanto:
log Kw = log [H+] + log [OH-]
-14 = log [H+] + log [OH-]
14 = -log [H+] - log [OH-]
pH + pOH = 14
Con lo que en un medio neutro [H+] = [OH-] =10-7. Un medio ácido será aquel en el que [H+] > [OH-] y uno básico aquel en el que [H+] < [OH-]. Es decir, en una solución ácida [H+] >10-7 y pH < 7, en una neutra [H+] = 10-7 y pH = 7 y en una básica [H+] < 10-7 y pH > 7.
El pH del suelo es importante porque las plantas sólo pueden absorber los minerales disueltos en el agua, mientras que la variación del pH modifica el grado de solubilidad de los minerales. Por ejemplo, el aluminio y el manganeso son más solubles en el agua a un pH bajo, y cuando esto ocurre, pueden ser absorbidos por las raíces, siendo tóxicos a ciertas concentraciones. Por el contrario, determinadas sales minerales que son esenciales para el desarrollo de las plantas, tal como el fosfato de calcio, son menos solubles a un pH alto, lo que hace que estén menos disponibles para ser absorbidos y nutrir las plantas.
También el pH del suelo afecta al proceso de lixiviación de las sustancias nutritivas para las plantas. Un suelo ácido tiene una capacidad menor de retención catiónica porque los iones hidrógeno desplazan a los cationes como el de potasio y el de magnesio los cuales son posteriormente lavados del suelo, disminuyendo la riqueza de nutrientes disponibles. Por el contrario, en un suelo de pH neutro o básico los iones de Ca+2, Na+ y K+ reemplazan a los H+.
El rango optimo del pH del suelo para el crecimiento de la mayor parte de los vegetales es de 6 a 7 porque la mayor parte de las sustancias nutritivas de las plantas están disponibles en este intervalo. En algunos suelos, incluso con un pH natural de 8, pueden obtenerse buenos rendimientos agropecuarios. Sin embargo, a partir de tal umbral las producciones de los cultivos pueden mermar.
El pH del suelo influye en el desarrollo de las plantas y a su vez el pH del suelo es afectado por los vegetales y otros organismos. Por ejemplo, el intercambio catiónico realizado por las raíces de las plantas reduce el valor del pH, la descomposición del humus produce productos que pueden aumentar o disminuir el pH y la respiración celular de los organismos edáficos que producen CO2 que pasa a H2CO3 generando H+ y una posterior disminución del pH.
La propiedad química más importante en un suelo destinado a cultivos, quizás sea la actividad de los iones hidrógeno. La actividad de otros iones nutrientes depende del pH.
Los factores que afectan la medida de pH son:
-
Contenido de agua o relación suelo / agua: cuanto más diluida es la suspensión, mayor es el pH medido sea el suelo ácido o alcalino.
-
Desecación de la muestra: si la medición se hace en suspensiones obtenidas con suelo seco al aire, el pH es diferente al obtenido con muestra que conserva la humedad natural.
-
Sales solubles: el pH de la suspensión disminuye a medida que aumenta la concentración de sales nutras como NaCl o CaSO4.
-
Presión de CO2: el aumento de la concentración de gas, hace disminuir el pH. Por lo tanto deben especificarse las condiciones experimentales y ambientales en que se realiza la determinación.
Técnica para la determinación del pH
La técnica consiste en una potenciometría ion-selectiva con un electrodo de vidrio.
Un electrodo de pH es un tubo lo suficientemente pequeño como para poder ser introducido en un recipiente normal. Está unido a un pH-metro por medio de un cable. Un tipo especial de fluido se coloca dentro del electrodo; este es normalmente “cloruro de potasio 3M”. Algunos electrodos contienen un gel que tiene las mismas propiedades que el fluido 3M. En el fluido hay un alambre de plata. El sistema es bastante frágil, porque contiene un sensor. El censor es una membrana que internamente contiene HCl de actividad constante, en contacto con un electrodo interno de Ag,AgCl. Cuando se expone a la solución estándar o problema, se hidrata e intercambia iones Na+ por H+ para formar una capa superficial de iones H+. Esta, junto a puntos fijos de silicatos cargados negativamente, produce un potencial en la interfase vidrio-solución, que es una función de la actividad del ión H+ y cuando esto haya sido determinado el pH aparecerá digitalmente en el pH-metro. El potencial depende de la temperatura de la solución. Es por eso que el pH-metro también muestra la temperatura.
Esquema de un electrodo combinado para medir pH.
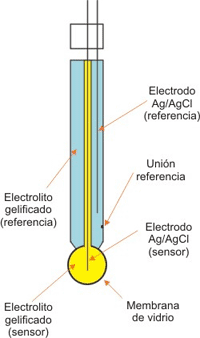
Procedimiento:
Para la determinación se utiliza una relación suelo / agua de 1 / 2,5.
Pesar 10 gr. de suelo seco en un vaso de precipitados y agregar 25 ml de agua destilada, agitar con una varilla de vidrio hasta lograr una suspensión de las partículas. Dejar reposar 30 min, pasado este tiempo, agitar nuevamente e inmediatamente medir el pH.
Valoración de los suelos de acuerdo a su pH
-
Muy ácido pH < 5,5
-
Ácido pH 5,6 - 6,9
-
Neutro pH 7 - 7,5
-
Alcalino pH 7,6 - 8,5
-
Muy alcalino pH > 8,6
Conductividad Eléctrica
Se basa en la propiedad que tienen los iones disuelto en agua de conducir la corriente eléctrica o de ofrecer resistencia al paso de esta en proporción a la cantidad de sales disueltas.
Cuando un suelo tiene un exceso de sales solubles se le denomina suelo salino. La medida de la conductividad eléctrica (CE) del suelo y de las aguas de riego permite estimar en forma casi cuantitativa la cantidad de sales que contiene. El análisis de la CE en suelos se hace para establecer si las sales solubles se encuentran en cantidades suficientes como para afectar la germinación normal de las semillas, el crecimiento de las plantas o la absorción de agua por parte de las mismas.
Las sales solubles que se encuentran en los suelos, están formadas principalmente por los cationes Na+, Ca2+ y Mg2+ asociados con los aniones Cl-, SO42-, NO3- y HCO3-.
La CE de una solución se mide a través de la resistencia que ofrece el paso de la corriente en la solución que se encuentra entre los dos electrodos paralelos de la celda de conductividad al sumergirla en la solución.
La conductividad se informa a 25 0C.
El instrumento utilizado tiene como fundamento a un puente de Wheatstone. Consta de cuatro resistencias, R1 y R2 que son conocidas, Rv que se una resistencia variable y Rx que es la resistencia que proporciona la solución del suelo.
Mediante Rv lo que se debe lograr es que A y B estén al mismo potencial, lo cual se sabe de acuerdo al instrumento detector que se utilice: si es un galvanómetro, la aguja no acusa paso de corriente.
Puente de Wheatstone. Conductímetro
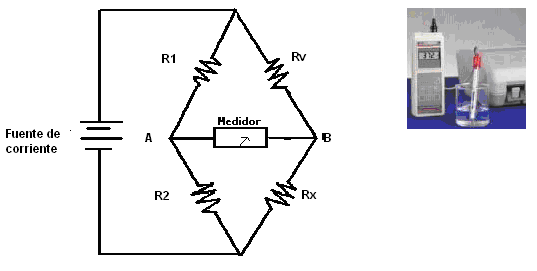
Los instrumentos traen escalas graduadas en unidades de resistencia (homs) o de conductividad Siemens/cm (S/cm).
Los equipos para medir la conductividad funcionan sobre la base del puente de Wheatstone, no obstante en muchos casos no se usa la resistencia variable y un componente mecánico o electrónico mide directamente la resistencia o conductividad de la solución basándose en el desequilibrio eléctrico producido.
Debido a que la conductividad se expresas en S/cm, y como los electrodos utilizados no siempre tienen 1cm2 de área y la distancia que los separa no es exactamente 1cm, es necesario hallar un factor llamado “constante de celda” por el cual han de multiplicarse las lecturas obtenidas para hallar la conductividad.
R= ρ(d/A) por lo tanto C= 1/R = A/ρd entonces C= kβ donde k= A/d y β= 1/ρ
R: resistencia de la solución al paso de la corriente eléctrica.
ρ: resistencia específica.
d: distancia entre los electrodos.
A: área de los electrodos.
C: conductividad.
k: constante de celda.
β: conductividad específica.
Procedimiento:
Se utiliza una relación de suelo / agua de 1 / 2.
Pesar 10 gr de suelo seco y agregar 20 ml de agua destilada, agitar con una varilla de vidrio hasta lograr una suspensión de las partículas. Dejar reposar 30 min. Pasado este tiempo, agitar nuevamente e inmediatamente medir la CE.
Valoración de la conductividad eléctrica de los suelos
| CE (ms/cm) | Valoración |
| 0,0 - 0,5 | Normal |
| 0,5 - 1,0 | Lig. alta |
| 1,0 - 2,0 | Alta |
| 2,0 - 4,0 | Muy alta |
Materia Orgánica
Se puede definir materia orgánica (MO) en sentido amplio y en sentido estricto. En el primer caso son todos los compuestos de origen biológico que hay en el suelo, independiente del grado de alteración de los mismos.
En sentido estricto son todos los compuestos de descomposición y resíntesis de la materia orgánica incorporada al suelo, de estructura diferente al material original y de una estabilidad frente a la descomposición mayor que los demás compuestos orgánicos del suelo (sustancias húmicas).
La materia orgánica, influye mucho sobre las propiedades del suelo, tanto físicas, físico-químicas y químicas. Algunas de ellas son:
Bajos contenidos de materia orgánica y predominio de limos y/o arenas muy finas determinan susceptibilidad de los suelos al “sellado” o “encostramiento”, disminuyendo las velocidades iniciales de infiltración de agua al suelo.
La materia orgánica tiene un efecto directo sobre la capacidad de retención de agua, ya que al ser un coloide hidrófilo es capaz de retener del 80 al 90 % de su peso en agua y un efecto indirecto, ya que modifica la porosidad del suelo, incrementando la proporción de los que almacenan agua.
En periodos cortos de tiempo, si se producen grandes adiciones de materia orgánica puede provocar altas concentraciones de CO2, con disminución del tenor de O2.
El color oscuro de la materia orgánica húmeda provoca una absorción de energía radiante provocando que el suelo se caliente.
En suelos con bajo contenido de coloide mineral, la materia orgánica es la principal responsable del intercambio cationico de los suelos.
Aumenta la capacidad buffer del suelo ya que se ionizan distintos grupos según el pH del suelo, evitando cambios bruscos del mismo. Esta propiedad se debe a la presencia en la materia orgánica de diferentes grupos funcionales, así a valores de pH entre 5 - 6 se ionizan grupos carboxilos, pH 7 - 9 oxhidrilos fenólicos y entre 9 - 10 oxhidrilos alcohólicos.
Puede haber disminución del pH del suelo cuando la mineralización es muy activa, debido a la generación de grandes cantidades de CO2.
El 98% del N, del 20 al 50% del P y del 60 - 70% del S, están bajo formas orgánicas. El aporte que la materia orgánica hace de estos nutrientes es función de su cantidad y evolución.
La materia orgánica puede afectar la disponibilidad de micronutrientes por la capacidad de formar quelatos con éstos Cu, Fe, Mn, Zn, etc. La constante de estabilidad de estos compuestos es alta con Cu y baja con Fe y Mn, lo que permite una lenta liberación de los mismos.
Técnica para la determinación de Materia Orgánica (Walkley-Black)
Los métodos más exactos de determinación de C, implican la combustión con evolución de CO2, pesada, etc. Los métodos aproximados más rápidos para determinar materia orgánica del suelo, se basan en la oxidación de la materia orgánica mediante un agente oxidante añadido en exceso al suelo, con la subsiguiente valoración redox o determinación colorimétrica del exceso de agente oxidante.
El método de Walkley-Black, utiliza una calefacción menos intensa, permite diferenciar en gran parte, la materia que integra el humus del suelo de las fuentes extrañas de C orgánico, tales como el grafito y el carbón vegetal. Mientras los otros métodos de combustión por vía seca incluyen todo el C elemental, el método de Walkley-Black excluye de un 90 a un 95 % del mismo.
Reacción entre Cr2O7-2 en medio ácido y C orgánico:
2 (Cr2O7-2 + 14 H+ + 6 e- 2 Cr+3 + 7 H2O)
3 (C + 2 H2O CO2 + 4 H+ + 4e-)
2 Cr2O7-2 + 3 C + 16 H+ 4 Cr+3 + 8 H2O + 3 CO2
Reacción entre Cr2O7-2 no consumido (exceso) y Fe+2:
Cr2O7-2 + 14 H+ + 6 e- 2 Cr+3 + 7 H2O
6 (Fe+2 Fe+3 + 1e-)
Cr2O7-2 + 14 H+ + 6 Fe+2 2 Cr+3 + 7 H2O + 6 Fe+3
Reactivos:
Dicromato de potasio (K2Cr2O7), 1 N. Se disuelven en agua destilada 49,04 gr exactos de la sal, y se diluye hasta un litro.
Ácido sulfúrico (H2SO4) concentrado.
Indicador ácido N-fenilantramílico. Se disuelve 0,2 g del indicador en 100 ml de una solución al 0,2% de Na2CO3.
Sulfato ferroso amónico Fe(NH4)2(SO4)2.6H2O o sal de Mohr, 0,1 N. Se disuelven 39,22 gr de la sal en 800 ml que contengan 4 ml de ácido sulfúrico concentrado. Llevar a un litro.
Procedimiento:
La determinación se realiza sobre la muestra seca, para esto se coloca la muestra en bandejas de plástico y se dejan secar al aire.
Tamizar la muestra por un tamiz de malla de 0,5 o 1,0 mm. Pesar 0,5 gr de suelo e introducirlo en un erlenmeyer de 250 ml.
A continuación, añadir mediante pipeta de doble aforo, 5 ml exactamente medidos de K2Cr2O7 1 N, realizando leves movimientos de giro para lograr intimo contacto entre el suelo y la solución. Añadir por las paredes y lentamente 10 ml de H2SO4 c.c y continuar mezclando suavemente durante un minuto. Dejar la muestra en reposo durante 30 min. Simultáneamente realizar un blanco (sin suelo) de la misma forma.
Valoración por retroceso: diluir la disolución agregando 85 ml de agua destilada (volumen total de100 ml). Tomar una alícuota de 20 ml a un erlenmeyer de 125 ml y agregar 40 ml de agua destilada, 2 ml de H2SO4 c.c y 4 gotas del indicador N-fenilantramílico y mezclar.
Valorar esta disolución y el blanco con sal de Mohr 0,1 N, procedente de una bureta, hasta viraje de rojo a verde brillante.
Cálculos:
%MO= ml de K2Cr2O7 x (1 - T/S) x 1,34
S: ml de la sal de Mohr gastados en la valoración del blanco.
T: ml de la sal de Mohr gastados en la valoración de la muestra.
Fósforo
El fósforo se encuentra en el suelo casi exclusivamente como ortofosfato y todos los compuestos son derivados del ácido fosfórico (H3PO4) u ortofosforico. Los fosfatos en el suelo se pueden dividir en dos grandes grupos: inorgánicos y orgánicos. Los inorgánicos se encuentra bajo varias formas (H2PO4-, HPO4-2, PO4-3) las cuales dependen del pH y los iones H+ se reemplazan por cationes formando sales.
Los orgánicos se encuentran en la materia orgánica como fosfolipidos, acidos nucleicos, fosfatos metabólicos, fosfoproteinas y fosfatos de inositol.
El fósforo es uno de los nutrientes esenciales para el crecimiento de las plantas. Sus funciones no pueden ser ejecutadas por ningún otro nutriente y se requiere un adecuado suplemento de fósforo para que la planta crezca y se reproduzca en forma óptima. El fósforo se clasifica como un nutriente primario, razón por la cual es comúnmente deficiente en la producción agrícola y los cultivos lo requieren en cantidades relativamente grandes.
El Fósforo es absorbido por la planta principalmente como (H2PO4-), pero también se absorbe como ion (HPO4-2). El pH del suelo controla la abundancia relativa de esas dos formas iónicas. El ión (H2PO4-) se favorece por debajo de pH 7 y el ión (HPO4-2) por encima de pH 7. Si el pH es muy alcalino todo el fósforo se encuentra bajo la forma de (PO4-3), la cual no es absorbible por las plantas.
Se encuentra en la planta como un componente de carbohidratos activados (por ejemplo la glucosa -6- fosfato, fructosa -6- fosfato, fosfoglicerato, fosfoenolpiruvato, glucosa -1- fosfato, etc). Acidos nucleicos, constituyente de cromosomas, fosfolípidos, fosfoaminoácidos que forman parte de fosfoproteinas.
El fósforo desempeña una función única y exclusiva en el metabolismo energético de la planta; sin su intervención no seria posible la fotosíntesis.
Los carbohidratos antes de ser metabolizados son fosforilados. La presencia de fósforo en la estructura molecular de los azúcares, los hace más reactivos.
El fósforo es también parte de la fitina, que es la principal forma de almacenamiento de fósforo en la semilla. Alrededor del 50% del fósforo total en las semillas de las leguminosas y del 60 al 70% en los cereales se almacena como fitina o compuestos muy parecidos. Un mal suplemento de fósforo puede reducir el tamaño, número y viabilidad de las semillas.
Además, el fósforo es necesario para la división celular, crecimiento merismatico, para el desarrollo de semillas y frutos. Favorece el desarrollo de las raíces al comienzo de la vegetación. Favorece el ahijamiento en cereales, hace que sus cañas sean más resistentes al encamado y forma mayor número de espigas.
Técnicas para la determinación de Fósforo método de BRAY y KURTZ
F- tiene la propiedad de formar complejos con Al+3 y Fe+3, con liberación de fósforo retenido en los suelos por estos cationes trivalentes. Las reacciones pueden representarse en disolución ácida de la siguiente forma:
3 NH4F + 3 HF + AlPO4 → H3PO4 + (NH4)3AlF6
3 NH4F + 3 HF + FePO4 → H3PO4 + (NH4)3FeF6
AlPO4, representa los diferentes fosfatos hidratados e hidroxílicos de Al, incluyendo las capas superficiales adsorbidas o precipitadas sobre óxidos y aluminosilicatos. Análogamente, FePO4, representa los distintos fosfatos hidratados e hidroxílicos de Fe, incluyendo las capas adsorbidas o precipitadas sobre óxidos de hierro. La reacción con FePO4, no es completa para fosfato concrecionado o recubierto de óxido de hierro. Además, fluorferrato es inestable en medio neutro o alcalino, de modo que el fósforo correspondiente a AlPO4, puede fraccionarse mediante extracción con NH4F 0,5 N. La especie (NH4)3AlF6, puede precipitar cuando existe un gran exceso de F-.
El procedimiento de extracción de fósforo disponible de los suelos mediante NH4F en HCl (Bray y Kurtz), se usa ampliamente, pues los resultados son concordantes con la respuesta de las cosechas a la fertilización con fosfatos. La inclusión de un ácido conduce a la disolución de los fosfatos de Ca más activos e impide la precipitación (en forma de fosfato cálcico) de fósforo disuelto a consecuencia de las reacciones anteriores.
Reactivos:
Solución de extracción NH4F 0,03 N en HCl 0,025 N: pesar 1,11 gr de NH4F sólido en un vaso de precipitado de 500 ml, agregar 200 ml de agua destilada, disolver por completo y agregar 4,16 ml de HCl 6 N. Luego transferirlo a un matraz de un litro y enrasar. Después de enrasar colocar en un recipiente de plástico.
Solución de reactivo cloromolíbdico 1,5%: disolver 15 gr de molibdato de amonio (NH4)6Mo7O24.4H2O, en 300 ml de agua destilada caliente a 50 °C, y si es necesario se filtra la disolución para separar los sedimentos. Se enfría la disolución y se añade 350 ml de HCl 10 N lentamente y agitando. Enfriar la disolución, diluir con agua destilada hasta 1 litro, mezclar y guardar en frasco oscuro. La disolución es 1,5% en molibdato y 3,5 N en HCl, y debe remplazarse cada dos meses.
Procedimiento:
Pesar 2gr de suelo tamizado en un erlenmeyer de 125 ml, agregar 20 ml de la solución extractiva y agitar 5 min. Filtrar con papel de filtro adecuado (Double Rings 103 cualitativo), tomar en una celda de reaccion 5 ml del filtrado, agregarle 20 ml de la solución de molibdato de amonio y esperar 10 min para que reacción.
En el fotómetro:
Ingresar el número de programa para fósforo (P). Presionar: 954 ENTER. La pantalla mostrará: Fijar a 882 nm.
Girar la perilla de longitud de onda hasta que la pantalla pequeña muestre 882 nm. Fijada la longitud de onda, la pantalla mostrará: muestra cero luego mg/L P.
Presionar: SHIFT TIMER. Comenzará un periodo de reacción de 7 minutos. Nota: Deje pasar el tiempo.
Cuando suene el cronómetro, la pantalla mostrará: mg/L P.
Llenar otra celda de medición con 25 ml de muestra (blanco). Nota: Si la muestra es única, este paso se realizara con la muestra misma.
Colocar el blanco en el soporte de la celda. Cerrar el escudo para luz.
Presione ZERO la pantalla mostrará: Puesta en cero luego: 0,0 mg/L P.
Quitar el tapón. Colocar la muestra preparada en el soporte de la celda. Cerrar el escudo para la luz.
Presionar: READ. La pantalla mostrara: Leyendo..., luego se visualizará el resultado en mg/L P.
Cálculos:
ppm P= mg/L P x 50
50: factor que surge de la dilución y de la conversión del peso de la muestra.
Azufre
Los sulfatos son necesarios para el crecimiento vegetal. El azufre es absorbido por las plantas principalmente en la forma inorgánica como sulfato (SO4-2), luego es reducido a las formas sulfhidrilo (-SH) o disulfuro (-S-S-) e incorporado a compuestos orgánicos.
El azufre se encuentra bajo las formas orgánicas de los aminoácidos, cisteína, cistina y metionina, así como en compuestos de azufre activados análogos al ATP, adenosina 5'-fosfosulfato (APS) y 3'-fosfoadenosina 5'-fosfosulfato (PAPS). Además, el azufre se encuentra en una variedad de esteres de sulfato, tales como el sulfato de colina, glicósidos del aceite de mostaza y sulfatos de polisacáridos. El azufre participa como un ligando en un gran número de enzimas y metalo-proteinas, de forma resaltante en ferro-sulfo-proteínas y en cupro-proteínas.
El grupo sulfhidrilo (-SH) puede participar directamente en reacciones de oxido-reducción, como con el ácido lipóico y el glutatión. Los grupos sulfhídrilos pueden ser sitios reactivos de enzimas o coenzimas, ejemplo: 3-fosfogliceraldehido deshidrogenasa y coenzima A. Muchas enzimas son inhibidas de forma no-competitiva por reactivos que se unen a los grupos sulfhidrilos, ejemplo: Pb, Hg, As, Ag. El azufre en forma reducida se encuentra en los anillos heterocíclicos de algunas coenzimas, como tiamina o biotina y en una cantidad de metabolitos secundarios como la sinigrina de Brassica nigra, que contiene azufre en forma reducida y oxidada o la alicina, la sustancia olorosa del ajo y el factor causante de lacrimeo en la cebolla.
Su papel es imprescindible en la constitución de enzimas de oxidación que regulan los procesos vitales del metabolismo en las plantas.
Ayuda a la persistencia de la clorofila, por lo que se le encuentra en mayor proporción en los tejidos jóvenes.
Convierte los nitratos que toman las raíces a formas que la planta las pueda utilizar.
Técnica para la determinación de Sulfatos
Los iones sulfato (SO4-2) se unen con los iones bario (Ba+2) en el reactivo de sulfato Sulfa Ver 4 formando una turbidez de sulfato de bario (BaSO4) insoluble, en un medio ácido que provee el ácido cítrico para que no precipiten otras sales insolubles de bario. La turbidez es proporcional a la concentración de sulfatos en la muestra.
Reactivos:
Solución de fosfato de calcio Ca(H2PO4)2 2,03 gr, disolver y llevar a un litro con agua destilada.
Carbón activado.
Sobre con reactivo en polvo Sulfa Ver 4 que contiene cloruro de bario y ácido cítrico.
Procedimiento:
Pesar 25 gr de suelo seco en un erlenmeyer de 125 ml, agregar 50 ml de fosfato de calcio.
Agitar 1 min y dejar reposar 10 min. Luego agregar 0,5 gr de carbón activado y agitar 30 seg. Filtrar con papel de filtro (Double Rings 103 cualitativo). Tomar 25 ml del filtrado en una celda de medición.
En el fotómetro:
1) Ingresar el número de programa para sulfato (SO4-2). Presionar: 705 ENTER. La pantalla mostrará: Fijar a 450 nm.
Girar la perilla de longitud de onda hasta que la pantalla pequeña muestre 450 nm. Fijada la longitud de onda, la pantalla mostrará: muestra cero luego mg/L SO4-.
3) Tomar los 25 ml de filtrado que se encuentran en la celda de medición y agregar el contenido de una bolsa de reactivo en polvo de sulfato (Sulfa Ver 4), tapar y girar para disolver. Nota: Si la muestra es única, el paso 3 deberá omitirse. El reactivo en polvo contiene cloruro de bario y ácido cítrico.
4) Presionar: SHIFT TIMER. Comenzará un periodo de reacción de 5 minutos con agitación. Nota: Si la muestra es única deje pasar el tiempo.
Cuando suene el cronómetro, la pantalla mostrará: mg/L SO4-2.
6) Llenar otra celda de medición con 25 ml de muestra (blanco). Nota: Si la muestra es única, este paso se realizara con la muestra misma.
7) Colocar el blanco en el soporte de la celda. Cerrar el escudo para luz.
Presione ZERO la pantalla mostrará: Puesta en cero luego: 0,0 mg/L SO4-2. Nota: Si la muestra es única, realizar el paso 3, agite 5 min.
9) Quitar el tapón. Colocar la muestra preparada en el soporte de la celda. Cerrar el escudo para la luz.
Presionar: READ. La pantalla mostrara: Leyendo..., luego se visualizará el resultado en mg/L de sulfato (SO4-2).
Cálculos:
ppm SO4-2 = mg/L SO4-2 x 2
2: factor que surge de calcular la concentración de SO4-2 en el volumen de extracción y de la conversión del peso de la muestra.
Resultados obtenidos en las muestras analizadas de Suelo
| LOTES | pH | N-NO3- | P | %MO |
| 1 | ||||
| 0-20 cm | 5,48 | 7,5 ppm | 31,1 ppm | 0,45 |
| 20-40 cm | 4,5 ppm | |||
| 40-60 cm | 1,7 ppm | |||
| 2 | ||||
| 0-20 cm | 5,42 | 13,4 ppm | 41 ppm | 0,52 |
| 20-40 cm | 7,3 ppm | |||
| 40-60 cm | 3,3 ppm | |||
| 3 | ||||
| 0-20 cm | 5,42 | 10 ppm | 32 ppm | 0,60 |
| 20-40 cm | 3,6 ppm | |||
| 40-60 cm | 1,4 ppm | |||
| 4 | ||||
| 0-20 cm | 5,76 | 15 ppm | 41,6 ppm | 0,30 |
| 20-40 cm | 4,6 ppm | |||
| 40-60 cm | 3,4 ppm | |||
| 5 | ||||
| 0-20 cm | 5,12 | 12,5 ppm | 34,8 ppm | 0,52 |
| 20-40 cm | 22,3 ppm | |||
| 40-60 cm | 7,1 ppm | |||
| 6 | ||||
| 0-20 cm | 5,01 | 30,1 ppm | 27,5 ppm | 0,52 |
| 20-40 cm | 12 ppm | |||
| 40-60 cm | 9,6 ppm | |||
| 7 | ||||
| 0-20 cm | 4,99 | 35 ppm | 25,6 ppm | 0,80 |
| 20-40 cm | 15,2 ppm | |||
| 40-60 cm | 11 ppm |
| LOTES | pH | N-NO3- | P | SO4-2 | CE |
| 8 | |||||
| 0-20 cm | 13,5 ppm | 19,5 ppm | 1 ppm | 756 μS | |
| 20-40 cm | 29,7 ppm | ||||
| 40-60 cm | 8,2 ppm | ||||
| 9 | |||||
| 0-20 cm | 36,6 ppm | 37,8 ppm | 3 ppm | 1253 μS | |
| 20-40 cm | 11,9 ppm | ||||
| 40-60 cm | 10,7 ppm | ||||
| 10 | |||||
| 0-20 cm | 17,7 ppm | 28,4 ppm | 5,2 ppm | 961 μS | |
| 20-40 cm | 11,2 ppm | ||||
| 40-60 cm | 6,9 ppm | ||||
| 11 | |||||
| 0-20 cm | 42,7 ppm | 15,3 ppm | 0 ppm | 734 μS | |
| 20-40 cm | 16,1 ppm | ||||
| 40-60 cm | 7,9 ppm | ||||
| 12 | |||||
| 0-20 cm | 17,5 ppm | ------- | 7 ppm | 842 μS | |
| 13 | |||||
| 0-20 cm | 12,9 ppm | ------- | 0 ppm | 750 μS | |
| 14 | |||||
| 0-20 cm | 12,4 ppm | ------- | 2 ppm | 985 μS | |
| 15 | 7 | 15,6 ppm | 44,9 ppm | 18,6 ppm | |
| 16 | 7,15 | 21,3 ppm | 38,1 ppm | 10 ppm | |
| 17 | 6,61 | 17,6 ppm | 52,4 ppm | 20 ppm | |
| 18 | 6,65 | 9,7 ppm | 48,8 ppm | 11,2 ppm | |
| 19 | |||||
| 0-20 cm | 12,7 ppm | ||||
| 20-40 cm | 13 ppm | ||||
| 40-60 cm | 17 ppm | ||||
| 20 | |||||
| 0-20 cm | 29,7 ppm | ||||
| 20-40 cm | 15,3 ppm | ||||
| 40-60 cm | 9,4 ppm | ||||
| 21 | |||||
| 0-20 cm | 10,4 ppm | ||||
| 20-40 cm | 4,3 ppm | ||||
| 40-60 cm | 3,1 ppm | ||||
| 22 | |||||
| 0-20 cm | 41,2 ppm | ||||
| 20-40 cm | 15,3 ppm | ||||
| 40-60 cm | 9,4 ppm | ||||
| 23 | |||||
| 0-20 cm | 23,4 ppm | ||||
| 20-40 cm | 9 ppm | ||||
| 40-60 cm | 5,6 ppm | ||||
| 24 | |||||
| 0-20 cm | 10,5 ppm | ||||
| 20-40 cm | 9,4 ppm | ||||
| 40-60 cm | 6,1 ppm |
ANÁLISIS DE AGUA

Agua
El agua químicamente pura es un líquido inodoro e insípido; incoloro y transparente en capas de poco espesor, toma color azul cuando se mira a través de espesores de seis y ocho metros, porque absorbe las radiaciones rojas. Sus constantes físicas sirvieron para marcar los puntos de referencia de la escala termométrica Centígrada. A la presión atmosférica de 760 milímetros de mercurio, el agua hierve a temperatura de 100 °C y el punto de ebullición se eleva a 374°, que es la temperatura critica a que corresponde la presión de 217,5 atmósferas; en todo caso el calor de vaporización del agua asciende a 539 calorías/gramo a 100°.
Propiedades Físicas Del Agua
1) Estado físico: sólida, liquida y gaseosa
2) Color: incolora
3) Sabor: insípida
4) Olor: inodoro
5) Densidad: 1 g./c.c. a 4 °C
6) Punto de congelación: 0 °C
7) Punto de ebullición: 100 °C
8) Presión critica: 217,5 atm.
9) Temperatura crítica: 374 °C
Es el único compuesto que puede estar en los tres estados (sólido, líquido y gaseoso) a las temperaturas que se dan en la Tierra. Se halla en forma líquida en los mares, ríos, lagos y océanos; en forma sólida, nieve o hielo, en los casquetes polares, en las cumbres de las montañas y en los lugares de la Tierra donde la temperatura es inferior a cero grados Celsius; y en forma gaseosa se encuentra formando parte de la atmósfera terrestre como vapor de agua.
El agua es una sustancia química esencial para la supervivencia de todas las formas conocidas de la vida. Sin el agua no existiría la vida en el planeta tierra.
Las aguas naturales se clasifican en meteóricas, superficiales, subterráneas y de mar.
Las aguas subterráneas son la principal fuente de suministro para consumo humano y prácticas agropecuarias. El recurso hídrico subterráneo juega un papel relevante en la actividad económica más importante de la región: la agricultura de tipo extensiva, en mono y poli-cultivos (forrajeras, cereales y oleaginosas) y ganadería, fundamentalmente aquélla dedicada a la cría y comercialización de ganado vacuno de tambo, invernada y cría. Si bien el agua subterránea es el único recurso disponible en el ambiente rural, está caracterizada por una serie de problemas vinculados a sus aptitudes.
El agua es esencial para aprovechar el potencial de la tierra y para permitir que las variedades mejoradas tanto de plantas como de animales utilicen plenamente los demás factores de producción que elevan los rendimientos. Al incrementar la productividad, la gestión sostenible del agua (especialmente si va unida a una gestión adecuada del suelo) contribuye a asegurar una producción mejor tanto para el consumo directo como para el comercio, favoreciendo así la producción de los excedentes económicos necesarios para elevar las economías rurales.
El agua es uno de los seis nutrientes básicos de la dieta animal. Animales, tanto de tambo, engorde o cría, sometidos a la ingesta de aguas salobres disminuyen todos sus índices de eficiencia productiva afectando finalmente la rentabilidad del planteo.
Descargar
| Enviado por: | Hernan |
| Idioma: | castellano |
| País: | Argentina |
