Química
Amoníaco. Ácido sulfúrico. Ácido clorhídrico. Ácido nítrico. Cloro
ÍNDICE
Amoníaco Págs. Nº2-5
Ácido sulfúrico Págs. Nº6-12
Ácido clorhídrico Págs. Nº13-15
Ácido nítrico Págs. Nº16-20
Cloro Págs.Nº21-26
Bibliografía Pág. Nº27Amoníaco:
Introducción
El amoníaco es un gas incoloro de olor picante desagradable. Es menos denso que el aire y muy soluble en agua.
Propiedades físicas y químicas:
-
Datos físicos:
Peso molecular: 17 g/mol
Punto de ebullición (a 1 atm):-33,35 ºC
Punto de fusión: -77,7ºC
Densidad: 0,895 g/ml
Está formado por un átomo de nitrógeno y tres de hidrógeno. Es muy abundante en el sistema solar, existiendo por tanto en las atmósferas de planetas gigantes, como hielo, en los astros pertenecientes al Sistema Solar exterior: satélites de planetas gigantes, Plutón y Caronte, Transneptunianos, cometas…
Gas irritante y d sabor cáustico que se licua fácilmente bajo presión.
Disuelto en agua forma el hidróxido de amonio, NH4OH, de marcado carácter básico y similar en su comportamiento químico a los hidróxidos de los metales alcalinos.
Es soluble en disolventes orgánicos y sobre todo en agua.
Disuelve cobre y zinc. Se forma humo en presencia de ácidos volátiles
Historia
El amoníaco era conocido por los antiguos, quienes lo obtuvieron a partir de la sal amónica, producida por la destilación del estiércol de camello cerca del templo de Júpiter Amón en Libia (de ahí su nombre).
También se atribuye a los egipcios su descubrimiento, llamándolo amoníaco o sal monacal, en memoria del dios del sol Ra Ammon, ya que en concentraciones elevadas produce severos daños en la salud de las personas, produciendo incluso la muerte.
En Europa, durante la edad media el amoníaco se obtenía calentando los cuernos y pezuñas de bueyes y se llamaba espíritu de cuerno de ciervo. El alquimista alemán Basil Valentine obtuvo el amoníaco libre, y el químico francés Claute Berthollet determinó su composición en torno a 1777.
En el siglo XIX, la principal fuente de amoníaco fue la destilación de la hulla, era un derivado importante en la fabricación de los combustibles gaseosos. Hoy, la mayoría del amoníaco se produce sintéticamente a partir de nitrógeno e hidrógeno en el proceso Haber.
Obtención:
-
En el laboratorio:
Se produce mediante la reacción:
2 NH4Cl + Ca(OH)2 CaCl2 + 2 H2O + 2 NH3
-
En la industria:
En la actualidad, el método industrial más importante es el proceso Haber, descrito por la siguiente reacción y figura:
N2 + 3 H2 2 NH3
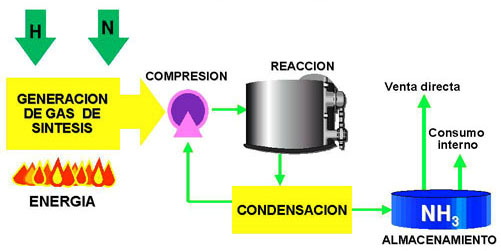
Según el principio de Le Chatelier, se conseguirá un mejor rendimiento a elevada temperatura y elevada presión. A baja temperatura la velocidad de la reacción es lenta, hay que aumentar la velocidad. La mayor parte del amoníaco producido se utiliza para la fabricación de ácido nítrico y abonos.
Principales usos:
-
Producción industrial de frío: cuando se comprime, se licua y al expandirse se evapora y absorbe el calor del medio, por lo que la temperatura disminuye
-
Producción de explosivos y nailon.
-
Abonos: bajo cuatro formas distintas:
-
Abonos con nitrógeno orgánico: abono flamenco, princhete, guano, sangre, materiales córneas, residuos del cuero o de la lana, basuras, tortas de semillas, estiércol.
-
Abonos con nitrógeno amoniacal: sulfato amónico, cianamida cálcica, urea, nitrato cálcico, crude ammoniac
-
Abonos con nitrógeno nítrico: nitrato sódico, nitrato cálcico
-
Abonos con fosfatos tricálcicos: fosfatos naturales o minerales, fosfatos de origen animal, polvo de huesos desgelatinados, ceniza de huesos.
Uso de los abonos:
| PAIS | % PRODUCCIÓN |
| E.U.A | 21.4 |
| URSS | 18.2 |
| China | 7.1 |
| Japón | 5.4 |
| Francia | 4.0 |
| R.F.A. | 3.6 |
| Polonia | 3.4 |
| Otros Países | 36.9 |
Ácido sulfúrico:
Introducción
Se trata de un ácido líquido, a temperatura ambiente, incoloro, inodoro de olor picante y de gran viscosidad.
Los antiguos alquimistas lo preparaban en grandes cantidades calentando sulfatos existentes en la naturaleza a alta temperatura y disolviendo en agua el trióxido de azufre obtenido de esta forma. En el siglo XV, aproximadamente, se desarrolló un método para obtener el ácido destilando sulfato ferroso hidratado con arena. En 1740 empezó a producirse el ácido a escala comercial quemando azufre y nitrato de potasio en un caldero suspendido en un gran globo de cristal cubierto parcialmente de agua. Como se puede observar, es un ácido de gran interés comercial, y desde la antigüedad se ha intentado obtener de la forma más sencilla y más rentable posible.
Propiedades físicas y químicas:
-
Datos físicos:
Peso molecular: 98 g/mol
Punto de ebullición (a 1 atm): 270ºC
Peso específico: 1,84 Kg/l
Punto de fusión: 3ºC
Solubilidad en agua g/100g de agua a 20ºC: miscible en todas las proporciones
-
Reactividad:
Incompatibilidades: el contacto con materiales orgánicos (como cloratos, carburos…) puede provocar incendios y explosiones. El contacto con metales crea emanaciones tóxicas de dióxido de azufre e hidrógeno gaseoso inflamable
Productos peligrosos de la descomposición: se pueden desprender gases y vapores tóxicos (el ya comentado dióxido de azufre y el monóxido de carbono)
Precauciones especiales: hay que tener en cuenta que este ácido ataque tanto a algunos plásticos, cauchos y revestimientos, como a la piel. En caso de producirse una quemadura por ácido sulfúrico hay que lavar la herida con abundante agua.
-
Propiedades químicas:
Al tratarse de un ácido fuerte cuando se encuentra en disolución se disocia en iones de hidrógeno (H+) e iones sulfato (SO42-) y puede cristalizar diversos hidratos, como el ácido glacial.
Es un ácido dibásico, ya que produce dos iones H+.
Sus disoluciones diluidas muestran las características de los ácidos: sabor amargo, conducen la electricidad, neutralizan y corroen los metales activos desprendiéndose gas hidrógeno. A partir del ácido sulfúrico se pueden preparar sales que contienen el grupo sulfato SO4, y sales ácidas que contengan el grupo hidrogeno sulfato, HSO4.
El concentrado, antiguamente conocido como aceite de vitriolo, es un gran agente desecante, así pues se utiliza para fabricar éter, nitroglicerina y tintes. Calentándose se comporta como un agente oxidante capaz de disolver metales, por muy poco reactivos que sean, como el cobre, mercurio y plomo, produciendo el sulfato del metal, dióxido de azufre y agua.
En el siglo XIX, Justus vol Liebig descubrió, que añadido al suelo aumentaba la cantidad de fósforo disponible para las plantas, aumentando el interés comercial del ácido.
Historia
El origen se desconoce, pero se empieza a hablar a partir del siglo X, quemándose azufre con salitre, esto fue descrito primeramente por Valentinus, en el siglo XV.
El trióxido de azufre fue aislado por Bussy en 1824, se presenta en forma de cristales transparentes y sedosos que funden a 17ºC y hierven a 45ºC. El calor lo disocia en oxígeno y anhídrido sulfuroso. Es muy ávido del agua, con la que se combina para dar ácido sulfúrico. Industrialmente se obtiene por la oxidación catálica del anhídrido sulfuroso o dióxido de azufre, como fase intermedia de la fabricación del ácido sulfúrico. En el laboratorio también puede obtenerse a partir de la destilación de un pirosulfato.
En 1746, Roebuck de Birmingham, introdujo las cámaras de plomo. El proceso de contacto fue descubierto en 1831 por Phillips, quien cuya patente incluía las características esenciales del proceso de contacto moderno. El invento de Phillips no obtuvo éxito debido a la falta de demanda de un ácido fuerte, ya que no se conocían las reacciones catalíticas de los gases y el progreso químico era lento
La demanda aumentó con el desarrollo de la industria de los tintes, debido a la demanda de ácidos concentrados para la manufactura de la Alizarina y otros materiales orgánicos colorantes; en 189 se demostró que un exceso de oxígeno en la mezcla gaseosa para el proceso de contacto era ventajoso, lo que ha sido mejorado en todos los detalles, siendo actualmente de bajo costo y controlado automáticamente.
Las plantas de fabricación nuevas de ácido sulfúrico utilizan el proceso de contacto; una de las desventajas que hicieron desaparecer el proceso de las cámaras de plomo, es que puede producir ácido de concentración hasta 78%; así pues en 1980 solo quedaba una planta de cámaras en Estados Unidos.
Obtención:
Como ya he nombrado existen dos métodos:
-
cámaras de plomo:
Se requiere el uso de dióxido de azufre, que se obtiene quemando piritas de hierro, FeSO2, o azufre, en el aire:
SO2 + ½ O2 + H2O = H2SO4
(Anhídrido sulfuroso + Oxígeno + Agua = Ácido Sulfúrico)
En este primer proceso, denominado método de las cámaras de plomo, la reacción se lleva a cabo en grandes torres de ladrillos recubiertas de plomo. Se hace reaccionar dióxido de azufre gaseoso, aire, vapor de agua y óxidos de nitrógeno, produciendo ácido sulfúrico en forma de gotas finas que caen al suelo de la cámara. Casi todos los óxidos de nitrógeno se recuperan del gas que sale y se vuelven a introducir en la cámara para ser utilizados de nuevo. El ácido sulfúrico producido de esta forma, y el ácido etiquetado, sólo contienen de un 62 a un 70% de H2SO4; el resto es agua. Actualmente, casi un 20% del ácido sulfúrico se produce por el método de las cámaras de plomo, pero este porcentaje está disminuyendo.
-
Método por contacto:
Una vez que ingresa el azufre a la planta, es depositado en un sitio denominado patio de azufre, labor realizada por ayudantes. Posteriormente se inicia la transformación del azufre. Una persona denominada Operario del Fundidor, traslada azufre a un compartimiento denominado Fundidor de Azufre, en donde de su estado sólido se torna líquido viscoso ya que es sometido a altas temperaturas (150º) con ésta iniciación de transformación del azufre se da comienzo al ciclo de producción de Ácido Sulfúrico.
Los pasos principales de proceso son:
Combustión del azufre:
Para generar dióxido de azufre (SO2)
S + O2 = SO2
(Azufre + Oxígeno = Anhídrido Sulfuroso)
El azufre para la planta se recibe en forma sólida. El azufre se funde y clarifica antes de transferirlo a una fosa de almacenamiento de azufre limpio. Luego se bombea a un quemador de azufre donde se quema con aire suministrado por un soplador para formar Dióxido de Azufre. Antes de entrar al quemador, el aire pasa por la torre de secado, donde se lava con ácido para retirarle el vapor de agua que contiene. La humedad del aire, si no se elimina, causará problemas en el proceso. Por ejemplo: problemas de corrosión en conductos y torres.
El aire pre-secado que entra al quemador contiene aproximadamente 21% de Oxígeno (O2) y 79% de Nitrógeno (N2). En el quemador de azufre se utiliza solamente una parte del oxígeno del aire para quemar el azufre.
Se genera una gran cantidad de calor, el cual eleva la temperatura del gas en el quemador. La temperatura alcanzada va en proporción a la concentración del gas (es decir, el porcentaje de SO2 en el gas) y también depende de la temperatura del aire que entra al quemador, así como de la cantidad de calor que se pierde en el quemador de azufre, debido a radiación del casco.
Combinación de dióxido de azufre con oxígeno:
SO2 + ½ O2 = SO3
( Anhídrido Sulfuroso + Oxígeno = Anhídrido Sulfúrico)
El SO2 que se encuentra en el gas se combina con parte del oxígeno para formar anhídrido sulfúrico (SO3). Para este paso, el gas debe estar a una temperatura menor que la de salida del quemador de azufre. Es necesario enfriar el gas de salida del quemador de azufre. El enfriamiento se consigue mediante una caldera de recuperación que contiene agua; el gas (SO2) caliente, que sale de la caldera de recuperación, pasa a través del filtro de gas caliente para extraerle el polvo que puede contener. Este se convierte en (SO3) en el convertidor, el cual contiene cuatro capas de catalizador que hace que la reacción química se produzca a velocidad mucho mayor que si no se utilizara el catalizador, éste no se afecta ni se agota.
Esta reacción es exotérmica y reversible, la temperatura de entrada del gas a cada a paso del convertidor debe mantenerse en el nivel correcto con el fin de conseguir la conversión requerida. El gas es enfriador entre cada paso para mantener la temperatura correcta de entrada a cada paso.
Después del segundo paso el gas pasa a través del intercambiador caliente de paso intermedio, el cual enfría el gas y también sirve para precalentar el gas que retorna de la torre de absorción intermedia hacia el cuarto paso de catalizador. Después del tercer paso el gas es conducido a la torre barredora (para extraerle el selenio), y luego a la torre de absorción intermedia, donde el SO3 que contiene el gas es absorbido en Ácido Sulfúrico del 98%. El gas es enfriado antes de la torre en el intercambiador frío; el intercambiador frío de paso intermedio también sirve para calentar el gas que retorna de la torre de absorción intermedia, para lograr la temperatura correcta al cuarto paso. El SO2 que queda en el gas es luego convertido en SO3 en el cuarto paso, el gas que sale del convertidor pasa a través del economizador supercalentador, donde es enfriado antes de pasar a la torre de absorción final, donde el SO3 remanente es absorbido en Ácido Sulfúrico del 98%.
Combinación del trióxido de azufre con agua:
Para formar una solución que contiene 98 a 99% de Ácido Sulfúrico.
SO3 + H2O = H2SO4
(Anhídrido Sulfúrico + Agua = Acido Sulfúrico)
El gas SO3 producido en el convertidor no se combinará directamente con agua, sino que debe combinarse indirectamente mediante absorción en ácido sulfúrico de 98-99%. En estas condiciones el SO3 se une fácilmente con el agua contenida en el ácido. Esta operación se lleva a cabo en las torres de absorción donde se efectúa la absorción del SO3 en dos etapas, la primera antes de que la conversión a SO3 se haya completado, denominado interabsorción. El SO3 absorbido en la torre intermedia sigue hacia adelante y el restante es absorbido en la torre de absorción final (segunda etapa).
El Ácido que recircula por la torre de secado se debilita con el vapor de agua que le quita el aire, mientras que en las torres de absorción el Ácido se refuerza mediante la absorción del gas SO3; el Ácido más débil se combina con el Ácido reforzado proveniente de las torres de absorción antes de ingresar a la torre de enfriamiento. La adición de agua a las corrientes combinadas también es necesaria para mantener la concentración adecuada del Ácido para lograr la absorción del SO3 y un buen secado.
El flujo de Ácido combinado es bombeado a través de los enfriadores de Ácido antes de recircular el Ácido a la torre de secado y las torres de absorción. La absorción del vapor de agua por el Ácido circulante de secado, además de la adición de agua a las corrientes combinadas de Ácido de las torres de secado final y paso intermedio, ha aumentado constantemente el volumen del Ácido dentro del tanque común de bombeo; como resultado de esto, constantemente se bombea Ácido de 98-99% desde el sistema común de secado final e intermedio al tanque de almacenamiento.
Absorción del selenio y producción del oleum:
La corriente de gas SO3 proveniente del tercer paso contiene selenio que entra en el proceso con el azufre volcánico alimentado al quemador de azufre.
El Ácido Sulfúrico puede disolver su propio anhídrido SO3 y dar una serie de productos que contienen más anhídrido de lo normal. Estos líquidos oleosos, frecuentemente de color pardo por la carbonización de polvos orgánicos, reciben el nombre de oleums o ácidos fumantes; al aire desprenden humos y van depositándose unos cristales de ácido pirosulfúrico H2S2O7; se trata de un sólido incoloro que funde a 36º C .La remoción del selenio es necesaria para poder cumplir con las especificaciones para ácido sulfúrico (producto).
El Oleum, Ácido Sulfúrico fumante, o ácido Nordhausen, es una disolución de anhídrido sulfúrico (SO3) en ácido sulfúrico 100% (H2SO4). Se utiliza principalmente en los procesos de "sulfonación". La producción se realiza en una instalación complementaria de la unidad productora de ácido sulfúrico 98%.
Sus materias primas son: Ácido Sulfúrico 98% y SO3 gaseoso, ambos productos son tomados de los circuitos correspondientes en las unidades de sulfúrico de la planta.
Las reacciones químicas involucradas son:
(H2SO4)x + H20 + SO3 --- produce ---> (H2SO4)x+1 + Calor
|--- ácido 98%----| ácido 100%
(H2SO4)y + (SO3)z --- produce ---> (H2SO4). SO3 + Calor
anhídrido sulfúrico disuelto en ácido = oleum
Nota: la x, y, z representan números arbitrarios de moléculas.
Él en sí consta de una torre de absorción rellena con material cerámico especial, una bomba de recirculación del producto, un sistema de refrigeración para eliminar el calor generado y una cuba de recirculación. Debido a que la absorción del SO3 es de bajo rendimiento, el gas que sale de la torre debe retornarse al circuito de gas de la planta de Ácido Sulfúrico, a fin de evitar la contaminación ambiental.
El producto final contiene de 22 a 24% de SO3 disuelto en Ácido Sulfúrico y la riqueza teórica en H2SO4 equivale a un ácido sulfúrico de 105% de concentración. El producto es necesario para algunas reacciones de química orgánica, pero su gran inconveniente es su alta peligrosidad, ya que tiene una gran avidez por el agua, extrayendo inclusive la combinada, por lo cual carboniza instantáneamente cualquier materia orgánica, tal como la piel humana.
Por este motivo, las medidas de seguridad y precaución en la zona de producción son extremas, se hace circular por la torre barredora con el fin de remover la mayor parte del selenio sin bajar el contenido de SO3 del gas. La corriente de Oleum circula a través de un enfriador antes de retornar a la torre barredora, para remover el calor que absorbió de la corriente de gas SO3.
Principales usos:
Se trata de un ácido industrial fundamental, y su consumo es altísimo, por ejemplo en la década de los 70, Estados Unidos produjo más de 29 millones de toneladas, es decir 1/3 Kg por persona al año. Se dice que su consumo es directamente proporcional al desarrollo de la industria del país. Algunos usos son:
-
Producción de superfosfato de calcio (fertlizantes).
-
Porabilización del agua: para producir sulfato de aluminio a partir de bauxita.
-
Detergentes: en la sufonación de dodecilbenceno,. También se utiliza oleum 22%.
-
Fábricas de papel: en el proceso de producción de la pulpa de papel, e indirectamente en el uso de sulfato de aluminio. También en la depuración de aguas residuales.
-
Agro-Fito Sanitario: en la producción de sulfato de cobre.
-
Refinación de petróleo: para calderas y varios procesos.
-
Generación térmica de energía.
-
Metalurgia
-
Producción de ácido para baterías eléctricas.
-
Producción de sulfato de cromo, como agente reductor
-
El sulfato de cromo se utiliza principalmente para el curtido de cueros
-
Fabricación de productos orgánicos, como pinturas, pigmentos y rayón.
Ácido clorhídrico:
Introducción
Es uno de los principales derivados del cloro, es un gas incoloro de olor penetrante cuya disolución acuosa es el ácido.
Es corrosivo para los ojos, la piel y las vías respiratorias. La inhalación de sus vapores puede provocar dificultades de respiración. Es el segundo ácido en importancia industrial, tras el ácido sulfúrico,
Propiedades físicas y químicas:
-
Datos físicos:
Peso molecular: 36,5 g/mol
Punto de ebullición (a 1 atm): -85,5ºC
Punto de fusión: -114,22ºC
Densidad: 1,268 g /ml
Se disuelve fácilmente en agua: 1 volúmen de agua a 20ºC absorbe 441 volúmenes de cloruro de hidrógeno gaseoso a 1 atmósfera, la disolución que resulta, el ácido clorhídrico, contiene un 40,3% de ácido clorhídrico en masa y una densidad relativa de 1,2.
En disolución emite gran cantidad de vapores en aire húmedo, pero al diluirla deja de emitirlos.
Pierde parte de su solubilidad en agua al aumentar la temperatura, y es menos soluble en alcohol, éter y disolventes orgánicos.
En disolución, las moléculas se disocian en iones de hidrógeno cargados positivamente y en iones cloruro cargados negativamente, fácilmente se ionizan, haciendo del ácido clorhídrico un buen conductor de la electricidad.
Los iones hidrógeno proporcionan sus propiedades ácidas al clorhídrico, y por tanto, todas las disoluciones de cloruro de hidrógeno en agua tienen sabor amargo, corroen los metales activos, formando cloruros de metal e hidrógeno, colorean de rojo el tomasol, neutralizan los álcalis y reaccionan con las sales de ácidos débiles formando cloruros y los ácidos débiles.
Obtención:
Se obtiene industrialmente como derivado al hacer reaccionar cloro con hidrocarburos para producir cloruros orgánicos.
Se obtiene haciendo reaccionar cloruro de sodio con ácido sulfúrico, o combinando hidrógeno y cloro.
Las células de las paredes del estómago segregan pequeñas cantidades de ácido clorhídrico para facilitar la digestión de los alimentos.
Aunque el método más utilizado para su obtención es la síntesis directa, quemando hidrógeno en una atmósfera de cloro.
Principales usos:
El ácido clorhídrico industrial en bruto se conoce como ácido muriático, que se usa en grandes cantidades para:
-
Preparar cloruros
-
Limpiar metales
-
En procesos industriales como la preparación de la glucosa a partir de la harina de maíz.
Y en menores cantidades para:
-
En la industria farmacéutica
-
En la industria fotográfica, alimenticia y textil.
-
En la fabricación de abonos
-
Obtención de colorantes
-
Curtido de pieles
-
Agente de hidrólisis
-
Catalizador de reacciones
-
Síntesis orgánica
-
…
Ácido nítrico:
Introducción
Se preparó por primera vez en 1648 a partir del nitrato de potasio por Glauber. En 1783, Covnedish logró la determinación de su composición, siendo la fórmula HNO3, la notación de Lewis , y su fórmula desarrollada:
Propiedades físicas y químicas:
Se encuentra en la atmósfera debido a las tormentas eléctricas. Es un líquido incoloro que se descompone gracias a la acción de la luz, adoptando una coloración amarilla por el dióxido de nitrógeno que se produce en la reacción. En el aire húmedo despide humos blancos.
Desde el punto de vista iónico, es uno de los ácidos más fuertes, pero este ácido se caracteriza por su energía de acción oxidante, que se manifiesta sobre casi todos los metales excepto por el oro y el platino, ciertas sales, sustancias orgánicas y en general toda sustancia capaz de oxidarse.
Es un ácido tóxico, muy corrosivo, manchando la piel de amarillo y destruyendo las mucosas. Su acción oxidante se intensifica cuando está disuelto con peróxido de nitrógeno, que actúa como catalizador, por eso el ácido más energético es el ácido nítrico rojo ofumante.
-
Datos físicos:
Peso Molecular: 63g/mol
Punto de ebullición: 83ºC
Punto de fusión: -43ºC
Soluble en agua, en cualquier proporción y cantidad.
Densidad: 1,5 g/ml
-
Propiedades químicas:
Ácido inestable
Ácido monoprótico: solo forma sales neutras, los nitratos, que es monovalente, es decir solo tiene una valencia.
De fácil disociación.
Fuertemente oxidante.
Ataca la materia orgánica, es tóxico y muy corrosivo, ataca las mucosas, en contacto con la piel la colorea de amarillo, esto se debe a una reacción de las proteínas de la piel llamada reacción “xantoprotéica”
Obtención:
-
Método de laboratorio.
Se trata al nitrato de sodio con ácido sulfúrico concentrado. Se aplican las reglas de Bertholet, ya que el ácido sulfúrico es mas fijo que el ácido nítrico.
NaNO3 + H2SO4 NaHSO4 + HNO3
Si se eleva la temperatura:
NaHSO4 + NaNO3 Na2SO4 + HNO3
Sumando ambas reacciones:
2 NaNO3 + H2SO4 Na2SO4 + 2 HNO3
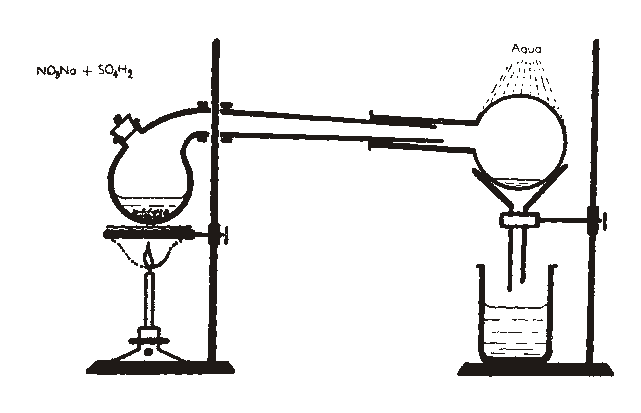
Este mismo método se utiliza también en la industria.
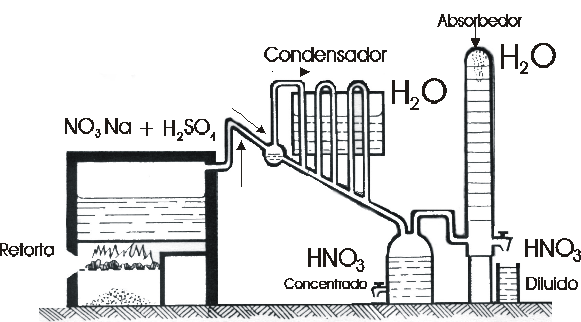
-
Método industrial: “la síntesis de Oswald”
Se hacen pasar vapores de amoníaco y aire previamente calentados por una malla de platino a 1000ºC.
Se produce la siguiente reacción:
4NH3 + 5O2 4NO ^ + 6 H2O
este gas pasa a unas torres metálicas de absorción donde se produce esta otra reacción:
2 NO + O2 2 NO2 ^
este dióxido de nitrógeno con agua forma:
3 NO2 + H2O 2 HNO3 +NO ^
El óxido nítrico vuelve a dar la reacción:
2 NO + O2 2 NO2 ^
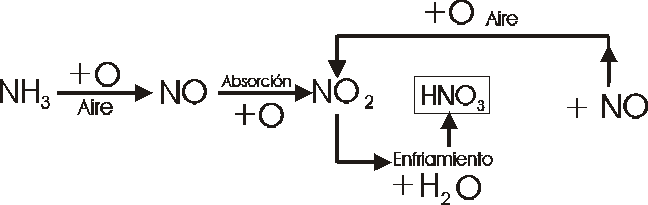
Principales usos:
Desde el punto de vista industrial, es uno de los ácidos más importantes, ya que se consume en grandes cantidades en la industria de abonos, colorantes, explosivos, fabricación del ácido sulfúrico, medicamentos y grabado de metales.
Los procedimientos de Biberland-Eyde, para fijar el nitrógeno atmosférico, de Haber, para el amoniaco, junto con la síntesis de Osdwald, tiene gran importancia en agricultura, pues las reservas naturales de abonos naturales como el salitre son insuficientes para satisfacer las necesidades de los cultivos, por lo que el aprovechamiento del nitrógeno atmosférico resolvió un problema económico importante
La clásica pólvora negra, utilizada como explosivo, ha sido reenlazada por derivados de nitratos, con el algodón se forma el algodón pólvora o nitrocelulosa; con el tolueno se forma el trinitrotolueno (T.N.T.) o Trotyl
Se emplea para preparar nitrobenceno, base de la anilina.
Forma parte de la dinamita, con la glicerina, formando la nitroglicerina.
Se usa en la industria de los colorantes debido a la acción nitrante y oxidante.
Se utiliza en la terna de ácidos de mayor aplicación industrial, junto con el ácido clorhídrico y el ácido sulfúrico.
Cloro:
Introducción
El cloro, de símbolo Cl, es un elemento gaseoso amarillo verdoso. Pertenece al grupo 17 del sistema periódico y es uno de lo halógenos. Su número atómico es 17.
El cloro libre no existe de forma natural, aparece en compuestos minerales, ocupando un el puesto número 20 de la corteza terrestre.
Tiene un olor irritante y muy concentrado es peligroso, de hecho fue la primera sustancia utilizada como gas venenoso en la I Guerra Mundial.
Propiedades físicas y químicas:
-
Datos físicos:
Peso atómico: 35,453
Peso específico: 1,57 (a 34ºC)
Punto de fusión: -101ºC
Punto de ebullición: -34,05ºC
Densidad relativa de 1,41 (a 35ºC)
Color: amarillo verdoso
Año de descubrimiento: 1774 por Wilhelm Scheele (sueco)
Tiene valencias 1, 3, 5, 7 y raramente 4. Es un gas diatómico (Cl2), de olor penetrante, y muy irritante en las membranas pituitarias, incluso muy diluido. Es un elemento muy reactivo, desprendiendo un gran calor en sus combinaciones. Mezclando volúmenes iguales de cloro e hidrógeno, por acción de la luz, el sol o una cinta combustible de magnesio, reacciona en forma explosiva con formación de cloruro de hidrógeno.
Se licua fácilmente bajo una presión de 6,8 atmósferas y 20ºC.
Historia
Al parecer, tanto el cloro como el ácido clorhídrico eran conocidos ya por los alquimistas del s. XIII, aunque su primera mención segura data de 1774, realizada por el químico y farmacéutico sueco Wilhelm Scheele, quien tomó el ácido clorhídrico por el compuesto oxigenado de un hipotético elemento simple, el murio, por lo que lo denominó ácido muriático, que persistió hasta 1810, en que Humphry Davi aisló el gas y lo designó con el nombre de cloro, debido a su color amarillo verdoso.
Obtención:
La obtención del cloro se hace por la oxidación del ácido clorhídrico o por electrólisis de disoluciones de cloruro potásico o sódico, en las cuales se libera gran cantidad de cloro como subproducto en la obtención de los hidróxidos sódico y potásico.
Se utiliza para la obtención del cloruro de cal, para preparar el ácido clorhídrico y en la síntesis de muchos compuestos orgánicos. También para obtener bromo, en el desestañado de la hojalata, como desinfectante, para el blanqueo químico de tejidos, etc. El agua clorada es una disolución acuosa de cloro.
Principales usos:
-
El cloro en la industria
Cerca del 60% de las industrias químicas lo usan, de forma directa o indirecta, ya que en numerosos casos el cloro actúa como fuente de energía, al ser un elemento muy reactivo que posibilita reacciones que de otro modo utilizarían más energía, es decir, más recursos no renovables, además de producir más residuos (peligrosos), más contaminación y sería más peligroso para trabajadores y usuarios.
-
Utilización del cloro
Se emplea para fabricar unos 10.000 productos, es decir el 95% de todos los productos de consumo, por ejemplo, estos son algunos de sus usos:
-
Medicinas: más del 80 % de medicamentos y vitaminas sintéticas se elaboran con cloroy en un 30%, el cloro es parte indispensable de ellos.
-
Desinfectantes: esun desinfectante barato y fiable en piscinas y agua potable.
-
Plásticos: se utiliza en la fabricación de plásticos con grandes aplicaciones, como el PVC y PVDC.
-
Catalizadores: en la obtención de cadenas de polietileno (HDPE, LLDPE) y polipropileno (PP) de alta y baja densidad.
-
Productos intermedios: es un producto intermedio en la fabricación de poliuretanos (PU para colchones), policarbonatos( en Cd's y DVD's de ordenador, ventanillas de avión y utensilios de cocina resistentes al calor), carboximetilcelulosa (CMC, utilizado como absorbente en servilletas), epoxi (pinturas y colas), siliconas (obturantes, cauchos, lubricantes), teflón, etc…
-
Disolventes: en los no inflamables, para desengrasar y limpiar en seco.
-
Decolorocaión: en la industria papelera y del algodón, para blanquear la pasta.
-
Metalurgia: para fabricar el titano de los cohetes, aluminio, magnesio, níquel y silicio, este último de gran importancia en la fabricación de chips electrónicos.
-
Alternativas al cloro
Según Greenpeace Internacional “el cloro mata” a 227 personas debido a la fabricación, transporte, utilización industrial y municipal del cloro, en los últimos cien años. Greenpeace también recomienda el uso de sustancias alternativas al cloro, sobretodo al PVC, pero se ha demostrado a través de muchas investigaciones que los sustitutos del cloro no son tan efectivos ni poco contaminantes como afirman, matando también a muchas personas en los procesos que llevan consigo.
De hecho, la omisión del cloro en la desinfección del agua potable en Perú, convirtió una incipiente epidemia de cólera en un desastre en el que murieron veintidós mil personas y más de doscientas mil sufrieron la enfermedad.
Bruce N. Ames, el famoso toxicólogo mundial, descubrió que, cuando se prueba en roedores la carcinogenidad de muchas sustancias que contienen o no cloro, ya sean naturales o no, a la DMT (dosis máxima tolerada), alrededor del 50 % dan un resultado positivo. Según Ames, gran parte de esta carcinogénesis se debe a la dosis elevada, no al potencial cancerígeno del material en sí. Si se reduce la dosis, los resultados desaparecen rápidamente, en general se puede ver una curva cuadrática de dosis-respuesta y por debajo de una dosis determinada no hay ningún efecto.
Existen otros materiales cancerígenos, incluso a una dosis inferior, pero en ese caso el efecto cancerígeno se reduce en proporción a la magnitud de la dosis.
Todo el mundo tendrá cáncer si llega a ser lo bastante mayor. La posibilidad de tener cáncer aumenta exponencialmente con la edad, siendo de 10^4 a 10^5. En el caso de ratones y ratas, esto resulta alrededor del 40% de muertes naturales por cáncer, a una edad media de dos años. En los seres humanos, que tienen un metabolismo diferente, la consecuencia es de un 25 % de muertes naturales por cáncer, a una edad media de setenta y cinco años.
Uno de los cancerígenos más comunes, indispensable para la vida y responsable de 10.000 aducciones oxidativas al ADN (fallos en el núcleo de la célula que pueden provocar cáncer) por célula y día, es el oxígeno. En realidad, casi todas las carencias que presenta el ADN se pueden subsanar por medio de algún mecanismo, pero no todas.
El temor de mucha gente de que incluso una molécula de una sustancia cancerígena provocará cáncer, puede ser verdad pero pierde relevancia si se compara este deterioro natural con la gran cantidad de cancerígenos naturales que digerimos con los alimentos. Si cree que el organismo trata a los cancerígenos naturales de manera diferente a los sintéticos, está equivocado. Desde hace sólo unos cuantos cientos de años hasta la actualidad, se han introducido en nuestra dieta numerosos productos químicos cancerígenos naturales, por lo que nuestro organismo no ha tenido tiempo de desarrollar ninguna mecanismo de neutralización. Las defensas de nuestro organismo son en realidad las generales de la naturaleza y tratan los productos químicos naturales y sintéticos de la misma forma.
¿ Qué cantidad de sustancia es cancerígena ?
La misma sustancia puede ser anticancerígena a dosis reducida y cancerígena a una dosis elevada.
Un ejemplo típico es la vitamina A. En la dosis normal que se encuentra en los alimentos, es indispensable para el crecimiento, la visión y el sistema inmunológico. Y parece que contribuye a la prevención del cáncer (de pulmón) porque es un antioxidante. A una dosis mayor, en torno a cuatro veces la media diaria, incrementa la posibilidad de que los fumadores contraigan cáncer de pulmón. A una dosis mucho más elevada, es muy peligrosa para el feto: los niños pueden nacer sin cerebro. Y parece ser cancerígena en sí misma a dosis muy elevada.
Hay enormes diferencias entre la potencia cancerígena de las diferentes sustancias, y ocurre exactamente lo mismo que en el caso de los tóxicos.
Si bebe una cerveza o un vaso de vino al día, será beneficioso para su corazón y no influirá en su posibilidad de padecer cáncer.
Algunos productos químicos clorados se consideran cancerígenos pero, con la excepción de la TCDD-dioxina, todos están dentro de los límites anteriores. En 1.970 aproximadamente, se descubrió que el VCM, componente básico del PVC, es cancerígeno. Antes de esa fecha, muchos trabajadores se habían expuesto a dosis masivas (hasta más de 1.000 ppm - partes por millón) de VCM durante años. El resultado fue que alrededor de 170 trabajadores en todo el mundo, murieron de angiosarcoma, un cáncer de hígado específico. Inmediatamente después de este descubrimiento, las concentraciones de VCM en el aire fueron rápidamente reducidas a menos de 1 ppm en el lugar de trabajo, lo que tuvo como resultado una posibilidad de desarrollar cáncer inferior a 1:100.000.
Cloro, alternativas y cáncer
Greenpeace tiene razón cuando dice que más de un centenar de compuestos que contienen cloro, son cancerígenos probados. En realidad esto no es mucho, ya que aproximadamente la mitad de los más de 10.000 compuestos clorados serán considerados cancerígenos a alguna dosis (elevada).
Lo mismo es cierto para las substancias no cloradas. Y si observa la lista completa de las substancias cancerígenas conocidas y la lista de compuestos de hidrocarburos y nitrógeno, también cancerígenos que son mucho más potentes, esta segunda lista es mucho más extensa.
Que sepamos, ninguna sustancia industrial o natural puede fabricarse sin que se liberen sustancias cancerígenas u otras sustancias peligrosas: la arena para el vidrio produce silicosis; el crudo de petróleo contiene cientos de substancias cancerígenas, tales como benceno, ceras y PAH. De modo que todos los productos derivados del petróleo y la utilización de petróleo para producir energía, libera algunas substancias cancerígenas. Etileno para polietileno (PE), butadieno para caucho sintético, benceno para poliestireno (PS), óxido de etileno para tereftalato de polietileno (PET), serrín para muebles, taninos y sales de cromo para el cuero: todos son peligrosos, si no se manipulan con precaución.
El PVC en el embalaje de alimentos y el cáncer
En los polímeros, siempre se encuentran trazas de monómeros. La posibilidad de que los usuarios desarrollen cáncer por la migración de cantidades de estas substancias a los alimentos es, en realidad, insignificante en todos los casos.
La cantidad de VCM en las botellas de PVC que se utilizan para el envasado del agua, es tan baja que, aunque bebiera dos litros al día durante toda la vida y todo el VCM que contiene el envase migrara al agua, la cantidad total de VCM que llegaría a acumular en una vida equivaldría a la que un trabajador del PVC puede asimilar durante un día de trabajo. Esto ofrece una posibilidad extra, puramente teórica, en la proporción de uno a cien millones para desarrollar un cáncer.
El profesor Maltoni, de Bologna (Italia), quien descubrió la carcinogenidad del VCM, ha demostrado que el PVC no es cancerígeno ni en polvo ni como embalaje. Esto último se descubrió en un experimento con 2.000 ratas, de las que 1.000 fueron alimentadas con agua de botellas de vidrio y 1.000 con agua de botellas de PVC, a las que incluso se añadieron gránulos de PVC. Todas las ratas fueron alimentadas desde antes de nacer (fetos) hasta su muerte. Se controlaron todos los movimientos y su comportamiento sexual y cuando murieron, se analizó asimismo la causa de la muerte.
Los resultados fueron que no había diferencia en el comportamiento ni en la edad media, y una diferencia no significativa en la cantidad de muertes por cáncer; en realidad, las que habían bebido agua embotellada en botellas de PVC desarrollaron un 1,9 % menos de cáncer.
La situación no es diferente para otros materiales que se utilizaron para embalaje: en todos los casos, algunas cantidades muy pequeñas de posibles cancerígenos migraron a la comida empaquetada. En el caso del vidrio, fueron los silicatos y el plomo; para los objetos de barro, el plomo y cadmio; para el polietileno (PE), el etileno y las ceras; para el tereftalato de polietileno (PET), El acetaldehido, etc. En todos los casos, el efecto es insignificante.
Bibliografía
Para realizar este trabajo se han utilizado los siguientes recursos:
-
Enciclopedia Salvat
-
Enciclopedia Larousse
-
Buscadores en internet como www.google.com; www.yahoo.es; www.ya.com …
-
Recursos de www.lafacu.com
-
Diversas enciclopedias químicas y universidades online.
Descargar
| Enviado por: | Torr |
| Idioma: | castellano |
| País: | España |
