Industria y Materiales
Almacenamiento de hidrógeno
Introducción
La necesidad energética, bien sea estimada en unos 10.000 millones de toneladas equivalentes de petróleo (BP, 2004), se ve cubierta en más de un 87% por combustibles fósiles como el carbón, petróleo y gas natural. Esta dependencia tiene importantes repercusiones tanto económicas como ambientales. Por el lado económico cabe destacar que su producción centralizada en determinadas zonas del mundo, está gobernada por factores esencialmente políticos, lo que resulta en precios volátiles y elevados. Así mismo, en ausencia de alternativas viables, el agotamiento de las reservas de petróleo, estimadas en no más de 40 años (BP, 2004), resultará en un encarecimiento progresivo hasta niveles tales que afecten el desarrollo económico global.
Desde el punto de vista ambiental, la combustión de combustibles fósiles constituye el principal causante de la emisión de gases de efecto invernadero (dióxido de carbono), responsables del efecto de calentamiento global que sufre nuestro planeta.
Esta situación no resulta sostenible a medio plazo y se apunta de forma insistente desde las administraciones públicas a la necesidad de preparar una transición controlada hacia una nueva forma de producción y consumo energético que sea limpio, seguro y fiable
(DOE, 2004; Comisión Europea, 2003). Una de las respuestas a esta crisis que se avecina es el uso de hidrógeno como fuente de energía y su transformación en electricidad por medio de las llamadas pilas de combustible.
Así, el término economía del hidrógeno responde a una visión de futuro donde este gas, generado de forma limpia y económica, serviría para alimentar el grueso de las necesidades energéticas de la sociedad. Esta propuesta reduciría la dependencia actual sobre los combustibles fósiles, ya que el hidrógeno podría ser generado a partir de otras fuentes primarias como las renovables o la nuclear. Igualmente se disminuiría la contaminación atmosférica y la emisión de gases de efecto invernadero, puesto que el único residuo generado por una pila de combustible es agua.
El Hidrógeno vs la Economía
La implantación de la economía del hidrógeno no es inmediata y requiere aún dar respuesta a importantes retos tecnológicos, económicos y sociales que se describen a continuación. Desde el punto de vista de la producción del hidrógeno, hay que considerar que los métodos actuales resultan costosos y se basan principalmente en la gasificación de combustibles fósiles a altas presiones y temperaturas. Los procesos basados en energía renovables o energía nuclear no se encuentran suficientemente desarrollados y a nivel industrial su coste es aún mayor. Por otro lado, para dar respuesta a una demanda global de este tipo de energía, se necesitaría el desarrollo de un sistema de distribución de hidrógeno similar al que existe hoy en día para la gasolina.
El almacenamiento supone otro reto aún por resolver ya que, debido a su baja densidad energética, se necesitan enormes volúmenes de hidrógeno para alimentar procesos con alta demanda energética. En la actualidad se investiga en el desarrollo de tanques de alta presión, adsorbentes porosos e hidruros metálicos que permitan almacenar cantidades suficientes de este compuesto en espacios reducidos.
El precio actual de las pilas de combustible y su fiabilidad supone otra barrera a la aplicación masiva de esta tecnología. El uso de electrodos con catalizadores de metales nobles como el paladio y el platino, con un elevado precio de mercado, y los problemas de envenenamiento, sobre todo en procesos que utilizan hidrógeno de menor pureza, también son objeto de investigación.
Otro de los aspectos a superar es el de la seguridad ya que el hidrógeno es un compuesto altamente inflamable y potencialmente explosivo en contacto con el oxígeno de la atmósfera. Por ello se deben adoptar normativas de seguridad específicas que son diferentes a las que hoy se aplican con éxito para otros compuestos como la gasolina, el butano o el gas natural. En este artículo se realiza una breve revisión de la situación actual y los avances científicos y tecnológicos que encontrarán aplicación en un futuro cercano sobre la producción de hidrógeno y su almacenamiento. Un segundo artículo que se publicará en breve tratará sobre las aplicaciones de este gas y el desarrollo de pilas de combustible que permiten transformar el hidrógeno en energía eléctrica.
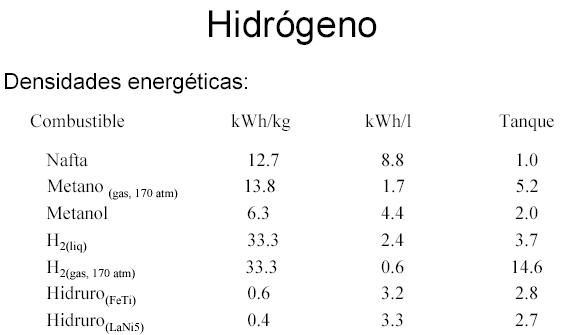
Producción de Hidrógeno
En la actualidad, aproximadamente el 96% de la producción mundial de hidrógeno se obtiene a partir de materias primas fósiles. Todos estos métodos pasan por la obtención de gas de síntesis mediante…
• Reformado con vapor de gas natural o naftas ligeras:
CH4 + H2O ↔ CO + 3H2 CO + H2O ↔ CO2 + H2 CH4 + CO2 ↔ 2CO + 2H2
• Oxidación de fracciones petrolíferas pesadas y (gasificación) carbón
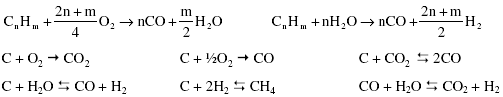
Globalmente podemos resumir el proceso de purificación así:
El gas de síntesis consiste en mezclas de hidrógeno, monóxido de carbono (productos principales), dióxido de carbono, vapor de agua añadido en exceso y otros productos formados en reacciones secundarias. La proporción entre los distintos componentes depende tanto de las materias primas empleadas como del proceso de obtención. Es necesario eliminar los componentes restantes hasta conseguir el hidrógeno de suficiente pureza para las posteriores aplicaciones, que pueden ser tan exigentes como algunas células de combustible que requieren valores muy altos.
Un proceso alternativo que actualmente supone el 4% de la producción mundial de hidrógeno es mediante electrolisis del agua. No obstante, se prevé un aumento importante de esta vía, ya que actualmente se pretende que el hidrógeno sustituya a los combustibles fósiles como fuente de energía. Por tanto, es lógico intentar desligar completamente el hidrógeno de dicho tipo de materias primas.
Un factor a considerar son los recientes desarrollos de aplicar energías baratas a la electrolisis del agua, como la fotovoltaica
Los equipos utilizados más habituales son los electrolizadores alcalinos, que emplean como electrolito una disolución alcalina, típicamente disoluciones de hidróxido potásico. Las reacciones que tienen lugar en estos sistemas son las siguientes:
Cátodo 2H2O ↔ H2 + 2OH- -2e-
Ánodo 2OH- ↔ ½O2 + H2O + 2e-
Célula H2O ↔ H2 + ½O2
Las investigaciones sobre la electrolisis clásica se dirigen al desarrollo de electrolizadores de halogenados y de membrana de intercambio protónico (R. J.
Friedland y A. J. Speranza, 2002). También existen líneas de investigación sobre métodos electrolíticos no convencionales como la electrolisis de vapor a alta temperatura (900-1.000 ºC). Este método tiene la ventaja de que proporciona la energía de reacción necesaria en forma de calor y electricidad. Otras investigaciones se dirigen a la electrolisis reversible del ácido bromhídrico. La energía eléctrica necesaria para disociar esta molécula es la mitad que en el caso de la molécula de agua. Una línea que está despertando especial interés en EE.UU. es la producción fotoelectroquímica. Este sistema es capaz de dividir la molécula de agua en hidrógeno y oxígeno, usando sólo la luz solar. A diferencia de los sistemas fotovoltaicos, éstos no necesitan cableado o convertidores externos. El sistema de recolección de radiación solar es capaz de generar suficiente voltaje para descomponer el agua.
Otras Técnicas
El metanol puede ser obtenido desde distintas fuentes de energía tanto de origen renovable (Biomasa) como de combustibles fósiles como el carbón o el gas natural. Es precisamente esta flexibilidad la que hace atractivo a este “vector” energético.
La idea general de estos procesos es a partir del biogas o del gas natural, realizar un reformado con lo que se obtiene una mezcla de H2, CO y CO2; o bien obtener el gas de síntesis a partir de la gasificación del combustible sólido (combustión parcial en presencia de vapor de agua).
El reformado catalítico del combustible tiene un rendimiento de entre el 70% y el 90%.
Una vez obtenido el gas de síntesis y después de acondicionarlo se pasa al proceso de síntesis del metanol que se realiza mediante reducción catalítica de monóxido de carbono (CO) con hidrógeno (H2) a altas presiones, utilizando un catalizador que consta de cobre, óxido de zinc y óxido de cromo (III).
Se puede usar la electricidad para generar hidrógeno a partir de la electrolisis del agua. Se usan fuentes de energía renovable (eólica, fotovoltaica), cuya generación de energía tiene una fuerte componente aleatoria, que incide negativamente en las redes eléctricas en las que se inyecta, por lo que su uso en la generación de H2 parece adecuado para evitar el problema.
Los electrolizadores más usados son los alcalinos y los SPE (Solid Polymer Electrolyte). Estos electrolizadores son de baja temperatura (50 - 80 ºC) lo que les permite tener tiempos de arranque relativamente pequeños, así como ser adaptables a los cambios de potencia de la fuente renovable.
La energía necesaria para generar hidrógeno es del orden de 5,4 kWh/Nm3 (53,5 kWh/kg), con eficiencias en la conversión del 85 %, eficiencias energéticas del orden del 65 % y coste de 7,0 €/kg H2 de inversión.
Ciertas algas y bacterias fotosintéticas pueden producir hidrógeno bajo determinadas condiciones. Los pigmentos en las algas absorben la energía del sol y las enzimas de la célula actúan como catalizadores para dividir el agua en hidrógeno y oxígeno (A. Melis y col, 1999; M. L. Ghirardi y col., 2001; M. L. Ghirardi y col., 2002).
Otra vía en desarrollo son los ciclos termoquímicos que consisten en una combinación de reacciones químicas a alta temperatura que producen la rotura de la molécula de agua en hidrógeno y oxígeno. En la actualidad se han estudiado diferentes sistemas de los que K. Schutz realizó una revisión recientemente (K. Schultz, 2003). Las eficacias que se han alcanzado rondan el 40%. Entre las posibles combinaciones de reacciones, las más prometedoras son el proceso UT-3, desarrollado por la Universidad de Tokio (A. T. Raiisi, 2003):
CaBr2 + H2O ↔ CaO + 2HBr T: 1170 K
CaO + Br2 ↔ CaBr2 + ½O2 T: 700 K
Fe3O4 + 8HBr ↔ 3FeBr2 + 4H2O + Br2 T: 130 K
3FeBr2 + 4H2O ↔ Fe3O4 + 6HBr + H2 T: 810 K
Igualmente las basadas en la descomposición del ácido yodhídrico, desarrollada por la empresa General Atomics (K. Schultz, 2003)
H2SO4 ↔ ½O2 + SO2 + H2O T: 1073 K
I2 + SO2 + 2H2O ↔ H2SO4 + 2HI T: 393 K
2HI ↔ I2 + H2 T: 723 K
Este es un esquema global de las distintas vías de producción de hidrógeno que se emplean comercialmente en la actualidad y de las áreas de más interés en desarrollo.
Almacenamiento de Hidrógeno
Aquí nos encontramos con uno de los mayores problemas técnicos que plantea la utilización del hidrógeno. Debido a su baja densidad energética, es muy complicado almacenar en un volumen razonable y sobre todo a bajo coste una cantidad de energía medianamente aceptable. Por ello, uno de los caballos de batalla de la economía del hidrógeno es el desarrollo de sistemas de almacenamiento con costes aceptables.
De los métodos planteados, sólo en el almacenamiento mediante hidruros metálicos, no es absolutamente necesaria la utilización de compresores; si bien, la presión que e necesario alcanzar varía de un método a otro. La complicación técnica se sitúa en que, por un lado, es necesario modificar el sello de los compresores tradicionales debido a la alta difusividad del hidrógeno (Hart 1997), y por otro la cantidad de volumen de hidrógeno a comprimir para alcanzar una masa aceptable es muy importante, lo que se traduce en unos costes muy elevados.
Dependiendo del proceso utilizado, es posible utilizar un “expander” para recuperar parte de la energía utilizada en la compresión.
Hay que tener en cuenta que de los métodos planteados, la compresión subterránea tan solo es válida cuando se trabaja con grandes cantidades de hidrógeno.
Para vehículos de transporte, cualquiera de los tres primeros métodos sería valido; si bien, se aprecia que el coste de almacenamiento es elevado.
Clatratos
Los clatratos son compuestos en los que las moléculas de un gas están encapsuladas en una red cristalina de moléculas de otro compuesto, usualmente agua. Se sabe que los clatratos de agua están presentes en cantidades abundantes en el fondo oceánico, donde dominan presiones suficientemente elevadas para estabilizarlos.

En estos hidratos las moléculas de agua forman cajas en las que un gas “huésped”, como el metano, queda atrapado. Se ha demostrado hace algunos años (Mao, W.L. et al. Science 2002: 297, 2247) que las moléculas de hidrógeno pueden encapsularse en estructuras clatrato a presiones del orden de 2.000 atmósferas, excesivamente elevadas para usarlos como almacén de hidrógeno.
Por tanto, estos clatratos de agua almacenan cantidades de hidrógeno comparables a otros sistemas de almacenamiento, tales como los hidruros de metales ligeros y, por supuesto, tienen una capacidad de almacenamiento superior a otros criosistemas que utilizan adsorbentes con una elevada superficie específica.
En los clatratos de hidrógeno puro se acomodan cuatro moléculas de hidrógeno en las cajas grandes y otras dos en las pequeñas, lo que proporciona una composición global: (2H2)2 (4H2) 17 H2O, que corresponde a un contenido de hidrógeno de 5% en peso. Se ha puesto de relieve que se puede conseguir un hidrato estable llenando solamente una parte de las cavidades grandes con THF. La cantidad de THF incorporado es un parámetro esencial. Por encima del umbral 2% molar, solo las cavidades pequeñas acomodan las moléculas de hidrógeno, de tal forma que la capacidad de almacenamiento se reduce a 2% en peso. Por debajo del 4% de THF, el hidrógeno empieza a penetrar en las cavidades más grandes y la capacidad de almacenamiento de H2 alcanza 4% en peso.
Es importante señalar que estos clatratos ofrecen ciertas ventajas que los hacen atractivos para uso en almacenamiento. En particular, los materiales de almacenamiento (agua y THF) son muy baratos comparados a los hidruros metálicos u otras alternativas de almacenamiento químico. No obstante, presentan una barrera importante y es que la velocidad de formación de estos hidratos es generalmente baja, debido al transporte difusional del H2 que opera durante la formación de la red cristalina del clatratso, y que transcurre a lo largo de días. Recientemente se ha logrado acelerar el proceso de formación de estos clatratos de H2 mediante la dispersión del hidrato sobre microesferas de sílice con elevada superficie específica. Esta modificación tan simple reduce el proceso de formación del hidrato a solamente unas horas.
Los clatratos representan una opción simple de almacenamiento de hidrógeno gaseoso, si bien hasta la fecha la presión externa requerida para mantener la estabilidad de estos compuestos es muy elevada. Esta tecnología ha dado un paso importante recientemente cuando se ha demostrado que incorporando pequeñas cantidades de un disolvente común (tetrahidrofurano) puede reducir sustancialmente esta presión lo que, a su vez, permite almacenamiento de hidrógeno hasta 4% en peso.
Mg
El magnesio es un elemento abundante, barato, ligero y que absorbe grandes cantidades de hidrogeno (7.6 % en peso) formando hidruro de magnesio (MgH2), lo que lo hace idóneo para aplicaciones móviles. Sin embargo, presenta algunas limitaciones comunes a otros elementos ligeros que tambiénabsorben grandes cantidades de hidrógeno: Los hidruros formados son compuestos muy estables con procesos de absorción y desorción de hidrógeno muy lentos, lo que significa que se necesita una temperatura elevada (~300ºC) para extraer e introducir el hidrógeno, planteando duras exigencias para su uso en aplicaciones móviles.
Para reducir esta temperatura, este grupo prepara láminas de magnesio de unas pocas decenas de nanómetros de espesor.

La reducción a escala nanométrica de los granos que forman las películas produce una aceleración de los procesos de absorción y desorción del hidrógeno así como una menor estabilidad del compuesto (debido a la elevada superficie existente) y, como consecuencia, una reducción de la temperatura necesaria para extraer e introducir el hidrógeno.
Sin embargo, es evidente que, desde el punto de vista de la capacidad, las nanoestructuras en láminas no son viables para almacenar hidrógeno. Para ello es necesario sintetizar una mayor cantidad de material sin perder el carácter de nanostructura, esto es, en forma de nanopartículas. Este proceso se complica debido a la facilidad que tienen las nanopartículas de magnesio para aglomerarse, reaccionar fácilmente, oxidarse y, en consecuencia, perder sus propiedades.
Anexo
(Europa vs el hidrógeno)
En enero de 2004, siguiendo las recomendaciones del Grupo de alto nivel (High Level Group), la Comisión Europea creó la Plataforma Europea del Hidrógeno y las Pilas de Combustible (HFP - European Hydrogen & Fuel Cell Technology Platform) una asociación de más de 300 grupos de interés. ¿Su cometido? Preparar y dirigir una estrategia efectiva para llevar el hidrógeno y las pilas de combustible al mercado con el objetivo de beneficiarse de su gran potencial económico y medioambiental.
Para guiar las actividades, junto con varios grupos subsidiarios1, se creó un Consejo Asesor (Advisory Council) de 35 representantes de origen diverso entre los que se encuentra la industria, la Comisión Europea, autoridades públicas, académicas y ONGs del sector. Además se crearon dos Paneles de Dirección (Steering Panels) denominados Agenda de Investigación Estratégica (Strategic Research Agenda - SRA) y Estrategia de Despliegue (Deployment Strategy - DS) cuyo objetivo es el de conducir los avances hacia la transición.
Este informe proporciona una visión de conjunto del trabajo que se está llevando a cabo. Para obtener más detalles se pueden consultar los Resúmenes Ejecutivos obtenidos en la SRA y en la DS. Ambos documentos fueron aprobados por el Consejo Asesor en diciembre de 2004.
Las razones de la economía energética del hidrógeno y las pilas de combustible no han sido nunca tan convincentes: las fluctuaciones en los precios del petróleo, la preocupación por el calentamiento global, y la alarmante creciente demanda de energía han evidenciado la inmensidad, y urgencia, del desafío de la energía global. De hecho, el hidrógeno está ahora ampliamente reconocido como un vector energético flexible y respetuoso con el entorno, cuyo potencial no atañe únicamente a la reducción sustancial de las emisiones de gases de efecto invernadero (GHG) y consecuente mejora de la calidad del aire, sino que supone un sistema de suministro energético seguro y, en particular con unas consecuencias significativas en el sector transportes. Asimismo, los combustibles que contienen hidrógeno se pueden emplear en sistemas estacionarios de pila de combustible, proporcionando una amplia flexibilidad para el uso de las pilas como sistemas combinados de producción de calor y electricidad.
Descargar
| Enviado por: | Kareem |
| Idioma: | castellano |
| País: | Panamá |
