Ingeniero Químico
Aguas
PRACTICAS
GENERALES
DE AGUAS
1ª EVALUACION
INDICE
Pags
Practica 1 2-7
Practica 2 8-12
Practica 3 13
Practica 4 13-14
Practica 5 14
Practica 6 14
Practica 7 15-16
Practica 8 16-18
Practica 9 18-19
Practica 10 19-20
Practica 12 20-23
Practica 13 23-24
Practica 14 24-28
Practica 15 28-30
Practica 15 (bis) 30-31
Practica 16 32
PRACTICA Nº1 “Reconocimiento de material”
1.-Realiza un dibujo del material habitual en un laboratorio
buretas probetas

matraz pera

pipetas pi-pum micro pipetas

pipeta pasteur embudos


gradillas portacubetas con cubetas


mortero soportes


autoclave estufa


ph-metro portátil espectrofotómetro


balanza electrónica embudo buchner


mechero matraz aforado


agitador baños


centrífuga conductímetro


cucharas escobas


floculador campana


microscopio pipetas


secador tiras de ph.

turbidimetro
PRACTICA 2º “Pipetas”
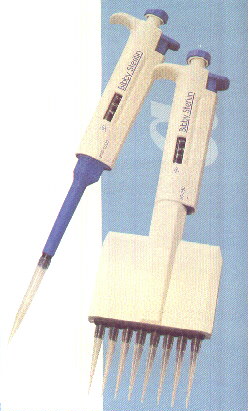
1.- Tomar 5 tubos de ensayo y una pipeta de 5ml. con divisiones de 1/10, a continuación realizar un pipeteo de 5ml. y luego un vertido de 1ml. en cada tubo de ensayo. Comprobar los resultados con una micropipeta automática.
Mat. Utilizado:5 tubos de ensayo
1 pipeta de 5 ml con divisiones 1/10 con una pera1 micropipeta automática de 500 microlitros
1 vaso de precipitados
1 gradilla
Procedimiento: 1.-Hemos llenado de agua un vaso de precipitados y ponemos la pera sobre la pipeta.
2.-Pipeteamos 5 ml de agua con una pipeta de 5 ml, divisiones 1/10 y vertemos 1 ml en cada tubo de ensayo. (llenamos la pipeta hasta la marca de 0)
3.-Comprobamos con una micropipeta automática de 500 microlitros con lo cual si hemos hecho bien la práctica haremos dos aspiraciones con la micropipeta en cada tubo. 500microlitros=0.5 ml.
Objetivo: Iniciamos con el material de laboratorio y aprender a pipetear pequeñas cantidades de agua así como utilización de una micropipeta y aprenderá manejar cantidades inferiores a 1 ml y manejo de las peras.
Resultado: Al final de la práctica hemos comprobado que realmente hay un ml en cada tubo ya que hemos realizado dos aspiraciones con la micropipeta cogiendo la cantidad justa de agua que hay en el tubo sin entrar en ella aire y tampoco sin dejar agua.
2.- Pipetear 3 ml. con una pipeta de 10 ml. y divisiones 1/10 y echarlos a un tubo de ensayo, hacer lo mismo con una pipeta de 5 ml. y divisiones de 1/10 y lo mismo con una pipeta de 1ml. y divisiones de 1/10. Comprobar los resultados con una micropipeta.
Mat. Utilizado:1 pipeta de 10 ml, divisiones 1/10
“ 5 ml “
“ 1ml “
3 tubos de ensayo
1 micropipeta automática
un vaso
una gradilla
Procedimiento: 1.-Llenamos un vaso de agua
2.-Cogemos la pipeta de 10 ml y pipeteamos 3 ml, con lo cual la enrasaremos hasta la marca de ds7 ml y lo vertimos en un tubo de ensayo.
3.-Cogemos la pipeta de 5 ml y pipeteamos 3 ml, con lo cual en rasaremos hasta la marca de 2 ml y lo vertimos en un tubo de ensayo.
4.-Cogemos la pipeta de un ml y pipeteamos 1ml y lo vertimos en un tubo de ensayo, tendremos qué hacer el mismo ejercicio 2 veces más para poder tener en el tubo de ensayo 3 ml.
3.-Con una micropipeta de 500 microlitros comprobaremos los resultados aspirando con ella 6 veces en cada tubo y poniéndolo en otro cada vez, ya que en cada aspiración cogemos 0.5 ml y en total hay que coger 3ml.
Objetivo: Continuar practicando el pipeteado con pipetas de distinta volumen y realizar las comprobaciones con micropipetas.
Resultado: Al final de la práctica hemos comprobado que hay 3 ml en cada tubo ya que hemos pipeteado 6 veces den cada tubo con la misma pipeta.
3.- Pipetear 1,750 ml.
-
Tomando 1,7 ml. con la pipeta adecuada y 0.050 ml. con una micropipeta automática.
-
Tomando todo el volumen con una micropipeta automática.
Mat. Utilizado:1 vaso de precipitados
-
pipeta de 2 ml de divisiones 1/100
-
tubos de ensayo
1 pera
1 micropipeta de 5-50 microlitros
1 micropipeta de 100 microlitros.
1 gradilla.
Procedimiento:1.-Llenamos un vaso de precipitados con agua.
2.-.Cogemos la pipeta de 2 ml con divisiones 1/100 y pipeteamos 1,7 ml hasta la marca de 0.3 ml y luego lo vertimos en un tubo de ensayo.
3- Con una pipeta de 5-50ml la ponemos en 50 microlitros.
4.-Realizamos una aspiración con la micropipeta y así pipeteamos 0,050 ml. que es lo que nos falta para tener 1,750 ml
5.- Lo vertimos en del mismo tubo de ensayo que hemos vertido la pipeta.
Procedimiento (2º):1.-Llenamos un vaso de precipitados con agua.
2.-Cogemos la micropipeta de 500 microlitros
3.-Realizamos 3 aspiraciones con esta, dejando cada vez el agua pipeteada en el tubo de ensayo, al cabo de las tres, el agua pipeteada será de 1,5 ml.
4.-Cogemos la pipeta de 100 microlitros.
5.-Con esta pipeta realizamos 2 aspiraciones vertiendo cada una en el mismo tubo de ensayo que el pto. 3 con lo cual ya tenemos pipeteados 1,700 ml.
6.- Cogemos la pipeta de 5-50 microlitros y marcamos 50 microlitros
7.- Con esta pipeta realizamos una aspiración vertiéndola en el mismo tubo de ensayo que antes teniendo así 1,750 ml pipeteados.
Objetivo: aprender a combinar la utilización de pipetas normales y micropipetas de distintas cantidades con distintas mediciones.
Resultado:Al final de la práctica podemos comprobar con una micropipeta de 100 microlitros por ejemplo que hemos hecho bien el ejercicio . Para ello tendríamos que realizar 17 pipeteos con ella y luego uno con una de 50 microlitros, al final de la cual se tienen que haber consumido el agua del tubo.
4.- Pipetear 3,755 ml. Razonar y comprobar el resultado.
Mat. Utilizado:1 pipeta de 5 ml. de divisiones 1/100
1 vaso de precipitados
1 tubo de ensayo
1 pera
1 micropipeta de 5-50 microlitros
1 gradilla
Procedimiento:1.-Llenamos el vaso con agua.
2.-Cogemos la pipeta de 5 ml. 1/100 con la pera puesta y aspiramos con ella 3,7 ml, es decir hasta la marca de 1,3 ml.
3.-Vertimos el agua pipetea da en el tubo de ensayo que esta reposando en la gradilla.
4.-Cogemos la micropipeta de 5-50 microlitros y hacemos una aspiración de 509 microlitros y lo vertimos en el tubo de ensayo. Ahora el volumen recogido es de 3,750 microlitros
5.-Cogemos la misma micropipeta pero ahora la marcamos para que aspire 5 microlitros, lo hacemos y lo vertimos
Objetivo:Aprender a pipetear combinando la utilización de micropipetas y pipetas normales con distintos volúmenes.
Resultado:Al final comprobamos el resultado con una micropipeta de 500 microlitro, con la cual tendremos que realizar siete aspiraciones del tubo de ensayo, (3,5 ml.) luego con la de 100 hacemos 2 aspiraciones (volumen total recogido= 3,7 ml) luego con la de 50 microlitros, una aspiración (V.T. recogido =3,75 ml), luego con la de 5 microlitross (V.T. recogido = 3,755 ml) quedando assí recogido justamente el volumen pipeteado anteriormente.
5.-Dibujar las pipetas necesarias para coger 0,075, 1,965, 7,54 ml.
PRACTICA 3 “Matraces”
1.- Añadir 50 ml. de agua de un vaso de precipitados a un matraz de 100 ml. completar con disolvente hasta el aforo.
Mat. Utilizado:1vaso de precipitado
1 matraz
1 pipeta de 10 ml.
1 pera
1 embudo
1 pipeta pasteur (opcional)
Procedimiento:1.- Llenamos un vaso de precipitados con agua.
2.-.Para hacerlo de una forma más exacta pipeteamos 5 veces 10 ml de agua con una pipeta de 10 ml y los vertimos en el matraz.
3.-Colocamos un embudo en el matraz, y añadimos el disolvente hasta enrasarlo en los 100 ml del matraz.
Objetivos:Aprender a enrasar en matraces.
Resultaddo:Obtenemos un matraz que contiene exactamente 100 ml.
Observaciones: Para un enrase exacto la curvatura del agua debe enrasar por encima de la marca.
Para hacerlo mas exacto podemos ajustar el enrase con una pipeta pasteur.
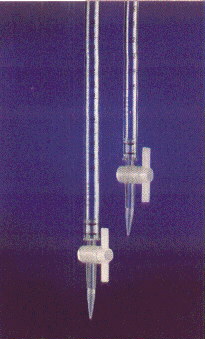
PRACTICA 4 “Buretas”
1.- Llenar una bureta hasta la marca 0 y dejar caer lentamente su contenido a un matraz erlenmeyer o vaso de precipitado
Mat. Utilizado:1 bureta
1 matraz erlemeyer
1vaso de precipitado
1 embudo
Procedimiento:1.-Llenamos el vaso de precipitados con agua.
2.-Con la bureta colocada como corresponde y cerrada la llenamos hasta la marca de 0 mediante un embudo.
3.-Colocamos el matraz erlenmeyer debajo de la bureta y abrimos muy poco la bureta con la posición que corresponde y ser deja caer el agua gota a gota hasta que se vacía la bureta.
Objetivo:Aprender el correcto manejo de la bureta
Resultado :Obtenemos el matraz erlenmeyer con la misma cantidad de agua que había en la bureta.
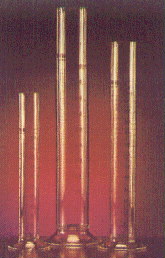
PRACTICA 5 “Probetas”
1.- Tomar una probeta a 50, 100 o 250 ml., después tomar el matraz aforado correspondiente y verter el contenido de la probeta. Compara los resultados.
Mat. Utilizado:1 probeta
1 matraz aforado de d50 ml
1 matraz aforrado de 1100 ml
1 matraz aforado de 250 ml
1 embudo
1 vaso de precipitados
1 pipeta pasteur (opcional)
Procedimiento:1.-Llenamos un vaso con agua
2.-Lo vertimos mediante un embudo en una probeta hasta la marca de 50 ml. ayudándonos si fuera necesario de una pipeta pasteur.
3.-Una vez enrasado lo vertimos en un matraz aforado de 50ml.
4.-Repetimos lo mismo con 100 ml y 250ml.
Objetivo. Comprobar los diferentes enrases que se dan en buretas y matraces.
Resultado:Obtenemos que al pasar los 50 ml de las probetas al matraz no se enrasa justamente con la línea marcada en el cuello de esto sino que la sobrepasa o no llega a ella. Esto también ocurre en los 100 y 2250 ml y se debe a que es más difícil enrasar en cuellos anchos como en las probetras que en cuellos estrechos como el matraz.
PRACTICA 6 “Dispensadores automáticos”
1.- Tomar un dispensador automático y echar 1 ml. luego 4 ml. a un vaso de precipitados, a continuación comprueba con una pipeta de 5 ml. y después con micropipetas la exactitud del resultado.
Material: Un dispensador automático, un vaso de precipitados de 25 ml., una pipeta de 5 ml. y una micropipeta de 500.
Procedimiento: Con el dispensador automático echamos 1 ml. al vaso de precipitados de 25 ml. y 4 ml. con la pipeta. Compruebo el resultado con la pipeta y con la micropipeta.
Observaciones: El resultado es muy inexacto, con la micropipeta he pipeteado para coger 5 ml. 10 veces.
PRACTICA 7 “Balanzas”
1.- Pesar 10 gr. de NaCl en la balanza electrónica
Mat. Utilizado:1 balanza electrónica
Cloruro de sodio
Un vidrio de reloj
Una cucharilla
Procedimiento:1.-Ponemos en funcionamiento la balanza electrónica (on)
2.-Colocamos el vidrio de reloj y “anulamos” su peso (lo taramos), para que a la hora de pesar el ClNa no tengamos en cuenta su peso. Para ello pretamos a la tecla (Zero)
3.-Pesamos con la cucharilla 10 g. De ClNa
Objetivo:Aprender a pesar en una balanza electrónica.
Resultado: Al final obtenemos 10 g. Exactos ya que lo mide con dos decimales de ClNa
2.-Pipetear 5 ml de agua y pesarlos. Averiguar la densidad del agua y comprobarla con el densímetro.
Mat. Utilizado:1 pipeta
1 pera
2 vasos de precipitados
1 balanza electrónica
Procedimiento:1.-Ponemos el vaso con los 5 ml y anulamos su peso como en el ejercicio anterior.
2.-Pipeteamos 5 ml de agua con la pipeta de una vaso de precipitados
3.- Lo depositamos en un 2º vaso de precipitado
4.-Ponemos en funcionamiento la balanza (on)
5.-Pesamos los 5 ml de agua y nos indica que pesa 4,96
Objetivo:Saber la densidad del agua.
Resultado:Una vez obtenidos los datos calculamos su densidad
D= m/v= 4,96/5= 1 aproximadamente.
PRACTICA 8 “Filtros”
1.-Confecciona un filtro liso
3.-Añade una cucharada de fenolftaleina a un vaso de agua, después realiza un filtrado, añade al líquido filtrado unas gotas de hidróxido amónico (NH4OH), veremos que si ha pasado fenolftaleina con el filtrado, éste tomara un color rosa. Añade también unas gotas del mismo álcali al filtro, verás que tomará color rosa intenso.
Mat. Utilizado:2 vasos de precipitados
1 cuchara
fenolftaleina
1 filtro liso
1 embudo
NH4OH
Procedimiento:1.-En un vaso disolvemos 1 cucharada de fenolftaleina.
2.-Hacemos nosotros mismos un filtro liso y lo colocamos sobre el embudo en el 2º vaso.
3.-Vertimos el agua con fenolftaleina en el filtro de forma que la fenolftaleina disuelta de forma que este permitirá el paso del agua pero no del soluto.
4.-Retiramos el filtro con la fenolftaleina que ha quedado retenida
Objetivo :Aprender a trabajar con un filtro realizado por nosotros mismos
Resultado:Ahora nos toca comprobar sí hemos hecho bien el ejercicio par ello depositaremos unas gotas de NH4OH en el agua filtrada. Si lo hemos filtrado bien ,el agua no tiene qué tomar color rosa. Al mismo tiempo pondremos unas gotas también en el filtro con fenolftaleina y veremos como este si que coge el color rosado intenso.
Osbservaciones:A la hora de colocar el filtro sobre el embudo nos aseguraremos de que este no queda por encima del borde del embudo sino que su borde ha de estar un dedo por debajo.
PRACTICA 9 “Centrífugas”
1.-Tomar dos tubos de centrífuga o de ensayo y añadir cloruro sódico hasta saturar la disolución, disolverlos en el agitador de tubos, centrifugar 5 minutos a 2.000 r.p.m. Posteriormente separar la fase líquida (sobrenadante) por decantación o con pipeta pasteur de la fase sólida (sal)
Mat. Utilizado:2 tubos de ensayo
ClNa
1 centrífuga
1 pasteur
1 vaso de precipitado
1 gradilla
1 cuchara.
Procedimiento:1.-Con un vaso de precipitado con agua llenamos 2 tubos de ensayo
2.-.Echamos ClNa con una cuchara en los tubos de ensayo hasta que disolución queda sobresaturada
3.-Preparamos la centrífuga para ello colocamos loas 2 tubos de ensayo de forma paralela para que la máquina esté equilibrada y seleccionamos el tº y las r.p.m. que nos piden (5 min. 2000r.p.m) y dejamos actuar a la maquina.
4.-Una vez acabada la centrífuga nos queda todo el soluto (NaCl) de forma compacta en el fondo del tubo de ensayo
5.-Sacamos los tubos y con una pipeta pasteur retiramos el agua con cuidado de no arrastrar el soluto que tiene que quedar solo en el fondo.
Objetivo:Aprender el manejo de la centrífuga..
Resultado:Obtenemos una separación entre la fase líquida y la fase solida que queda compacta
PRACTICA 10 “Baños termostatizados”
1.-Toma dos tubos de hemólisis y colócalos dentro de una gradilla en un baño termostatizado a una temperatura de 37ºC
Mat. Utilizado:2 tubos de ensayo
1 gradilla
1termostato con 2 termometros
Procedimiento:1.-Llenamos 2 tubos de ensayo con agua.
2.-Los ponemos en una gradilla
3.-Los metemos en el termostato
4.-Enchufamos y ponemos en funcionamiento el termostato
5.-Seleccionamos los 37ºC en el termostato de la izquierda ¿Cómo se hace? Soltamos un poco el capuchón y girándolo a un lado o al otro seleccionamos la tª deseada.
6.-Esperamos hasta que el otro termómetro alcance la tª
7.-Retiramos los tubos una vez que se han calentado
Objetivos:Aprender a utilizar el termostato y los termómetros que tiene.
Resultado: Obtenemos el material que deseemos caliente a una tª determinada.
PRACTICA 12 “Limpieza, descontaminación, desinfección y esterilización”
1.-Preparar 50 ml de mezcla sulfocrómica.
Mezcla sulfocrómica:
Dicromato potásico............5g.
Ácido sulfúrico concentrado.....12,5 ml
Agua destilada c.s.p...................50 ml
Mat. Utilizado:Dicromato potásico
Ácido sulfúrico
Agua destilada
1 vaso de precipitado
1 matraz de 50 ml
guantes
1 balanza
1 cucharada
1 pipeta
-
pera
1 vidrio de reloj
1 campana
1 pipeta pasteur
Procedimiento:1.-Echamos alrededor de 20 ml de agua en el vaso de precipitados
2.-Pesamos en la balanza electrónica 5 g de dicromato potásico
3.-Lo vertimos al vaso y lo disolvemos
4.- Lo vertimos en el matraz
5.-Pipeteamos 12,5 ml de ácido y lo vertimos al matraz.
6.-Enrasamos con agua hasta alcanzar los 50 ml
7.-Para un mejor enrase se puede utiliza la pasteur
Objetivo:Hacer una mezcla en la que intervienen ácidos, sales y agua.
Resultado:Obtenemos una mezcla sulfocrómica de 50 ml de volumen
2.-Esterilizar en el horno Poupinel el siguiente material de vidrio (pipetas, tubos de ensayo, matraces probetas....)Comprobar que las tiras indicadoras cambian de color.
Mat. Utilizado:Mat que queremos esterilizar
1 horno poupinel
1 reloj
Tiras indicadoras
Papel de aluminio
Algodón graso.
Procedimiento:1.-Elegimos el mat. A esterilizar.
2.-Tapamos con algodón graso la boca de cada instrumento para esterilizarlo.
3.-Envolvemos cada elemento con papel de aluminio excepto pipetas que se envuelven todas juntas al igual que los tapones.
4.-En el cuello de cada elemento envuelto por papel de aluminio se coloca un trozo de tira indicadora.
5.-Se coloca todo en el horno
6.-Se enchufar y se pone en funcionamiento el horno
7.-Elegimos la tª en función del tº que queremos que este esterilizando 1 hora.........180º 1,5 hora......160º
El tº se toma a partir de que el horno llegue a la tª
8.-Se pone el seguro en la ruleta de la tª para que esta no varié.
9.-Nuestra elección fue de una hora (180ºC), tras este tiempo, se apaga el horno.
10.-Sacamos los aparatos cuando la tª del horno ha bajado hasta los 10º
11.-Comprobamos que las tiras indicadoras han cambiado de color.
Objetivo:Esterilizar elementos de laboratorio
Resultado:Obtenemos los elementos esterilizados
3.-Esterilizar en el Autoclave material de vidrio y metálico. Comprobar que las tiras indicadoras situadas en el interior de algún material de vidrio ha virado de color
Mat. Utilizado:El mismo que el pto. 2
Procedimiento:Igual hasta el paso cuarto en el pto. 2
5.-Nos aseguramos de que el agua llega hasta la rejilla.
6.-Mentemos todo en el autoclave nos aseguramos al cerrarlo
7.-Seleccionamos la tª que queremos alcanzar y que esta relacionada con la presión. Seleccionamos 120ººC=1 atm.
8.-Seleccionamos el tº alrededor de 20 min.
9.-Ponemos en funcionamiento STR
10.-El autoclave empieza a subir su tª y presiona hasta alcanzar la tª y presión seleccionada. 28 min.
11.-Después de alcanzar permanece los 20 min seleccionados para esterilizarlo.
12.-Tras los 20 min. Tenemos que esperar a que la presión disminuya hasta 0 para abrirlo 19-20 min.
13.-Sacamos los materiales.
14.-T. Transcurrido=68 min
Objetivo:Aprender a esterilizar con el Autoclave
Resultado:Mat. Esterilizado.
Observaciones:No abrirlo hasta que la presión no disminuya a cero por qué puede explotar.
4.-Realizar un control físico de esterilización. Sumar el tiempo que le cuesta alcanzar la temperatura fijada mas el tiempo de esterilización mas el tiempo de descenso de la temperatura hasta abrir el autoclave.
PRACTICA 13 “Manejo del microscopio”
1.-Enfocar una cámara de recuento celular (Neubauer) con objetivos de 10x y 40x en microscopio IROSCOPE MODELO W-3K
Mat utilizado:1 microscopio
1 cámara de recuento celular
Procedimiento:1.- Enchufamos el microscopio
2.-Colocamos la cámara que queremos observar entre las pinzas del microscopio
3.-Encendemos la luz y la graduamos a la intensidad que queremos.
4.-Miramos por el microscopio con la posibilidad de ir variando la imagen mediante las ruedas
Objetivo:Aprender a observar en el microscopio
2.-Toma una muestra de agua contaminada (agua de tortugas u otra similar ) y realizar en un porta excavado una gota pendiente con dicha agua.
Mat. Utilizado:1 microscopio
1 porta excavado
Procedimiento:1.-.Enchufamos el microscopio
2.-Colocamos la cámara que queremos observar entre las pinzas del microscopio
3.- Encendemos la luz y la graduamos a la intensidad que queremos.
4Miramos por el microscopio variando la imagen hasta que encontremos la parte marcada en el porta.
Objetivo: Aprender a observar en el microscopio
PRACTICA 14 “Disoluciones y diluciones”
1.-Preparar 100 ml de alcohol etílico de 70º a partir del alcohol etílico de 96º
Mat. Utilizado:Alcohol etílico 96º
Agua destilada
Pipetas
1 vaso de precipitados
Procedimiento:1.-Tras hacer los cálculos
2.-Recoger 72,9 ml de alcohol etílico 96º y lo vertimos en un vaso
3.-.Enrasamos ese vaso con alcohol , con agua hasta llegar a los 100 ml
Objetivo¡: Aprender a hacer disoluciones y diluciones
Resultado:Obtenemos 100 ml de alcohol 70º a partir de alcohol etílico 96º
2.-Preparar 100 ml de hipoclorito sódico (lejía común) al 0,5% a partir de hipoclorito sódico comercial (4%)
Mat. Utilizado:Hipoclorito sodico
Agua destilada
1 vaso de precipitados
Pipetas
Procedimiento:Tras los cálculos:
1.-Recogemos 12,5 ml de hipoclorito sodico 4%, y lo vertimos en un vaso
2.- Enrasamos con agua hasta 100ml
Objetivo:Aprender a hacer disoluciones y diluciones
Resultado:Obtenemos hipoclorito sodico 0,5% a partir de hipoclorito sódico comercial 4%
3.-Diluir una muestra de agua de río a:
1/5
1/100
1/10.000
1/100.000
Nota:No debes sobrepasar en ninguna caso 15 ml
4.-Determinación del dióxido de azufre (SO2) atmosférico por el método de la Thorina. Aquí nos vamos a limitar sólo a elaborar algunos de sus componentes.
-Preparar 100 ml de ácido perclórico 0,1M a partir del comercial. Hazlo tomando la disolución en gramos y mililitros.
-Preparar 100 ml de ácido perclórico 0,01 M a partir del anterior.
-Preparar 100 ml de peróxido de hidrógeno (H2O2) a partir del comercial
-Preparar 100 ml de ácido sulfúrico 0,1N.
-Preparar una solución patrón de 100 microgramos de SO2 por mililitro, a partir del anterior
-Preparar 100 ml de soluciones patrones equivalentes a 2,4,8 y 10 ug de SO2/ml a partir de lo anterior.
PRACTICA 15 “Medida del pH”
1.-Medir el pH del agua usando tiras reactivas y el peachímetro.
Mat. Utilizado:Tiras reactivas.
Peachímetro
Tubos de ensayo
Agua
Procedimiento: a)Con tiras reactivas.
1.-Llenamos un tubo de ensayo con agua
2.-Cortamos un trozo de tira reactiva y la mojamos con el agua
3.-Al cabo de un momento la tira reactiva nos mostrará el valor del pH del agua medida atendiendo a un patrón de colores.
b)Con el peachímetro
1.-Calibramos el peachímetro con los tampones 4 y 9
2.-Entre tampón y tampón limpiamos el tubo del peachímetro
3.-Una vez calibrado y limpio el tubo , lo introducimos en el tubo con agua para medir
4.- El peachímetro nos dará el valor del pH en el agua.
Objetivo:Aprender a medir el pH del agua de distintas formas , ya sea con tiras reactivas o con un peachímetro.
Resultado: Obtenemos el valor del pH del agua , estando de una forma más precisa en el peachímetro..
2.- Tomar un tubo de ensayo de cristal y añadirle 1 ml de HCl 1 M y unas gotas del indicador rojo congo o naranja de metilo al 0,5% en agua, a continuación añadir gota a gota 1 M NaOH. Determinar el pH al principio, en el momento del viraje de color (neutralización) y al final.
3.-Tomar un tubo de ensayo de cristal y añadirle 1 ml de NaOH 1M y unas gotas del indicador fenolftaleina al 0,5% en disolución hidroalcohólica, a continuación añadir gota a gota HCl 1 M. Determinar el pH al principio, en el momento del viraje de color (neutralización) y al final.
PRACTICA 15 “Titulación ácido base”
1.- Titular 10 ml de HCl 1 M ( en matraz erlenmeyer) con una disolución 1M de KOH ( en bureta se ponen 20 ml ) usar como indicador el rojo congo o naranja de metilo. Calcular previamente los mililitros de HCl necesarios para producir la neutralización de la base y comprobarlo después de realizar la práctica.
2.-Titular 10 ml de amoniaco KOH 1M con ácido clorhídrico HCl 1M. Usar fenolftaleina como indicador., Calcular previamente los mililitros de HCl necesarios para producir la neutralización de la base y comprobarlo después de realizar la práctica
PRACTICA 16 “Manejo del espectrofotómetro”
1.-Tomar 3 tubos de ensayo y echar en el 1º dos gotas de rojo de metilo (blanco), en el 2ºº cuatro gotas (patrón) y en el 3º seis gotas (problema). A continuación y suponiendo que el tubo patrón tiene una concentración de 10 gr. determinar la concentración del tubo problema de dos formas diferentes:
-Mediante cálculos matemáticos.
-Introduciendo el valor del patrón.(lectura directa)
Procedimiento:Tras calibrar el espectrofotómetro , realizamos la medida de los tubos de ensayo , limpiando para ello la parte sensible por donde va a penetrar la luz para realizar la medida, que vendrá reflejada en la máquina.
24
Descargar
| Enviado por: | Crash |
| Idioma: | castellano |
| País: | España |
