Química
Ácidos y bases
INFORME
EXPERIMENTO REALIZADO EN EL LABORATORIO DE
CS. NATURALES
ACTIVIDAD DE LABORATORIO: REACCIONES QUÍMICAS INDICADORES QUÍMICOS.
ACIDEZ Y ALCALINIDAD DE DISTINTAS
SUSTANCIAS - INDICADORES:
Guía de estudios y respuestas del apunte:
Cuando comemos uvas, mandarinas o naranjas y no están aun bien maduras, su gusto es agrio desagradable decimos que esta
verde - ácido
Efectivamente, las frutas cuando están verdes, tienen exceso de unas sustancias llamadas ácidos.
hay otros alimentos o bien sustancias usadas en la industria que son ácidos.
Las sustancias que son lo contrario u opuestas a los ácidos se llaman alcalinas o básicas.
Los químicos, para saber si las sustancias son ácidas o básicas, usan compuestos llamados indicadores. estos tienen un color cuando se pone en contacto con los ácidos y adquieren otro color en contacto con las sustancias básicas.
EXISTEN COLORANTES NATURALES Y ARTIFICIALES:
Los indicadores naturales se extraen de las plantas y flores. una de las plantas que tiene indicador en sus hojas, es el repollo colorado.
PARTE A
¿obtenemos nuestro indicador?
Materiales a utilizar:
-
varias hojas de repollo colorado
-
rallador de verduras
-
1 plato
-
1 cuchillo
-
agua caliente
-
embudo
-
algodón
-
2 frascos de vidrio, uno de ellos con tapa
Ralla el repollo y córtalo en trozos muy pequeños machácalo bien.
Colócalo en uno de los frascos de vidrio y agrega agua caliente hasta cubrir las hojas, no más.
Guarda la solución del indicador en el frasco con tapa y colócaselo.
PARTE B
¿Probamos el indicador obtenido?
Busca los siguientes materiales
-
6 tubos de ensayo o pequeños frascos
-
gradilla para tubos de ensayo
-
varilla
-
bicarbonato de sodio
-
jugo de sodio
-
agua con jabón
-
alcohol
-
agua con sal
-
agua con azúcar
-
jugo de pomelo
| SUSTANCIAS | COLOR DEL INDICADOR | CARÁCTER DE LA SUSTANCIA: ACIDA BASICA O NEUTRA |
| ROSA CLARO ROSADO VERDOSO VIOLETA FUCSIA VERDE AZULADO | ACIDA ACIDA BÁSICO ALCALINO ACIDA ACIDO BÁSICO - ACIDO |
| AMARILLENTO | NEUTRO |
| FUCSIA | ACIDO |
| VIOLACEO | ACIDA |
| BORDO | ACIDA |
| VIOLETA AZULADO | ACIDA |
| LILA | BÁSICO |
Averigua con tu medico ¿que sustancias producidas por nuestro estomago nos hacen producir acidez?
Los jugos gástricos
¿Que medicamentos tomamos para evitar la acidez estomacal?
Antiácidos, protectores gástricos (RANITIDINA)
¿que carácter tienen estos medicamentos?
Protección de la mucosa gástrica.
Ácidos y bases
Dos tipos de compuestos químicos que presentan características opuestas. Los ácidos tienen un sabor agrio, colorean de rojo el tornasol (tinte vegetal obtenido de los líquenes, normalmente del género Variolaria, y que se utiliza en química para determinar la presencia de ácidos y bases en una disolución. Para indicar la presencia de un ácido o una base, se utilizan tiras de papel impregnadas en una disolución de tornasol azul o rojo, o pequeñas cantidades de la misma disolución; los ácidos colorean de rojo el tornasol azul, y las bases colorean de azul el tornasol rojo) y reaccionan con ciertos metales desprendiendo hidrógeno. Las bases tienen sabor amargo, colorean el tornasol de azul y tienen tacto jabonoso. Cuando se combina una disolución acuosa de un ácido con otra de una base, tiene lugar una reacción de neutralización. Esta reacción en la que, generalmente, se forman agua y sal, es muy rápida. Así, el ácido sulfúrico y el hidróxido de sodio NaOH, producen agua y sulfato de sodio
H2SO4 + 2NaOH!2H2O + Na2SO4
Medida de la fuerza de ácidos o bases
La fuerza de un ácido se puede medir por su grado de disociación al transferir un protón al agua, produciendo el ion hidronio, H3O+. De igual modo, la fuerza de una base vendrá dada por su grado de aceptación de un protón del agua. Puede establecerse una escala apropiada de ácido-base según la cantidad de H3O+ formada en disoluciones acuosas de ácidos, o de la cantidad de OH- en disoluciones acuosas de bases. En el primer caso tendremos una escala pH, y en el segundo una escala pOH. El valor de pH es igual al logaritmo negativo de la concentración de ion hidronio y el de pOH al de la concentración de ion hidroxilo en una disolución acuosa:
pH = -log [H3O+]
pOH = -log [OH-]
El agua pura tiene un pH de 7,0 al añadirle ácido, la concentración de ion hidronio, [H3O+] aumenta respecto a la del agua pura, y el pH baja de 7,0 según la fuerza del ácido. El pOH del agua pura también es de 7,0, y, en presencia de una base cae por debajo de 7,0.
El químico estadounidense Gilbert N. Lewis expuso una nueva teoría de los ácidos y bases en la que no se requería la presencia de hidrógeno en el ácido. En ella se establece que los ácidos son receptores de uno o varios pares de electrones y las bases son donantes de uno o varios pares de electrones. Esta teoría también tiene la ventaja de que es válida con disolventes distintos del agua y no se requiere la formación de una sal o de pares ácido-base conjugados. Según esto, el amoníaco se comporta como una base, pues es capaz de ceder un par de electrones al trifluoruro de boro para formar un par ácido-base:
H3N: + BF!H3N-BF3
Soluciones:
Definimos una solución neutra, una ácida, y una básica, desde el punto de vista ácido base, como aquellas donde se cumple:
Una solución neutra [H3O+] = [OH-]
Una solución ácida [H3O+] > [OH-]
Una solución básica [H3O+] < [OH-]
A 25º C
En una solución neutra [H3O+] = [OH-] = 1,00.10 -7 M
En una solución ácida
En una solución básica
Es importante recordar que el valor del producto [H3O+]. [OH-] debe ser constante, en agua o en soluciones acuosas diluidas, y que solo se modifica con la temperatura. [OH-]
| NOMBRE | FÓRMULA | PRESENTE EN | ||
| Ácidos | ||||
| Ácido acético | HC2H3O2 | Vinagre | ||
| Ácido acetilsalicílico | HC9H7O4 | Aspirina | ||
| Ácido ascórbico | H2C6H6O6 | Vitamina C | ||
| Ácido cítrico | H3C6H5O7 | Jugo de limón y de otros cítricos | ||
| Ácido clorhídrico | HCI | Jugos gástricos | ||
| Ácido sulfúrico | H2SO4 | Pilas | ||
| Bases | ||||
| Amoníaco | NH3 | Limpiadores domésticos | ||
| Hidróxido de calcio | Ca(OH)2 | Cal apagada | ||
| Hidróxido de magnesio | Mg(OH)2 | Lechada de magnesio | ||
| Hidróxido de potasio (también | KOH | Jabón suave | ||
| Hidróxido de sodio | NaOH | Limpiadores de tuberías y hornos | ||
Descripción de lo Realizado:
Una observación (creo yo) importante fue que el elemento de prioridad en este experimento, el repollo, fue traído solo por un grupo y gracias a que este generosamente dono parte de el repollo a cada uno de los otros grupos se pudo hacer el experimento, sin problemas.
Además de esto cabe destacar que un componente no de demasiada urgencia, fue donado por el profesor en muestra de su devoción por la enseñanza, y querer ayudarnos a poder tener experiencias “raras” o asombrosas paras lo que es nuestra vida cotidiana.
En otros aspectos del esto se puede decir que al parecer uno de los
De la experiencia realizada en el laboratorio de Cs Naturales, se obtuvieron conclusiones y aprendizaje nuevo acerca de las sustancias y la separación del agua en el momento que se la mezcla con el repollo y, a su vez con otras sustancias. Por otra parte se califico de ácidas bacica y/o alcalinas para saber de que tipo son.
A lo largo del experimento se machuco el repollo, se lo mezclo con agua caliente, y se lo puso en los tubos de ensayo. Después se puso cada sustancia en cada tubo, de esto se saco la conclusión de que por cada sustancia se manifestaba un color que determinaba que tipo de sustancia era. Por ejemplo: cuando se mezclo con limpiador de horno y del violáceo del repollo con el agua se torno amarillento esto no concluyo en que el limpiador de hornos es una sustancia casi neutra, con un pH de 6,0 y 10,5 además de que puede llegare a ser un elemento de limpieza se sabe algo más del mismo.
8
[H3O+] < 1,00.10 -7 M
[OH-] > 1,00.10 -7 M
[H3O+] > 1,00.10 -7 M
[OH-] < 1,00.10 -7 M
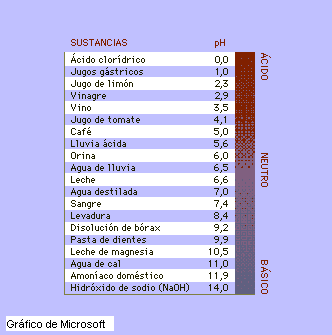
Acidos y bases corrientes
Escala de pH en soluciones comunes
Descargar
| Enviado por: | Federico Muro |
| Idioma: | castellano |
| País: | España |
