Química
Separaciones de sistemas materiales
QUÍMICA GENERAL
TRABAJO PRACTICO Nº 1
Separaciones de sistemas materiales
Fecha de entrega: 25/4
Año: 2001
Objetivo del trabajo práctico realizado.
Se debe lograr los componentes de un sistema heterogéneo en forma separada, es decir, apartar cada una de las sustancias puras que los componen. Se emplean para ello diversos métodos de separación (en sist. heterogéneos) y fraccionamiento (en las soluciones). De ésta última clase, utilizaremos la cristalización, pues se desea conseguir la sal disuelta aislada del solvente. Para todos los pasos previos, se utilizarán métodos de separación.
Por otra parte, se intenta observar las diferentes características de cada uno de los constituyentes, sus comportamientos y características, propias y exclusivas, que llevarán a la elección de uno u otro método.
Nombrar todas las operaciones unitarias en el orden en que fueron efectuadas.
Partiendo de una mezcla de virutas de hierro, arena y cromato de potasio, y con el objetivo de aislarlos en forma particular, realizamos para ello las siguientes operaciones:
Separación magnética
Conocidas de antemano las cualidades magnéticas del Fe (s), elegimos este procedimiento, para el cual utilizamos un imán y lo traspasamos por toda la superficie de la mezcla, hasta que todas las virutas queden atraídas por dicho imán. Las mismas quedarán adheridas al imán y separadas de la arena y el cromato. Retiramos el hierro del imán y lo dejamos en lugar apartado del sistema del cual formó parte.
Disolución
Ahora nos encontramos con la arena sólida, por un lado, y el K2CrO4, por otro. Percibimos en ellos una característica que los distingue: el último, una sal, es soluble en agua, mientras que la arena no lo es. Entonces, disolvemos la mezcla en agua y la llevamos a unos 50ºC aproximadamente, agitando con la varilla de vidrio, para ayudar a diluir la sal. Se forma una solución de cromato en agua (líquido amarillento), y la arena se ubica en la parte inferior, no disuelta. La razón por la cual aumentamos la temperatura es que esto permite una mayor concentración de soluto, pues las moléculas del líquido quedan más distantes, y hacen que la sol. no se llegue a saturar.
Este es el primer paso a la separación de las 2 sustancias, pero aún vemos partículas de arena en la superficie exterior del sistema.
Sedimentación
Con el objeto de eliminar el residuo de arena por sobre la solución, dejamos sedimentar (reposar) hasta tanto, por acción de la gravedad, este caiga al fondo del recipiente (vaso de precipitados), y así completar el segundo paso, en el cual vemos al sólido totalmente por debajo de la mezcla homogénea.
Decantación (Sólido-Líquido)
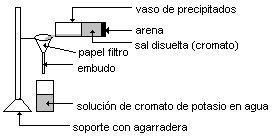
Ahora debemos traspasar el contenido a un embudo en cuyo interior colocamos un papel de filtro. El papel se pliega dos veces por la mitad, y se abre interiormente, de manera que no haya ningún orificio por donde puedan traspasar sólidos. La decantación propiamente dicha consiste en efectuar el traspaso sofrenadamente, es decir, en forma moderada y a través de un borde, para que la caída de grandes volúmenes no dañe el filtro. De este modo, percibimos que la arena queda remanente en el vaso, y la solución ha pasado al filtro.
Vale aclarar que esto nunca se realiza en forma absoluta, pues hay restos de arena en el filtro, y de cromato junto a la arena residual en el recipiente.
5. Filtración
Esto es una continuación del paso anterior, pues es el acto preciso de traspasar la solución por el papel de filtro, de manera que si hubiere algún resto de arena quedará retenido. El filtrado será recogido en otro vaso de precipitados, y deberá haber solución en la misma cantidad que se encontraba previo a la decantación, pues caso contrario nos indicará que ha quedado en el filtro o en el primer vaso. Se sabe con seguridad de que en el segundo contenedor solo habrá cromato, pues la arena o cualquier otra impureza no habrá traspasado la filtración.
6. Lavado
Después del primer filtrado, han quedado residuos de K2CrO4 en el papel (vemos que toma un color amarillento), en la arena retenida (se encuentra húmeda, por lo que hay solución), y en la otra porción arenosa que permanece en el primer recipiente (también muestra humedad). Como el fin del trabajo es conseguir las sustancias totalmente puras, sin residuos, someteremos la arena del primer vaso a un lavado de H2O. Así podremos vaciar este contenedor y llevar la arena al filtro (con las impurezas de sal). Lo que se halle de cromato será disuelto en agua y llegará al segundo vaso. De igual forma se procederá con los residuos del filtro, se lavará desde el borde y alrededor de toda la periferia del mismo, para erradicar ese color definido de la sal, y lo que aún haya de ésta en la arena húmeda.
Se lavará en pequeñas cantidades (2 cm3) hasta tanto no se observe impureza en el filtro, y no haya coloración en el líquido que es filtrado (solo caiga H20).
7. Cristalización
Aunque no haya sido total y eficazmente completado el proceso de lavado, con la solución ya filtrada se iniciará la cristalización del cromato de potasio. Esto nos dará la sal en su estado de agregación original, sólida. Para aislarla del agua, utilizamos un método de fraccionamiento, pues se trata de una solución. Colocaremos únicamente unos 2 cm3 de mezcla para cristalizar, en un vidrio de reloj, y serán dejadas en baño maría, es decir, a calentar indirectamente a través de un vaso de agua sobre el mechero. El K2CrO4 (ac) se evaporará y se condensará en el vidrio de reloj, en forma de cristales sólidos.
8. Reacción con nitrato de plata
Para verificar la eficacia y concreción del lavado de torta, se recogerá un pequeño volumen filtrado y se lo hará reaccionar en un tubo de ensayo con nitrato de plata (AgNO3), que demostrará un color anaranjado en caso de que todavía haya cromato, lo cual indicará que ha sido insuficiente el lavado. Se seguirá lavando hasta que la reacción con nitrato no aprecie coloración alguna, lo que indicará que estamos filtrando agua pura, y allí recién habremos finalizado el lavado.
9. Secado de la arena
La arena permaneciente en el papel de filtro, una vez completado el lavado, necesitará ser secada, con lo cual se hará evaporar el agua dejando la arena húmeda en reposo fuera del dispositivo de filtración. La humedad superficial pasará al estado de vapor, y percibiremos arena seca.
c) Dibujar los dispositivos y nombrar los materiales utilizados en las operaciones de filtración y cristalización.
Filtración:
Cristalización del K2CrO4:

d) Objetivo del lavado de la torta. Ecuación molecular y iónica correspondientes a la reacción efectuada para reconocer el ión eliminado en esta operación.
El lavado, en este trabajo, se efectúa para eliminar cualquier impureza de sal en la arena o en el papel de filtro. En el momento en que no se observe coloración en el líquido filtrado o en el mismo dispositivo de filtración, necesitamos cerciorarnos realmente de que el anión cromato esta ausente. Esta se logra haciendo reaccionar una pequeña cantidad del líquido filtrado con KNO3 (ac) en solución al 1%. Si esta se produce, por haber presencia de sal, el líquido aparece teñido de un color pardo-anaranjado, y se deberá proseguir el lavado; por el contrario, el color transparente indicará la ausencia de dicho ión y el fin del lavado de torta.
Las ecuaciones molecular y iónica correspondientes a la reacción entre las sales en solución son las siguientes:
Ecuación molecular: 2 AgNO3 (ac) + K2CrO4 (ac) ------ Ag2CrO4 (ac) + 2 KNO3 (ac)
Ecuación iónica total: Ag+ + NO3- + 2 K+ + CrO42- ------ 2 Ag+ + CrO42- + K+ + NO3-
Ecuación iónica neta: 2 K+ + CrO42- ------ 2 Ag+ + CrO42-
e) ¿Que operaciones debería haber realizado para obtener al final del trabajo la totalidad de la arena y el cromato de potasio exentos de agua?
En el primer caso, con respecto a la arena, el secado se realiza solo haciendo evaporación, que es un fenómeno de superficie que se realiza a temperatura ambiente, en sustancias que se encuentran en estados sólido o líquido. Por acción de la energía cinética en algunas moléculas del sistema, estas pasan al estado gaseoso, pero no la totalidad de la masa a la que nos referimos. Por todo esto, si en verdad necesitamos que todo el volumen de arena quede exento de agua, debemos llevarla al punto de ebullición del agua (100ºC) y como la ebullición es un fenómeno de volumen, todo el H20 se convertirá en gas. La arena quedará absolutamente seca.
En alusión al cromato, justamente el proceso es la cristalización, con la salvedad que hay que hacerla en forma completa. Se debe calentar la solución filtrada en un recipiente hermético, hasta que toda la sal se evapore y luego se condense en forma de cristales en las paredes del recipiente. Eliminamos el agua (liq) y poseemos el K2CrO4 (s).
Descargar
| Enviado por: | Up-and-under |
| Idioma: | castellano |
| País: | Argentina |
