Química
Química
Proceso de Texcoco
Alberto Urbina del Raso, Ingeniero Químico
A principios de la década de 1940, la industrialización en México había alcanzado un desarrollo primitivo. En 1943 se creó una compañía cuyo interés primordial era la fabricación de sosa cáustica, NaOH, a partir de sales disueltas en el lago de Texcoco (aledaño a la ciudad) por lo que se llamo “SOSA TEXCOCO”.
El llamado “VASO DE TEXCOCO” esta impregnado de sales de sodio que se encuentran primordialmente como cloruro, NaCL, carbonato, Na2CO3, y bicarbonato, NaHCO3. La concentración salina del lago era tan alta que, en tiempo de secas, aparecían sobre el suelo unas florescencias llamadas “TEQUESQUITE”, que fueron utilizadas por los aztecas para cocer y condimentar los alimentos, así como para el aseo
La idea original que era aprovechar el terreno de Texcoco para cultivo, resulto imposible por la enorme salinidad que presenta, además no era factible desechar las sales al desagüe, pues se hubiera contaminado todo el valle aledaño (del Mezquital). Por ello, pensó que tal riqueza natural de sales podría ser aprovechada con propósitos industriales. En 1938 se intento por primera vez el aprovechamiento del área tequesquitosa. La empresa fracaso debido a las variaciones de la materia prima, a lo difícil que resulto deshacerse de la arcilla que acompaña al Tequezquite y algunos defectos en el diseño de la plata.
Una vez concentrada la salmuela, es posible separar las sales de la disolución, pero ¿Cómo? El proceso ideado por Maldinaveitia, director entonces de las investigaciones del instituto de la química en la UNAM, aprovecho la baja solubilidad del bicarbonato en presencia del cloruro de sodio.
NaHCO3 (S) + H2O (I) Na+ (ac) + HCO3 - (ac)
Disminuye en cuanto aumenta la concentración del ion na+ la razón es que la constante del producto de la solubilidad K ps = [Na+] [HCO] siempre se toma el mismo valor, y si existe ion disuelto, o sea tiende a desplazarse hacia el reactivo, en este caso se le llama efecto ion común.
Para empezar, se lleva acabo la “carbo natación” en una reaccion en la que la solución recibe el burbujeo de CO2 obtenida al quemar piedra caliza:
CaCO3 CaO + CO2

El caracol. Las aguas del lago de Texcoco siguen siendo aprovechadas hoy para obtener carbonato de sodio. Como primer paso, la industria Sosa Texcoco emplea un enorme evaporador solar, ¡de 800 hectáreas!, Que concentra en sales las aguas extraídas del subsuelo. (Foto tomada del artículo "un caracol gigante permanece activo", ICYT, núm. 136, enero de 1988, p.47. cortesía del ingeniero Alberto Urbina del Raso.)
Cocaína

La cocaína es una droga estimulante del sistema nervioso central, concretamente del sistema dopaminérgico. Su fórmula química es C17H21NO4
Se extrae de la hoja de coca, una planta originaria de Sudamérica y es usada por los indígenas para combatir el hambre, el mal de altura, el dolor estomacal y otras dolencias.
La cocaína es un estimulante adictivo que afecta directamente al cerebro. La cocaína ha sido llamada la droga de los ochenta y noventa por su gran popularidad y uso durante esas décadas. Sin embargo, la cocaína no es una droga nueva. En realidad, es una de las drogas más antiguas. La sustancia química pura, el clorhidrato de cocaína, se ha venido usando por más de 100 años, mientras que las hojas de la cocaína se han ingerido por miles de años.
A mediados del siglo diecinueve, se extrajo por primera vez la cocaína pura de la hoja de la planta Erytroxilon, que crece principalmente en Perú y Bolivia. A principios del siglo veinte, la cocaína se convirtió en el ingrediente principal en la mayoría de los tónicos y elixires que se crearon para tratar numerosas enfermedades, incluyendo la Coca-Cola y el Vin Mariani. En la actualidad la cocaína es una droga clasificada bajo la Lista II en Estados Unidos ("Schedule II"), lo que significa que se considera que hay un gran potencial para su abuso, pero que puede ser administrada por un médico para usos médicos legítimos, como por ejemplo, anestesia local para ciertos tipos de cirugías de los ojos, oídos y garganta.
Básicamente hay dos formas químicas de la cocaína: las sales y los cristales de cocaína (como base libre). El clorhidrato, la forma más común del polvo de cocaína, se disuelve en agua, y cuando se abusa, puede ser usada en forma intravenosa (en la vena) o intranasal (por la nariz). La base libre se refiere a un compuesto que no ha sido neutralizado por ácido para producir la sal correspondiente. Esta forma de la cocaína se puede fumar, ya que no se descompone como si lo hace el clorhidrato.
La cocaína usualmente se vende en la calle en forma de un polvo blanco, fino y cristalino que se conoce como "coke" o coca, "C", "snow" (nieve), "flake" (copo) o "blow" (golpe). Los traficantes generalmente la mezclan con otras sustancias, tales como maizena, talco y/o azúcar; o con ciertas drogas como la procaína (un anestésico local de estructura química parecida), o con otros estimulantes, como las anfetaminas. También se vende en una forma llamado "crack", roca, y basuco (en Colombia y el Caribe), en forma de piedritas blancos o amarillos procesado con amonia o bicarbonato de sodio, que generalmente se fuma en pipa de vidrio. Ese forma es muy popular en las clases media y baja y causa más adicción que la forma cristalina.
Los efectos son inmediatos y consisten en una elevación de la autoestima y la confianza en uno mismo, acompañado de una gran locuacidad, excitación (pudiendo llegarse a la extrema irritabilidad). El efecto dura relativamente poco tiempo (unos 30-60 minutos) y en cuanto empieza a declinar el sujeto experimenta ansiedad por recibir otra dosis. A largo plazo, su uso descontrolado produce adicción, desórdenes mentales y muerte, bien sea por efectos físicos directos, suicidio, o accidentes.
Novocaína o Procaína
Procaína, anestésico local, conocido por su nombre comercial Novocaína, que se utiliza en odontología y cirugía. El clorhidrato de procaína, término correcto para designar este alcaloide, fue sintetizado por primera vez en 1905 y sustituyó con rapidez a la cocaína ya que es más fácil de sintetizar y esterilizar, su acción es más breve, no produce adicción y es de cuatro a seis veces menos tóxico. La procaína, al igual que otros anestésicos locales como la tetracaína, actúa como un dispositivo de bloqueo nervioso, interrumpiendo la generación y conducción de los impulsos nerviosos para el dolor. En odontología permite efectuar extracciones dentales sin dolor. En la cirugía menor se suele utilizar junto con un fármaco vasoconstrictor que limita el flujo de sangre.
También se emplea en obstetricia y en ocasiones para aliviar el dolor lumbar. En la actualidad la procaína ha sido reemplazada en gran parte por otros anestésicos como la lidocaína. Algunos individuos son hipersensibles a la procaína, y cuando se inyecta debajo de la piel se produce una urticaria.
La fórmula química de la procaína es C13H20O2N2HCl.
.
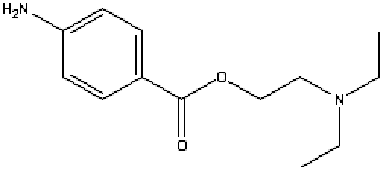
Xilocaina o Clorhidrato de lidocaína
El clorhidrato de lidocaína es un anestésico local que se utiliza tanto por vía endovenosa como subcutánea, en dependecia de su forma de presentación, con o sin preservo respectivamente. La determinación de la concentración de clorhidrato de lidocaína en el inyectable se realiza mediante un método anhidrovolumétrico que requiere un gasto considerable de reactivo de importación. Para racionalizar esta técnica, se realizaron ensayos preliminares en los cuales se varió el volumen de extrayente y el número de extracciones. Los mejores resultados se obtuvieron con 10 mL de cloroformo en 3 extracciones, lo que permitió un ahorro aproximado del 70 % de este solvente.
Descriptores DeCS: LIDOCAINA/análisis; QUIMICA FARMACEUTICA/métodos; DISEÑO DE DROGAS; INYECCIONES.
El clorhidrato de lidocaína (figura 1) es uno de los inyectables que se produce actualmente en la Empresa de Productos Biológicos "Carlos J. Finlay". En el Laboratorio de Aseguramiento de la Calidad se realizaron los ensayos cualitativos y cuantitativos, según el Procedimiento Normalizado de Operación (PNO) para este inyectable:
- Comprobación de las características organolépticas.
- Identificación de lidocaína.
- Identificación de cloruros.
- Identificación de parabenos.
- Determinación del contenido mínimo de inyectable envasado.
- Determinación de pH.
- Determinación de la concentración de clorhidrato de lidocaína.
FIGURA 1. Fórmula estructural del clorhidrato de lidocaína
Este último ensayo se realiza mediante un método anhidrovolumétrico basado en la valoración del nitrógeno como base en un medio protogénico de ácido acético,2 el cual requiere un gasto considerable de solvente orgánico para la extracción del principio activo del medio acuoso, por lo que el objetivo de este trabajo consiste en la racionalización de la técnica, con el propósito de disminuir las extracciones y el volumen del solvente.
La determinación de la concentración de clorhidrato de lidocaína en el producto final, con o sin preservo, se realiza actualmente según lo establecido en el Procedimiento Normalizado de Operación 3.02.024.94. de la Empresa de Productos Biológicos "Carlos J. Finlay". De acuerdo con el diagrama de flujo (figura 2) se efectuaron los ensayos preliminares para reducir de 20 a 10 mL el volumen de cloroformo y de 5 a 2 el número de extracciones.2
Para evaluar la concentración del clorhidrato de lidocaína se emplea como valorante una solución de ácido perclórico 0,1 mol/L disuelto en ácido acético glacial, el cual debe ser previamente valorado. Para el cálculo de dicha concentración se utiliza la expresión siguiente:
C = (Vm B Vb) * f * 28,88 (%) 50
donde:
Vm = volumen de solución de ácido perclórico 0,1 mol/L consumido por la muestra (mL).
Vb = volumen de solución de ácido perclórico 0,1 mol/L consumido por el blanco (mL).
f = factor de la solución de ácido perclórico.
28,88 = deciequivalente de clorhidrato de lidocaína.
50 = factor para el cálculo.
Esta determinación se realiza por triplicado.
El comportamiento de la técnica al realizar estas variantes fue similar en los casos de 3, 4 y 5 extracciones, independientemente del volumen de cloroformo utilizado, no así en el caso de 2 extracciones. En todos los casos se obtuvieron concentraciones dentro del límite de aceptación del producto (1,8 a 2,2 %). Teniendo en cuenta estos resultados se seleccionó el régimen de extracción más rápido y económico.
Proceso de Solvay
Para Ernest Solvay proceso comercial para la fabricación del carbonato de sodio (soda de lavado). El bióxido del amoníaco y de carbono se pasa en una solución saturada del cloruro de sodio para formar el carbonato soluble del hidrógeno del amonio, que reacciona con el cloruro de sodio a si el cloruro soluble del amonio de la forma y un precipitado del carbonato del hidrógeno del sodio (bicarbonato de sodio) la temperatura se mantiene debajo de 15°C. El carbonato del hidrógeno del sodio se filtra apagado y se calienta para producir el carbonato de sodio.
Sosa comercial, término aplicado al carbonato de sodio (Na2CO3). Es un polvo blanco con fuertes propiedades alcalinas, con una densidad relativa de 2,35 y un punto de ebullición de 851 ºC. Se encuentra en la naturaleza en los estratos de sal y también disuelto en las aguas de lagos interiores, llamados lagos de sosa. Se fabrican varias formas hidratadas de carbonato de sodio; las más importantes son: el decahidrato (Na2CO3·10H2O), llamado sosa de blanquear, y en monohidrato (Na2CO3·H2O), denominado carbonato de cristal.
El carbonato de sodio se solía obtener de las cenizas de las algas y se conocía como cenizas de sosa, pero su consumo no se extendió hasta que el químico francés Nicolás Leblanc inventó un método, llamado proceso Leblanc, para la obtención del compuesto a partir de la sal de mesa, el cloruro de sodio. El proceso Leblanc fue superado por el proceso Solvay, mucho menos costoso, que inventó el químico belga Ernest Solvay al tratar de utilizar el amoníaco obtenido como subproducto en la industria del coque. En este último proceso, el cloruro de sodio se trata con amoníaco gas y luego con dióxido de carbono, formándose bicarbonato de sodio (NaHCO3) y cloruro de amonio. El precipitado de bicarbonato de sodio se filtra y se separa de la disolución de cloruro de amonio, para secarse y calentarse posteriormente, consiguiéndose el carbonato de sodio. Sin embargo, cada vez es más frecuente obtener este compuesto de fuentes naturales, como los lagos de sosa, en vez de sintetizarlo mediante el proceso Solvay.
El carbonato de sodio se emplea en la fabricación de artículos de vidrio y cerámica, en la elaboración de papel a partir de la madera de los árboles y para hacer jabón. También se utiliza en el refinado del petróleo, como ablandador del agua, agente limpiador y desengrasante en detergentes, y para producir otros compuestos de sodio como el hidróxido de sodio.
ÁCIDOS.
| NOMBRE | FÓRMULA | PRESENTE EN |
| ÁCIDOS | ||
| Ácido acético | HC2H3O2 | Vinagre |
| Ácido acetilsalicílico | HC9H7O4 | Aspirina |
| Ácido ascórbico | H2C6H6O6 | Vitamina C |
| Ácido cítrico | H3C6H5O7 | Jugo de limón y de otros cítricos |
| Ácido clorhídrico | HCI | Jugos gástricos |
| Ácido sulfúrico | H2SO4 | Pilas |
BASES
| NOMBRE | FÓRMULA | PRESENTE EN |
| Bases | ||
| Amoníaco | NH3 | Limpiadores domésticos |
| Hidróxido de calcio | Ca(OH)2 | Cal apagada |
| Hidróxido de magnesio | Mg(OH)2 | Lechada de magnesio |
| Hidróxido de potasio (también | KOH | Jabón suave |
| Hidróxido de sodio | NaOH | Limpiadores de tuberías y hornos |
Descargar
| Enviado por: | Tavo |
| Idioma: | castellano |
| País: | México |
