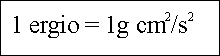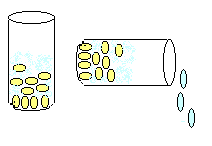Química
Química
DEFINICION DE QUIMICA.
Concepto de Química
La química puede describirse como el estudio de la composición de la materia y los cambios por los que atraviesa.
Origen de la Química
La química como ciencia comenzó a partir del siglo 17 los chinos, egipcios, griegos y alquimistas contribuyeron a su desarrollo.
Química Orgánica
La que estudia especialmente los compuestos del carbono.
Química Inorgánica
Es el estudio de todos los compuestos y elementos que no son orgánicos, sus reacciones y propiedades.
Química Industrial
Comprende la producción de sustancias químicas básicas y de artículos básicos tales como plástico, fertilizantes y drogas. Interviene en la producción de alimentos preparados.
Bioquímica
Estudio de las reacciones químicas en los seres vivos, como la utilización de los alimentos que contienen energía y la síntesis de los organismos que están activos en los seres vivos.
Química Medica
Es la química que a través de procesos químicos crea diferentes sustancias para el mejoramiento de la medicina.
Química Ambiental
Es la rama de la química que se encarga de lo que sucede entre la química y la naturaleza. Trata también de crear productos que ayudan a la naturaleza.
Química Cosmética
Es la química que ayuda con lo que se refiere a la cosmética, tal como se pueden mencionar artículos de belleza, como perfumes maquillajes etc.
Química Nuclear
Es la rama de la química que estudio la parte intima de la materia y las reacciones en las cuales intervienen los núcleos de los átomos. Estudia los procesos y fenómenos de radiación nuclear ya sea provocada o espontánea.
Química orgánica, rama de la química en la que se estudian el carbono, sus compuestos y reacciones. Existe una amplia gama de sustancias (medicamentos, vitaminas, plásticos, fibras sintéticas y naturales, hidratos de carbono, proteínas y grasas) formadas por moléculas orgánicas. Los químicos orgánicos determinan la estructura de las moléculas orgánicas, estudian sus reacciones y desarrollan procedimientos para sintetizar compuestos orgánicos. Esta rama de la química ha afectado profundamente a la vida en el siglo XX: ha perfeccionado los materiales naturales y ha sintetizado sustancias naturales y artificiales que, a su vez, han mejorado la salud, han aumentado el bienestar y han favorecido la utilidad de casi todos los productos empleados en la actualidad.
La aparición de la química orgánica se asocia a menudo al descubrimiento, en 1828, por el químico alemán Friedrich Wöhler, de que la sustancia inorgánica cianato de amonio podía convertirse en urea, una sustancia orgánica que se encuentra en la orina de muchos animales. Antes de este descubrimiento, los químicos creían que para sintetizar sustancias orgánicas, era necesaria la intervención de lo que llamaban 'la fuerza vital', es decir, los organismos vivos. El experimento de Wöhler rompió la barrera entre sustancias orgánicas e inorgánicas. Los químicos modernos consideran compuestos orgánicos a aquéllos que contienen carbono y otros elementos (que pueden ser uno o más), siendo los más comunes: hidrógeno, oxígeno, nitrógeno, azufre y los halógenos. Por ello, en la actualidad, la química orgánica tiende a denominarse química del carbono.
Química, estudio de la composición, estructura y propiedades de las sustancias materiales, de sus interacciones y de los efectos producidos sobre ellas al añadir o extraer energía en cualquiera de sus formas. Desde los primeros tiempos, los seres humanos han observado la transformación de las sustancias -la carne cocinándose, la madera quemándose, el hielo derritiéndose- y han especulado sobre sus causas. Siguiendo la historia de esas observaciones y especulaciones, se puede reconstruir la evolución gradual de las ideas y conceptos que han culminado en la química moderna.
Química.Es una ciencia que trata del estudio de la materia, las transformaciones que sufre y las leyes que rigen estos cambios.
Mucho se ha hablado de los orígenes de la química lo que, si se sabe es que deriva de la palabra alkimia nombre del antiguo arte de convertir el plomo en oro o en metales preciosos. Como todo lo que utilizamos normalmente pasa por una transformación química procedamos a abordar la importancia de esta ciencia.
Importancia de la Química.
La Química ha venido desarrollándose conforme el desarrollo del hombre, interviniendo en su alimentación, vestido, casa, medicina, suficientes motivos para intentar desentrañar el mundo que le rodeaba. Así pudo descubrir qué sustancias servían para conservar sus alimentos, como los antioxidantes por citar algunos ejemplos tenemos: (vitamina C, ácido fosfórico, BHT) los cuales retrasan la descomposición bacteriana, preservadores como: ácido benzoico, benzoato de sodio, ácido láctico, saborizantes como: la sal para aumentar el sabor y hacerlos más atractivos al paladar y edulcorantes: como: sacarina y aspartame.
Lo mismo aplicó a las prendas de vestir, al encontrar que las mezclas de polímeros plásticos como: nylon, rayón, dacrón, hacían más perdurables las prendas . Utilizando lana produjó prendas más durables y más cálidas.
En su vivienda aplicó las sustancias como los silicatos en los cementos lo cual dió resistencia a sus construcciones.
En la medicina desarrolló nuevos compuestos que aplicó como: vacunas, sueros, antipiréticos, etc. Todo esto gracias al conocimiento de la Química. Como todo en el Universo interactúa es importante mencionar como se relaciona esta ciencia pura con otras ciencias.
Relación de la Química con otras ciencias.
La Química como una ciencia que estudia la materia tiene amplia relación con otras ciencias apoyándolas o recibiendo apoyo de ellas.
En la Medicina a diario se descubren nuevas sustancias que son probadas para prevenir o curar una enfermedad, siguiendo algunas rutas de síntesis elaboradas con ayuda de las siguientes ramas de la Química: Orgánica, Analítica, Inorgánica, etc.
Para la Física ha resultado importante el conocimiento de la estructura interna de los elementos o de las propiedades de los materiales.
En la Arqueología mediante la prueba con Carbono 14 un elemento radiactivo, se determinan las fechas de existencia de civilizaciones pasadas.
En la Astronomía la Química ha ayudado a conocer la composición de cometas, planetas o estrellas mediante técnicas de análisis.
En la Biología, la Química ha proporcionada herramientas para determinar la composición de las proteínas, aminoácidos o del ADN, así como la descripción de los procesos de metabolismo mediante el cual las sustancias se transforman en los organismos. Un ejemplo de ello sería la transformación que sufre la energía solar que es capturada por las plantas durante la fotosíntesis.
En las Matemáticas ha proporcionado las herramientas para establecer la relación o combinación de los elementos en un compuesto así mismo para realizar cálculos en las reacciones químicas.
Al paso del tiempo el estudio de esta ciencia se hizo cada vez más completo y por los mismo fue necesario subdividirla a continuación vamos a mencionar cuáles son las ramas que posee esta ciencia pura.
Ramas de la Química.
Química Analítica.
Ciencia que trata del estudio de la composición, identificación y medida de las cantidades de las diferentes sustancias presentes en un material.
Radioquímica.
Rama de la Química que estudia las propiedades radiactivas de los elementos.
Electroquímica.
Ciencia que aborda los cambios químicos relacionados con el uso o producción de la corriente eléctrica.
Química Orgánica.
Ciencia que trata del estudio de los compuestos del carbono.
Química Inorgánica.
Ciencia cuyo estudio versa sobre los compuestos formados por la mayoría de los elementos químicos conocidos.
Fisicoquímica.
Ciencia que estudia los mecanismos por los que transcurre una reacción, así como las velocidades de los mismos.
PROPIEDADES DE LA MATERIA.
| 1.2 PROPIEDADES FUNDAMENTALES DE LA MATERIA. |
|
|
| Albert Einstein |
Este subtema esta enfocado al estudio y entendimiento del concepto de materia. Como es bien sabido todo lo que ocupa un lugar en el espacio es materia, por este motivo es importante,mencionar este concepto.
Materia: Es todo aquello que nos rodea, todo lo que el hombre estudia, puede ser tan dura como el diamante o tan blanda como la plastilina, tan grande como un planeta o tan pequeña como una bacteria. Concluyendo se puede decir que todo lo que constituye el Universo es materia.
Durante mucho tiempo el concepto materia y masa se tomaron como sinónimos; sin embargo a principios del siglo XX Albert Einstein, demostró en su ecuación que la masa y la energía son dos componentes de la materia, pudiéndose interconvertir una en la otra.
El estudio de la materia realizado por la Física relativista ha permitido identificar y estudiar las cuatro manifestaciones o propiedades de la materia las cuales son: masa, energía, espacio y tiempo.
Gracias a esos estudios es que podemos definir como masa. A la existencia de materia en forma de partículas o también como la cantidad de sustancia de un cuerpo susceptible de ser acelerada.
| m = F/a. |
| El significado de estas siglas es: |
La masa se mide mediante una balanza, sus unidades son el kilogramo o el gramo Pero como estamos iniciando el estudio de la materia es válido hacer la siguiente pregunta.
¿Qué es una partícula?.
Respondiendo al cuestionamiento planteado una partícula es la parte más pequeña que conforma una sustancia. Y eso nos lleva a mencionar que el conjunto de partículas forman, las sustancias, este concepto es sumamente importante pues como se menciono anteriormente la Química se dedica a estudiar las transformaciones que sufren las sustancias.
Como todas las transformaciones químicas que sufren las sustancias necesitan de Energía es conveniente mencionar este concepto.
Energía. Es una propiedad de un sistema, es la medida de su capacidad para realizar trabajo por esta razón la unidad de medida de la energía es el Joule o Ergio.
|
|
Propiedades de la Materia.
Para poder estudiar y entender que es la materia y como se comporta es necesario estudiar sus propiedades. Las cuales se clasifican como: generales ó extensivas y específicas ó intensivas.
Propiedades generales de la materia o extensivas.
Son aquellas propiedades de un cuerpo cuyo valor medible depende de la cantidad de masa, ejemplos: volumen, peso, número de moles, inercia, porosidad.
Estas propiedades las presentan todos los cuerpos, por lo que no se emplean para diferenciar una sustancia de otra.
-
Volumen: Es el espacio que ocupa un cuerpo, se determina por tres coordenadas tridimensionales.
-
Peso.
-
Es la fuerza de atracción de la tierra sobre un cuerpo, se mide mediante un dinamómetro. Sus unidades son el kilogramo-fuerza (Kgf).
-
Inercia.
-
Es el estado de reposo o movimiento nulo de un cuerpo.
-
Porosidad.
-
Es el espacio que existe entre las moléculas de un cuerpo, son los huecos entre las moléculas.
-
Número de moles.
-
Es una medida de la cantidad de partículas de un cuerpo numéricamente es igual al número de Avogadro 6.023x1023 átomos o moléculas para un elemento o un compuesto respectivamente.
-
Propiedades intensivas o específicas de la materia.
Estas propiedades no las presentan todos los cuerpos, ya que no dependen de la cantidad de masa, son importantes porque permiten distinguir a un cuerpo de otro. Pueden ser físicas como: la densidad, la tenacidad, la conductividad eléctrica y calorífica, la elasticidad, maleabilidad, cambios de estado o químicas como: la fuerza oxidante, la acidez o basicidad, combustibilidad, capacidad de combinación (valencia), electronegatividad. Tratando de que estos conceptos queden claros a continuación se mencionan los definiciones de cada una de las propiedades mencionadas. -
Tenacidad.
-
Es la resistencia de un cuerpo a ser fracturado.
-
Densidad.
-
Es la relación que existe entre la masa y el volumen de un cuerpo.
-
Cada sustancia posee una densidad única y no depende de la cantidad de masa y es diferente para cada sustancia.
-
Conductividad eléctrica.
-
Es la capacidad de los materiales de conducir corriente eléctrica.
-
Oxidación.
-
Facilidad de una sustancia para perder electrones.
-
Acidez.
-
Es la característica que presentan ciertas sustancias para ceder protones.
-
Elasticidad.
-
Es la facilidad de un cuerpo para estirarse por una fuerza y volver a recuperar su forma al desaparecer esa fuerza. Este fenómeno lo observamos cuando estiramos una liga.
-
Magnetismo.
-
Fenómeno que presentan ciertos cuerpos de ser atraídos por un campo magnético.
-
Maleabilidad .
-
Facilidad de ciertos materiales para poder moldearse.
-
Combustibilidad .
-
Es la capacidad de ciertas sustancias para poder arder fácilmente.
-
Electronegatividad.
-
Fuerza para atraer electrones por parte de un elemento durante la formación de un enlace.
-
Para explicar la utilidad e importancia de las propiedades específicas a continuación se van a resolver dos problemas de densidad, los cuales tienen la siguiente redacción.
-
Problema 1.
Una persona encontró una mina con sustancias cristalinas parecidas a los diamantes, deseando saber, si efectivamente había encontrado diamantes realizó una prueba. Colocó una probeta de un litro con agua hasta un volumen de 200 mililitros, después sumergió una de las piedras que previamente había pesado, y cuya masa era de:70.2g. Observó que el volumen aumentó a 220 mililitros y se hizo la siguiente pregunta.
¿Serán diamantes? -
Desarrollo y Resolución del problema No. 1. -
Problema número 2.
¿Cuál es la densidad de 750 ml. de gasolina, cuya masa es de: 637.5 g. -
Leyes de la conservación de la materia.
-
Su interpretación es: "La materia no se crea ni se destruye, sólo se transforma". La masa y energía son componentes de la materia y sólo se convierten una en la otra.
FORMAS DE PRESENTACIÓN DE LA MATERIA.(Clasificación de la materia). -
En la naturaleza los diversos materiales se presentan en forma de:
-
Sustancias puras. Dentro de esta presentación tenemos a los elementos y los compuestos.
-
Mezclas . Son sistemas que se forman por la combinación física de elementos o compuestos en diferente proporción, los cuales conservan sus propiedades y se pueden separar por métodos físicos.
-
A las soluciones como: los refrescos, sueros.
-
Los coloides como:la mayonesa y la gelatina.
-
Las suspensiones como: jugos de frutas, y algunos medicamentos como el melox.
-
Mezclas homogéneas.
-
Mezclas heterogéneas.
-
Soluciones sólidas
-
soluciones líquidas.
-
gas-líquido.
-
sólido-líquido.
-
líquido-líquido.
-
MÉTODOS DE SEPARACIÓN DE MEZCLAS.
-
Decantación.Este método es utilizado para separar un sólido de grano grueso e insoluble de un líquido. Este método permite separar componentes que contienen diferentes fases. La separación se efectúa vertiendo la fase superior (menos densa) o la inferior (más densa).
-
Centrifugación. Método utilizado para separar un sólido insoluble de grano muy fino y de difícil sedimentación de un líquido. La operación se lleva a cabo en un aparato llamado centrífuga.
-
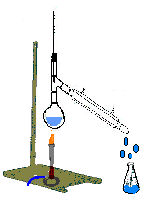
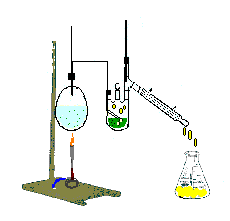
Destilación.Este método permite separar mezclas de líquidos miscibles, aprovechando sus diferentes puntos de ebullición. Este procedimiento incluye una evaporación y condensación sucesivas. Existen varios tipos de destilaciones, las cuales son:
-
Destilación simple, Destilación fraccionada y Destilación por arrastre de vapor. En la destilación simple el proceso se lleva a cabo en una sola etapa, es decir se evapora el líquido con punto de ebullición más bajo y se condensa con ayuda de un refrigerante.
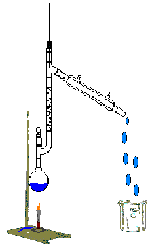
-
En la Destilación fraccionada el proceso se realiza en multietapas por medio de una columna de destilación en la cual, se llevan a cabo continuamente numerosas evaporaciones y condensaciones. Este método es mucho más eficiente que una Destilación simple y mientras más etapas involucre mejor separación se obtiene de los componentes.
-
En la Destilación por arrastre de vapor se hace pasar una corriente de vapor a través de la mezcla de reacción y los componentes que son solubles en el vapor son separados. Entre las substancias que se pueden separar con esta técnica podemos citar a los aceites esenciales.
-
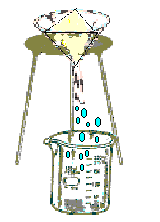
Filtración. Permite separar un sólido de grano insoluble (de grano relativamente fino) de un líquido. Para tal operación se emplea un medio poroso de filtración o membrana que deja pasar el líquido y retiene el sólido. Los filtros más comunes son: papel filtro, fibra de asbesto, fibra de vidrio.
-
Evaporación. Este método permite separar un sólido disuelto en un líquido por incremento de temperatura hasta que el líquido hierve o ebulle y pasa al estado de vapor, quedando el sólido como residuo en forma de polvo seco. Mediante este método se obtiene la sal del mar en los estanques de arena.
-
Sublimación. Es un método utilizado en la separación de sólidos, aprovechando que algunos de ellos es sublimable (pasa del estado sólido al gaseoso). Mediante este método se obtiene el café de grano.
-
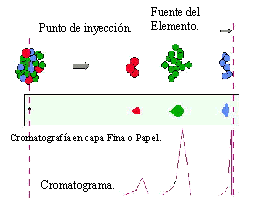
Cromatografía. La palabra Cromatografía significa "escribir en colores", ya que cuando fue desarrollada los componentes separados eran colorantes. Las técnicas cromatográficas se basan en la aplicación de la mezcla en un punto (punto de inyección o aplicación) seguido de la influencia de la fase móvil. Existen varios tipos de cromatografía, como los siguientes:
-
Cromatografía en columna
-
Cromatografía en capa fina.
-
Cromatografía en papel.
-
Cromatografía de líquidos de alta eficiencia.
-
Cromatografía de gases.
-
Diferencia de solubilidad. Este método permite separar sólidos de líquidos o líquidos de sólidos al contacto con un solvente que selecciona uno de los componentes de la mezcla. Este componente es soluble en el solvente adecuado y es arrastrado para su separación, ya sea por decantación, filtración, vaporización, destilación, etc. Este método es muy útil para la preparación y análisis de productos farmacéuticos
-
Imantación. Este método aprovecha la propiedad de algún material para ser atraído por un campo magnético. Los materiales ferrosos pueden ser separados de la basura por medio de un electroimán.
-
Cristalinos. Estos sólidos tienen punto de fusión único. Ejemplo: NaCl
-
Amorfos. Son sólidos que no tienen punto de fusión único. Ejemplos: plástico, vidrios y geles.
-
Viscosidad. Resistencia fluir libremente es decir al flujo.
-
Tensión Superficial. Atracción de las moléculas en la superficie.
-
Presión de vapor Habilidad de las moléculas para escapar del líquido.
-
Punto de ebullición. Cuando la presión de vapor es igual a la presión atmosférica.
-
En este estado las partículas tienen suficiente energía para vencer la fuerza de atracción de las otras.
-
Cada partícula esta completamente separada de las otras.
-
Tienen densidades bajas ya que los gases ocupan completamente el recipiente que los contiene.
-
Endotérmicos. Son cambios de estado que se originan cuando al sistema se le administra energía.
-
Exotérmicos. Cambios de estado que se originan cuando el sistema desprende energía.
-
Sublimación. Es un cambio de estado directo de sólido a gas. Ejemplos: La sublimación del Iodo, Hielo seco (CO2 sólido).
El proceso inverso, o sea cuando una sustancia en estado gaseoso solidifica, sin pasar por el estado líquido, se llama deposición mediante este método se obtiene la naftalina. -
Fusión. Es un cambio de estado que permite que una sustancia en estado sólido pase al estado líquido. Ejemplos: hielo derritiéndose, la mantequilla derretida en un sartén, un chocolate derretido en la palma de la mano.
-
Solidificación. Es un cambio de estado que ocurre cuando un liquido pasa al estado sólido. Ejemplos: La nieve , la formación de figuras de cera , la obtención de figuras de plástico.
-
Evaporización. Es cambio de estado endotérmico que permite que una sustancia en estado líquido pase al estado gaseoso.
-
Ejemplos: Agua hirviendo, la formación de las nubes por medio de la evaporización del agua de los ríos y mares.
-
Condensación. Es la conversión del estado de vapor al estado líquido. Este proceso es el inverso de la evaporización.
Ejemplo. Empañamiento de una ventana. -
Licuefacción. Es el paso del estado gaseoso al estado líquido. Ejemplos. La obtención de aire líquido o de alguno de sus componentes.
-
Cristalización. Proceso por el cual se forman cristales. Hay formación de cristales cuando una sustancia se enfría. Este proceso se observa cuando se tiene un sólido disuelto en una disolución saturada.
-
Fenómeno Físico: Son cambios que no involucran la obtención de nuevas sustancias químicas.
Ejemplos: Cambios de Estado, Disolución, Cristalización, filtración, fragmentación, la formación del arcoiris, reflexión y refracción de la luz, fusión de la cera, electrización del vidrio, dilatación de un metal, movimiento de los cuerpos, transmisión del calor. -
Fenómeno Químico: Son cambios que implican la transformación de una sustancia en otras sustancias. Ejemplos: Combustión, Oxidación, Polimerización, Neutralización de Acidos y Bases, Precipitación, Formación de Complejos, Explosiones, Digestión de los Alimentos, Corrosión de los metales, Combustión de un cerillo, Fotosíntesis, fermentación etcétera.
-
Los fenómenos químicos y físicos de la materia son muy extensos e interesantes. Por esta razón a continuación se anexa una tabla con varios ejemplos. -
Los electrones giran en órbitas definidas, en las que no admiten ni absorben energía (estado basal).
-
Cuando un electrón pasa de un nivel superior a un inferior emite un fotón de energía.
-
Cuando un electrón pasa a un nivel superior absorbe un fotón de energía y se encuentra en un estado excitado.
-
El electrón posee una energía definida y característica de la órbita en la cual se mueve. Un electrón de la capa K (más cercana al núcleo) posee la energía más baja posible. Con el aumento de la distancia del núcleo, el radio del nivel y la energía del electrón en el nivel aumentan. El electrón no puede tener una energía que lo coloque entre los niveles permitidos.
-
Un electrón en la capa más cercana al núcleo (Capa K) tiene la energía más baja o se encuentra en estado basal. Cuando los átomos se calientan, absorben energía y pasan a niveles exteriores, los cuales son estados energéticos superiores. Se dice entonces que los átomos están excitados.
-
Cuando un electrón regresa a un Nivel inferior emite una cantidad definida de energía a la forma de un cuanto de luz. El cuanto de luz tiene una longitud de onda y una frecuencia características y produce una línea espectral característica.
-
La longitud de onda y la frecuencia de un fotón producido por el paso de un electrón de un nivel de energía mayor a uno menor en el átomo de Hidrógeno esta dada por:
-
Para Bohr el átomo sólo puede existir en un cierto número de estados estacionarios, cada uno con una energía determinada.
-
La energía sólo puede variar por saltos sucesivos, correspondiendo cada salto a una transición de un estado a otro. En cada salto el átomo emite luz de frecuencia bien definida dada por:
-
Es natural pensar que si una partícula esta localizada, debemos poder
-
Queda claro que para localizar una partícula es necesario sumar todas
-
Para ilustrar lo anterior hemos indicado en la siguiente figura diferentes
-
En el primer caso vemos que un paquete de ondas bien localizado en el
-
En el segundo caso vemos que si relajamos un poco la posición del paquete de ondas, también es posible definir el número de ondas (o el momento) de la partícula.
-
En el último caso vemos que para definir bien el momento

de la partícula, entonces su posición queda completamente indefinida. -
Es posible determinar el ancho, o la incertidumbre, del paquete de ondas tanto en el espacio normal

como en el espacio de momentos
. -
La expresión matemática que describe el principio de incertidumbre de Heisenberg es
-
Si queremos determinar con total precisión la posición:
-
De la desigualdad para el principio de incertidumbre verificamos
-
Familias o Grupos.
-
Periodos.
-
Bloques.
-
Clases: metales y no metales, elementos representativos, elementos de transición y elementos de transición interna.
-
Familias o grupos.
Son el conjunto de elementos ubicados en una columna, estos tienen propiedades químicas muy similares. Se encuentran divididas en A y B. -
Periódos.
Son los elementos colocados en una línea horizontal abarcan del 1 al 7, se localizan 3 períodos cortos y 4 largos. -
Bloques.
Esta clasificación se basa en la configuración electrónica de los elementos. A continuación con ayuda de una tabla se detallan los bloques existentes. -
A los elementos con configuración terminada en s o p, se les denomina elementos representativos, aquellos que tienen una configuración electrónica terminada en d, se les llama elementos de transición y finalmente los elementos que tienen una configuración electrónica que termine en f, se les llama elementos de transición interna.
-
Si se ordenan los elementos según sus pesos atómicos, muestran una evidente periodicidad.
-
Los elementos semejantes en sus propiedades químicas poseen pesos atómicos semejantes ejemplos: (K, Rb, Cs).
-
La colocación de los elementos en orden a sus pesos atómicos corresponde a su valencia. Los elementos más difundidos en la Naturaleza son los de peso atómico pequeño. estos elementos poseen propiedades bien definidas. Son elementos típicos.
-
Se puede esperar el descubrimiento de elementos desconocidos.
-
En determinados elementos puede corregirse el peso atómico si se conoce el de los elementos adyacentes.
-
No tiene un lugar fijo para el hidrógeno.
-
Destaca una sola valencia.
-
El conjunto de elementos con el nombre de tierras raras o lantánidos no tiene ubicación en la tabla o es necesario ponerlos todos juntos en un mismo lugar.
-
No había explicación al hecho de que algunos períodos contarán con 8 elementos, otros con 18, otros con 32 etcétera.
-
La distribución de los elementos no está siempre en orden creciente de sus pesos atómicos.
-
Radio atómico. (R.A)
Es la distancia que existe entre el electrón más lejano y el núcleo considerando al átomo como si fuera una esfera. Se determina por espectroscopia de rayos x. Calculando la distancia entre los núcleos de átomos enlazados. El tamaño aumenta en un periodo a medida que disminuye el número atómico en una familia a medida que aumenta el número atómico. -
Potencial de ionización o energía (E.I.)
Es la energía necesaria para arrancar un electrón a un átomo en estado gaseoso y neutro. -
La energía de ionización aumenta si el átomo es más pequeño por lo que su variación es contraria al tamaño de los elementos.
-
Electronegatividad.
Es una propiedad que se utiliza como una medida de la fuerza de un átomo para ganar e-. Se determinó por Pauling asignando arbitrariamente un valor de 4.0 al flúor.
Su variación también varía en sentido contrario al tamaño de los elementos, ya que es más fácil quitar electrones a aquellos átomos muy grandes requiriendo poca energía. -
Afinidad Electrónica (A.E.).
La afinidad electrónica aumenta de izquierda a derecha y de abajo hacia arriba en la tabla. -
Poseen bajo potencial de ionización.
-
Tienen un elevado peso específico.
-
Son sólidos con excepción del mercurio, galio, cesio y francio, los cuales son líquidos.
-
Presentan aspecto y brillo metálico.
-
Son buenos conductores de la electricidad y del calor.
-
Son dúctiles y maleables.
-
Se oxidan por pérdida de electrones.
-
Su estructura está formada por un solo átomo.
-
Los elementos alcalinos son los más activos.
-
Tienen tendencia a ganar electrones.
-
Poseen alto potencial de ionización y bajo peso específico.
-
Son malos conductores del calor y la electricidad con excepción del Carbono que en estado sólido si conduce la corriente eléctrica.
-
En su último nivel de energía tienen por lo regular de 4 a 7 electrones.
-
Se presentan en los tres estados físicos de agregación.
-
No poseen aspecto ni brillo metálico.
-
Son malos conductores de la electricidad y el calor.
-
No son dúctiles, ni maleables ni tenaces.
-
Se reducen por ganancia de electrones.
-
Su molécula está formada por dos o más átomos.
-
Al unirse con el oxígeno forman anhídridos.
-
Los halógenos y el oxígeno son los más activos.
-
Varios presentan alotropía.
-
Se escriben las estructuras antes de la unión de la unión y después mediante una ecuación
-
Se hace una resta de electronegatividades. La resta se hace restando al mayor valor le resta el menor.
-
Punto de fusión elevado.
-
Punto de ebullición elevado.
-
Estructura cristalina.
-
Son buenos conductores del calor.
-
Son buenos conductores de la electricidad.
-
Se disocian en agua.
-
Son sólidos.
-
ENLACE COVALENTE COORDINADO.
Es el enlace que se produce cuando dos átomos comparten una pareja de electrones, pero dicha pareja procede solamente de uno de los átomos combinados.
En este caso el enlace se llama covalente dativo o coordinado. El átomo que aporta la pareja de electrones recibe el nombre de donante, y el que los recibe, aceptor. Cuando queremos simplificar la formula electrónica se pone una flecha que va del donante al aceptor. -
PROPIEDADES DE LOS COMPUESTOS COVALENTES
-
Presentan puntos de fusión bajos
-
La mayor parte de las sustancias covalentes, a temperatura ambiente, son gases o líquidos
-
Presentan puntos de ebullición bajos ( ejemplo: agua ).
-
Son solubles en disolventes no polares o apolares y son insolubles en disolventes polares.
-
Algunos sólidos covalentes prácticamente son infusibles e insolubles ejemplo:el diamante.
-
Orbital "s" con sp.
-
Orbital "s" con sp2.
-
Orbital "s" con sp3.
-
Convertir la energía química en eléctrica
-
Convertir la energía eléctrica en química
-
Son reacciones que ocurren en la superficie del electrodo.
-
Son reacciones heterogéneas.
-
La transformación química se da por transferencia de electrones a través de los electrodos.
-
Los electrones intercambiados provienen de especies en solución.
-
La fuente de poder sólo crea las condiciones adecuadas para la reacción.
-
Son reacciones altamente específicas.
-
Depositación y disolución electrolítica de metales.Ejemplos:
-
Electrorecuperación de aluminio.
-
Electrorefinado del cobre.
-
Maquinado (proceso catódico: electroforming; proceso anódico: electromaquinado)
-
Productos no metálicos obtenidos por procesos electroquímicos industriales. Ejemplos:
-
Electrólisis de cloruros alcalinos.
-
Obtención de flúor a partir de KHF2.
-
Electrólisis del agua.
-
Oxidación aniónica de aniones óxidos de metales.
-
Regeneración de halógenos.
-
Electrosíntesis orgánica.
-
La cantidad de electricidad que circula a través de la pila electrolítica.
-
De la masa equivalente de la sustancia que forma el electrolito.
| L x A x G, largo x ancho x grueso. |
| Sus unidades son: cm3 = 1ml o dm3 = 1L. |
| El significado de las letras para calcular |
| Su expresión matemática es: d=m/v |
| Sus unidades son g/cm3 o g/ml. |
| El significado de estas siglas es: m=masa, v=volumen y d=densidad |
| Elementos químicos de la A-B | |||||
| No. | Nombre | Símbolo | Densidad | P. E. | P. F. |
| 1 | Actinio | Ac | 10,07 | 3300 | 1050 |
| 2 | Aluminio | Al | 2,7 | 2450 | 660 |
| 3 | Americio | Am | 13,67 | 2600 | 994 |
| 4 | Antimonio | Sb | 6,68 | 1380 | 630,5 |
| 5 | Argón | Ar | 1,40 | -185,8 | -189,4 |
| 6 | Arsénico | As | 5,73 | 613 | 817 |
| 7 | Astato | At | No reportada | 350 | 300 |
| 8 | Azufre | S | 2,33 | 444,6 | 119,0 |
| 9 | Bario | Ba | 3,5 | 1640 | 714 |
| 10 | Berilio | Be | 1,85 | 2770 | 1278 |
| 11 | Berquelio | Bk | 14,78 | 2660 | 1140 |
| 12 | Bismuto | Bi | 9,8 | 1560 | 271 |
| 13 | Boro | B | 2,34 | 3865 | 2080 |
| 14 | Bromo | Br | 3,12 | 58,78 | -7,25 |
| Elementos químicos de la C-E | |||||
| No. | Nombre | Símbolo | Densidad | P.E. | P.F. |
| 15 | Cadmio | Cd | 8,65 | 765 | 321 |
| 16 | Calcio | Ca | 1,55 | 1440 | 839 |
| 17 | Californio | Cf | No reportada | 1490 | 900 |
| 18 | Carbono | C | 2,62 | 4830 | 3727 |
| 19 | Cerio | Ce | 6.78 | 3468 | 796 |
| 20 | Cesio | Cs | 1,87 | 690 | 28,4 |
| 21 | Circonio | Zr | 6,49 | 3580 | 1852 |
| 22 | Cloro | Cl | 1,56 | -34,05 | -101 |
| 23 | Cobalto | Co | 8,9 | 2900 | 1495 |
| 24 | Cobre | Cu | 8,96 | 2595 | 1083 |
| 25 | Criptón | Kr | 2,6 | -152 | -157,3 |
| 26 | Cromo | Cr | 7,19 | 2665 | 1875 |
| 27 | Curio | Cm | 13,5 | 3540 | 1340 |
| 28 | Disprosio | Dy | 8,54 | 2600 | 1407 |
| 29 | Einstenio | Es | No reportada | No reportada | No reportada |
| 30 | Erbio | Er | 9,1 | 2900 | 1497 |
| 31 | Escandio | Sc | 3,0 | 2730 | 1539 |
| 32 | Estaño | Sn | 7,30 | 2270 | 232 |
| 33 | Estroncio | Sr | 2,6 | 1380 | 768 |
| 34 | Europio | Eu | 5,26 | 1439 | 826 |
| Elementos químicos de la F-L | |||||
| No. | Nombre | Símbolo | Densidad | P.E | P.F |
| 35 | Fermio | Fm | 1,69 | No reportado | No reportado |
| 36 | Flúor | F | 1,505 | -188,13 | -219,61 |
| 37 | Fósforo | P | 1,82 | 280 | 44,1 |
| 38 | Francio | Fr | No reportada | 677 | 27 |
| 39 | Gadolinio | Gd | 7,89 | 3273 | 1313 |
| 40 | Galio | Ga | 5,91 | 2403 | 30 |
| 41 | Germanio | Ge | 5,32 | 2830 | 937 |
| 42 | Hafnio | Hf | 13,1 | 4602 | 2227 |
| 43 | Hahnio | Ha | No reportada | No reportado | No reportado |
| 44 | Helio | He | 0,126 | -268,9 | -272,2 |
| 45 | Hidrógeno | H | 0,08988 | -252,87 | -255,34 |
| 46 | Hierro | Fe | 7,86 | 2750 | 1535 |
| 47 | Holmio | Ho | 8,8 | 2700 | 1474 |
| 48 | Indio | In | 7,31 | 2080 | 157 |
| 49 | Iridio | Ir | 22,5 | 4130 | 2410 |
| 50 | Iterbio | Yb | 6,98 | 1196 | 819 |
| 51 | Itrio | Y | 4,5 | 3338 | 1522 |
| 52 | Lantano | La | 6,7 | 3464 | 918 |
| 53 | Laurencio | Lr | No reportada | No reportado | No reportado |
| 54 | Litio | Li | 0,53 | 1342 | 181 |
| 55 | Lutecio | Lu | 9,84 | 3402 | 1663 |
| Elementos químicos de la M-P | |||||
| No. | Nombre | Símbolo | Densidad | P.E | P.F |
| 56 | Magnesio | Mg | 1,74 | 1107 | 649 |
| 57 | Manganeso | Mn | 7,43 | 962 | 1245 |
| 58 | Mendelevio | Md | No reportada | No reportado | No reportado |
| 59 | Mercurio | Hg | 13,53 | 356,58 | -38,87 |
| 60 | Molibdeno | Mo | 10,22 | 5560 | 2610 |
| 61 | Neodimio | Nd | 7,01 | 3074 | 1021 |
| 62 | Neón | Ne | 1,20 | -246,08 | -248,6 |
| 63 | Neptunio | Np | 20,4 | 3902 | 630 |
| 64 | Niobio | Nb | 8,55 | 4742 | 2468 |
| 65 | Níquel | Ni | 8,91 | 2732 | 1453 |
| 66 | Nitrógeno | N | 1,2506 | -196 | -210 |
| 67 | Nobelio | No | No reportada | No reportado | No reportado |
| 68 | Oro | Au | 19,3 | 2970 | 1064,4 |
| 69 | Osmio | Os | 22,4 | 5027 | 3030 |
| 70 | Oxígeno | O | 1,43 | -182,96 | -218,4 |
| 71 | Paladio | Pd | 12,02 | 2970 | 1554 |
| 72 | Plata | Ag | 10,50 | 2212 | 961,93 |
| 73 | Platino | Pt | 21,4 | 3827 | 1772 |
| 74 | Plomo | Pb | 11,4 | 1740 | 328 |
| 75 | Plutonio | Pu | 19,84 | 3235 | 641 |
| 76 | Polonio | Po | 9,4 | 962 | 254 |
| 77 | Potasio | K | 0,86 | 760 | 63 |
| 78 | Praseodimio | Pr | 6,77 | 3520 | 931 |
| 79 | Promecio | Pm | 6,475 | 3000 | 1042 |
| 80 | Protactinio | Pa | 15,4 | 4227 | 1552 |
| Elementos químicos de la R-Z | |||||
| No. | Nombre | Símbolo | Densidad | P.E | P.F |
| 81 | Radio | Ra | 5,5 | 1140 | 700 |
| 82 | Radón | Rn | 9,91 | -62 | -71 |
| 83 | Renio | Re | 20,53 | 5627 | 3180 |
| 84 | Rodio | Rh | 12,41 | 3727 | 1966 |
| 85 | Rubidio | Rb | 1,53 | 686 | 38,89 |
| 86 | Rutenio | Ru | 12.2 | 3900 | 2310 |
| 87 | Rutherfordio | Rf | No reportada | No reportado | No reportado |
| 88 | Samario | Sm | 7,54 | 1794 | 1074 |
| 89 | Selenio | Se | 4,79 | 685 | 50 |
| 90 | Silicio | Si | 2,33 | 2355 | 1410 |
| 91 | Sodio | Na | 0,97 | 883 | 98 |
| 92 | Talio | Tl | 11,85 | 1457 | 304 |
| 93 | Tántalio | Ta | 16,6 | 5425 | 2996 |
| 94 | Tecnecio | Tc | 11,5 | 4567 | 2200 |
| 95 | Teluro | Te | 6,24 | 990 | 452 |
| 96 | Terbio | Tb | 8,27 | 3230 | 1356 |
| 97 | Titanio | Ti | 4,5 | 3287 | 1660 |
| 98 | Torio | Th | 11,7 | 4850 | 1750 |
| 99 | Tulio | Tm | 9,33 | 1950 | 1545 |
| 100 | Tungsteno | W | 19,3 | 5660 | 3410 |
| 101 | Uranio | U | 18,90 | 3818 | 1132 |
| 102 | Vanadio | V | 5,8 | 3380 | 1890 |
| 103 | Xenón | Xe | 3,06 | -108,1 | -111,8 |
| 104 | Yodo | I | 4,92 | 185 | 113,6 |
| 105 | Zinc | Zn | 7,14 | 907 | 420 |
| Datos. | Fórmulas. | Sustituciones. |
| vf=220 ml | v=vf-vi | 220-200=20 ml |
| vi=200 ml | d=m/v | 70.2/20 |
| m=70.2 g |
| Significado de las siglas: |
| Resultado=3,51 g/ml |
| La respuesta es: Sí son diamantes, pues la densidad de los diamantes es: 3,51 g/ml. |
| Datos. | Fórmula. | Sustitución |
| m=637.5g | d=m/v | 637.5/750 ml |
| v=750 ml |
| Significado de las siglas: |
| Resultado= 0,85g/ml |
| Lavoisier |
| Estas leyes son pilares ya que permiten estudiar y entender los cambios químicos que sufren las sustancias. Tal vez uno de los conceptos pilares para la medición en Química, lo fue la teoría del flogisto que era como el alma que poseían las sustancias, la cual se perdía o ganaba al quemarlas según convenía, con la cual se justificaba la pérdida o ganancia de peso en este cambio. |
| E = mc2 |
| donde: |
Un elemento es aquella sustancia que no puede descomponerse por métodos químicos en otra más sencilla. Los elementos conocidos se encuentran clasificados en la tabla periódica en total son 105.
Los Compuestos resultan de la combinación de 2 o más elementos en una proporción definida, los elementos unidos pierden sus propiedades individuales . Los compuestos pueden separarse por métodos químicos. Ejemplos: NaCl, CO2,HCl etcétera.
Por citar algunos ejemplos de mezclas tenemos:
Dependiendo del número de fases que presentan las mezclas estas se dividen en:
Las mezclas homogéneas presentan una fase y dentro de esta clasificación tenemos:
Soluciones, las cuales a su vez se subdividen en:
Las Soluciones sólidas a su vez pueden ser: gas-sólido, líquido-sólido y sólido-sólido.
Las soluciones líquidas pueden ser a su vez:
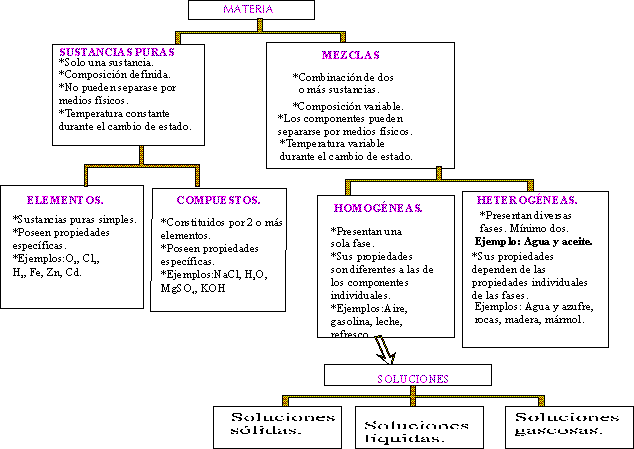
Con ayuda de la siguiente figura se resume la clasificación de la materia que está contenida en los párrafos anteriores.
|
|
A continuación se ilustran los dispositivos para montar cada una de las destilaciones mencionadas.
|
|
|
|
| Destilación Simple. | Destilación Fraccionada. | Destilación por arrastre de vapor. |
|
|
La Cromatografía en columna.Utiliza columnas de vidrio rellenas de Alúmina (Al2O3), Sílica u Oxido de magnesio. Este método de separación necesita hacer pasar la mezcla, empleando un disolvente.
La Cromatografía en capa fina utiliza una placa de vidrio recubierta con fase estacionaria (generalmente del tipo de escrito para la cromatografía en columna con algunas variantes).
La Cromatografía en papel utiliza tiras de papel cromatográfico los cuales se introducen en la cuba cromatográfica.
La Cromatografía de líquidos de alta eficiencia (HPLC) es parecida a la Cromatografía en columna, sólo que se aplica el flujo a presión (entre 1500 a 2200 psi), el tamaño de partícula es entre 3 y 10 micras, la longitud de la columna es entre 5 y 25 cm y requiere de equipo sofisticado.
La Cromatografía de gases . En este tipo de Cromatografía la fase móvil es un gas llamado gas portador o acarreador y la fase estacionaria puede ser un sólido o una película de líquido de alto punto de ebullición (generalmente Polietilén - Glicol o Silición).
Los compuestos que se pueden separar por Cromatografía de gases deben ser volátiles y térmicamente estables.
|
|
ESTADOS DE AGREGACIÓN DE LA MASA.
La materia se presenta básicamente en cuatro estados, los cuales son: sólido, líquido , gaseoso y plasma. En la siguiente tabla se muestran algunas características físicas de los 3 primeros estados de agregación de la materia.
| Estado de Agregación | Volumen | Forma | Compresibilidad | Atracción entre moléculas |
| Sólido | Definido | Definida | Incomprensible | Intensa |
| Líquido | Definido | Indefinida | Incomprensible | Moderada |
| Gas | Indefinido | Indefinida | Compresible | Despreciable |
Estado sólido. Es un estado de la materia en el cual las partículas ocupan posiciones fijas dándole a la sustancia una forma definida. Los sólidos comúnmente tienen unidad similar. Presentan enlaces muy fuertes por esa razón no tienen movilidad. Se presentan en dos formas las cuales son:
A continuación se muestra la estructura de un compuesto sólido , es muy importante observar que como se mencionó en las líneas anteriores los sólidos presentan una forma definida.
|
|
| Sólido cristalino de NaCl |
Estado Líquido.Estado de agregación de la materia en el cuál las partículas de una sustancia están unidas débilmente y gracias a que el enlace que presentan es débil, las partículas se pueden mover y por consiguiente los líquidos pueden cambiar su forma dentro de un volumen fijo. La movilidad de sus partículas permite que un líquido tenga fluidez y eso hace que tome la forma del recipiente donde se almacene. Con el objeto de ilustra que los líquidos presentan movimiento a continuación se anexa un dibujo que intenta ilustrar las características que ya fueron mencionadas.
|
|
| figura de un líquido |
PROPIEDADES DE LOS LÍQUIDOS.
Este estado de agregación tiene las siguientes propiedades:
Estado gaseoso. Es un estado de agregación de la materia en el cual las fuerzas de atracción entre las partículas de una sustancia son muy débiles, prácticamente no existen. Por esta razón las partículas se mueven a enormes velocidades. Los gases se caracterizan por no tener forma definida ni volumen. En este estado de agregación las partículas se encuentran en un estado de movimiento continuo y por lo mismo las partículas chocan entre sí y con las paredes del recipiente que los contiene. Un gas empuja constantemente en todas direcciones por esa razón los gases llenan por completo los recipientes que ocupan.
Las colisiones en las paredes originan la presión del gas. A continuación se anexa un dibujo de una sustancia en estado gaseoso.
|
|
| Gas |
CARACTERÍSTICAS DEL ESTADO GASEOSO.
Plasma.
Es considerado como el cuarto estado de la materia, pues su presencia en el universo es muy abundante. Se trata de una masa gaseosa fuertemente ionizada en la cual, como consecuencia de temperaturas extremadamente elevadas, los átomos se han visto despojados de su envoltura de electrones y coexisten con los núcleos atómicos en un estado de agitación intensa. Las estrellas, durante una parte importante de su vida, están constituidas por grandes masas de plasma. Debido a la violencia de los choques entre núcleos, en tales condiciones se producen reacciones de síntesis de núcleos nuevos con una considerable liberación de energía. El Sol es esencialmente una enorme esfera de plasma.
CAMBIOS DE ESTADO.
Cuando una sustancia cambia de estado ese cambio implica suministro o liberación de energía del sistema. Por esa razón los cambios de estado pueden ser de dos tipos.
Cambios de Estado Endotérmicos.
|
|
|
|
|
|
|
|
|
|
Cambios de Estado Exotérmicos.
|
|
FENÓMENOS FÍSICOS Y QUÍMICOS.
|
|
|
|
|
|
| TABLA DE FENÓMENOS FÍSICOS Y QUÍMICOS Proceso | Tipo de fenómeno | Observaciones |
| Oxidación del hierro | Químico | El metal brillnate y lustroso se transforma en óxido café rojizo |
| Ebullición del agua | Físico | El líquido se transforma en vapor |
| Ignición de azufre en aire | Químico | El azufre sólido y amarillo se transforma en dióxido de azufre, gas sofocante |
| Pasar un huevo por agua hirviendo | Químico | La yema y la clara líquida se transforman en sólidas, desnaturalización de proteínas |
| Combustión de la gasolina | Químico | La gasolina líquida se quema y se transforma en monóxido de carbono, dióxido de carbono, agua, todos en estado gaseoso |
| Digestión de los alimentos | Químico | Los alimentos se transforman en nutrientes líquidos y, parcialmente, en desechos sólidos |
| Aserrado de la madera | Físico | Se producen trozos más pequeños de madera y aserrín, a partir de una pieza mayor de madera |
| Quemado de la madera | Químico | La madera arde y se transforma en cenizas,dióxido de carbono gaseoso y agua |
| Calentamiento del vidrio | Físico | El vidrio sólido se transforma en pasta deformable, y así se puede cambiar la forma del vidrio |
Fuente:Hein Arena, Fundamentos de Química, Editores Thomson, p.72
MODELO ATOMICO DE BOHR.
Modelo de Bohr.
Al modelo de Rutherford se le encontraron pequeños inconvenientes, como el de explicar
porqué los electrones no pierden su energía y caen al núcleo, la formación de espectros por un elemento en estado gaseoso para lo cual Niels Bohr propusó.
La concepción del electrón como partícula y onda a la vez surgió que no puede localizarse con precisión.
|
|
| |
Modelo Atómico de Bohr
El físico danés Niels Bohr ( Premio Nobel de Física 1922), postula que los electrones giran a grandes velocidades alrededor del núcleo atómico. Los electrones se disponen en diversas órbitas circulares, las cuales determinan diferentes niveles de energía. El electrón puede acceder a un nivel de energía superior, para lo cual necesita "absorber" energía. Para volver a su nivel de energía original es necesario que el electrón emita la energía absorbida ( por ejemplo en forma de radiación). Este modelo, si bien se ha perfeccionado con el tiempo, ha servido de base a la moderna física nuclear. Este propuso una Teoría para describir la estructura atómica del Hidrógeno, que explicaba el espectro de líneas de este elemento. A continuación se presentan los postulados del Modelo Atómico de Bohr:
El Atomo de Hidrógeno contiene un electrón y un núcleo que consiste de un sólo protón. · El electrón del átomo de Hidrógeno puede existir solamente en ciertas órbitas esféricas las cuales se llaman niveles o capas de energía. Estos niveles de energía se hallan dispuestos concéntricamente alrededor del núcleo. Cada nivel se designa con una letra (K, L, M, N,...) o un valor de n (1, 2, 3, 4,...).
hv = | Ei - Ei |
De esta manera se explican los espectros atómicos, que en el caso del Hidrógeno los niveles de energía posibles están dados por la fórmula:
E = - (h/R)/n2 , ( n = 1, 2, 3, . . . infinito)
h = 60625 x 10-34 Joule - seg, Const. de Plank
R = 1.10 x 107 m-1 , Const. de Rydberg
El modelo de Niels Bohr, coincide con el propuesto por Rutherford, admite la presencia de un núcleo positivo que contiene, prácticamente, toda la masa del átomo, donde se encuentran presentes los protones y los neutrones.
Los electrones con carga negativa, se mueven alrededor del núcleo en determinados niveles de energía, a los que determinó estados estacionarios, y les asignó un número entero positivo. El nivel más cercano tiene el número 1, le sigue el 2, como se citó en párrafo de éste mismo enunciado (Modelo atómico de Bohr).
Siempre que el electrón se mantenga en la órbita que le corresponde, ni gana ni pierde energía.
Si un electrón salta de una órbita a otra capta o libera energía en forma de fotones. La cantidad viene dada por la diferencia de energía entre los dos (02) niveles.
La energía de cada nivel es mayor en la medida que se aleja del núcleo; sin embargo, las diferencias entre los niveles va disminuyendo, lo que permite que las transiciones electrónicas se produzcan con facilidad.
El número de electrones de cada elemento en su estado natural es característico, puesto que depende de su número atómico. Estos electrones estarán distribuidos en diferentes niveles energéticos que pueden funcionar como estaciones de paso para aquellos que reciben suficiente energía para saltar de un nivel a otro. Al devolverse, la luz que, difractada, produce el espectro característico.
Principios de incertidumbre
Para poder estudiar las propiedades de un átomo y de sus partículas constituyentes, es necesario iluminarlo; es decir lograr la incidencia de luz sobre el; esto trae un cambio en su contenido energético y, a s vez en la posición. En otra palabras: el estudio del átomo lleva un error necesario que nos impide hablar con certeza de la posición o contenido energético del mismo.
Esto imposibilita presentar un átomo como hasta el momento se ha hecho, puesto que se puede describir un espacio donde es muy probable encontrar un electrón, pero no se pude excluir la posibilidad de que se encuentre en otro lugar.
Según el principio de incertidumbre no se puede conocer con exactitud la posición del electrón ni su contenido energético. Esto obliga a usar un nuevo termino "probabilidad", para la descripción del átomo.
Modelo Atómico actual
Entre los conocimientos actuales o no sobre el átomo, que han mantenido su veracidad, se consideran los siguientes:
1. La presencia de un núcleo atómico con las partículas conocidas, la casi totalidad de la masa atómica en un volumen muy pequeño.
2.Los estados estacionarios o niveles de energía fundamentales en los cuales se distribuyen los electrones de acuerdo a su contenido energético.
3.La dualidad de la materia (carácter onda-partícula), aunque no tenga consecuencias prácticas al tratarse de objetos de gran masa. En el caso de partículas pequeñas (electrones) la longitud de onda tiene un valor comparable con las dimensiones del átomo.
4. La probabilidad en un lugar de certeza, en cuanto a la posición, energía y movimiento de un electrón, debido a la imprecisión de los estudios por el uso de la luz de baja frecuencia.
Fue Erwin Schodinger, quien ideó el modelo atómico actual, llamado "Ecuación de Onda", una fórmula matemática que considera los aspectos anteriores. La solución de esta ecuación, es la función de onda (PSI), y es una medida de la probabilidad de encontrar al electrón en el espacio. En este modelo, el área donde hay mayor probabilidad de encontrar al electrón se denomina orbital.
El valor de la función de onda asociada con una partícula en movimiento esta relacionada con la probabilidad de encontrar a la partícula en el punto (x,y,z) en el instante de tiempo t.
En general una onda puede tomar valores positivos y negativos. una onda puede representarse por medio de una cantidad compleja.
Piense por ejemplo en el campo eléctrico de una onda electromagnética. Una probabilidad negativa, o compleja, es algo sin sentido. Esto significa que la función de onda no es algo observable. Sin embargo el módulo (o cuadrado) de la función de onda siempre es real y positivo. Por esto, a se le conoce como la densidad de probabilidad.
La función de onda depende de los valores de tres (03) variables que reciben la denominación de números cuánticos. Cada conjunto de números cuánticos, definen una función específica para un electrón.
Números Cuánticos
Son cuatro (04) los números encargados de definir la función de onda (PSI) asociada a cada electrón de un átomo: el principal, secundario, magnético y de Spin. Los tres (03) primeros resultan de la ecuación de onda; y el último, de las observaciones realizadas de los campos magnéticos generados por el mismo átomo.
Número cuántico principal
Es un criterio positivo, representado por la letra "n", indica los niveles energéticos principales. Se encuentra relacionado con el tamaño. En la medida que su valor aumenta, el nivel ocupa un volumen mayor y puede contener más electrones, y su contenido energético es superior. Sus valores pueden ser desde 1 hasta infinito.
Número cuántico secundario
Representado por la letra "I", nos indica la forma que pueden tener el espacio donde se encuentra el electrón. El valor que se le asigna depende del número principal; va desde cero (0) hasta n-1.
Se ha conseguido que para dos (02) electrones que pertenecen al mismo nivel energético (igual "n"), las diferencias en valores de "I", se expresan en diferencias de contenidos energéticos, debido a esto reciben la denominación de subniveles de energía con un aumento progresivo en la medida que "I" aumenta de valor.
| I = 0 |
| I = 1 |
| I = 2 |
| I = 3 |
| Orbital s |
| Orbital p |
| Orbital d |
| Orbital f |
| I = 0 |
| I = 1 |
| I = 2 |
| I = 3 | Comparación |
| Orbital | < | Orbital | < | Orbital | < | Orbital | Desde el punto de |
| s |
| p |
| d |
| f | Vista energético |
Número cuántico magnético
Representa las orientaciones que pueden asumir los diferentes orbitales frente a un campo magnético; el símbolo utilizado es "m"; y los valores que tienen son los números orbitales enteros que van desde -1 hasta +1. El números de valores que pueden tener "m" indican el números de órbitas que puede contener un sub-nivel de energía.
Número cuántico de Spin
Tiene dos(02) valores permitidos +1/2 y -1/2. Estos valores representan el movimiento del electrón, tipo de rotación sobre su eje, con dos (02) únicas posibilidades y opuestas entre sí, hacía la derecha o hacía la izquierda. Cada uni de los orbitales puede contener dos (02) electrones, uno con cada spin. De estar los dos (02), el momento magnético se anula, es cero, esto sucede debido a lo apuesto.
Isótopos e isóbaros
Los Isótopos:
Son átomos que tienen el mismo número atómico, pero diferentes masas. Al pertenecer al mismo elemento químico presentan las mimas propiedades, pero no son reconocibles por su masa diferente La diferencia se encuentra en el número de neutrones presentes en el núcleo.
Los Isóbaros:
Son átomos que, a pesar de presentar diferentes número atómico, tiene masas iguales. Sus propiedades químicas son diferentes puesto que se trata de elementos químicos también diferentes.
Fusión y Fisión nuclear
Fusión Nuclear:
Es la unión de dos núcleos ligeros, para producir uno más pesado.
Dos Isótopos de Hidrógeno se unen formando un núcleo con dos protones y dos neutrones que corresponden a un átomo de Helio.
Sin embargo esta reacción requiere de una alta energía de activación, para que los núcleos se acerque y se fundan en uno. Una vez comenzada la reacción, la energía liberada es enorme, del orden de 1700GJ (Gigajoule).
Fisión Nuclear:
Es la ruptura de un núcleo atómico en dos partes parecidas en el contenido de protones, originado con el bombardeo de neutrones.
Al chocar un neutro con un átomo de Uranio, se crea un núcleo provisional que posteriormente se divide en dos núcleos.
Con respecto a la energía que se produce, para la fisión de un gramo de Uranio, es de 85 Gigajoule (Gj) 109 J, aproximadamente a la misma que se produce al quemar tres toneladas de Carbón. Debido a este enorme despedimiento de energía fue usado como bomba el la segunda guerra mundial.
Conclusión
La evolución de los modelos físicos del átomo se vio impulsada por los datos experimentales. El modelo de Rutherford, en el que los electrones se mueven alrededor de un núcleo positivo muy denso, explicaba los resultados de experimentos de dispersión, pero no el motivo de que los átomos sólo emitan luz de determinadas longitudes de onda (emisión discreta).
Bohr partió del modelo de Rutherford pero postuló además que los electrones sólo pueden moverse en determinadas órbitas; su modelo explicaba ciertas características de la emisión discreta del átomo de hidrógeno, pero fallaba en otros elementos.
El modelo de Schrödinger, que no fija trayectorias determinadas para los electrones sino sólo la probabilidad de que se hallen en una zona, explica parcialmente los espectros de emisión de todos los elementos; sin embargo, a lo largo del siglo XX han sido necesarias nuevas mejoras del modelo para explicar otros fenómenos espectrales.
Bibliografía
Freddy G, Suárez F, Química Editorial Romor, 1º Ciclo diversificado, 1997.
Mayor serrano de Benítez y José Fabián Zonella, Química editorial Larenze, 1º ciclo diversificado 1987.
Wilian I. Mantecton, Emil Slowinski. Química Superior, Tercera edición , Editorial Interamercana.
Lic. María del Pilar Rodríguez, Química Editorial salesiana.
Microsoft Encarta 2000.
NUMEROS CUANTICOS, TEORIA CUANTICA.
NÚMEROS CUÁNTICOS.
Este problema fue tratado por Heisenberg en su principio de incertidumbre en el que señaló que es imposible determinar al mismo tiempo la posición y velocidad del electrón. Lo cuál llevo al concepto de probabilidad de encontrar al electrón en un lugar determinado del átomo. Los cálculos de esta probabilidad requieren de una ecuación llamada función de ondas.
De la ecuación matemática, se obtiene 4 números cuánticos que describen la posición del electrón, denominados números cuánticos.
| Número cuántico. | Descripción. |
| n | Número cuántico principal señala el orden de aumento en la distancia de la distribución electrónica sus valores son: 1,2,3,4,5,6 y 7 |
| l | Segundo número cuántico designa el subnivel e indica la forma de la distribución electrónica sus valores son: 0,1,2,3,5, y 6. Es decir n-1. Sólo se tienen descritas las formas para los primeros 4 valores. |
| m | Es el tercer número cuántico designa el movimiento de la carga eléctrica, que da lugar al magnetismo, esto permite que el subnivel se separe en distintos orbitales. Sus valores son: +l, 0 -l. |
| ms ó "s" | Corresponde al cuarto número cuántico designado a menudo por ms y recibe el nombre de número cuántico de spin, sólo tiene los valores de +½ y -½, los cuales corresponden a las dos orientaciones para las que se emplean flechas arriba y flecha hacia abajo respectivamente. |
Subniveles y formas de los 4 valores que puede adquirir el número cuántico l
| Valor del número cuántico l | subnivel | |
| 0 | s | |
| 1 | p | |
| 2 | d | |
| 3 | f |
| Orbital "s" |
| Orbital "p" |
|
|
| Orbital px | Orbital py | Orbital pz |
| Orbital "d"
|
|
|
|
|
| Orbital dxy | Orbital dxz | Orbital dyz | Orbital dx2y2 | Orbital dz2 |
| Orbital "f".
|
|
|
|
| Orbital 4fxz2 | Orbital 4fz3 | Orbital 4fyz2 | Orbital 4fxy2 |
|
|
|
| |
| Orbital 4fz(x2-y2) | Orbital 4fx(x2-3y2) | Orbital 4fy(3x2-y2) |
ESTADO BASAL Y ESTADO EXCITADO.
|
|
Estado basal o fundamental. Es el estado mínimo disponible de energía dentro de un átomo.
Estado excitado. Es el estado de un átomo, molécula u otro sistema con energía mayor a la de su estado fundamental o basal.
Teoría cuántica.
La base de ésta consiste en considerar que el electrón tiene propiedades de partícula y de onda. Matemáticamente se puede describir el movimiento de los electrones en función de su energía, por medio de ecuaciones de onda. Resolviéndolas se puede saber en que lugar pueden encontrarse los electrones; la solución se llama función de onda y existe una solución para cada nivel energético. La solución puede representarse con una gráfica en 3 dimensiones, que nos indica en que regiones del espacio es más probable encontrar al electrón. A esta región la conocemos como orbital.
Los números cuánticos son 4: principal (n), orbital o azimutal (l), magnético (m) y spin (n)
Número cuántico principal.- puede valer cualquier número entero desde uno hasta infinito; es el que gobierna principalmente la energía del electrón y también el tamaño del orbital.
Número cuántico orbital.- puede tener cualquier valor entero pero debe ser menor que n, es decir, su máximo valor será n-1; gobierna la forma del orbital y el momento angular del electrón a medida que circula por el orbital alrededor del núcleo.
Número cuántico magnético.- toma valores enteros que varían de +l a -l; gobierna la dirección del orbital y el comportamiento del electrón en un campo magnético.
Número cuántico spin.- sólo puede valer 1/2, gobierna el momento angular axial de un electrón.
EL PRINCIPIO DE INCERTIDUMBRE.
El hecho de que cada partícula lleva asociada consigo una onda, impone restricciones en la capacidad para determinar al mismo tiempo su posición y su velocidad. Este principio fué enunciado por W. Heisenberg en 1927.
asociar con ésta un paquete de ondas mas o menos bien localizado.
Un paquete de ondas se construye mediante la superposición de un número
infinito de ondas armónicas de diferentes frecuencias.
En un instante de tiempo dado, la función de onda asociada con un paquete
de ondas esta dado por

donde k representa el número de onda

y donde la integral representa la suma de ondas con frecuencias (o número
de ondas) que varian desde cero a mas infinito ponderadas mediante el factor
g(k).
El momento de la partícula y el número de ondas estan relacionados
ya que

de lo cual se deduce que

las contribuciones de las ondas cuyo número de onda varia entre cero e
infinito y por lo tanto el momento 
tambien varia entre
cero e infinito. Es decir que esta completamente indeterminado.
tipos de paquetes de onda y su transformada de Fourier que nos dice
como estan distribuidas las contribuciones de las ondas con número de ondas
k dentro del paquete.

espacio x, tiene contribuciones practicamente iguales de todas las ondas
con número de ondas k.
| El principio de incertidumbre nos dice que hay un límite en la precisión con el cual podemos determinar al mismo tiempo la posición y el momento de una partícula. |


entonces que

Es decir, que la incertidumbre en el momento es infinita.
CONFIGURACION ELECTRONICA DE LOS ELEMENTOS.
El descubrimiento de un gran número de elementos y el estudio de sus propiedades puso de manifiesto entre algunos de ellos ciertas semejanzas. Esto indujo a los químicos a buscar una clasificación de los elementos no sólo con el objeto de facilitar su conocimiento y descripción, sino también para obtener información específica acerca de las propiedades y formas de combinación de los elementos.
Primera tentativa de clasificación.
En 1817 J. W. Döbereiner realizó agrupaciones de tres elementos en donde se observó que el elemento central tenía una masa atómica, correspondiente al promedio de los otros dos. Por lo que sus clasificaciones se conocen como triadas.
| Cloro=35.5 | Calcio=40 | ||
| Bromo=79.9 | Br=35.5+126.9/2=81.2 | Estroncio=87.6 | Sr=40+137.4/2=88.7 |
| Iodo=126.9 | bario=137.4 |
Segunda tentativa de clasificación.
En 1864 A.R. Newlands creó un nuevo arreglo conocido como octavas. Ordenando los elementos en orden creciente de su masa atómica. El octavo elemento se parecía al primero, el noveno al segundo y así consecutivamente.
| Li | Be | B | C | N | O | F |
| Na | Mg | Al | Si | P | S | Cl |
El descubrimiento de nuevos elementos creó la necesidad de una nueva clasificación. Tercera tentativa de clasificación. (Clasificación de Mendeleiev.)
Para 1869 D.I. Mendeleiev, construye una tabla cuyo ordenamiento se basaba en las propiedades químicas y físicas de los elementos. Al descubrirse la estructura atómica de los elementos, se encontró que las propiedades físicas y químicas de los mismos estaban en función del número atómico. A esta afirmación se le conoce como ley periódica moderna y fue establecida por Henri Moseley. La tabla periódica se basa en el ordenamiento de los elementos a partir de su número atómico y se debe a las aportaciones de Mendeleiev, Moseley Werner y Meyer, etc. La tabla periódica actual se clasifica por:
| Bloque. | Configuración electrónica. |
| s | Su configuraciónn termina en s. |
| p | Su configuración termina en p. |
| d | Su configuración termina en d. |
| f | Su configuración termina en f. |

Metales. Son las sustancias puras ubicadas a la izquierda de la tabla periódica, a partir de la línea escalonada es decir del elemento Aluminio al Polonio.
No metales. Son aquellas sustancias puras ubicadas a la derecha de la tabla periódica , a partir de la línea escalonada del elemento químico Polonio al Alumnio.
Los primeros trabajos de Mendeleiev datan de 1860 y sus conclusiones fueron leídas en 1869 en la Sociedad Química Rusa. Su trabajo se resume en los siguientes postulados.
Desventajas de la tabla periódica de Mendeleiv.
La Tabla Periódica finalmente clasifica a los elementos según sus propiedades químicas en:
| Grupo. | Nombre. |
| IA | Metales alcalinos |
| II A | Metales alcalinotérreos. |
| VI A | Calcógenos |
| VII A | Halogénos. |
| VIII A |
|
Tabla Periódica
Es una forma ordenada de agrupar a los elementos, por tal motivo se puede utilizar como una herramienta para poder predecir el comportamiento de los elementos, en la formación de compuestos.
LEY PERIÓDICA.
También se conoce como periodicidad esto quiere decir que los elementos químicos de acuerdo al grupo en que se encuentran presentan una periodicidad es decir un comportamiento similar y esto implica que si se conoce la química por ejemplo del Potasio entonces se puede predecir el comportamiento del Litio. Es decir los elementos de un mismo grupo tienen propiedades químicas similares y los elementos de un mismo período tienen propiedades que van cambiando gradualmente. Esta ley permite agrupar a los elementos en la tabla periódica y colocarlos en un lugar específico. Podemos mencionar por lo tanto que tenemos dos agrupaciones. La primera agrupación es corta y organiza a la tabla periódica en 7 períodos (Filas horizontales) y dos grupos o columnas identificados por las letras "A" y "B". La segunda agrupación es larga y distribuye los elementos en 7 períodos (filas horizontales) y 18 columnas, las cuales están numeradas progresivamente. Esta ley facilitó el estudio sistemático de los elementos, permitió pronosticar las propiedades de algunos elementos.
PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS.
|
|
|
|
Ejemplo:
| a) Ko + energía de ionización. | K +1 + 1e- | 1ª energía de ionización = 418.8 Kcal/mol. | |
| b)Cao + energía de ionización | Ca +1 + 1 e- | 1ª energía de ionización = 589.5 Kcal/mol |
|
|
DIFERENCIAS ENTRE METALES Y NO METALES.
Una característica muy importante de los metales es que estos elementos químicos tienden a perder electrones y son sumamente reactivos en cambio los no metales son elementos que tienden a ganar electrones y su actividad química en comparación con los metales es menor. A continuación se enlistan algunas características de los metales y de los no metales.
CARACTERÍSTICAS DE LOS METALES.
CARACTERÍSTICAS DE LOS NO METALES.
METALES DE TRANSICIÓN.
Los metales de transición se localizan en la parte central de la tabla periódica y se les identifica con facilidad mediante un número romano seguido de la letra "B".
Ciertas tablas periódicas no emplean la designación de "A" o "B" para identificar a las familias, en lugar de ello se numeran en forma ,progresiva con números arábigos las familias y con esta numeración se tienen un total de: 18.
En general, las propiedades de los metales de transición son bastantes similares estos metales son más quebradizos y tienen puntos de fusión y ebullición mas elevados que los otros metales, las densidades, puntos de fusión y puntos de ebullición de los metales de transición aumentan primero y luego disminuyen. Dentro de cada periodo, conforme aumenta el número atómico, esta tendencia es mas notoria en los metales de transición del sexto periodo, los metales de transición son muchos menos reactivos que los metales alcalinos y alcalinotérreos, así, aunque los metales alcalinos, como el sodio o el potasio, nunca se encuentran libres en la naturaleza, si se ha podido encontrar muestras relativamente puras de varios metales de transición, como: oro, plata, hierro y manganeso.
Los metales de transición pueden perder dos electrones de valencia del subnivel "s" más externo, además de electrones en el subnivel "d" retenidos con poco fuerza en el siguiente nivel energético más bajo. así un metal de transición en particular, puede perder un numero variable de electrones para formar iones positivos con cargas distintas. Por, ejemplo, el hierro pueden, formar el ion Fe2+ o el ion Fe3+ se dice que el hierro tienen números de oxidación +2 y +3. muchos compuestos de metales de transición presentan un colorido brillante gracias a un número variable de electrones no apareados. El cobre, la plata y el oro se les llama metales de acuñación.
Los tres son buenos conductores de calor y electricidad. El cobre tiene un color rojizo característico, que poco a poco se oscurece conforme reacciona el metal con el oxigeno y los compuestos de azufre del aire. El cobre se emplea de manera extensa en aplicaciones eléctricas, monedas, tubería para agua y en aleaciones muy conocidas como el latón, el bronce y la plata esterlina. La plata con un brillante lustre metálico, es el mejor conductor tanto de calor como de la electricidad, se emplea en monedas, joyería, contactos eléctricos, circuitos impresos, espejos, baterías, y productos químicos para fotografía. El oro es el más maleable y dúctil de los metales. Es blando, pero por lo general contiene cantidades pequeñas de otros metales para hacer aleaciones que son más, resistentes. el oro no reacciona con el aire ni con la mayor parte de las sustancias químicas. Otros metales de transición importantes son: el cromo, hierro cobalto, níquel y zinc, todos ellos pertenecen al cuarto periodo de la tabla periódica estos metales se emplean mucho en diversas herramientas y en aplicaciones relacionadas. El hierro es el cuarto elemento más abundante y es el metal menos costoso. Las aleaciones del hierro, conocidas como acero, contienen cantidades pequeñas de metales como cromo, manganeso y níquel, que le dan resistencia dureza y durabilidad. El hierro que esta cubierto con una delgada capa de zinc se dice que esta galvanizado. Algo así como la tercera parte de todo el zinc que se produce de emplea para galvanizar alambre, clavos y metal laminado. El zinc es importante en la producción de latón, pilas secas y fundiciones a troquel para objetos automotrices y de ferretería.
HALÓGENOS.
Comprenden el Flúor (F2), Cloro (Cl2), Bromo (Br2), Iodo (I2), y Astato (At2). el nombre de la familia halógeno provienen de las palabras griegas que significan " formadores de sales". Cada átomo de halógeno tiene siete electrones de valencia. Como elementos, los halógenos son todos diatómicos, tienen dos átomos por molécula y son demasiado reactivos como para encontrarse libres en la naturaleza.
MASA ATOMICA.
El descubrimiento del isomorfismo condujo a establecer que los compuestos isomorfos tienen una composición química análoga. Este enunciado se conoce como ley ley de Mitscherlich y se utiliza para la determinación de masas atómicas. El siguiente ejemplo muestra la forma de aplicación a esta ley.
El arseniato sódico es isomorfo del fosfato sódico (PO4HNa2) y le correspondera, por tanto, la fórmula AsO4HNa2, lo que permite determinar el valor As=75 de la masa atómica del arsénico.
También Dulog y Petit observaron que multiplicando la masa atómica correspondiente por el calor específico de numerosos cuerpo simples, considerados en estado sólido, se obtenía un número de calorías igual a 6,3.
Esta observación, considerada como ley general aproximada, ha permitido resolver a veces la indeterminación que pesa sobre la elección de las masas atómicas. De este modo entre los valores 31,5 y 63 aceptables para la masa atómica del cobre, se escogerá el valor 63, que, multiplicado por el calor específico 0,095 del metal en estado sólido, da el producto 6,1, próximo a 6,3.
Sin embargo, el análisis y la síntesis químicos constituyen los metodos más precisos para la determinación de las masas atómicas.
Sin entrar en los detalles de los experimentos realizados para conseguir estas determinaciones, nos limitaremos a indicar que el agua ha servido de base para establecer la masa atómica del oxígeno, y el óxido nítrico (NO) para fijar la del nitrógeno.
Mol
Móleculas-gramo.- La definición análoga de móleculas-gramo, o mol, de un cuerpo compuesto: es una masa de este cuerpo expresada en gramos por el mismo número que representa la masa molecular. Una mólecula-gramo de agua representa 18 gramos de agua; una mólecula-gramo de anhídrido carbónico, 44 gramos de dicho cuerpo.
La masa real de la molécula es igual a la masa molecular (molécula gramo) dividida por el número N de Avogadro. La masa molecular M del anhídrido carbónico, CO2, es
M = 12 + 2 x 16
Dividamos por N los dos miembros de esta igualdad. Resulta
Ahora bien, 12/N representa la masa real de un átomo de carbono; 16/N , la masa real de un átomo de oxígeno, expresadas ambas en una fracción de gramo. El segundo miembro representa la masa real de la molécula de anhídrido carbónico, que es igual a M/N.
La masa molecular es sensiblemente igual a la relación entre la masa real de la molécula y la masa real del átomo de hidrógeno.
Número de Avogadro
Es el número de moléculas que existen en un mol, o peso molecular de gramo, de cualquier sustancia. Un gramo de peso molecular es el peso de una sustancia, en gramos, que es numéricamente equivalente a las dimensiones del peso molecular de esa sustancia. El número de moléculas en un gramo de peso molecular se ha determinado para ser aproximadamente 6.0221367 × 1023 moléculas, como lo establecen diversos métodos actualmente disponibles para químico físicos.
El número de Avogadro se nombra en honor al físico Italiano Amedeo Avogadro, quien postuló en 1811 que volúmenes iguales de gases, en presiones y temperaturas equivalentes, contienen el mismo número de moléculas. La teoría era importante en el desarrollo de la química, pero el número en sí no fue calculado hasta finales del siglo XIX, cuando el concepto fue extendido para incluir no solamente a los gases si no a todos los químicos. Las consideraciones de volumen no se aplican a líquidos o a los sólidos, pero el número de Avogadro en sí retiene la verdad para todas las sustancias, en cualesquier estado.
Bibliografía:
Libro: Enciclopedia de las Ciencias Larousse
Autor: Ramón García-Pelayo y Gross
Editorial: Larousse
Pag: 5-8
Ley de Avogadro
El estudio de los gases atrajo la atención del físico italiano Amedeo Avogadro, que en 1811 formuló una importante ley que lleva su nombre (véase ley de Avogadro). Esta ley afirma que dos volúmenes iguales de gases diferentes contienen el mismo número de moléculas si sus condiciones de temperatura y presión son las mismas. Si se dan esas condiciones, dos botellas idénticas, una llena de oxígeno y otra de helio, contendrán exactamente el mismo número de moléculas. Sin embargo, el número de átomos de oxígeno será dos veces mayor puesto que el oxígeno es diatómico.
De la ley de Avogadro se desprende que las masas de un volumen patrón de diferentes gases (es decir, sus densidades) son proporcionales a la masa de cada molécula individual de gas. Si se toma el carbono como patrón y se le asigna al átomo de carbono un valor de 12,0000 unidades de masa atómica (u), resulta que el hidrógeno tiene una masa atómica de 1,0079u, el helio de 4,0026, el flúor de 18,9984 y el sodio de 22,9898. En ocasiones se habla de "peso atómico" aunque lo correcto es "masa atómica". La masa es una propiedad del cuerpo, mientras que el peso es la fuerza ejercida sobre el cuerpo a causa de la gravedad.
La observación de que muchas masas atómicas se aproximan a números enteros llevó al químico británico William Prout a sugerir, en 1816, que todos los elementos podrían estar compuestos por átomos de hidrógeno. No obstante, medidas posteriores de las masas atómicas demostraron que el cloro, por ejemplo, tiene una masa atómica de 35,453 (si se asigna al carbono el valor 12). El descubrimiento de estas masas atómicas fraccionarias pareció invalidar la hipótesis de Prout hasta un siglo después, cuando se descubrió que generalmente los átomos de un elemento dado no tienen todos la misma masa. Los átomos de un mismo elemento con diferente masa se conocen como isótopos. En el caso del cloro, existen dos isótopos en la naturaleza. Los átomos de uno de ellos (cloro 35) tienen una masa atómica cercana a 35, mientras que los del otro (cloro 37) tienen una masa atómica próxima a 37. Los experimentos demuestran que el cloro es una mezcla de tres partes de cloro 35 por cada parte de cloro 37. Esta proporción explica la masa atómica observada en el cloro.
Durante la primera mitad del siglo XX era corriente utilizar el oxígeno natural como patrón para expresar las masas atómicas, asignándole una masa atómica entera de 16. A principios de la década de 1960, las asociaciones internacionales de química y física acordaron un nuevo patrón y asignaron una masa atómica exactamente igual a 12 a un isótopo de carbono abundante, el carbono 12. Este nuevo patrón es especialmente apropiado porque el carbono 12 se emplea con frecuencia como patrón de referencia para calcular masas atómicas mediante el espectrómetro de masas. Además, la tabla de masas atómicas basada en el carbono 12 se aproxima bastante a la tabla antigua basada en el oxígeno natural.
ENLACE QUÍMICO.
Enlace químico.
Es la fuerza que mantiene unidos a los átomos en un compuesto.
Los átomos al unirse lo hacen para completar 8 e- (regla del octeto) y tener una alta estabilidad). Esta teoría fue propuesta por Gilbert N. Lewis y Walter Kossel en 1916. El enlace es la fuerza que mantiene unidos a los átomos en un compuesto, estas fuerzas son de naturaleza eléctrica.
Molécula.
Es la unidad individual más pequeña, sin carga de un compuesto y se forma por la unión de dos o más átomos.
Compuesto.
Es una sustancia distinta que contiene dos o más elementos combinados químicamente en proporciones definidas de masa.
Los compuestos a diferencia de los elementos se pueden descomponer químicamente y formar sustancias más simples y, o elementos.
FÓRMULAS SEMIDESARROLLADA, DESARROLLADA Y CONDENSADA DE MOLÉCULAS.
FÓRMULA SEMIDESARROLLADA.
Expresa por medio de grupos o radicales los átomos que forman una molécula. Ejemplo:
|
|
FÓRMULA DESARROLLADA O GRÁFICA.
Esta fórmula da una idea de la distribución de los átomos en el espacio.
Ejemplo:
|
|
FÓRMULA CONDENSADA.
Esta representación indica cuantos átomos de cada elemento están presentes en la molécula.
Ejemplo:
|
|
Enlaces covalentes
Un enlace covalente se forma cuando dos átomos se acercan entre sí y comparten uno o más de sus electrones. En un enlace entre dos átomos se comparte un electrón de cada uno de los átomos; en un doble enlace se comparte un total de cuatro electrones (dos de cada átomo). Un enlace covalente típico en una molécula biológica tiene una energía de entre 15 y 170 Kcal/mol, dependiendo de los átomos involucrados. La energía térmica promedio en los organismos vivos es de sólo 0.6 Kcal/mol, por lo que la colisión azarosa de dos moléculas bajo estas condiciones energéticas es incapaz de escindir el enlace covalente entre dos átomos.
Un átomo en particular sólo puede formar enlaces covalentes siguiendo una distribución espacial específica: los cuatro posibles enlaces de un átomo de carbono siguen una distribución tetraédrica, mientras que los tres del nitrógeno siguen una conformación piramidal. Una vez que dos átomos se unen covalentemente ya no pueden rotar libremente sobre el eje del enlace, limitándose entonces la conformación tridimensional de una macromolécula. En los sistemas biológicos, los enlaces covalentes son los responsables de la polimerización de las moléculas monoméricas constituyentes de las proteínas, el DNA, los polisacáridos y los lípidos.
Enlaces no covalentes
La conformación de una proteína no es resultado únicamente de los enlaces covalentes que se establecen entre cada uno de los residuos de aminoácidos y que conforman la estructura primaria. La conformación tridimensional es determinada en gran medida por un conjunto de interacciones no covalentes.
I) Interacciones electrostáticas. Este tipo de interacciones se establecen entre dos grupos con cargas (iónicos) opuestas. Este tipo de enlaces también se denominan par iónico o puente salino. En la ausencia de agua las interacciones iónicas son muy fuertes; sin embargo, en solución los enlaces iónicos se debilitan debido a la presencia de sales disociadas cuyos iones funcionan como contraiones que apantallan las cargas de los grupos iónicos que mantenían el enlace previamente. A pesar de lo anterior, los enlaces iónicos son importantes en sistemas biológicos como en el caso de enzimas que unen sustratos cargados positivamente empleando grupos funcionales con carga opuesta.
II) Puentes de hidrógeno. Los puentes de hidrógeno son un tipo de interacción electrostática que se establece entre un grupo donador débilmente ácido -que pueda ceder un átomo de hidrógeno- y un grupo aceptor que posea un par de electrones libres -es decir, una carga negativa parcial- con la cuál atraer el átomo de hidrógeno del donador. Los dos átomos entre los que se establece el puente son de naturaleza electronegativa. En los sistemas biológicos el donador por lo general es el oxígeno o el nitrógeno enlazado con un hidrógeno, mientras que el aceptor suele ser los mismos oxígeno o nitrógeno pero con carga parcial negativa. Una característica importante de los puentes de hidrógeno es que son colineares, es decir, tanto el donador como el aceptor deben localizarse espacialmente en el mismo plano. Este tipo de enlace es más fuerte que las fuerzas de van der Waals pero más débil que los enlaces covalentes.
III) Interacciones de van der Waals. Esta interacción es de tipo electrostática y se establece entre dos grupos no cargados pero que sean dipolos permanentes o dipolos inducidos. Un dipolo se establece cuando la distribución electrónica de un átomo o molécula se desplaza de manera no equitativa, formando una región con una mayor densidad electrónica con respecto a la otra. Las fuerzas de van der Waals son muy débiles individualmente, pero son importantes cuando su número es elevado.
IV) Interacciones hidrofóbicas. Las interacciones hidrofóbicas son producto de las fuerzas que minimizan el contacto de moléculas no polares (e.g. lípidos) con moléculas polares (e.g. agua). Físicamente las interacciones hidrofóbicas se observan como el agrupamiento de moléculas no polares. En el caso de las proteínas, las fuerzas hidrofóbicas determinan de manera importante la conformación de ésta: los grupos hidrofóbicos de los aminoácidos se agrupan en el interior de la proteína, lo más lejos posible del solvente acuoso. Aunque las fuerzas hidrofóbicas se denominen enlaces o interacciones hidrofóbicas en realidad son provocadas por la repulsión de grupos polares por parte del agua.
aTomado de Alberts, B., et al. Molecular Biology of the Cell. 3a edición. Garland Publishing, Inc. E.U.A. pp 91.
ENLACE IÓNICO.
Es aquél que se forma entre dos átomos un, metal ,y un no metal, la resta de electronegatividades debe ser igual o mayor que 1.7. Debido a esta diferencia de electronegatividades, se presenta una transferencia de electrones del metal al, no metal, por ejemplo el cloruro de potasio(KCl), es una sustancia que presenta este tipo de enlace. La resta de las electronegatividades nos permite identificar el tipo de enlace que presenta un compuesto para determinar el valor de la electronegatividad se sigue el siguiente procedimiento.
Formación del KCl.
ECUACION:
|
|
|
|
|
|
| Metal cede su |
|
|
| No metal |
| Elemento. | Electronegatividad. |
| K | 0.8 |
| Cl | 3.0 |
Resta de electronegatividades:
| 3.0 -0.8 = 2.2 el enlace es "Iónico" |
Al perder su electrón el potasio, queda con una carga de +1 (catión), el cloro al recibirlo adquiere una carga de -1 (anión). De aquí que el enlace iónico se defina como la fuerza de atracción entre dos iones de signo contrario, originados por una transferencia de electrones. Este enlace es por lo tanto, de naturaleza electrostática. El enlace iónico se lleva a cabo entre metales del grupo IA o II A con los no metales de la familia VI A o VII A.
A continuación vamos a desarrollar la configuración electrónica de cada uno de los elementos para comprobar que efectivamente ambos cumplen con la regla del octeto. En este ejemplo el Potasio es el elemento que cede un electrón y el Cloro es el elemento que gana el electrón que el potasio cedió.
| Configuración electrónica. | Número de electrones. |
|
| 8 |
|
| 8 |
Formación del CaBr2.
Ecuación:
|
|
|
|
|
|
|
|
|
| Compuesto. | Resta de electronegatividades. | Tipo de enlace. |
| CaBr2 | Br: 2.8 | Iónico. |
Ejercicio. Desarrolle la configuración electrónica del calcio y del bromo para demostrar que ambos elementos cumplen con la regla del octeto.
| Elemento. | Configuración electrónica. |
| Ca |
|
| Br |
|
A continuación con ayuda de algunos dibujos se explica la transferencia de electrones y la formación de los iones que se forman en el enlace iónico. La explicación se hace con el compuesto NaCl.
|
|
|
|
|
|
|
|
|
Con ayuda de estos dibujos se observa claramente que el Sodio queda como un ion positivo o catión porque pierde un electrón. En cambio el cloro queda como un ion negativo o anión porque adquiere un electrón. Nótese también el incremento y decremento de tamaño que sufren estos átomos; los cationes son pequeños porque pierden un porcentaje de su masa atómica y los aniones son grandes porque incrementan su masa atómica.
ESTRUCTURA Y PROPIEDADES DE LAS SUSTANCIAS CON ENLACE IÓNICO.
El cloruro de sodio NaCl, se arregla formando un cubo de iones positivos y negativos. Cada ión sodio está rodeado de 6 iones de cloro y cada cloro por 6 átomos de sodio.
|
|
| Ión | Nombre |
| Na+ Ión positivo | Catión |
| Cl-1 Ion negativo | Anión |
PROPIEDADES DE LOS COMPUESTOS CON ENLACE IÓNICO.
Debido a la forma en que están unidos, puede verse que el enlace es muy fuerte, lo que origina las siguientes propiedades.
Ejercicio.
Indica el tipo de enlace presente en las siguientes sustancias.
| Número. | Compuesto. | Electronegarividad | Resta de electronegatividad. | Tipo de enlace. |
| 1 | Rb2O | Rb= 0.8 |
|
|
| 2 | MgCl2 | Mg= 1.2 |
|
|
| 3 | NaBr | Na= 0.9 |
|
|
| 4 | CsI | Cs= 0.7 |
|
|
Escribe la ecuación que representa la formación de los compuestos citados en la tabla anterior.
| Número. | Ecuación |
| 1 |
|
| 2 |
|
| 3 |
|
| 4 |
|
Escribe la configuración electrónica de cada ión e indica si cumple con la regla del octeto o gas noble.
| Ión. | Configuración electrónica. |
|
|
|
|
|
|
|
|
|
|
|
|
|
HIBRIDACIÓN.
Es la combinación de dos o más orbitales diferentes. Estas combinaciones forman orbitales híbridos. La formación de estos orbitales permite justificar los enlaces que presentan las moléculas.
Hibridación sp.
Esta hibridación se logra cuando se combina un orbital "s" con un orbital "p". La aportación de energía es del 50% de cada uno de los obitales participantes. La geometría molecular que se obtiene es lineal con un ángulo de 180° y la podemos observar en los elementos del grupo II. El resultado de esta hibridación es: 2 orbitales sp .
|
|
|
|
|
|
| 1 orbital "s" puro |
| 1 orbital "p" puro. |
| 2 orbitales sp |
Angulo.
|
|
Sustancias con hibridación sp.
BaCl2,CaF2,HCN.
Hibridación sp2.
Esta hibridación se logra cuando se combina un orbital "s" con dos orbitales "p"". La aportación de energía es del 33.3% y del 66.6% de cada uno de los orbitales participantes. La geometría molecular que se obtiene es plana o trigonal con un ángulo de 120° y la podemos observar en los elementos del grupo III. El resultado de esta hibridación es: 3 orbitales sp2.
|
|
|
|
|
|
| orbital "s" puro |
| 2 orbitales "p" puros. |
| 3 orbitales sp2 |
Angulo.
|
|
Sustancias con hibridación sp2.
HF3, AlCl3,C2H4.
Hibridación sp3.
Esta hibridación se logra cuando se combina un orbital "s" con tres orbitales "p"". La aportación de energía es del 25% y del 75% de cada uno de los orbitales participantes. La geometría molecular que se obtiene es tetraédrica con un ángulo de 109.5° y la podemos observar en los elementos de los grupos IV y VI. El resultado de esta hibridación es la formación de 4 orbitales sp3.
|
|
|
|
|
|
| Orbital "s" |
| 3 Orbitales "p" |
| 4 Orbitales sp3 |
Enlace Sigma.
Este tipo de enlace se origina por la superposición de un orbital "s" puro con un orbital hibrido del tipo: sp, sp2 y sp3. Las combinaciones quedan de la siguiente manera:
Este tipo de enlace es muy fuerte y origina simples ligaduras y por lo mismo es un enlace muy estable.producen hibridaciones del tipo sp, sp3 y sp2.
ENLACE PI.
Este enlace se forma por superposición de orbitales "p" puros cada uno con un electrón. Este tipo de enlace es muy reactivo y genera dobles o triples ligaduras. Para que se pueda formareste enlace se necesita la formación de orbitales con este mismo nombre, los cuales se generan por la unión de electrones en orbitales "p".
ESTDOS DE LA MATERIA.
LOS ESTADOS DE LA MATERIA
La forma en que las partículas que constituyen una sustancia se reúnen o agregan determina una buena parte de las propiedades físicas y, entre ellas, su estado sólido, líquido o gaseoso. Las leyes que rigen el comportamiento de la materia en la escala ordinaria de observación pueden ser explicadas a partir de teorías que hacen referencia a las interacciones entre sus componentes elementales. Sometida a condiciones extremas, la materia puede pasar a estados físicos muy especiales; tal es el caso del plasma y de la materia constitutiva de las estrellas de neutrones.
La materia se presenta esencialmente, en nuestro planeta, bajo tres formas o estados de agregación diferentes: el estado sólido, el estado líquido y el estado gaseoso. Cada uno de estos tres estados presenta unas propiedades directamente observables que le son características. Así los sólidos poseen una forma y volumen propios; los líquidos, por su parte, aunque adoptan la forma del recipiente que los contiene, poseen un volumen propio que se mantiene prácticamente constante aun en el caso de ser sometidos a presiones exteriores considerables. Los gases, sin embargo, adoptan la forma del recipiente y además ocupan todo su volumen interior.
A lo largo de la historia, filósofos y científicos han profundizado en el estudio de los diferentes estados de la materia y las aportaciones en este tema, han contribuido, de manera decisiva, al desarrollo de otros campos de la ciencia y de la técnica. Así, el estudio de los gases sirvió de base para establecer los fundamentos de la química; el conocimiento de la dilatación de los líquidos hizo progresar el estudio de los fenómenos caloríficos; y, más recientemente, la física del estado sólido no sólo ha permitido poner a prueba la mecánica cuántica como teoría física, sino que a la vez ha abierto perspectivas de aplicación en el terreno de la electrónica y de los nuevos materiales, que son, en buena parte, el fundamento del actual progreso tecnológico.
OTROS ESTADOS DE LA MATERIA
Los estados sólido, líquido y gaseoso constituyen las formas en que se presenta la materia en condiciones no demasiado alejadas de las que reinan en nuestro planeta. Sin embargo, bajo condiciones extremas, la materia modifica su composición y propiedades y se aleja de las leyes que describen el comportamiento de sólidos, líquidos o gases.
El plasma es considerado como el cuarto estado de la materia, pues su presencia en el universo es muy abundante. Se trata de una masa gaseosa fuertemente ionizada en la cual, como consecuencia de temperaturas extremadamente elevadas, los átomos se han visto despojados de su envoltura de electrones y coexisten con los núcleos atómicos en un estado de agitación intensa. Las estrellas, durante una parte importante de su vida, están constituidas por grandes masas de plasma. Debido a la violencia de los choques entre núcleos, en tales condiciones se producen reacciones de síntesis de núcleos nuevos con una considerable liberación de energía. El Sol es esencialmente una enorme esfera de plasma.
La materia componente de las estrellas en un estado avanzado de su evolución degenera hacia formas en las que los electrones se funden con los núcleos atómicos, dando lugar a una masa compacta de neutrones cuya densidad alcanza valores del orden de los 1018 kg/m3. Éstas son las características de la materia componente de las llamadas estrellas de neutrones. Se trata, no obstante, de una etapa previa a la degeneración total característica de un estado de extrema densidad, en el que los propios neutrones son aplastados por la presión hacia adentro debida las fuerzas gravitatorias. Éste es el estado de la materia en esos objetos oscuros y misteriosos del universo conocidos como agujeros negros.
EL ESTADO GASEOSO
Las experiencias de Boyle
El estudio de los gases, y en particular del aire, atrajo la atención de los físicos del siglo XVII y más concretamente la del irlandés Robert Boyle (1627-1691). Las experiencias que le permitieron establecer su conocida ley consistieron, básicamente, en añadir mercurio a un tubo acodado suficientemente largo abierto por un extremo y provisto de una llave en el otro. Con la llave abierta vertía mercurio y su nivel en las dos ramas del tubo se igualaba (principio de los vasos comunicantes). A continuación cerraba la llave y añadía sucesivamente cantidades de mercurio iguales, con lo cual, la presión a la que estaba sometido el gas encerrado en el otro extremo del tubo, aumentaba en igual proporción. Mediante sucesivas medidas de la distancia entre los dos niveles alcanzados por el mercurio en ambas ramas del tubo, observó que la disminución del volumen del gas guardaba cierta relación con el aumento de presión. Si doblaba el peso de mercurio, el volumen se reducía a la mitad, si lo triplicaba se reducía a la tercera parte y así sucesivamente. Un análisis cuidadoso de tales resultados experimentales le permitió, finalmente, enunciar su ley.
Aun cuando Boyle no indicó explícitamente que la temperatura debía permanecer constante durante el experimento, el descubrimiento independiente efectuado por el físico francés Edme Mariotte (1630-1684) lo puso de manifiesto, completando así las conclusiones del irlandés. A temperatura constante, el volumen de un gas es inversamente proporcional a la presión que soporta:
P · V = cte para T = cte (20.1)
Este enunciado constituye la llamada ley de Boyle-Mariotte.
Algunas investigaciones históricas recientes han puesto de manifiesto que, en la interpretación de sus datos experimentales, Boyle dispuso de una importante ayuda: la lectura de un artículo en el que dos científicos británicos, Henry Power y Richard Towneley proponía la relación PV = constante. El propio Boyle lo reconoció en su día públicamente sin pretender atribuirse la originalidad del descubrimiento, sin embargo, la historia sí que lo hizo, ignorando injustamente la aportación de Power y Towneley al estudio de los gases.
Las leyes de Gay-Lussac
El estudio de la dilatación de los gases puede efectuarse con la ayuda de un matraz de vidrio que termine en un tubo capilar acodado por cuyo interior puede deslizarse un índice de mercurio sobre una escala graduada. La dilatación de la sustancia gaseosa contenida en el recipiente, puede observarse, de forma controlada, sumergiendo el matraz en un baño de agua cuya temperatura puede variarse a voluntad. La lectura del volumen del gas sobre la escala graduada y de la temperatura del agua sobre un termómetro empleado al efecto, permite encontrar una relación entre ambas magnitudes físicas en condiciones de presión constante e igual a la presión atmosférica.
Experimentos de este tipo llevaron al químico francés Joseph Louis Gay-Lussac (1778-1850) a concluir que, a presión constante, el volumen de un gas aumenta proporcionalmente al incremento de temperatura, siendo la constante de proporcionalidad la misma para todos los gases. Este enunciado, que se conoce como primera Ley de Gay-Lussac, se expresa matemáticamente mediante la ecuación:
Vt = V0 (1 + ðt) (20.2)
donde Vt representa el volumen a la temperatura de t ºC, V0 el volumen a 0 ºC y ð es una constante aproximadamente igual para todos los gases que se denomina coeficiente de dilatación y cuyo valor es: ð = 1/273. El que ð sea igual a 1/273 significa que cuando la temperatura de un gas se eleva en un grado centígrado, su volumen aumenta 1/273 veces el volumen inicial, es decir, se dilata en un
0,37 % por grado centígrado.
La primera ley de Gay-Lussac se conoce también como ley de Charles-Gay Lussac, ya que fue sugerida con anterioridad en una forma semejante por Jacques Charles (1746-1823).
Experiencias semejantes realizadas manteniendo constante el volumen y estudiando la variación de la presión con la temperatura permitieron al químico francés establecer la que se conoce como segunda Ley de Gay Lussac: a volumen constante, la presión de un gas aumenta proporcionalmente al incremento de temperatura, siendo la constante de proporcionalidad la misma para todos los gases.
Este enunciado, semejante al de la primera ley, se expresa mediante una ecuación similar en la forma:
Pt = P0 (1 + ðt) (20.3)
siendo ð el coeficiente de compresibilidad a volumen constante, aproximadamente igual para todos los gases y cuyo valor es ð = 1/273.
La ley de los gases perfectos
Las leyes de Boyle-Mariotte y de Gay-Lussac sobre el comportamiento de los gases, aunque son aplicables dentro de una buena aproximación a los gases existentes en la naturaleza, son tanto más imprecisas cuanto mayor es la densidad, la presión o la temperatura del gas. Por ello los gases que cumplen con exactitud dichas leyes físicas se denominan gases perfectos o ideales.
Es posible combinar las leyes de los gases en una sola ecuación sencilla si la temperatura se expresa en la escala absoluta o Kelvin. Así la ley de Charles-Gay Lussac puede escribirse como:
V = kT
Operando en la ecuación (20.2) se tiene:
V = V0 (1 + ðt) =
![]()
y como 273 + t(ºC) = T(K), expresando la temperatura en Kelvin resulta, en efecto:
![]()
Por otra parte la ley de Boyle establece la proporcionalidad inversa entre V y P, es decir:

Combinando ambas relaciones de proporcionalidad se tiene:

o lo que es lo mismo:


que indica que el producto del volumen de un gas por su presión dividido por su temperatura absoluta es una cantidad constante. Ello significa que una muestra gaseosa dada puede evolucionar de un estado inicial a otro final cambiando en el proceso su presión, su volumen o su temperatura, pero siempre que la cantidad PV/T no varíe.
La ecuación (20.4) constituye una expresión de la llamada ley de los gases ideales o perfectos, que también se conoce como ecuación de estado. Para dos estados cualesquiera inicial y final las magnitudes P, V y T están relacionadas en la forma:

La constante de proporcionalidad depende de la cantidad de sustancia gaseosa considerada. Cuando esta circunstancia se introduce en la ecuación (20.4) resulta la expresión de la ley de los gases ideales más usada:
P V = n R T (20.5)
donde n es el número de moles de la muestra gaseosa considerada y R es la llamada constante de los gases perfectos igual a:
0,082 atm · 1/K · mol.
La teoría cinética: una explicación para las leyes de los gases
Las experiencias de Boyle y de otros físicos de la época pusieron claramente de manifiesto que los gases podían comprimirse y expandirse. Pero, ¿cómo explicar estas propiedades que los diferenciaban claramente de los líquidos y los sólidos? Las ideas de los atomistas griegos influyeron en Boyle de tal manera que propuso dos explicaciones alternativas para el comportamiento de los gases basadas ambas en la hipótesis de que la materia estaba compuesta de partículas indivisibles o átomos.
La primera partía del supuesto de que los átomos estaban en reposo y en contacto mutuo, y explicaba la compresibilidad como consecuencia de una cierta elasticidad de los átomos que podrían comportarse como una especie de muelles blandos. Este modelo estático, sin embargo, no podía explicar la expansibilidad ilimitada de los gases. En cambio, si los átomos no estuvieran ni en reposo ni en contacto mutuo entonces podrían desplazarse rápidamente de un lado a otro en el interior del recipiente, llenando así todo el espacio.
Las ideas tímidamente expuestas por Boyle respecto de la posibilidad de un modelo cinético fueron desarrolladas por el físico suizo Daniel Bernouilli (1700-1782). Según Bernouilli los átomos o corpúsculos de gas, debido a su pequeño tamaño, se encontraban en un enorme número aun en pequeños volúmenes gaseosos. Su movimiento incesante producía choques entre sí y con las paredes del recipiente. Esta innumerable cantidad de impactos de los corpúsculos gaseosos explicaba el efecto observable de la presión del gas y, por tanto, su expansibilidad.
De acuerdo con sus razonamientos, la disminución del volumen del gas restringe el recorrido de los corpúsculos móviles y por tanto, incrementa el número de choques por segundo contra las paredes del recipiente, esto es, aumenta la presión del gas. Estudios teóricos apropiados permitieron a Bernouilli deducir, matemáticamente, la ley de Boyle a partir de estas sencillas ideas. Junto con la explicación del por qué de la ley de Boyle, la teoría cinética de los gases logró, asimismo, la explicación de las leyes de Gay-Lussac.
Además, a partir del significado de la presión del gas según el modelo cinético y de la segunda ley de Gay-Lussac, fue posible encontrar un significado también cinético a la magnitud temperatura. Así cuanto mayor es la temperatura de un gas tanto mayor es la presión que ejerce, es decir, más enérgicos deben ser los impactos de las partículas del gas sobre el interior del recipiente. Estudios más rigurosos desarrollaron esta idea sencilla sugerida por el físico alemán Rudolph Clausius (1822-1888) y permitieron establecer que la temperatura absoluta de un gas constituye una medida de la energía cinética media de las moléculas del gas en su movimiento de agitación desordenada.
La extensión de la teoría cinética a otros estados de agregación de la materia ha permitido comprender los fenómenos de cambio de estado desde un punto de vista molecular.
APLICACIÓN DE LA ECUACIÓN DE ESTADO DE LOS GASES
Una cierta masa de nitrógeno ocupa 10 litros a 1 atm de presión y 27 ºC de temperatura. ¿Qué volumen ocupará la misma masa de gas si las condiciones cambian a 2 atm y 207 ºC? ¿Cuál sería la presión del gas si las condiciones finales de volumen y temperatura fueran de 20 litros y 27 ºC?
La relación entre los valores de las magnitudes P, V y T de un gas en un estado inicial y otro final puede encontrarse aplicando correctamente la ecuación de estado. En todo caso, es preciso recordar que la T que aparece en ella es temperatura absoluta. Si se designa con el subíndice 0 el estado inicial y con el 1 el estado que corresponde a las condiciones de la primera pregunta del problema, se tendrá entonces:

en donde
P0 = 1 atm
V0 = 10 litros
T0 = 27 + 273 = 300 K
P1 = 2 atm
T1 = 207 + 273 = 480 K
luego despejando V1 resulta:

Análogamente y designando con el subíndice 2 el estado que corresponde a las condiciones de la segunda pregunta, resulta:

siendo V2 = 20 litros y T2 = T0 = 300 K. Luego:

En este caso la transformación se ha efectuado a T = cte, es decir, en las condiciones que recoge la ley de Boyle.
EL ESTADO LÍQUIDO
Características del estado líquido
A nivel microscópico el estado líquido se caracteriza porque la distancia entre las moléculas es sensiblemente inferior a la de los gases. Mientras que en un gas la distancia intermolecular media es igual o mayor que diez veces el tamaño de la molécula, en un líquido viene a ser del mismo orden de magnitud que el diámetro molecular, y sólo un poco mayor que en los sólidos. Eso explica que la densidad de los líquidos sea, salvo algunas excepciones, sólo algo inferior a la de los sólidos.
La proximidad entre las moléculas hace que se dejen sentir fuerzas atractivas de interacción, que evitan que una molécula pueda «escaparse» de la influencia del resto, como sucede en el estado gaseoso, pero que les permite moverse deslizándose unas sobre otras. Por esta razón los líquidos no poseen forma propia, sino que se adaptan a la del recipiente que los contiene, es decir, pueden fluir. Sin embargo, el hecho de que las moléculas estén ya suficientemente próximas hace de los líquidos fluidos incompresibles. Toda compresión lleva consigo una disminución de la distancia intermolecular, y si ésta fuera apreciable entrarían en juego las fuerzas repulsivas entre los núcleos atómicos que se opondrían a dicha compresión y la neutralizarían.
Viscosidad
Aunque las moléculas de los líquidos pueden deslizarse unas sobre otras, esto no sucede para todos con igual facilidad. La existencia de fuerzas de rozamiento que se oponen al deslizamiento de las moléculas define una propiedad de los fluidos que se denomina viscosidad. La viscosidad se traduce en una mayor resistencia al movimiento en el interior del fluido. Así un frasco de aceite es más difícil de agitar que uno de agua porque el aceite es más viscoso que el agua. Los líquidos ideales carecen de viscosidad. En los reales, la viscosidad varía de unos a otros, siendo extrema en los líquidos superviscosos, también llamados sólidos amorfos, porque a la temperatura ambiente presentan el aspecto de sólidos sin que la ordenación interna de sus moléculas corresponda a la que es característica de los sólidos cristalinos.
El vidrio constituye un ejemplo de este estado intermedio de la materia. Aumentando la temperatura, disminuye su viscosidad y el material se reblandece, pasando a un estado líquido espeso. El alquitrán que se utiliza en el asfaltado de carreteras es otro ejemplo de sólido amorfo; en verano, al aumentar la temperatura, se llega a deformar por efecto de la presión que ejercen, sobre el firme, los vehículos pesados.
Tensión superficial y capilaridad
Todos los líquidos presentan una cierta tendencia a disminuir su superficie libre, la cual se comporta de forma parecida a como lo hace una membrana elástica. Dicha propiedad es debida a la existencia de fuerzas tangenciales a la superficie o fuerzas de tensión, por lo que se denomina tensión superficial.
La tensión superficial se pone de manifiesto en multitud de fenómenos; así cuando se sumerge un alambre circular en una solución jabonosa se forma una película que recuerda a simple vista la membrana de un tambor, pues se recupera de pequeñas deformaciones; si sobre la película de líquido se deposita cuidadosamente un hilo cerrado, y se elimina la parte interior de la película, se observa cómo el hilo se extiende hasta alcanzar la forma de una circunferencia.
Una aguja de acero, engrasada simplemente por el tacto, puede flotar en el agua y, del mismo modo, los patos se mantienen en la superficie de un lago sin necesidad de nadar; en ambos casos los cuerpos son más densos que el agua, a pesar de lo cual flotan.
Esta aparente contradicción con respecto a lo que establecen las leyes de la hidrostática, se explica como debida al fenómeno de la tensión superficial que convierte la superficie del líquido en una especie de malla tensa que neutraliza las fuerzas del peso.
Desde un punto de vista molecular, la tensión superficial se explica como debida a la condición especial de las moléculas situadas en la superficie del líquido. Una molécula del líquido situada en el interior del mismo es solicitada en todas direcciones por fuerzas atractivas procedentes de las otras moléculas que la rodean, de modo que, por simetría, se compensan mutuamente sus efectos.
En la superficie o en sus proximidades, la simetría se rompe y sólo las moléculas que están por debajo de la superficie atraen a las de la capa límite, dando lugar a una fuerza neta dirigida hacia el interior de la masa líquida que tensa la superficie libre y produce ese efecto de malla o membrana elástica.
La tensión superficial de un líquido viene expresada por su correspondiente coeficiente de tensión superficial σ, que representa el trabajo necesario para incrementar en una unidad la superficie libre del líquido o, en términos equivalentes, la fuerza tangencial por unidad de longitud.
Cuando un tubo delgado de vidrio o capilar se introduce en agua situando su extremo inferior por debajo de la superficie límite, el líquido asciende por su interior hasta alcanzar una cierta altura de equilibrio. En este fenómeno conocido como capilaridad el principio de los vasos comunicantes deja de tener validez porque junto con las fuerzas del peso y de la presión atmosférica interviene la tensión superficial.
Razonando en términos de equilibrio es posible encontrar una expresión para la altura de la columna de líquido. Dado que el coeficiente de tensión superficial representa la fuerza de tensión superficial por unidad de longitud, la resultante de estas fuerzas responsables de la elevación de la columna será:
T = 2 ð R σ
siendo 2ðR la longitud del borde circular de la superficie libre. Por otra parte, el peso de la columna viene dado por:
P = m · g = volumen · ρ · g = ðR2hgρ
en donde ρ representa la densidad y h la altura.
Dado que las fuerzas de tensión superficial forman, en general, un ángulo ð de contacto con las paredes del capilar, la condición de equilibrio se expresará en la forma:
T cosð = P
es decir: 2ðRσ cosð = ðR2hρg
y por tanto:


Esta expresión constituye la llamada Ley de Jurin e indica que la altura de la columna líquida es directamente proporcional a la tensión superficial o del líquido e inversamente proporcional al radio R del tubo. Para un cierto número de líquidos, entre ellos el agua, puede considerarse en primera aproximación que el ángulo de contacto ð es igual a cero, con lo cual la anterior ecuación se simplifica en la forma:

expresión que permite estimar el valor de σ de un líquido, de densidad conocida, midiendo h y R.
EL ESTADO SÓLIDO
Características de los sólidos cristalinos
En el estado sólido, las moléculas, átomos o iones que componen la sustancia considerada están unidas entre sí por fuerzas relativamente intensas, formando un todo compacto. La mayor proximidad entre sus partículas constituyentes es una característica de los sólidos y permite que entren en juego las fuerzas de enlace que ordenan el conjunto, dando lugar a una red cristalina. En ella las partículas ocupan posiciones definidas y sus movimientos se limitan a vibraciones en torno a los vértices de la red en donde se hallan situadas. Por esta razón las sustancias sólidas poseen forma y volumen propios.
La mayor parte de los sólidos presentes en la naturaleza son cristalinos aun cuando en ocasiones esa estructura ordenada no se refleje en una forma geométrico regular apreciable a simple vista. Ello es debido a que con frecuencia están formados por un conjunto de pequeños cristales orientados de diferentes maneras, en una estructura policristalina. Los componentes elementales de una red cristalina pueden ser átomos, moléculas o iones, de ahí que no se pueda hablar en general de la molécula de un cristal, sino más bien de un retículo elemental o celdilla unidad, que se repite una y otra vez en una estructura periódica o red cristalina.
Las propiedades físicas de los sólidos, tales como temperatura de fusión, capacidad para conducir la corriente, resistencia a la deformación, dureza, etc., dependen de las características de las fuerzas de enlace que unen las entidades elementales. Así, los sólidos iónicos, como las sales, son duros y a la vez frágiles, con puntos de fusión altos. Aunque son malos conductores de la electricidad sus disoluciones, sin embargo, presentan una conductividad elevada. Los sólidos formados por moléculas apolares, como el Cl2, el H2 o el CO2, son blandos como corresponde a la debilidad de las fuerzas de interacción entre ellas (fuerzas de Van der Waals). Presentan un punto de fusión bajo lo que indica que sólo a bajas temperaturas, las débiles fuerzas ordenadores del enlace pueden predominar sobre el efecto disgregador del calor. Su conductividad eléctrica es extremadamente baja como corresponde a la ausencia de cargas libres.
Los sólidos formados por moléculas polares, como el agua, presentan características intermedias entre ambos tipos de sólidos, los iónicos y los apolares. Las características del enlace metálico con un gas de electrones externos compartidos hace que los sólidos metálicos sean buenos conductores de la electricidad y del calor, y dúctiles y maleables, aunque con elevados puntos de fusión. Un tipo de sólido de propiedades extremas lo constituyen los sólidos covalentes; están formados por una red tridimensional de enlaces atómicos fuertes que dan lugar a propiedades tales como elevados puntos de fusión, escasa conductividad y extraordinaria dureza. El diamante, que es carbono puro cristalizado, constituye un ejemplo de este tipo de sólidos.
Teoría de bandas en los sólidos
Todos los sólidos cristalinos presentan una estructura periódica, por lo que un electrón genérico que se viese sometido a la influencia de la red cristalina poseería una energía potencial que variaría también de una forma periódica en las tres direcciones del espacio. Esta situación se traduce, de acuerdo con la mecánica cuántica, en que cada uno de los niveles de energía que correspondería a un átomo aislado se desdobla tanto más cuanto mayor es el número N de átomos constitutivos de la red, dando lugar a una serie de niveles prácticamente contiguos que en conjunto constituyen una banda de energía.
El número máximo de electrones que pueden ocupar una banda determinada viene limitado por el principio de exclusión de Pauli que indica que en cada nivel atómico se pueden acomodar, a lo más, dos electrones y siempre que sus espines respectivos sean opuestos; por tal motivo en una cualquiera de las bandas correspondientes a una red cristalina formada por N átomos iguales, podrán acomodarse como máximo 2N electrones.
Las bandas de energía en un sólido cristalino desempeñan el mismo papel que los niveles electrónicos de un átomo aislado e incluso se representan de la misma manera mediante las letras s, p, d, f, etc.; por tanto, la energía de un electrón en un sólido sólo puede tomar valores comprendidos en alguna de las múltiples bandas de energía del sólido.
En algunos tipos de sólidos las bandas pueden solaparse y en otros, sin embargo, los correspondientes diagramas de energía aparecen separados por espacios intermedios que representan valores de la energía que no pueden poseer los electrones; por ello se les denomina bandas prohibidas.
La teoría de bandas permite explicar con una excelente aproximación el fenómeno de la conducción eléctrica en los sólidos. En algunos sólidos, la última banda no está ocupada completamente, lo que permite a los electrones de esa banda ganar energía por la acción de un campo eléctrico externo y desplazarse por la red.
La mayor parte de los metales presentan, no obstante, bandas superiores incompletas que se superponen entre sí permitiendo, asimismo, la movilidad de los electrones que son excitados por un campo eléctrico. Este movimiento de cargas en el seno de la red cristalina constituye una corriente eléctrica.
Una gran mayoría tanto de sólidos iónicos como de covalentes, son malos conductores de la electricidad (aisladores). En ellos la banda más alta conteniendo electrones (banda de valencia) está completamente llena.
Ello supone, de acuerdo con el principio de exclusión de Pauli, que los electrones no pueden ganar energía y saltar de un nivel a otro dentro de la banda, lo que equivale a restringir su movilidad al entorno de su núcleo atómico.
Además la siguiente banda vacía (banda de conducción) está lo suficientemente separada de aquélla como para que la banda prohibida no pueda ser salvada por la acción de un campo eléctrico ordinario. Tal circunstancia explica su reducida conductividad eléctrica.
Existen algunos sólidos como el silicio y el germanio que tienen una estructura de bandas semejante a la de los aisladores. Sin embargo, en ellos la banda prohibida que separa la de valencia, completamente llena, y la de conducción, completamente vacía, es estrecha, de modo que es posible excitar los electrones más altos de la banda de valencia y transferidos a la de conducción.
En tal caso se puede hablar tanto de una conducción por los electrones de la banda superior, como de conducción por los huecos que se generan en la banda inferior y que se comportan como cargas positivas. Se trata de sólidos semiconductores. El hecho de que su banda prohibida sea estrecha permite bombear electrones a la banda de conducción sin más que elevar suficientemente la temperatura.
Los semiconductores constituyen los materiales sólidos clave en la fabricación de dispositivos electrónicos. Sus propiedades, mejoradas y aprovechadas gracias a la investigación básica y aplicada, no sólo han constituido un elemento clave en el desarrollo de la informática, la instrumentación científica de alto nivel y las telecomunicaciones, sino también en el diseño de aparatos electrodomésticos y de uso habitual.
SEMICONDUCTORES CON IMPUREZAS
Las propiedades eléctricas de los materiales semiconductores pueden mejorarse si se introducen en el momento de la formación del cristal algunos átomos de otra sustancia. Se forma entonces un semiconductor con impurezas. Así, cuando a un cristal de silicio se le añaden impurezas de arsénico aumenta su conductividad. Ello se explica como debido a que, mientras que cada átomo de silicio contribuye con sus cuatro electrones externos a la banda de valencia, los de arsénico contribuyen con cinco. Dado que en los semiconductores la banda de valencia está llena, ese electrón adicional ocupará niveles discretos de energía por encima de ella y muy próximos a la banda de conducción, lo que hace más fácil su promoción a dicha banda y mejora la capacidad de conducción eléctrica del cristal.
Es posible, asimismo, inyectar en el cristal en formación átomos de impureza con menos electrones externos que el elemento semiconductor. Tal es el caso, por ejemplo, del galio, con tres electrones externos. Por la presencia de este tipo de impurezas aparecen nuevos niveles de energía vacantes en las proximidades de la banda de valencia que pueden ser ocupados por electrones excitados. Ello da lugar a la generación de huecos en dicha banda que contribuyen a la corriente eléctrica como si se tratara de cargas positivas.
El semiconductor que resulta por la presencia de átomos como el arsénico, donadores de electrones extra, se considera del tipo n o negativo. Si los átomos de impureza, como en el caso del galio, son aceptores de electrones respecto del cristal, el semiconductor resultante es del tipo p o positivo. En los semiconductores del tipo n la conducción es por electrones y en los del tipo p es, sin embargo, por huecos. La unión p-n de dos semiconductores de tales características constituye un dispositivo electrónico fundamental de utilización amplia en la industria y que ha permitido reducir considerablemente el tamaño y el coste de aparatos basados en la electrónica.
CAMBIOS DE ESTADO
Fusión y solidificación
Cuando se le comunica calor a un sólido cristalino, su temperatura aumenta progresivamente y al alcanzar un determinado valor se produce la transición o cambio de fase del estado sólido al líquido que denominamos fusión. Si las condiciones de presión exterior se mantienen constantes, el cambio de fase se verifica a una temperatura fija o punto de transición entre ambos estados, que se mantiene constante hasta que el sólido se ha fundido totalmente.
El calor que debe suministrarse a la unidad de masa de un sólido para convertirlo en líquido a la temperatura de fusión se denomina calor de fusión lf. En el agua lf vale 80 cal/g o su equivalente en unidades S.l.: 3,34 · 105 J/kg.
A nivel molecular la fusión se produce como consecuencia del derrumbamiento de la estructura cristalina. El incremento de temperatura da lugar a un aumento en la amplitud de las vibraciones de las partículas en la red, que termina por romper los enlaces y producir la fusión. Una vez que se alcanza la energía de vibración correspondiente a la temperatura de fusión, el calor recibido se emplea en romper nuevos enlaces, de ahí que se mantenga constante la temperatura durante el proceso.
La solidificación es la transición de líquido a sólido que se produce de forma inversa a la fusión, con cesión de calor. Cualquiera que sea la sustancia considerada el punto o temperatura de transición entre dos estados o fases de la materia es el mismo independientemente del sentido de la transformación. La disminución progresiva de la temperatura del líquido hace que en las proximidades del punto de solidificación las fuerzas de enlace vayan imponiendo progresivamente su orden característico.
Vaporización y condensación
Constituyen dos procesos inversos de cambio de estado. La vaporización es el paso de una sustancia de la fase líquida a la fase de vapor o fase gaseosa. La condensación es la transición de sentido contrario. Cuando la vaporización se efectúa en el aire recibe el nombre de evaporación. La evaporación afecta principalmente a las moléculas de la superficie del líquido.
Cada molécula de la superficie está rodeada por un menor número de sus compañeras; ello hace que puedan vencer con más facilidad las fuerzas atractivas del resto del líquido e incorporarse al aire como vapor. De ahí que cuanto mayor sea la superficie libre del líquido tanto más rápida será su evaporación.
El aumento de temperatura activa este proceso. Para cada valor de la presión exterior existe una temperatura para la cual la vaporización se vuelve violenta, afectando a todo el líquido y no sólo a su superficie. Esta forma tumultuoso de vaporización se denomina ebullición. El punto de ebullición de un líquido depende de las condiciones de presión exterior, siendo tanto más elevado cuanto mayor sea ésta.
Todo proceso de vaporización implica la absorción de calor por parte del líquido respecto del entorno. La cantidad de calor necesaria para transformar la unidad de masa de un líquido en vapor, a la temperatura de ebullición, se denomina calor de vaporización lv. En el agua lv vale 540 cal/g o, en unidades S.l.: 22,57 · 105 J/kg.
La condensación como transición de vapor a líquido se lleva a efecto invirtiendo las condiciones que favorecen la vaporización. Así, mientras que la disminución de la presión exterior facilita la vaporización, la compresión del vapor formado facilita la condensación; el aumento de temperatura de un líquido provoca su vaporización e, inversamente, el enfriamiento del vapor favorece su condensación.
En términos moleculares, tanto el aumento de presión como la disminución de la temperatura del vapor reducen la distancia media de las moléculas y hacen posible su unión.
Sublimación
Aunque es un fenómeno poco frecuente a la temperatura y presión ordinarias, algunas sustancias como el yodo o el alcanfor pueden transformase directamente de sólido a vapor sin necesidad de pasar por la fase intermedia de líquido. A tal fenómeno se le denomina sublimación.
La transición o cambio de estado de sentido inverso se denomina de igual manera, por ello a veces se distinguen ambas llamando a la primera sublimación progresiva y a la segunda sublimación regresiva.
En principio, cualquier sustancia pura puede sublimarse, pero debido a las condiciones de bajas presiones y temperaturas a las que es posible esta transición, el fenómeno sólo es reproducible, para la mayor parte de las sustancias, en el laboratorio.
Al igual que la fusión y la vaporización, también la sublimación (progresiva) absorbe una determinada cantidad de calor. Se denomina calor de sublimación ls a la cantidad de calor necesaria para sublimar la unidad de masa de una sustancia.
COLOIDES.
Un coloide es una partícula que mantiene su identidad física pero se mantiene en suspensión liquida. Los coloideos son partículas de tamaño bien pequeño los cuales pueden ser fácilmente absorbidos por el organismo. Las plantas convierten los minerales metálicos en coloides, El Dr. Carey Reams, bioquímico y biofísico, demostró que los coloides son de un tamaño tan pequeño que pueden pasar a través de un vidrio.
ACIDOS BASES Y SALES.
La acidez y la basicidad constituyen el conjunto de propiedades características de dos importantes grupos de sustancias químicas: los ácidos y las bases. Las ideas actuales sobre tales conceptos químicos consideran los ácidos como dadores de protones y las bases como aceptoras. Los procesos en los que interviene un ácido interviene también su base conjugada, que es la sustancia que recibe el protón cedido por el ácido. Tales procesos se denominan reacciones ácido-base.
La acidez y la basicidad son dos formas contrapuestas de comportamiento de las sustancias químicas cuyo estudio atrajo siempre la atención de los químicos. En los albores mismos de la ciencia química, Boyle y Lavoisier estudiaron sistemáticamente el comportamiento de las sustancias agrupadas bajo los términos de ácido y álcali (base).
Pero junto con los estudios descriptivos de sus propiedades, el avance de los conocimientos sobre la estructura del átomo y sobre la naturaleza íntima de los procesos químicos aportó nuevas ideas sobre los conceptos de ácido y de base.
En la actualidad, el resultado final de la evolución de esos dos conceptos científicos constituye un importante capítulo de la química general que resulta imprescindible para entender la multitud de procesos químicos que, ya sea en la materia viva, ya sea en la materia inerte, se engloban bajo el nombre de reacciones ácido-base.
El estudio de los procesos químicos en los que intervienen ácidos y bases ocupa un lugar destacado en la historia de la química. Antes de que se conociera el comportamiento a nivel molecular de este tipo de sustancias, se reconocían por sus propiedades características. Esta idea de definir el concepto de ácido y de base indicando cómo ha de comportarse químicamente una sustancia para que pueda considerarse como miembro de una u otra familia de compuestos fue introducida por Boyle en 1663. Posteriormente un conocimiento más preciso de las fórmulas químicas llevó a algunos investigadores, como Justus von Liebig (1803-1873), a definir los ácidos por su composición molecular; sin embargo, la vieja idea de Boyle, aunque transformada con las sucesivas definiciones de ácidos y bases, sigue aún en pie.
Propiedades químicas de los ácidos
El comportamiento químico de los ácidos se resume en las siguientes propiedades:
· Poseen un sabor agrio. La palabra ácido procede, precisamente, del latín (acidus = agrio) y recuerda el viejo procedimiento de los químicos antiguos de probarlo todo, que fue el origen de un buen número de muertes prematuras, por envenenamiento, dentro de la profesión.
· Colorean de rojo el papel de tornasol. El tornasol es un colorante de color violeta en disolución acuosa (tintura de tornasol) que puede cambiar de color según el grado de acidez de la disolución. Impregnado en papel sirve entonces para indicar el carácter ácido de una disolución. Es, pues, un indicador.
· Sus disoluciones conducen la electricidad. La calidad de una disolución ácida como conductor depende no sólo de la concentración de ácido, sino también de la naturaleza de éste, de modo que, a igualdad de concentración, la comparación de las conductividades de diferentes ácidos permite establecer una escala de acidez entre ellos.
· Desprenden gas hidrógeno cuando reaccionan en disolución con cinc o con algunos otros metales.
Propiedades químicas de las bases
Las bases, también llamadas álcalis, fueron caracterizadas, en un principio, por oposición a los ácidos. Eran sustancias que intervenían en aquellas reacciones en las que se conseguía neutralizar la acción de los ácidos. Cuando una base se añade a una disolución ácida elimina o reduce sus propiedades características. Otras propiedades observables de las bases son las siguientes:
· Tienen un sabor amargo característico.
· Al igual que los ácidos, en disolución acuosa conducen la electricidad.
· Colorean de azul el papel de tornasol.
· Reaccionan con los ácidos para formar una sal más agua.
Los conceptos de ácido y de base según Arrhenius
Cuando el HCI se disuelve en el agua (aq) sus moléculas se disocian en la forma:
HCl ® H+ (aq) + Cl- (aq)
Este mismo comportamiento puede aplicarse a los ácidos típicos:
![]()
![]()
y extenderse a otros ácidos.
De acuerdo con su idea de disociación iónica, la existencia en todos los casos de iones H+ libres en la disolución, llevó a Arrhenius a postular que el carácter ácido está relacionado directamente con la capacidad de una sustancia para dar en disolución acuosa iones H+. La diferencia en la fuerza de los ácidos se puede cuantificar mediante la medida de la conductividad eléctrica de sus respectivas disoluciones acuosas; cuanto más fuerte es un ácido mejor conduce la electricidad. Según la teoría de Arrhenius, la relación entre ambos hechos es clara. La reacción de disociación de un ácido en disolución es un caso particular de equilibrio químico. Representando por AH la fórmula de un ácido genérico, la reacción de disociación del ácido se puede escribir, de acuerdo con las ideas de Arrhenius, en la forma:
AH « A-(aq) + H+(aq)
En los ácidos fuertes la reacción estaría desplazada hacia la derecha de modo que abundarían más los iones H+(aq), ya que todo el AH estaría prácticamente disociado. Ello explicaría a la vez el fuerte carácter ácido y su elevada conductividad, debida a la abundancia en la disolución de iones portadores de carga. Por el contrario, en los ácidos débiles el grado de disociación sería pequeño, es decir, sólo una pequeña fracción de sustancia estaría disuelta en forma de iones, estando el equilibrio desplazado hacia la izquierda.
De acuerdo con las ideas de Arrhenius, un esquema explicativo análogo podría aplicarse a las bases. Los hidróxidos, que eran las bases mejor conocidas, al disolverse en el agua se disociarían en la forma:
KOH ® K+(aq) + (OH)-(aq)
NaOH ® Na+(aq) + (OH)-(aq)
Mg(OH)2 ® Mg+2(aq) + 2(OH)-(aq)
Generalizando los resultados de las anteriores reacciones, Arrhenius concluyó que eran bases todas aquellas sustancias capaces de dar en disolución acuosa iones OH-.
Al igual que para los ácidos, la fuerza de una base y su conductividad estarían relacionadas entre sí y ambas, con el grado de disociación que presenta dicha base en disolución acuosa.
Aun cuando no sean las únicas sustancias que se comportan como bases, las combinaciones de óxidos metálicos con el agua, es decir, los hidróxidos, son bases típicas. Las disoluciones acuosas de bases fuertes, como el hidróxido de sodio (NaOH) o el hidróxido de potasio (KOH), son agresivas o cáusticas con los tejidos animales blandos, como las mucosas; de ahí que el NaOH se denomine usualmente sosa cáustica y el KOH potasa cáustica. Sus disoluciones acuosas reciben el nombre de lejías.
Una explicación para la neutralización
La reacción mediante la cual una base neutraliza las propiedades de un ácido recibe el nombre de neutralización y se ajusta, en términos generales, a una ecuación química del tipo:
ácido + base ® sal + agua
Así, por ejemplo:
HCI(aq) + NaOH(s) ® NaCl(aq) + H2O
De acuerdo con la teoría de Arrhenius, la neutralización se reduce a una reacción entre los iones H+ y OH- característicos respectivamente de ácidos y bases para dar agua:
H+ + OH- ® H2O
Si la concentración de base es suficiente, todos los iones H+ procedentes del ácido serán neutralizados por los OH- procedentes de la base. Un exceso de base otorgará a la disolución resultante un carácter básico. Por el contrario, la existencia de iones H+ no neutralizados, debido a un exceso de ácido, dará lugar a que la disolución tenga carácter ácido.
Aun cuando la teoría de Arrhenius tiene esa validez restringida característica de las primeras aproximaciones, constituyó, sin embargo, un adelanto importante en la explicación de los procesos químicos, y a pesar de sus limitaciones, se sigue aún utilizando por su sencillez en aquellas circunstancias en las que la facilidad de comprensión pesa más que el estricto rigor científico.
CONCEPTOS ACTUALES DE ÁCIDO ...
Limitaciones de las definiciones de Arrhenius
Las definiciones de ácido y base dadas por Arrhenius tropiezan con algunas dificultades. En primer lugar, el ion H+ en disolución acuosa no puede permanecer aislado; dado el carácter dipolar de la molécula de agua, el ion H+ se unirá, por lo menos, a una de ellas formando el ion hidronio H3O+ según la reacción:
H2O + H+ « H3O+
Por ello, cuando se escribe H+(aq), se ha de sobrentender que el ion H+ está hidratado como H3O+. La formación de unidades moleculares más grandes en las que un ion H+ es rodeado por cuatro moléculas de agua es, asimismo, posible. Se trata de una hidratación que se manifiesta, por ejemplo, en el calentamiento que se produce al disolver en agua ácidos como el sulfúrico o el clorhídrico concentrados. La energía liberada en el proceso de hidratación (solvatación) calienta el sistema.
En segundo lugar, el concepto de base de Arrhenius implica la capacidad de ceder iones OH- a la disolución. Sin embargo, sustancias tales como el amoníaco (NH3) se comportan a todos los efectos como bases sin contener en sus moléculas iones OH-. Así, reaccionan con el ácido clorhídrico de una forma semejante a la de los hidróxidos:
![]()
En disolución acuosa conducen la corriente eléctrica y presentan un comportamiento alcalino análogo en todo al característico de los hidróxidos.
En tercer lugar, las definiciones de Arrhenius se refieren únicamente a sustancias en disolución acuosa e ignoran, por tanto, la posibilidad de que existan ácidos y bases en condiciones diferentes. De acuerdo con todo lo anterior, las nociones de ácido y base de Arrhenius, sin ser falsas, poseen una validez limitada. Los conceptos actuales debidos a Brönsted y Lowry amplían dichas nociones y contienen a aquéllas como un caso particular.
Definición de Brönsted-Lowry
La disociación de un ácido genérico de fórmula AH en un medio acuoso, lleva consigo la cesión de un H+ a una molécula de agua según una reacción del tipo:
AH + H2O « H3O+(aq) + A-(aq)
Pero el H+ es un átomo de hidrógeno que ha perdido su electrón; es por tanto un protón, de modo que el ácido ha cedido un protón durante el proceso.
Razonamientos de este estilo llevaron al químico danés J.N. Brönsted (1879-1947) a proponer la siguiente definición de ácido:
Ácido es toda sustancia capaz de ceder uno o más protones a otra molécula.
Al proponer este nuevo concepto de ácido, Brönsted buscaba una definición que se pudiera relacionar con la correspondiente de base, tal y como lo estaban las propiedades químicas de ambos tipos de sustancias. Puesto que un ácido tiene propiedades opuestas a las de una base, la definición de base debería reflejar una propiedad opuesta a la del ácido. Así, de acuerdo con la definición de Brönsted:
Base es una sustancia capaz de aceptar uno o más protones de otra molécula.
El comportamiento del amoníaco (NH3) se explica como consecuencia de la siguiente reacción con el agua:
![]()
El NH3 ha actuado como base captando un protón de la 
en el caso de los hidróxidos, grupos OH-:

Estas nuevas definiciones de ácido y de base salvan los inconvenientes de las de Arrhenius, pudiendo ser aplicadas independientemente de cuál sea el medio disolvente en el que tiene lugar el proceso de donación o de aceptación de protones.
Reacciones ácido-base
Como se deduce de sus propias definiciones, los conceptos de Brönsted de ácido y base están relacionados entre sí. Recurriendo a un símil económico puede decirse que en una operación de compra-venta, la existencia de un comprador va ligada necesariamente a la de un vendedor y viceversa; en otras palabras, si alguien compra algo es porque alguien se lo ha vendido. Análogamente sucede en los procesos en los que intervienen ácidos o bases (reacciones ácido-base) y que implican una transferencia de protones: si una molécula cede un protón a otra, la molécula que lo cede se comporta como ácido y la que lo recibe como base.
El análisis detallado de la reacción del ácido clorhídrico con el agua puede servir de ejemplo:
HCI(aq) + H2O ® H3O+(aq) + Cl-(aq)
ácido base
Si el HCI cede un protón al H2O, de acuerdo con el concepto de Brönsted, ésta actúa como base y aquél como ácido.
Pero tal reacción es reversible, de modo que puede escribirse en la forma:
HCI(aq) + H2O ¬ H3O+(aq) + Cl-(aq)
ácido base
El CI- puede aceptar un protón del H3O+ y convertirse de nuevo en HCI. Así, pues, considerada la reacción de partida en el sentido inverso, CI- se comporta como base y H3O+ como ácido. Escrita en forma reversible la reacción del clorhídrico con el agua resulta ser:
HCI(aq) + H2O « H3O+(aq) + Cl-(aq)
ácido 1 base 2 ácido 2 base 1
Los números iguales indican una relación mutua y definen lo que se llama un par conjugado ácido/base. Ello significa que cuando un ácido cede un protón, se convierte en una especie química capaz de aceptar nuevamente otro protón, es decir, en una base de Brönsted; y viceversa. Tales especies, que difieren tan sólo en un protón (o en un mismo número de protones), constituyen un par conjugado ácido-base.
Los pares conjugados ácido/base se relacionan entre sí mediante los siguientes procesos de transferencia de protones, representados de forma genérica:


Independientemente del trabajo de Brönsted, otro químico, el inglés T. M. Lowry (1874-1936) llegó a conclusiones análogas, por lo que estas nuevas definiciones de ácido y de base se conocen como definiciones de Brönsted y Lowry.
VALORACIONES DE ÁCIDO-BASE
Una disolución ácida puede neutralizarse con otra básica (y viceversa) parcial o totalmente. La neutralización total, que lleva consigo la pérdida de propiedades de ácido o de base por la disolución, se consigue cuando se igualan sus concentraciones de iones H3O+ y OH-.
Debido a esta circunstancia, será posible determinar la cantidad de ácido (o de base) presente en una disolución desconocida midiendo el volumen de base (o de ácido) de una disolución de concentración conocida o disolución patrón que es necesario añadir para conseguir la neutralización. La utilización de un pH-metro o de un indicador adecuado señalará el momento o punto final de la reacción, que se alcanza cuando el pH de la disolución toma un valor igual a siete. El proceso correspondiente recibe el nombre de análisis volumétrico o valoración ácido-base y es una técnica frecuente en los laboratorios químicos.
Los cálculos químicos para esta reacción de neutralización se efectúan con la ayuda de la ecuación:
Vácido Mácido nácido = Vbase Mbase nbase
donde V representa el volumen, M la concentración molar y n el número de protones cedidos (nácido) o aceptados (nbase) por cada molécula de ácido o de base respectivamente. Dicha ecuación traduce el hecho de que, para alcanzar el punto final de la reacción, el número total de protones cedidos por el ácido ha de ser igual al número total de protones aceptados por la base. El producto V · M representa, de acuerdo con la definición de molaridad, el número de motes, el cual es proporcional al número de moléculas (1 mol = NA moléculas, siendo NA el número de Avogadro). Luego el producto V · M · n es proporcional en ambos casos al número de protones cedidos por el ácido o aceptados por la base, según la correspondiente ecuación
química, siendo la constante de proporcionalidad la misma para ambos e igual a

En términos prácticos nácido coincide con el número de átomos de hidrógeno que pierde cada molécula de ácido en la reacción, y si la base es un hidróxido, nbase es igual al número de grupos OH- de la base que reacciona con el ácido.
Con el fin de controlar cuidadosamente el volumen de solución patrón empleado en la valoración, se utiliza una bureta que permite medir no sólo la cantidad total de disolución añadida, sino también añadir gota a gota la disolución patrón a la disolución problema. La representación gráfica de la variación del pH con la cantidad de disolución patrón añadida recibe el rombre de curva de valoración. El punto de corte de la gráfica con la línea horizontal de pH = 7 define el punto final de la valoración. En la figura se advierte cómo en el entorno de ese punto la pendiente de la gráfica se hace muy elevada, lo que significa que pequeñas cantidades de disolución producen cambios importantes en el pH. En tal circunstancia la adición de disolución patrón ha de efectuarse gota a gota para no sobrepasar el valor neutro del pH.
APLICACIÓN DE LA VALORACIÓN ÁCIDO-BASE
Se desea valorar una disolución de ácido sulfúrico con la ayuda de otra de hidróxido de sodio 0,5 M y un indicador apropiado. Se toman 10 ml de la disolución problema y se depositan, junto con el indicador, en un vaso de precipitados. Con la llave cerrada, se llena la bureta con la solución patrón. A continuación se abre la llave y se hace gotear sobre el vaso. Cuando el descenso del nivel de la bureta indica que se han consumido 20 ml, el indicador, con su cambio característico de color, señala el punto final de la valoración. Calcular la concentración molar de la disolución problema y la cantidad de gramos de H2SO4 disueltos en la muestra.
La ecuación química de la correspondiente neutralización viene dada por:
2 NaOH + H2SO4 ® Na2SO4 + 2 H2O
Cuando la disolución patrón ha neutralizado a la disolución problema se cumple la ecuación estequiométrica:
Vácido Mácido nácido = Vbase Mbase nbase
es decir:
10 ml · Mácido · 2 átomos de H/molécula de ácido =
= 20 ml · 0,5 · 1 grupo OH-/molécula de base
luego, despejando Mácido resulta:

El número de gramos contenidos en la muestra será entonces:
0,5 moles/litro · 98,02 g/mol · 10 · 10-3 liros de muestra = 0,49 g
puesto que:
M(H2SO4) = 2 M(H) + M(S) + 4 M(O) =
= 2 · 1,00 + 32,06 + 4 · 15,99 = 98,02 g/mol
ACIDEZ BASICIDAD Y EQUILIBRIO...
El equilibrio ácido-base del agua
La cesión de protones por un ácido y la aceptación de protones por una base son procesos reversibles. Dado que este tipo de procesos desembocan al cabo de un cierto tiempo en una situación de equilibrio, su estudio puede efectuarse aplicando los conceptos fundamentales del equilibrio químico.
El equilibrio ácido-base más sencillo y fundamental a la vez es el que corresponde a la disociación del agua:
H2O + H2O « H3O+ + OH-
base 1 ácido 2 ácido 1 base 2
Esta reacción pone de manifiesto que el agua puede actuar como una base (base 1) ganando protones para convertirse en H3O+ (ácido 1) y puede actuar como un ácido (ácido 2) perdiendo protones para convertirse en OH- (base 2). Se dice por ello que es una sustancia anfolita.
Como pone de manifiesto la escasa conductividad del agua pura, el equilibrio iónico del agua está considerablemente desplazado hacia la izquierda, lo que significa que, de acuerdo con la ley de acción de masas, su constante de equilibrio K es muy pequeña:

Determinaciones experimentales de dicha constante a 25 ºC han arrojado un valor para K igual a 3,2 · 10-18, lo que indica la existencia de una disociación exigua. La concentración de H2O es, por tanto, prácticamente igual a 1 000 g/litro, o en términos de molaridad:

Escribiendo la anterior expresión en la forma:
K [H2O]2 = [H3O+] [OH-]
y operando, resulta:
3,2 · 10-18 · (55,5)2 = [H3O+] [OH-]
10-14 = [H3O+] [OH-]
que se representa por Kw y se denomina producto iónico del agua.
El grado de acidez de una disolución. Concepto de pH
En el agua pura la presencia de iones H3O+ y OH- procede únicamente de su disociación iónica, por lo que sus concentraciones respectivas son iguales. Es decir:

La presencia de un ácido en disolución dará lugar a un aumento de la concentración de iones H3O+, o lo que es lo mismo, el exponente disminuirá en valor absoluto por debajo de siete, alcanzando, por ejemplo, el valor:

En disoluciones diluidas el producto iónico del agua Kw es constante, por lo que un aumento de [H3O+] supondrá una disminución de [OH-] y viceversa. Por tanto, la adición de una base aumentará la concentración de iones OH- y disminuirá la de iones H3O+, de modo que el exponente de la potencia decirnal que lo representa aumentará el valor absoluto por encima de siete, por ejemplo:

Parece entonces razonable considerar el exponente de la concentración de iones H3O+ de una disolución como una medida de su grado de acidez.
Se denomina pH de una disolución al valor absoluto del exponente de la concentración de iones H3O+ expresada en la forma de potencia decimal; es decir:
[H3O+] = 10-pH
Si se recurre a la noción de logaritmo resulta:
pH = -log [H3O+]
El pH de una disolución es, pues, el logaritmo cambiado de signo de la concentración de iones hidronio.
En una disolución neutra como el agua pura el pH vale siete; en disoluciones ácidas es menor que siete y en disoluciones básicas es mayor que siete.
Fuerza de ácidos y bases
Según los conceptos de ácido y de base de Brönsted y Lowry la fuerza de un ácido se mide por su tendencia a ceder protones y la de una base por su tendencia a aceptarlos, pero también se puede definir por referencia al equilibrio de disociación en disolución acuosa. Así, para un ácido genérico AH en disolución se produce la reacción reversible:
HA + H2O « A-(aq) + H3O+(aq)
y la constante Ka de disociación del ácido vendrá dada por:

que se denomina, también, constante de acidez.
Si el ácido es fuerte, su tendencia a ceder protones desplazará considerablemente el equilibrio hacia la derecha y la disociación será prácticamente total, lo que se reflejará en un valor elevado de Ka.
Análogamente se tendrá para una base genérica B:
B + H2O « BH+(aq) + OH-(aq)
y la constante de disociación de la base o constante de basicidad será, en este caso:

Cuanto mayor sea Kb más desplazado estará el equilibrio hacia la derecha y, por tanto, mayor será la fuerza de la base o su capacidad para captar protones y convertirse en BH+.
En general, para una reacción del tipo
ácido 1 + base 2 « ácido 2 + base 1
si el ácido 1 es más fuerte que el ácido 2 la reacción estará desplazada hacia la derecha y viceversa. Lo mismo sucederá con la base 2 respecto de la base 1.
CONCEPTO DE PK
La descripción del grado de acidez en términos de pH tiene la enorme ventaja de evitar operaciones con potencias decimales de exponentes negativos. Dado que las constantes de equilibrio vienen dadas, por lo general, como potencias de diez, es posible extender la idea recogida en la definición de pH al caso de los valores de K. Así, se define el pK, para una reacción en equilibrio, en la forma:
pK = -log K
En equilibrios ácido-base la constante de equilibrio se denomina constante de acidez o de basicidad y su pK constituye una forma de expresar su valor. Así, por ejemplo, la constante de acidez del ácido acético a 25 ºC es Ka = 1,8 · 10-5 y su pKa se calcula, de acuerdo con la definición, como pKa = -log (1,8 · 10-5) = 4,8.
Dado que el valor de la constante de acidez constituye una medida directa de la fuerza de un ácido, su pKa es entonces una medida inversa de dicha fuerza; cuanto mayor es la fuerza de un ácido menor es su pKa. Los ácidos fuertes, como el clorhídrico (HCI) o el sulfúrico (H2SO4), tienen pKa negativos y los débiles, como el acético (CH3COOH) o el carbónico (H2CO3), pKa positivos.
De la misma manera puede definirse el pKb de una base, cuyo significado es análogo.
APLICACIÓN DEL CONCEPTO DE PH
El ácido clorhídrico es un ácido fuerte, por lo que puede considerarse totalmente disociado en disolución acuosa, según la ecuación química:
HCI + H2O ® Cl-(aq) + H3O+(aq)
Se prepara una disolución que contiene 1,823 g de HCI por cada litro de disolución. Calcular la concentración de iones H3O+ en moles/litro, [H3O+], y a continuación determinar el pH de la disolución.
De acuerdo con la ecuación química, el número de moles de HCI y de H3O+ está en relación de 1:1; por tanto, por cada mol de HCI disociado se generará un mol de H3O+(aq) de disolución. La concentración de H3O+ procedente de la disociación del agua es muy pequeña frente a la que procede del ácido y por ello puede despreciarse. Además, como todo el HCI está prácticamente disociado, la concentración en moles por litro del HCI Inicial coincidirá con [H3O+], es decir.

ya que
M(HCI) = M(H) + M(CI) = 1,0 + 35,46 = 36,46
Por lo tanto:
pH = -log [H3O+] = -log 0,05 = 1,3
AGUA.
Nuestro medio ambiente y nuestra vida, dependen de un recurso muy conocido, el AGUA.
El Agua es una sustancia química que tiene propiedades muy peculiares, una de ellas es su gran poder de disolver, se le ha llamado " El solvente Universal ", es por ello que casi nunca encontramos una agua "Pura". Normalmente el agua se clasifica según su origen y las sustancias que tiene en solución:
Clasificación del agua según su origen:
ð Agua superficial
ð Agua de río.
ð Agua de pozo.
ð Agua de lagos y lagunas
ð Agua de mar.
ð Agua de lluvia
ð Agua destilada.
El agua es un componente de nuestra naturaleza que ha estado presente en la Tierra desde hace más de 3.000 millones de años, ocupando 3/4 partes de la superficie del planeta. Su naturaleza se compone de tres átomos, dos de oxígeno que unidos entre sí forman una molécula de agua, H2O, la unidad mínima en que ésta se puede encontrar. La forma en que estas moléculas se unen entre sí determinará la forma en que encontramos el agua en nuestro entorno; como líquidos, en lluvias, ríos, océanos, lagos, etc., como sólidos en témpanos y nieves o como gas en las nubes.
Gran parte del agua de nuestro planeta, alrededor del 98%, corresponde a agua salada que se encuentra en mares y océanos, el agua dulce que poseemos en un 69% corresponde a agua atrapada en glaciares y nieves eternas, un 30% está constituida por aguas subterráneas y una cantidad no superior al 0,7% se encuentra en forma de ríos y lagos que son y han sido nuestra principal fuente de agua para la vida y el desarrollo de la civilización, constituyen no más del 0.3% del agua dulce del planeta.
El agua asociada a los orígenes mismos de la vida, es imprescindible para la existencia de ella en el planeta. Todos los seres vivos, independiente del medio en que viven, aire, suelo, mares, lagos, etc., necesitan al menos de un mínimo de humedad. Por otra parte, tan importante como el disponer de las cantidades mínimas imprescindibles para la vida, está el requerimiento de una adecuada calidad del agua para desarrollar los procesos de reproducción y crecimiento inherentes a ella.
En nuestro país la diversidad geográfica y climática da origen a desiertos, valles, y montañas, determinando una distribución de las aguas, tanto en términos del espacio (las distintas regiones), como del tiempo (invierno, verano, etc.), muy variada a través del territorio nacional.
En la región del Norte Grande donde predomina el desierto, las precipitaciones son muy escasas, menos de 10 mm en la costa y alrededor de 200 mm en el Altiplano. En esta zona el agua es traída desde grandes distancias para abastecer a las ciudades.
Aunque la época de lluvias es corta, en primavera y verano los deshielos permiten la crecida de los caudales.
Agua purificada
Cada una de ellas tiene en forma disuelta, suspendida o coloidal, diversas sales minerales y gases en cantidades variables dependiendo de donde procedan.
El agua se clasifica también según el uso que se le vaya a dar:
· Agua de uso doméstico
· Agua para limpieza y lavado
· Agua para uso industrial:
* Para generadores de vapor de alta y baja presión
* Para enfriamiento
· Agua para análisis químicos
· Agua para aplicaciones biológicas (libre de pirógenos)
El agua tal como existe, pocas veces se puede usar en su forma natural.
Se requiere conocer sus características físicas, químicas y la naturaleza y cantidad de las sustancias disueltas o suspendidas que contengan, para acondicionar un agua particular al uso deseado.
``ALGUNAS PROPIEDADES Y ELEMENTOS PRESENTES EN EL AGUA´´
CALCIO:
El calcio es el 5º elemento en orden de abundancia en la corteza terrestre, su presencia en las aguas naturales se debe al su paso sobre depósitos de piedra caliza, yeso y dolomita.
La cantidad de calcio puede variar desde cero hasta varios cientos de mg/l, dependiendo de la fuente y del tratamiento del agua
Las aguas que contienen cantidades altas de calcio y de magnesio, se les da el nombre de " aguas duras".
CLORUROS:
Los cloruros son una de las sales que están presentes en mayor cantidad en todas las fuentes de abastecimiento de agua y de drenaje.
El sabor salado del agua, producido por los cloruros, es variable y dependiente de la composición química del agua, cuando el cloruro está en forma de cloruro de sodio, el sabor salado es detectable a una concentración de 250 ppm de NaCl.
Cuando el cloruro está presente como una sal de calcio ó de magnesio, el típico sabor salado de los cloruros puede estar ausente aún a concentraciones de 1000 ppm.
El cloruro es esencial en la dieta y pasa a través del sistema digestivo, inalterado.
Un alto contenido de cloruros en el agua para uso industrial, puede causar corrosión en las tuberías metálicas y en las estructuras.
La máxima concentración permisible de cloruros en el agua potable es de 250 ppm, este valor se estableció más por razones de sabor, que por razones sanitarias.
COLOR:
Usualmente cuando se examina el agua, las primeras propiedades que se suelen considerar son las siguientes: color, sabor y olor, características inherentes a ella.
Considerando la primera de ellas, el color: el agua de uso doméstico e industrial tiene como parámetro de aceptación la de ser incolora, pero en la actualidad, gran cantidad del agua disponible se encuentra colorida y se tiene el problema de que no puede ser utilizada hasta que no se le trata removiendo dicha coloración.
Las aguas superficiales pueden estar coloridas debido a la presencia de iones metálicos naturales
( hierro y manganeso ), humus, materia orgánica y contaminantes domésticos e industriales como en el caso de las industrias de papel, curtido y textil; esta ultima causa coloración por medio de los desechos de teñido los cuales imparten colores en una amplia variedad y son fácilmente reconocidos y rastreados.
El color que en el agua produce la materia suspendida y disuelta, se le denomina "Color aparente", una vez eliminado el material suspendido, el color remanente se le conoce como "Color verdadero".
CONDUCTIVIDAD ELECTRICA:
La conductividad eléctrica, se define como la capacidad que tienen las sales inorgánicas en solución
( electrolitos ) para conducir la corriente eléctrica.
El agua pura, prácticamente no conduce la corriente, sin embargo el agua con sales disueltas conduce la corriente eléctrica. Los iones cargados positiva y negativamente son los que conducen la corriente, y la cantidad conducida dependerá del número de iones presentes y de su movilidad.
En la mayoría de las soluciones acuosas, entre mayor sea la cantidad de sales disueltas, mayor será la conductividad, este efecto continúa hasta que la solución está tan llena de iones que se restringe la libertad de movimiento y la conductividad puede disminuir en lugar de aumentas, dándose casos de dos diferentes concentraciones con la misma conductividad. ( ver Tabla )
Todos los valores de conductividad están referidos a una temperatura de referencia de 25 ° C.
Valores de conductividad de algunas muestras típicas
| Temperatura de la muestra 25 ° C | Conductividad, µS/cm |
| Agua ultrapura | 0.05 |
| Agua de alimentación a calderas | 1 a 5 |
| Agua potable | 50 a 100 |
| Agua de mar | 53,000 |
| 5 % NaOH | 223,000 |
| 50 % NaOH | 150,000 |
| 10 % HCl | 700,000 |
| 32 % de HCl | 700,000 |
| 31 % HNO3 | 865,000 |
Algunas sustancias se ionizan en forma más completa que otras y por lo mismo conducen mejor la corriente. Cada ácido, base o sal tienen su curva característica de concentración contra conductividad.
Son buenos conductores: los ácidos, bases y sales inorgánicas: HCl, NaOH, NaCl, Na2CO3 ....etc.
Son malos conductores: Las moléculas de sustancias orgánicas que por la naturaleza de sus enlaces son no iónicas: como la sacarosa, el benceno, los hidrocarburos, los carbohidratos.... etc, estas sustancias, no se ionizan en el agua y por lo tanto no conducen la corriente eléctrica.
Un aumento en la temperatura, disminuye la viscosidad del agua y permite que los iones se muevan más rápidamente, conduciendo más electricidad. Este efecto de la temperatura es diferente para cada ion, pero típicamente para soluciones acuosas diluidas, la conductividad varía de 1 a 4 % por cada ° C.
Conociendo estos factores, la medición de la conductividad nos permite tener una idea muy aproximada de la cantidad de sales disueltas.
DUREZA DEL AGUA:
La DUREZA es una característica química del agua que esta determinada por el contenido de carbonatos, bicarbonatos, cloruros, sulfatos y ocasionalmente nitratos de calcio y magnesio.
La dureza es indeseable en algunos procesos, tales como el lavado doméstico e industrial, provocando que se consuma más jabón, al producirse sales insolubles.
En calderas y sistemas enfriados por agua, se producen incrustaciones en las tuberías y una pérdida en la eficiencia de la transferencia de calor.
Además le da un sabor indeseable al agua potable.
Grandes cantidades de dureza son indeseables por razones antes expuestas y debe ser removida antes de que el agua tenga uso apropiado para las industrias de bebidas, lavanderías, acabados metálicos, teñido y textiles.
La mayoría de los suministros de agua potable tienen un promedio de 250 mg/l de dureza.
Niveles superiores a 500 mg/l son indeseables para uso domestico.
La dureza es caracterizada comúnmente por el contenido de calcio y magnesio y expresada como carbonato de calcio equivalente.
Existen dos tipos de DUREZA:
Dureza Temporal: Esta determinada por el contenido de carbonatos y bicarbonatos de calcio y magnesio. Puede ser eliminada por ebullición del agua y posterior eliminación de precipitados formados por filtración, también se le conoce como "Dureza de Carbonatos".
Dureza Permanente: está determinada por todas las sales de calcio y magnesio excepto carbonatos y bicarbonatos. No puede ser eliminada por ebullición del agua y también se le conoce como "Dureza de No carbonatos".
Interpretación de la Dureza:
Dureza como CaCO3 Interpretación
0-75 agua suave
75-150 agua poco dura
150-300 agua dura
> 300 agua muy dura
______________________________________
En agua potable El límite máximo permisible es de 300 mg/l de dureza.
En agua para calderas El límite es de 0 mg/l de dureza.
pH (potencial de hidrógeno):
En 1909, el químico danés Sorensen definió el potencial hidrógeno (pH) como el logaritmo negativo de la concentración molar (mas exactamente de la actividad molar) de los iones hidrógeno.
Esto es:
pH = - log [H +]
Desde entonces, el término pH ha sido universalmente utilizado por la facilidad de su uso, evitando así el manejo de cifras largas y complejas. Por ejemplo, una concentración de [H+] = 1x10-8 M

( 0.0000001) es simplemente un pH de 7 ya que: pH= - log[10-7] =7
ALGUNOS DATOS IMPORTANTES:
· El ser humano utiliza un promedio de 200 litros diarios de agua para diferentes actividades y consumo.
· El agua en los seres humanos representa entre un 65% a un 70% del peso corporal y se encuentra en los huesos, la sangre, tejidos musculares y en todos los fluidos del cuerpo humano. Algunas funciones importantes del agua en nuestro organismo son:
* Mantener la humedad en los pulmones a fin de que se realice la respiración.
* Lubricar y limpiar la superficie de los ojos con las lagrimas; y de la cavidad bucal con la saliva.
* La saliva al humedecer la lengua nos permite sentir los sabores de los alimentos.
* Desintoxicar nuestro organismo por medio de la transpiración y orina.
* En la generación de energía y tejidos, como músculos y huesos, a partir de los alimentos ingeridos, producimos una cantidad de sustancias que el cuerpo no utiliza o no es capaz de utilizar, y que son eliminadas por la orina y transpiración, evitando así que estas se acumulen provocando enfermedades.
* Regular la temperatura del organismo, a modo de termostato corporal.
En algunos animales como la medusa de mar, el agua constituye el 99% de su peso, mientras que en algunos insectos no alcanza a más del 40%
Los vegetales contienen alrededor de un 95% de agua, por ejemplo:
· Un árbol en crecimiento está compuesto de un 50% de agua
· Una planta acuática contiene el 95%;
· El tomate contiene un 95%
· La manzana contiene un 85%
· El melón contiene un 98%
· La papa contiene un 80%
En los vegetales y animales el agua funciona como vehículo que transporta y distribuye sustancias nutritivas que éstos obtienen del medio.
El ser humano necesita un mínimo de cinco litros de agua diarios para subsistir. Sin embargo considerando los aspectos de higiene personal y usos domésticos, se calcula en un promedio de 200/250 litros según datos de la OMS (Organización Mundial de la Salud). En ciudades de mayor industrialización esta cifra se eleva a 500/600 litros diarios, mientras que en otras zonas, por razones climáticas, no supera los 15 litros diarios en promedio.
El agua desempeña un papel fundamental en la estructura del cuerpo. La cantidad de agua es proporcionalmente mayor en algunos tejidos, como la sangre y el cerebro; es menor en los músculos y es mínima en los tejidos adiposos. El agua puede estar en forma combinada en el protoplasma de las células, como en los geles coloidales o intercelularmente, como verdaderas soluciones. Los procesos vitales se llevan a cabo en el medio acuoso de las células y en las sustancias intercelulares.
La cantidad de agua en el organismo varía con la edad. El sexo y la adiposidad. Compone alrededor del 50 al 70 % del cuerpo del hombre adulto y del 45 a 65 % de la mujer adulta. En los individuos obesos, pueden encontrarse niveles tan bajos como del 40 % de su peso corporal; en cambio, el contenido de agua del recién nacido puede llegar hasta un 80 %.
BALANCE DE AGUA Y DE ELECTROLITOS.
Los fluidos del cuerpo ocupan tres ``compartimentos´´ hipotéticos. Uno de ellos es dentro de las células; otro, fuera de las células, en los espacios intercelulares, y el tercero, un compartimiento extracelular en los sistemas vascular y linfático. Los fluidos de dichos compartimientos se designan como fluido intracelular, fluido intersticial y fluido extracelular.
La ingestión diaria de agua debe ser igual a la cantidad que sale del cuerpo; de otra manera se presenta una deshidratación (pérdida de agua) o un edema (acumulación de agua) en los tejidos. El cuerpo sano, bajo condiciones promedio de ejercicio y a temperatura ambiente, intercambia dos a tres litros de agua por día. El agua entra al cuerpo en forma de líquidos que se toman, agua preformada en los alimentos y como agua formada en el cuerpo por procesos oxidativos. El agua sale del cuerpo a través de los riñones en forma de orina, como también por la piel por transpiración y sudor, como vapor por los pulmones y en las materias fecales.
Básicamente los fluidos del cuerpo son soluciones de electrólitos, es decir, de compuestos químicos que se disocian en el agua en partículas iónicas cargadas.
OXIDACION Y REDUCCION.
Todos los organismos son capaces de realizar reacciones de óxido-reducción (reacciones redox); de hecho, dependen de estos procesos para la vida. Los microorganismos son particularmente notables al mostrar entre todos ellos: bacterias, hongos, levaduras y algas, una gran variedad de procesos redox
Con el fin de obtener energía (ATP) para sus multiples funciones, los microorganismos oxidan diversos compuestos a través de la respiración o la fermentación e igualmente hay microorganismos que oxidan compuestos orgánicos e inorgánicos por medio de la fotosíntesis.
Otras actividades microbianas, por ejemplo, las transformaciones biogeoquímicas o la actividad microbiana que se realiza durante los procesos de biorremediación, hacen constatar la importancia de las reacciones de óxido-reducción.
En una reacción redox participa un elemento, ión o compuesto capaz de compartir (cediendo), electrones, y otro elemento, ión o compuesto que los acepta. A la sustancia que cede los electrones se le llama donador de electrones, y al cederlos, se oxida; lo contrario sucede con la sustancia que acepta los electrones: al aceptarlos, se reduce; éste es el aceptor de electrones.
En el par redox : SO42- / H2S
el ión sulfato SO42- , es el aceptor de electrones y puede reducirse;
el ácido sulfhídrico H2S, es el donador de electrones y puede oxidarse.
En los sistemas biológicos, las oxidaciones implican una deshidrogenación en la que son eliminados de una sustancia, iones hidrógeno (protones), junto con los electrones. Por el contrario, la adición de hidrógeno (H+ + e-), a una sustancia durante su reducción, es una reacción de hidrogenación. Así, una oxidación es acompañada por una reducción; es decir las oxidaciones y las reducciones son reacciones acopladas.
Todas las sustancias tienen diferente capacidad para donar o aceptar electrones; hay algunas que tienen mayor afinidad que otras por los electrones. La habilidad de una sustancia para donar o aceptar electrones puede medirse, lo cual, constituye un parámetro característico de esa sustancia y se le llama potencial de oxidación-reducción, o potencial redox (E0).
El potencial redox de un par redox , es una medida eléctrica con referencia al electrodo estándar de hidrógeno: ½ H2 <- -> H+ + e-
A pH 0 y en condiciones estándar, el potencial redox del electrodo de hidrógeno es 0.00V. A pH 7, lo cual es más el caso de sistemas biológicos, el potencial redox se expresa como E'0 y para el electrodo de hidrógeno el valor es de -0.42V. El potencial redox de todas las demás sustancias será relativo al potencial redox del par 2 H+ + H2 y se tendrá una escala de valores de potencial redox.
A partir de esta escala o gradiente de potenciales redox, se puede obtener la relativa afinidad de diferentes sustancias por los electrones.
Como regla general, en un par redox, la sustancia reducida, es decir, la que tiene el valor de E'0 más negativo, es el donador de electrones para la sustancia oxidada, que es la que tiene el valor más positivo.
Por ejemplo, la reacción de oxidación:
Fe2+ <- -> Fe3+ + e- (+0.77)
Se acopla con la reacción de reducción:
½ O2 + 2H+ + 2e- <- -> H2O (+0.82V)
la cual tiene un potencial redox menos negativo (o más positivo).
En cambio, aquella reacción de oxidación, no puede acoplarse con la reacción :
Fumarato + 2H+ +2e- <- -> succinato (+0.03V)
la cual tiene un valor de potencial redox más negativo (menos positivo), que la mitad de oxidación de la reacción acoplada.
Otra regla general es que mientras más grande sea la diferencia, en potencial redox entre el par redox que sirve como donador de electrones y el par que sirve de aceptor de electrones, será mayor la energía disponible de esa reacción redox.
Los compuestos o elementos que tienen altos (muy negativos), potenciales redox y están muy reducidos (por ejemplo, glucosa -0.43V), pueden liberar grandes cantidades de energía conforme van cediendo sus electrones a un aceptor de electrones, con la condición que el aceptor disponible en la célula tenga un potencial redox más positivo.
Hay sustancias que tienen potenciales redox menos negativos, es decir, están menos reducidas y por lo tanto no liberan mucha energía durante su oxidación; por ejemplo el CO2, que está completamente oxidado, no puede servir como donador de electrones, por lo tanto, no puede ser una fuente de energía.
Las reacciones redox, como cualquier otro tipo de reacción, van acompañadas por un cambio en energía libre. Parte de la energía que se libera durante a mitad oxidativa (exergónica), de las reacciones redox se conserva en los enlaces de los productos reducidos al aceptar los electrones en la mitad reductiva (endergónica), de la reacción.
Durante las oxidaciones biológicas, los electrones liberados por un compuesto, por lo general no son directamente aceptados por el último aceptor del proceso; por el contrario, los electrones son transferidos a un compuesto o a una serie de compuestos, llamados acarreadores de electrones, antes de llegar a su aceptor final.
Los acarreadores de electrones actúan como relevos que transfieren electrones desde el donador inicial, hasta el aceptor final. Durante la, o las transferencias, los mismos acarreadores de electrones son oxidados y reducidos sucesivamente. Estas reacciones de oxidación-reducción van acompañadas por cambios de energía libre.
Entre los acarreadores de electrones más importantes, están los que además de electrones, acarrean átomos de hidrógeno. Estos acarreadores son:
1) derivados de piridín nucleótidos NAD (nicotinamida-adenina dinucleótido) y NADP (nicotinamida adenina dinucleótido-fosfato)
2) las flavoproteínas FAD (flavina adenina dinucleótido) y FMN (flavina mononucleótido)
Para estar disponibles como acarreadores de electrones, por ejemplo, el NAD, en la parte oxidativa de la reacción redox, debe estar oxidado (NAD+), y se reducirá al recibir los electrones y los hidrógenos. Lo contrario se dirá si el NADH va a servir como donador de electrones en la parte reductiva de la reacción redox
NAD+ + 2e- + 2H+ <- -> NADH + H+
Estos compuestos sirven únicamente como acarreadores intermediarios de protones y electrones. Los hidrógenos y electrones que llevan son transferidos a otros aceptores en la célula, los cuales, finalmente serán reducidos.
Como resultado de la asociación de estos acarreadores con ciertas vías metabólicas en las células la energía liberada se utiliza para sintetizar ATP y se conserva en los enlaces de este compuesto para ser utilizada por la célula en los procesos en que sea necesaria.
ELECTROQUIMICA.
Desde el punto de vista Fisicoquímico los conductores más importantes son los del tipo electrolíticos, es decir los electrolitos; estos se distinguen de los conductores electrónicos, como los metales por el hecho de que el paso de una corriente eléctrica va acompañada por el transporte de materia.
Cuando pasa una corriente eléctrica a través de un conductor electrolito, el transporte de materia se manifiesta en las discontinuidades del sistema. Por ej., si en una disolución acuosa diluida en un ácido se sumergen dos alambres, preferentemente de platino, unidos a los 2 polos de una batería voltaica que actúa como fuente de corriente, se desprenden en los alambres burbujas de hidrogeno y oxigeno respectivamente, si la disolución electrolítica contuviera una sal de cobre o plata se liberaría el metal correspondiente en lugar de hidrogeno. Los fenómenos asociados con la electrólisis fueron estudiados por Faraday y la nomenclatura que utilizó y que se emplea todavía fue ideada por Whewell.
Las celdas electroquímicas se usan principalmente con dos fines:
En las pilas secas comunes y en el acumulador de plomo tenemos convertidores de energía química en eléctrica, mientras que en la carga de la batería de almacenamiento y en la purificación electrolitica del cobre se utiliza la energía eléctrica para realizar una acción química. Una celda es un dispositivo simple de dos electrodos y un electrolito capaz de dar electricidad por la acción química dentro de la celda, o de producir una acción química por el paso de electricidad a su través. Una batería, por otra parte, es una combinación de dos o mas celdas dispuestas en serie o en paralelo. Así el acumulador de plomo es una batería constituidas por tres celdas conectadas en serie.
El método mas común de determinar la diferencia de potencial entre dos puntos cualesquiera en un circuito eléctrico es el de conectar un voltímetro entre aquellos, leyendose directamente el voltaje con el instrumento
Estudia las diferentes formas en que la electricidad produce cambios químicos y viceversa. Las reacciones electroquímicas tienen las siguientes características:
Las principales aplicaciones de la electroquímica son:
ELECTRÓLISIS:
Es un proceso que tiene lugar cuando se aplica una diferencia de potencial entre dos electrodos y se realiza una reacción redox. La diferencia de potencial aplicada a los electrodos depende del electrolito y del material que constituye los electrodos. Las pilas que producen corriente eléctrica se denominan pilas voltaicas mientras que las pilas que consumen corriente eléctrica se denominan pilas electrolíticas.
En algunas electrólisis, si el valor de la diferencia de potencial aplicada es tan sólo ligeramente mayor que el calculado teóricamente, la reacción es lenta o no se produce, por lo que resulta necesario aumentar el potencial aplicado. Este fenómeno se da cuando en alguno de los electrodos se produce algún desprendimiento de gas. El potencial añadido en exceso se denomina potencial de sobretensión.
La cantidad de producto que se forma durante una electrólisis depende de:
La cantidad de electricidad que circula por una celda electrolítica puede determinarse hallando el producto de la intensidad de la corriente, expresada en amperios por el tiempo transcurrido, expresado en segundos. Es decir, Q(culombios) = I*t.
Tras efectuar múltiples determinaciones, Faraday enunció las dos leyes que rigen la electrólisis y que son:
Primera Ley de Faraday: La masa depositada por electrólisis es directamente proporcional a la cantidad de electricidad que ha circulado.
Segunda Ley de Faraday: Si varias celdas electrolíticas conectadas en serie y provistas de electrodos inertes son atravesadas por la misma cantidad de corriente eléctrica, las cantidades de sustancia depositadas en cada electrodo son proporcionales a los equivalentes-gramo de las sustancias depositadas.
Se denomina equivalente electroquímico de una sustancia a la masa en gramos de duicha sustancia depositada por el paso de un culombio. De acuerdo con esta definición podemos escribir:
m=P I t /(96500 n)
Donde:
m masa en gramos que se han depositado
P peso atómico del elemento
n número de electrones intercambiados
I intensidad de la corriente en amperios
t tiempo en segundos
6500 es el factor de equivalencia entre el Faraday y el Culombio. 1 F= 96500 C
Descargar
| Enviado por: | Manuel Alberto Barragan Dominguez |
| Idioma: | castellano |
| País: | México |