Biología
Química
CROMATOGRAFÍA EN CAPA FINA
Medida del factor de retención (RF)
Fundamento teórico:
La Cromatografía, es una técnica de análisis químico utilizada para separar sustancias puras de mezclas complejas. Esta técnica depende del principio de adsorción selectiva .Por ejemplo, se separó los pigmentos de las plantas (clorofila) vertiendo extracto de hojas verdes en éter de petróleo sobre una columna de carbonato de calcio en polvo en el interior de una probeta. A medida que la solución va filtrándose por la columna, cada componente de la mezcla precipita a diferente velocidad, quedando la columna marcada por bandas horizontales de colores, denominadas cromatogramas. Cada banda corresponde a un pigmento diferente.
La cromatografía en columna utiliza un amplio espectro de adsorbentes sólidos, incluidas la sílice, la alúmina y la sílice gelatinosa. También los líquidos pueden ser adsorbidos en estos sólidos y a su vez sirven como adsorbentes (un proceso denominado partición cromatográfica) permitiendo al químico elaborar columnas de diferentes propiedades para diversas aplicaciones. En la cromatografía con líquidos de alto rendimiento, una variante de esta técnica de uso frecuente hoy en día, se utilizan líquidos adsorbidos en partículas muy pequeñas y uniformes, lo cual proporciona una sensibilidad bastante alta. Para llevar la mezcla a través de la columna se precisa una bomba. La cromatografía de capas finas es otra forma de cromatografía en columna en la cual el material adsorbente reposa en un cristal o en una película de plástico.
En la cromatografía en papel, una muestra líquida fluye por una tira vertical de papel adsorbente, sobre la cual se van depositando los componentes en lugares específicos de la lámina debido a sus factores de retención, que determinarán hasta donde son arrastrados por el disolvente en relación a los demás. Otra técnica conocida como cromatografía gas-líquido permite la separación de mezclas de compuestos gaseosos o de sustancias susceptibles de vaporizarse por calor. La mezcla vaporizada es conducida mediante un gas inerte a través de un estrecho tubo en espiral que contiene una sustancia, por la que los componentes fluyen en diferentes proporciones, siendo detectados al final del tubo. Otro método es la cromatografía por infiltración gelatinosa, basado en la acción filtrante de un adsorbente poroso de tamaño uniforme. Con este método se consigue separar y detectar moléculas de mayor masa molecular.
El uso de la cromatografía está ampliamente extendido en el análisis de alimentos, medicinas, sangre, productos petrolíferos y de fisión radiactiva.
El objetivo de esta práctica es aislar e identificar las distintas sustancias de una mezcla.
Procedimiento:
En una placa cromatográfica realizamos finamente una línea con lápiz paralela al borde de la placa y en ella cuatro puntos con una separación suficiente para colocar una gota en cada uno sin que se mezclen.
En los tres primeros puntos ponemos una gota de cada sustancia (rojo neutro, anaranjado de metilo y azul de bromotimol) y en el último punto una gota de una mezcla de ellos en la que está ausente una de las 3 sustancias.
A continuación secamos con un secador la preparación y la introducimos verticalmente en un frasco con suficiente disolvente (Etanol) y lo cerramos.
Lo que ocurre es que el disolvente empapa la placa y tiende a subir por ella arrastrando las gotas de las muestras en relación a su factor de retención (una marca subirá más que otra).
Cuando el disolvente empapa la placa suficientemente (2 cm del borde superior) quitamos esta del frasco y la secamos de nuevo con el secador.
Ahora medimos las distintas distancias que el disolvente arrastró a las sustancias y calculamos sus factores, observando cual de las 3 sustancias es la que estaba ausente en la mezcla.
Cuestiones:
1.- El factor de retención viene dado por la fórmula S/d donde S es la distancia que subió el disolvente y d la distancia que desplazo a las sustancias (distinta en cada caso).
Rf (rojo neutro) = 4,5/6,7 = 0,67
Rf (azul de bromotimol) = 5,5/6,7 = 0,82
Rf (anaranjado de metilo) = 5/6,7 = 0,74
2.- Debido a que el factor de cada sustancia es distinto y sabemos cuales son así como la distancia que fueron desplazados, determinamos que el indicador ausente en la mezcla es el Azul de bromotimol.
EXTRACCIÓN LÍQUIDO - LÍQUIDO
Fundamento teórico:
Sobre ácidos y bases nos centraremos en los fundamentos de la práctica de “equilibrios ácido-base” así como los fundamentos de los equilibrios químicos, por ello, mencionaremos poco en relación a lo que esta práctica daría de sí en su parte teórica como los ácidos y bases, equilibrios, principio de Le Chatelier,PH....
Un disolvente es una sustancia líquida que disuelve o disocia a otra sustancia en una forma más elemental, y que normalmente está presente en mayor cantidad que esa otra sustancia. El agua, por ejemplo, es un disolvente de la sal común. Una cantidad de sal común (cloruro de sodio) mezclada con agua se disocia en sus componentes, iones sodio y cloro, que acaban por dispersarse en el agua. En este caso, el agua es el disolvente, la sal es el soluto y la mezcla es la disolución. Sin embargo, el soluto no es sólo un componente pasivo o inerte de la disolución. Tanto el disolvente como el soluto se pueden considerar activos. Un disolvente puede poseer una composición compleja, por ejemplo, el alcohol utilizado para fabricar las llamadas tinturas contiene siempre un 5% o más de agua. Los disolventes tienen un valor comercial particular. Son un componente importante de las pinturas, lacas y productos farmacéuticos, y se utilizan para producir materiales sintéticos.
Seleccionando el disolvente adecuado, se puede separar un ingrediente o grupo de ingredientes de un sustancia compleja. Este proceso se llama extracción con disolventes. Por ejemplo, un disolvente puede extraer una fragancia o sabor de una planta o sustancia animal. Una vez disuelta, se puede concentrar la fragancia o sabor evaporando el disolvente. En un proceso de extracción con disolventes bien diseñado, el disolvente se recupera y se vuelve a utilizar una y otra vez.
Los sistemas de extracción por medio de disolventes deben ser diseñados y manejados con mucho cuidado. Por ejemplo, el sabor de una fruta no se debe a una sustancia individual, sino a una combinación compleja de sustancias. La esencia de fresas tiene más de 80 componentes, y el sabor de naranja más de 90. Si las proporciones de esos componentes cambian debido al proceso de extracción con disolventes, el aroma o el sabor pueden ser alterados indebidamente.
Existen disolventes llamados “polares” y disolventes “polares”, tienen en común que disuelven sustancias, pero se diferencian en que disuelven mejor sustancias con una composición polar y apolar respectivamente. Esto se debe a que la composición de las moléculas de disolvente s polares les provee de una polaridad estructural, que hace que disuelvan sustancias polares a causa de interacciones de tipo de, por ejemplo, como en el caso del agua, de carga parcial.
La molécula de agua no posee carga neta, pero su geometría triangular y la electronegatividad de sus átomos (mucho mayor la del oxígeno) hacen que los electrones (con carga negativa) estén más cercanos al átomo de oxígeno creando una carga parcial negativa alrededor de éste átomo y una carga parcial positiva alrededor del átomo de hidrógeno, lo que ayuda a que estas moléculas de agua tiren de las demás moléculas a disolver según la carga que tengan, es decir , según si son o no polares.
Lo que ocurre en nuestra práctica es un equilibrio entre dos formas de un compuesto que dependen del PH del medio para ser las predominantes, si el medio es ácido, neutro o básico presentará una de las formas.
Atendiendo a esto y a lo definido anteriormente sobre la polaridad y los disolventes polares y apolares, podemos decir que nuestra sustancia cuando se encuentre en su forma iónica será más soluble en el disolvente polar, el agua, mientras que cuando se encuentre en su forma neutra será más soluble en el disolvente apolar. Para conseguir la forma iónica o neutra de nuestro compuesto, solo tendremos que acidificar , basificar o neutralizar el medio, de acuerdo al Pk de éste, de manera que si tenemos un medio neutro, como el Pka de la sustancia es cercano a 3, esta se encontrará en su forma iónica, y si lo acidificamos se encontrará en su forma neutra.
El objetivo de esta práctica es separar un colorante orgánico (rojo de metilo) de una disolución acuosa básica .
Procedimiento:
Nos situamos en la campana extractora de gases y la encendemos para que aspire aquellos tóxicos.
Comenzamos cogiendo 20 ml de disolución de rojo de metilo en medio básico, los vertemos en un embudo de decantación y añadimos 40 ml de . Tapamos el embudo y agitamos, abriendo de vez en cuando la llave para eliminar la sobrepresión. A continuación añadimos 10 ml de HCl 2M y volvemos a agitar y separamos la fase orgánica en un erlenmeyer, habiendo reposado previamente.
Añadimos ahora 20 ml de y volvemos a extraer el rojo de metilo a la fase orgánica.
Recogemos la fase orgánica en el mismo erlenmeyer de antes y desechamos la fase acuosa porque no hay rojo de metilo ya disuelto en ella.
El contenido del erlenmeyer lo metemos en el embudo de decantación y añadimos 100 ml de NaOH 1M, recogemos el rojo de metilo a la fase acuosa y al separarse las dos fases recogemos también el en un erlenmeyer y la fase acuosa en otro.
La fase acuosa la desechamos y recogemos la orgánica en un matraz.
Finalmente obtenemos un erlenmeyer con y otro con disolución acuosa de rojo de metilo.
Cuestiones:
1.- La primera vez que agitamos la disolución, el rojo de metilo se encuentra en forma iónica que es más soluble en el disolvente polar (agua).
Al acidificar la fase acuosa añadiendo HCl 2M conseguimos que el rojo de metilo pase a la forma neutra siendo así más soluble en el cloroformo, que es menos polar.
2.- Al hacer básico el medio añadiendo NaOH, volvemos a la forma iónica del rojo de metilo y como inicialmente, es más soluble en agua que en el cloroformo, puesto que este es menos polar.
3.- El cloroformo es más denso que el agua, por lo tanto siempre queda abajo.
Densidad del cloroformo = 1,478 g/cc
D agua = 1 g/cc
REACCIONES REDOX
Fundamento teórico:
Reacción de oxidación-reducción es aquella reacción química correspondiente a la acción de un cuerpo oxidante sobre un cuerpo reductor, que da lugar a la reducción del oxidante y a la oxidación del reductor.
Oxidante y reductor
Por ejemplo, una disolución acuosa de iones Cu2+ es azul. Si se le añaden limaduras de hierro (Fe), se comprueba que el color azul desaparece: los iones Cu2+ han reaccionado. Por otra parte, en la disolución se forman iones Fe2+, lo que se manifiesta por el precipitado verdoso que forman en presencia de sosa. También se observa que el hierro queda recubierto por un depósito rojo. Efectivamente, se forma cobre metálico, Cu. El balance de la reacción es el siguiente:
Fe + Cu2+ Fe2++ Cu
El hierro ha sido oxidado por los iones Cu2+, que a su vez han sido reducidos por el hierro. La reacción anterior es una reacción de oxidación-reducción (o reacción redox) en la que el hierro es el reductor y el cobre el oxidante.
La reacción es de hecho la suma de las dos semirreacciones siguientes:
oxidación: Fe Fe2+ + 2e-
reducción: Cu2+ + 2e- Cu
Por tanto, la oxidación de un cuerpo corresponde a una pérdida de electrones y la reducción corresponde a una ganancia de electrones. Un oxidante (en este caso los iones Cu2+) es una sustancia susceptible de captar uno o varios electrones; un reductor (en este caso el hierro) cede fácilmente uno o varios electrones.
Si se designa el oxidante por Ox, el reductor por Red y el número de electrones implicados por n, las semirreacciones pueden escribirse del modo siguiente:
![]()
Par redox
A cualquier oxidante de un tipo se le puede asociar un reductor del mismo tipo, y viceversa: de este modo se define un llamado `par redox', que se designa por Ox/Red. Una reacción de oxidación-reducción es un intercambio de electrones entre el oxidante de un par redox y el reductor de otro par. Se puede observar que este tipo de reacción es análoga a las reacciones ácido-base, que corresponden a un intercambio de protones entre la base de un par ácido-base y el ácido de otro par.
Consideremos dos pares redox designados como Ox1/Red1 y Ox2/Red2. Si se sabe que el oxidante Ox1 reacciona con el reductor Red2, se producirán las siguientes semireacciones:
Ox1 + n1e- Red1
Red2 Ox2 + n2e-
con el siguiente balance final:
n2Ox1 + n1Red2 n2Red1 + n1Ox2
(Se ha multiplicado la primera ecuación por n2 y la segunda por n1 para que el número de electrones intercambiados en ambas semirreacciones sea el mismo.)
Número de oxidación
En la medida en que cada especie puede existir en una forma más o menos oxidada, es posible definir un `número de oxidación' para caracterizar la forma que se está considerando. Cuanto más elevado es el número, más oxidada está la forma.
En los cuerpos simples, el número de oxidación corresponde a la carga del elemento químico. Así, el hierro puede existir en su forma reducida, el hierro metálico Fe (número de oxidación 0), o en dos formas oxidadas, los iones Fe2+ (número de oxidación II) y Fe3+ (número de oxidación III). En casos más complejos, el número de oxidación está ligado a la valencia del elemento químico considerado.
Cuando un cuerpo se oxida, aumenta su número de oxidación; cuando se reduce, disminuye. Por tanto, un oxidante es un compuesto cuyo número de oxidación puede disminuir, mientras que un reductor es una sustancia cuyo número de oxidación puede aumentar.
Previsión de las reacciones
Un par redox está caracterizado por un potencial normal de electrodo, E0, que, según la Unión Internacional de Química Pura y Aplicada (IUPAC), es su potencial de reducción, es decir, el que corresponde a la semirreacción:
Ox + ne- Red
Así, los pares redox se ordenan según el valor de su potencial normal de reducción: cuanto más elevado es el potencial, mayor es el poder oxidante de la forma oxidada.
En disolución, cuando hay dos pares redox Ox1/Red1 y Ox2/Red2 con potenciales normales respectivos E01 y E02, si E01>E02 la reacción que se produce es:
n2Ox1 + n1Red2 n2Red1 + n1Ox2
balance de las semirreacciones siguientes:
Ox1 + n1e- Red1
Red2 Ox2 + n2e-
Las reacciones de oxidación-reducción son muy frecuentes en la industria: constituyen el principio de funcionamiento de las pilas eléctricas y se emplean para refinar electroquímicamente determinados metales. En la naturaleza, intervienen en la respiración celular y la fotosíntesis.
La electrólisis de las disoluciones salinas es una reacción de oxidación-reducción: se produce oxidación en el ánodo y reducción en el cátodo. Para llevar a cabo una electrólisis se establece una diferencia de potencial entre los electrodos con el fin de seleccionar la reacción deseada.
El objetivo de esta práctica consiste en observar el funcionamiento de una célula electrolítica por medio de reacciones de reducción y oxidación.
Procedimiento:
Ponemos en un vaso de precipitados 50 ml de HCl 1M e introducimos posteriormente cinc una barra de cinc metálico y observamos reacción entre ellos, en la que de la barra de cinc se desprenden burbujitas de gas.
Análogamente introducimos un alambre de cobre y vemos que no sucede reacción alguna, de la misma forma que cuando introducimos después dos alambres separardos.
Ahora, para observar el funcionamiento de una celda electrolítica unimos los dos alambres de cobre a una pila de 6v en el polo + y - respectivamente y observamos que sucede la reacción en el alambre conectado al polo - con el desprendimiento de gas en este.
Ahora sustituimos uno de los alambres de cobre por un electrodo de grafitoy vemos que se produce reacción en ambos polos, aunque menos en el electrodo de grafito.
Continuamos preparando un vaso de precipitados con NaCl 1M, añadimos unas gotas de fenolftaleína e introducimos dos alambres de cobre unidos por una pila y cuando observamos un cambio de coloración en las proximidades de uno de los electrodos, sustituimos el electrodo + de Cu por uno de grafito y vemos como el electrodo - sigue coloreándose de rosa pero en este caso no sufre tanta reacción como antes.
Cuestiones:
1.- Al introducir cinc observamos reacción (burbujas de gas procedentes de la lámina de Zn) Esto es debido a que el potencial de reducción de la reacción Zn (s) (ac) + 2 es positivo, y el balance total junto con la reaccion 2(ac) + 2 (g) con Eo=0,
es positivo, con lo cual se produce la reacción.
Al introducir cobre en la disolución no se observa reacción debido a que el potencial de reducción de la reacción Cu(s) + 1 es negativo, y el correspondiente balance con la reacción del hidrógeno (antes mencionada) es negativo.
2.- Porque aportamos la energía necesaria para que se produzca la reacción de oxidación en el ánodo.
3.- Se desprende Hidrógeno gas. Reacción: 2(ac) + 2 (g)
En el cátodo se produce la oxidación: Cu(s) + 1
4.- Ánodo: 2 (g) + 2
Cátodo: 2H (ac) + 2e (g)
5.- El colorante se muestra rosa en medio básico, y está rosa en nuestra preparación porque se vuelve básica con esta reacción: 2 + 2 (g) + 2 (ac). Se desprende (g) en el ánodo.
Con el electrodo de grafito se desprende (g)
PRECIPITACIÓN : FILTRACIÓN AL VACÍO
Fundamentos teóricos:
Filtración es el proceso de separar un sólido suspendido (nuestro precipitado) del líquido en el que está suspendido al hacerlos pasar a través de un medio poroso por el cual el líquido puede penetrar fácilmente. La filtración es un proceso básico en la industria química que también se emplea para fines tan diversos como la preparación de café, la clarificación del azúcar o el tratamiento de aguas residuales. El líquido a filtrar se denomina suspensión, el líquido que se filtra, el filtrado, y el material sólido que se deposita en el filtro se conoce como residuo o precipitado.
Precipitación:
Es el proceso o fenómeno de formación de un segundo estado o fase de la materia, dentro de una primera fase . Si por ejemplo, el aire que contiene vapor de agua se enfría por debajo del punto en que se forma el rocío, se crea un precipitado de agua líquida dentro de la fase gaseosa.. Si una disolución se sobresatura de un componente que se vuelve sólido a la temperatura existente, este componente tenderá a cristalizar y formar núcleos, o bien precipitará espontáneamente,.. Así esta sustancia podrá sedimentarse o separarse de la fase líquida por el proceso de filtración o centrifugación, que es el caso de nuestra práctica. También puede darse un precipitado de una fase sólida en una segunda fase sólida, como es el caso de algunas aleaciones metálicas en las que el precipitado aporta un aumento significativo de dureza y resistencia a la tracción del metal.
El Producto de solubilidad es la constante que indica en una disolución saturada de un electrólito poco soluble el producto de las concentraciones de los iones, elevada cada una a un exponente igual al coeficiente estequiométrico con el que aparecen en la ecuación de disociación.
Incluso las sustancias más insolubles tienen alguna solubilidad, de modo que una sal insoluble en contacto con el líquido de donde ha sido precipitada está en equilibrio con sus iones, que se depositan continuamente sobre la superficie del sólido, a la vez que de éste pasa a la disolución. La constante que mide este equilibrio es el producto de solubilidad.
Así, sólo pueden existir en disolución concentraciones de los iones que permitan que el producto de solubilidad permanezca constante. Para que una sal precipite, el producto de las concentraciones de los iones elevadas a sus coeficientes estequiométricos ha de ser mayor que su producto de solubilidad.
Kps y la solubilidad están relacionados. Por ejemplo , en la reacción las solubilidades de los ioes plomo y yodo son “s” y “2s” respectivamente, y el producto de solubilidad de esta reacción es:
De todo ello se puede deducir que la cantidad de uno de los dos iones (mejor dicho concentración) mínima para que comience la precipitación será:
El objetivo de la práctica es separar un compuesto formado en disolución aprovechando su baja solubilidad. Obtendremos el precipitado de la disolución mediante filtración al vacío.
Procedimiento:
Disolvemos 5 gr de en agua (unos 50 ml) en un vaso de precipitados.
Disolvemos también 10 g de en 100 ml de agua y mezclamos las dos disoluciones cuando la primera esté a unos 50 ºC de temperatura (aportaremos calor a la misma y mediremos con el termómetro hasta obtener esta tempratura).
Mediante el embudo Buncher y el Kitasato filtramos la disolución una vez la hayamos dejado enfriar y obtenemos filtrado el carbonato de calcio de manera rápida gracias al vacío. Realizaremos este paso hasta que no queden iones en el precipitado, hecho que comprobamos si al añadir unas gotas de al líquido restante de la filtración se observa la aparición de un color blanquecino.
Por último, lo dejaremos secar en el horno y lo pesaremos.
Cuestiones:
1.- + + 2NaCl
5 gr 2,5 gr insoluble soluble:,
2.- Para eliminar iones que se encuentran en disolución y obtener un precipitado lo más puro posible.
3.- Reaccionar con los iones y formar un precipitado blanquecino que nos indica su presencia (cosa que nos ayuda para saber si tenemos que seguir lavando el precipitado)
4.- Rendimiento:
Hemos pesado después de dejarlo secar, 1,25 gramos de Carbonato cálcico, que suponen 0,0125 moles de sal.
Como el reactivo limitante es el y haciendo el clálculo: , obtenemos 0,0171 moles. Entonces ,como el rendimiento de la reacción lo obtenemos con la siguiente fórmula, es aproximadamente el 73%
EQUILIBRIOS QUÍMICOS ( I )
Fundamentos teóricos:
El Equilibrio es el estado de un sistema cuya configuración o propiedades macroscópicas no cambian a lo largo del tiempo. Por ejemplo, si se introduce una moneda caliente en un vaso de agua fría, el sistema formado por el agua y la moneda alcanzará el equilibrio térmico cuando ambos estén a la misma temperatura. En ese punto, las propiedades macroscópicas del sistema (es decir, la temperatura del agua y de la moneda) no cambian a lo largo del tiempo. En mecánica, un sistema está en equilibrio cuando la fuerza total o resultante que actúa sobre un cuerpo y el momento resultante son. En este caso, la propiedad macroscópica del cuerpo que no cambia con el tiempo es la velocidad.
Aunque la configuración o propiedades macroscópicas de un sistema en equilibrio no cambian con el tiempo, su configuración microscópica no es necesariamente estática. Por ejemplo, consideremos una reacción química reversible. En uno de los sentidos (reacción directa), las moléculas A y B reaccionan para formar las moléculas C y D; en el otro sentido (reacción inversa), las moléculas C y D reaccionan para formar las moléculas A y B. Un sistema así está en equilibrio cuando la velocidad de la reacción directa es igual a la velocidad de la reacción inversa; en este caso, las propiedades macroscópicas del sistema, esto es, las concentraciones de las moléculas A, B, C y D, no cambian con el tiempo. Sin embargo, desde el punto de vista microscópico, la configuración del sistema no es estática porque en todo momento se están produciendo la reacción directa e inversa. En general, las propiedades microscópicas de un sistema en equilibrio se compensan de forma que las propiedades a gran escala sean constantes.
La Constante del equilibrio es la constante que equivale al producto de las concentraciones de las sustancias formadas en una reacción química reversible en la que se ha alcanzado el equilibrio, dividido entre el producto de las concentraciones de las sustancias que reaccionan, elevada cada una a un exponente igual al coeficiente que precede a su respectiva fórmula en la ecuación química ajustada.
Sea la reacción reversible entre los reactivos A y B para dar los productos de reacción C y D, según:
aA + bB Á cC + dD
siendo A, B, C y D especies químicas cualesquiera y [A], [B], [C] y [D] sus concentraciones respectivas expresadas en mol/litro.
La velocidad de la reacción directa, v, es directamente proporcional al producto de las concentraciones de los reactivos, elevada cada una a un exponente igual al coeficiente del reactivo en la reacción:
v = k [A]a · [B]b
donde k es la constante de velocidad de la reacción de A con B a una temperatura determinada.
La velocidad de la reacción inversa, v!', es, de forma análoga:
v!'= k' [C]c · [D]d
Cuando se alcanza el equilibrio, la velocidad de las dos reacciones es la misma y, por tanto:
![]()
donde Kc es la constante de equilibrio, que depende únicamente de la temperatura.
En reacciones entre gases se utilizan las presiones parciales en lugar de las concentraciones molares, y la constante de equilibrio se denomina Kp.
En las reacciones heterogéneas, las sustancias sólidas no aparecen en la expresión de la constante de equilibrio, ya que no influyen en las constantes de velocidad. Por ejemplo, en la reacción:
FeO(s) + CO(g) Á Fe(s) + CO2(g)
la constante de equilibrio Kc = [CO2]/[CO], y
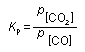
Principio de Le Châtelier: según éste, si se realiza cualquier cambio en las condiciones de un sistema en equilibrio, éste tiende a desplazarse de forma que compensa la variación producida.
En una reacción química, un cambio en la temperatura, la presión o la concentración de los reactivos o los productos en el equilibrio químico provoca el desplazamiento del equilibrio en uno u otro sentido (reacción directa o inversa) según este principio. Así, el aumento de temperatura causa reacciones que absorben energía, pero si la temperatura desciende se producen reacciones que desprenden energía. El aumento de presión favorece reacciones que disminuyen el volumen; sucede lo contrario cuando la presión baja.
Al incrementar cualquier concentración se provocan reacciones que gastan el material añadido, y al disminuirla se favorecen reacciones que forman dicho material, que es lo que veremos en nuestra práctica.
Los isoómeros son dos o más moléculas con composiciones químicas idénticas, pero que difieren en la disposición de los átomos. Dos sustancias isómeras pueden diferir en sus propiedades físicas, químicas y biológicas: una puede ser una medicina útil y la otra ineficaz, una inofensiva y la otra explosiva. Los isómeros se clasifican en isómeros estructurales, en los cuales la secuencia de los átomos es diferente, y en estereoisómeros, en los cuales los átomos están unidos en el mismo orden, pero están orientados de forma distinta en el espacio. Un tipo particular de esteroisomería es la isomería cis-trans (isomería geométrica), producida por una molécula forzada por la rotación limitada de los enlaces a una de las posibles posiciones.
Isómeros ópticos y geométricos
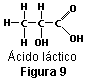
La estructura tetraédrica de los enlaces del carbono dicta algunas propiedades de los compuestos orgánicos que sólo pueden explicarse por medio de las relaciones espaciales. Cuando cuatro grupos distintos de átomos están unidos a un átomo de carbono central, pueden construirse dos moléculas diferentes en el espacio. Por ejemplo, el ácido láctico (ver figura 9) existe en dos formas; este fenómeno es conocido como isomería óptica. Los isómeros ópticos o enantiómeros se relacionan del mismo modo que un objeto y su imagen en el espejo: el CH3 de uno refleja la posición del CH3 del otro, el OH refleja al OH…, al igual que un espejo colocado ante un guante de la mano derecha refleja la imagen de un guante de la mano izquierda.
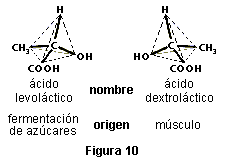
Los isómeros ópticos tienen exactamente las mismas propiedades químicas y físicas, excepto una: el sentido en que cada isómero gira el plano de la luz polarizada. El ácido dextroláctico gira el plano de la luz polarizada a la derecha, y el ácido levoláctico a la izquierda . El ácido láctico racémico (una mezcla 1:1 de ácido dextroláctico y ácido levoláctico) presenta una rotación cero porque los giros hacia derecha e izquierda se cancelan mutuamente.
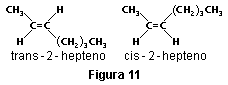
Los dobles enlaces en los compuestos del carbono dan lugar a la isomería geométrica (que no tiene relación con la isomería óptica) si cada carbono del doble enlace está unido a grupos distintos. Por ejemplo, una molécula de 2-hepteno puede estar distribuida en dos formas distintas en el espacio porque la rotación alrededor del doble enlace está restringida. Cuando los grupos iguales (átomos de hidrógeno en este caso) están en partes opuestas de los átomos de carbono unidos por el doble enlace, el isómero se llama trans y cuando los grupos iguales están en la misma parte, el isómero se llama cis.
El objetivo de esta práctica es observar el efecto de la concentración y de la temperatura sobre el equilibrio químico.
Procedimiento A (concentración):
Comenzaremos mezclando en un erlenmeyer 5 ml de con 5 ml de KSCN y 10 ml de agua destilada, obteniendo un compuesto de color vino.
Tomamos cuatro tubos de ensayo y les añadimos a cada uno 2 ml de disolución. A continuación, a un tubo se le añaden 8 ml de KSCN, a otro tubo 8ml de , a otro 10 ml de KCl y al último 15 ml de agua destilada, observando en cada uno de ellos un cambio de coloración.
Cuestiones:
1.- 2 + 6 KSCN Fe + 6 KCl
2.- Si añadimos sustancias que coinciden con los reactivos el equilibrio se desplaza hacia la derecha, modificándose el color (vino más intenso del complejo producto)
Si añadimos KCl (que en nuestra ecuación es producto) el equilibrio se desplaza espontáneamente hacia la izquierda, logrando la aclaración del color de la disolución.
3.- No puede presentar isomería debido a que sus 6 ligandos son los mismos y no puede presentar cis-trans .
Procedimiento B (temperatura):
Introducimos en un vaso de precipitados 2 gr de NaCl y añadimos también 20 ml de 0,2 M, obteniendo una disolución de color azul.
Procedemos a aportarle calor hasta que vemos que la muestra torna el color a verde, y luego, una vez verde dejamos que se enfríe hasta que vuelve al color inicial azul. El cambio de coloración inicial (azul) a verde es debido a la formación de .
Cuestiones:
Endotérmica
1.- + 4NaCl + + 4
(azul) Exotérmica (verde)
2.- El equilibrio se desplaza en el sentido de formación del ión producto (derecha), con el consiguiente cambio de coloración (a verde).
3.- Debido a que sabemos que la aparición de color verde está relacionada con la formación del ión y todo ello sucede con una aportación de calor, sabemos que esta reacción es endotérmica.
4.- No puede presentar isomería por sus cuatro ligandos iguales, ni CIS-TRANS
EQUILIBRIOS ÁCIDO - BASE
Fundamentos teóricos:
Ácidos y bases son dos tipos de compuestos químicos que presentan características opuestas. Los ácidos tienen un sabor agrio, colorean de rojo el tornasol, (tinte rosa que se obtiene de determinados líquenes) y la fenolftaleína queda incolora, y reaccionan con ciertos metales desprendiendo hidrógeno. Las bases tienen sabor amargo, colorean el tornasol de azul, rosa la fenolftaleína, y tienen tacto jabonoso. Cuando se combina una disolución acuosa de un ácido con otra de una base, tiene lugar una reacción de neutralización. Esta reacción en la que, generalmente, se forman agua y sal, es muy rápida. Así, el ácido sulfúrico y el hidróxido de sodio NaOH, producen agua y sulfato de sodio:
H2SO4 + 2NaOH 2H2O + Na2SO4
Primeras teorías
Los conocimientos modernos de los ácidos y las bases parten de 1834, cuando el físico inglés Michael Faraday descubrió que ácidos, bases y sales eran electrólitos por lo que, disueltos en agua se disocian en partículas con carga o iones que pueden conducir la corriente eléctrica. En 1884, el químico sueco Svante Arrhenius (y más tarde el químico alemán Wilhelm Ostwald) definió los ácidos como sustancias químicas que contenían hidrógeno, y que disueltas en agua producían una concentración de iones hidrógeno o protones, mayor que la existente en el agua pura. Del mismo modo, Arrhenius definió una base como una sustancia que disuelta en agua producía un exceso de iones hidroxilo, OH-. La reacción de neutralización sería:
H+ + OH- H2O
La teoría de Arrhenius y Ostwald ha sido objeto de críticas. La primera es que el concepto de ácidos se limita a especies químicas que contienen hidrógeno y el de base a las especies que contienen iones hidroxilo. La segunda crítica es que la teoría sólo se refiere a disoluciones acuosas, cuando en realidad se conocen muchas reacciones ácido-base que tienen lugar en ausencia de agua.
Teoría de Bronsted-Lowry
Una teoría más satisfactoria es la que formularon en 1923 el químico danés Johannes Bronsted y, paralelamente, el químico británico Thomas Lowry. Esta teoría establece que los ácidos son sustancias capaces de ceder protones (iones hidrógeno H+) y las bases sustancias capaces de aceptarlos. Aún se contempla la presencia de hidrógeno en el ácido, pero ya no se necesita un medio acuoso: el amoníaco líquido, que actúa como una base en una disolución acuosa, se comporta como un ácido en ausencia de agua cediendo un protón a una base y dando lugar al anión (ion negativo) amida:
NH3 + base NH2- + base + H+
El concepto de ácido y base de Bronsted y Lowry ayuda a entender por qué un ácido fuerte desplaza a otro débil de sus compuestos (al igual que sucede entre una base fuerte y otra débil). Las reacciones ácido-base se contemplan como una competición por los protones. En forma de ecuación química, la siguiente reacción de Acido (1) con Base (2)
Ácido (1) + Base (2) Ácido (2) + Base (1)
se produce al transferir un protón el Ácido (1) a la Base (2). Al perder el protón, el Ácido (1) se convierte en su base conjugada, Base (1). Al ganar el protón, la Base (2) se convierte en su ácido conjugado, Ácido (2). La ecuación descrita constituye un equilibrio que puede desplazarse a derecha o izquierda. La reacción efectiva tendrá lugar en la dirección en la que se produzca el par ácido-base más débil. Por ejemplo, HCl es un ácido fuerte en agua porque transfiere fácilmente un protón al agua formando un ion hidronio:
HCl + H2O H3O+ + Cl-
En este caso el equilibrio se desplaza hacia la derecha al ser la base conjugada de HCl, Cl-, una base débil, y H3O+, el ácido conjugado de H2O, un ácido débil.
Al contrario, el fluoruro de hidrógeno, HF, es un ácido débil en agua y no transfiere con facilidad un protón al agua:
HF + H2O H3O+ + F-
Este equilibrio tiende a desplazarse a la izquierda pues H2O es una base más débil que F- y HF es un ácido más débil (en agua) que H3O+. La teoría de Brønsted y Lowry también explica que el agua pueda mostrar propiedades anfóteras, esto es, que puede reaccionar tanto con ácidos como con bases. De este modo, el agua actúa como base en presencia de un ácido más fuerte que ella (como HCl) o, lo que es lo mismo, de un ácido con mayor tendencia a disociarse que el agua:
HCl + H2O H3O+ + Cl-
El agua también actúa como ácido en presencia de una base más fuerte que ella (como el amoníaco):
NH3 + H2O NH4+ + OH-
Medida de la fuerza de ácidos o bases
La fuerza de un ácido se puede medir por su grado de disociación al transferir un protón al agua, produciendo el ion hidronio, H3O+. De igual modo, la fuerza de una base vendrá dada por su grado de aceptación de un protón del agua. Puede establecerse una escala apropiada de ácido-base según la cantidad de H3O+ formada en disoluciones acuosas de ácidos, o de la cantidad de OH- en disoluciones acuosas de bases. En el primer caso tendremos una escala pH, y en el segundo una escala pOH. El valor de pH es igual al logaritmo negativo de la concentración de ion hidronio y el de pOH al de la concentración de ion hidroxilo en una disolución acuosa:
pH = -log [H3O+]
pOH = -log [OH-]
El agua pura tiene un pH de 7,0; al añadirle ácido, la concentración de ion hidronio, [H3O+] aumenta respecto a la del agua pura, y el pH baja de 7,0 según la fuerza del ácido. El pOH del agua pura también es de 7,0, y, en presencia de una base cae por debajo de 7,0.
El químico estadounidense Gilbert N. Lewis expuso una nueva teoría de los ácidos y bases en la que no se requería la presencia de hidrógeno en el ácido. En ella se establece que los ácidos son receptores de uno o varios pares de electrones y las bases son donantes de uno o varios pares de electrones. Esta teoría también tiene la ventaja de que es válida con disolventes distintos del agua y no se requiere la formación de una sal o de pares ácido-base conjugados. Según esto, el amoníaco se comporta como una base, pues es capaz de ceder un par de electrones al trifluoruro de boro para formar un par ácido-base:
H3N: + BF3 H3N-BF3
La Hidrólisis
es un tipo de reacción química en la que una molécula de agua, con fórmula HOH, reacciona con una molécula de una sustancia AB, en la que A y B representan átomos o grupos de átomos. En la reacción, la molécula de agua se descompone en los fragmentos H+ y OH-, y la molécula AB se descompone en A+ y B-. A continuación, estos fragmentos se unen proporcionando los productos finales AOH y HB. A este tipo de reacción se le conoce a menudo como doble descomposición o intercambio.
De interés especial es la hidrólisis de diversas sales que origina disoluciones ácidas o básicas, esto lo estudiamos a lo largo de esta práctica viendo como los iones que proceden de bases o ácidos débiles reaccionan con el agua provocando la hidrólisis de esta, proporcionando a la disolución un PH ácido o básico según sea nuestro caso.
Un Indicador, es una sustancia natural o sintética que cambia de color en respuesta a la naturaleza de su medio químico. Los indicadores se utilizan para obtener información sobre el grado de acidez o pH de una sustancia, o sobre el estado de una reacción química en una disolución que se está valorando o analizando. Uno de los indicadores más antiguos es el tornasol, un tinte vegetal que adquiere color rojo en las disoluciones ácidas y azul en las básicas. Otros indicadores son la alizarina, el rojo de metilo y la fenolftaleína; cada uno de ellos es útil en un intervalo particular de acidez o para un cierto tipo de reacción química.
Indicadores ácido - base
El objetivo de la práctica es determinar el PH de una disolución mediante indicadores.
Procedimiento:
Preparamos 100 ml de disolución de HCl 0,1 M a partir de una disolución de HCl 1 M por dilución, introduciendo 10 ml de HCl 1M en la Pipeta y enrasando hasta 100 ml.
Tomamos cuatro tubos de ensayo con HCl 0,1 M y cuatro tubos con NaOH 0,1 M. Añadimos a cada tubo que con ácido 2 gotas de un indicador diferente y hacemos lo mismo con los tubos que contienen la base, y observamos las distintas coloraciones que adquieren las disoluciones.
En otros dos tubos de ensayo ponemos disolución de extracto de lombarda, ( que la preparamos previamente machacando, con la varilla agitadora, unos trocitos de hoja de lombarda junto con 80 ml de etanol), y añadimos gota a gota a uno de los tubos, NaOH 0,1 M, y al otro, HCl 0,1 M hasta que observamos un cambio de coloración considerable.
Cuestiones:
1.- 2 gotas de colorante Color PH
1 Fenolftaleína Incoloro menor a 8
Tubos 2 Rojo neutro Rosa claro menor a 6,8 con HCl
3 Anaranjado de metilo Rojo claro menor a 3,1
4 Azul de Bromotimol Amarillo menor a 6
1 Fenolftaleína Violeta mayor a 10
Tubos 2 Rojo neutro poco amarillo mayor a 8 - NaOH
3 Anaranjado de metilo amarillo-naranja mayor a 4,4
4 Azul de Bromotimol Azul fuerte mayor a 7,6
2.- - Ácido , color rosa violeta ( 20 gotas de HCl )
-
Básico, color verde azulado ( 20 gotas de NaOH )
Papel indicador de PH
El objetivo es determinar el PH de disoluciones por medio de la coloración que adquieren los papeles indicadores cuando se impregnan con ellas.
Procedimiento:
Preparamos 100 ml de disolución de NaCl 0,1 M por pesada directa realizando los cálculos siguientes:
M = nº moles / Volumen 0,1 = nºmoles / 0,1 litros nºmoles = 0,01 que pasados a gramos nos da 0,5844 gr, que pesamos y tomamos. A esto añadimos 100 ml de agua y listo.
Ahora cogemos cuatro tubos de ensayo y los llenamos hasta la mitad con las disoluciones de NaCl 0,1M, NaAc 0,1M y 0,1M.
A continuación tomamos cuatro trocitos de papel indicador, los colocamos sobre un vidrio de reloj, y les echamos a cada uno unas gotas de una de las disoluciones respectivamente, ayudándonos de la varilla.
Observamos que cada uno de los papeles adquiere una coloración y, comparando con el patrón de la caja del papel, determinamos el PH de las disoluciones.
Cuestiones:
1.- Disolución PH
NaCl 7 (neutro)
3 (ácido)
NaAc 8 (ácido)
7 (neutro)
2.- a) NaCl +
estos dos iónes provienen de base y ácido fuertes respectivamente, y sus ácido y base conjugados no tienen reacción de hidrólisis con el agua, con lo que mantienen el PH neutro.
b) +
En este caso, el Cl procede de un ác. fuerte y no presenta hidrólisis. el ión NH procede de una base débil, y su ácido conjugado (nuestro ión) reacciona con el agua (hidrólisis) de la siguiente manera, desprendiendo protones y acidificando el medio.
+ +
--------------------------------------------------------------------------------------------------------------
c) NaAc +
Aquí nos encontramos con que el Na procede de una base fuerte y no presentará hidrólisis, mientras que el ión Ac , procedente de un ácido débil sí presenta hidrólisis con el agua, proporcionando al medio OH , que basifican el medio de esta manera:
+ AcH +
--------------------------------------------------------------------------------------------------------------
d) +
En este caso nos encontramos con que los dos iones obtenidos presentan hidrólisis con el agua al proceder de acido y base débiles.
Los dos compensan las dos reacciones uno a otro gracias a la estequiometría, y fundamentalmente a sus constantes de disociación, que se contrarrestan, quedando así un PH neutro.
DISOLUCIONES REGULADORAS
Fundamentos teóricos:
Disolución tampón o Disolución amortiguadora, es aquella disolución que contiene unas sustancias que inhiben los cambios de pH, o concentración de ion hidrógeno de la disolución. Dichas sustancias pueden contener un ácido débil y su sal, por ejemplo, ácido acético y acetato de sodio, o una base débil y una sal de esa base, por ejemplo, hidróxido de amonio y cloruro de amonio. Los fluidos de los organismos vivos están fuertemente tamponados, y el agua del mar y ciertas sustancias del suelo son otros ejemplos de disoluciones tampones existentes en la naturaleza. Las disoluciones tampones se utilizan en química y sirven como referencia en la medida del pH.
La forma de actuar de estas disoluciones reguladoras de PH consiste en obedecer al principio, anteriormente citado, de Le Châtelier, de manera que crea un equilibrio químico en la disolución que para los cambios que produzcamos, en nuestro caso la concentración de los protones o de los OH, se vean contrarrestados por un desplazamiento espontáneo del equilibrio hacia la dirección en oportuna.
El objetivo consiste en observar como actúan las sustancias reguladoras o tampones en el PH de las disoluciones, manteniéndolos constantes.
Procedimiento:
Tenemos que preparar una disolución reguladora de carbonato. Para ello mezclamos en un erlenmeyer 15 ml de disolución 0,1M con 15 ml de disolución 0,1M.
También preparamos una disolución reguladora de fosfatos: Mezclamos en otro erlenmeyer 15 ml de dislución 0,1M con 15 ml de disolución 0,1M.
A continuación preparamos dos tubos de ensayo con 10 ml de tampón de carbonato. En otros dos , 10 ml de tampón fosfato en cada uno y otros dos tubos con agua destilada. En cada una de las disoluciones sumergimos un poco de papel indicador y observamos la coloración.
Con una pipeta pasteur añadimos una gota de HCl 1M a uno de los tubos que contienen amortiguador de carbonatos, otra a uno de amortiguador de fosfatos y otra a uno de agua destilada. Mezclamos bien las disoluciones con la varilla, y volvemos a mirar las tonalidades.
Repetimos el proceso con los tubos restantes pero añadiendo esta vez NaOH 1M en vez de HCl.
A los tubos que contienen las reguladoras añadimos hasta que se produzca un cambio apreciable en el PH, determinándolo. Una vez apreciado el cambio de PH añadimos 5 ml de HCl al tubo que contenía tampón de carbonato y se le había añadido gotas de HCl .
Tabla de lo que hicimos y observamos:
Tubos PH inicial añadimos PH final
1 10 1 gota HCl 1M 9
/
2 10 1 gota NaOH 1M 10
1 7 1 gota HCl 1M 7
/
2 7 1 gota NaOH 1M 7
1 7 1 gota HCl 1M 2
2 7 1 gota NaOH 1M 10
Al primer tubo 1 de la reguladora de carbonatos le echamos 20 gotas de HCl para notar un cambio de PH ( de 9 a 7). Al segundo le echamos 20 gotas de NaOH y cambió de 10 a 11-12.
A los tubos de reguladora de fosfatos: al 1 con 25 gotas HCl cambió de 7 a 3. Al tubo 2 con 20 gotas de NaOH cambió de PH 7 a PH 8-9.
Cuestiones:
1.- Ecuación de Henderson - Hasselbalch: PH = lg Pka + ([anión] / [ácido])
a) PH = 10,32 + lg 1 = 10,32 [anión] = [ácido] ; x están disueltos.
b) PH = 7,21 + lg 1 = 7,21 [anión] = [ácido] ; x están disueltos.
2.- + +
+ +
Debido al equilibrio en las disoluciones reguladoras, que contienen los iones que desprenderán los ácidos que añadamos, la adición de estos iones provoca que el equilibrio mencionado se desplace hacia la formación del compuesto del que proviene manteniendo constante la concentración de los iones que podrían modificar el PH.
3.- Se desprende gaseoso . Ecuación: (g) + al meter ácido hay un desplazamiento brusco de esta reacción hacia la derecha.
EQUILIBRIOS DE SOLUBILIDAD Y FORMACIÓN DE COMPLEJOS
Fundamentos teóricos:
La Solubilidad de una sustancia en un disolvente, es la cantidad de esa sustancia contenida en el disolvente, a una temperatura y presión dadas.
Una disolución está saturada a una determinada presión y temperatura cuando contiene disuelta la máxima cantidad de soluto posible a esa temperatura. La concentración de soluto correspondiente a su disolución saturada expresa el grado de solubilidad de la sustancia en un disolvente determinado y a una temperatura dada.
En general, la solubilidad de las sustancias sólidas en agua aumenta con la temperatura.
Los gases se disuelven en los líquidos en una proporción que depende de la naturaleza de ambos. Las disoluciones de gases obedecen la ley de Henry, según la cual, a una temperatura dada, la masa de gas disuelto en una cantidad determinada de líquido es proporcional a la presión que el gas ejerce sobre la superficie del mismo.
Salvo excepciones, la solubilidad de los gases en agua disminuye al aumentar la temperatura.
Sobre la precipitación y el producto de solubilidad ya hemos hablado anteriormente en la práctica de “precipitación: filtración al vacío”.
Iones complejos y su formación:
Son moléculas neutras o iones formados por un metal, situado en el centro, rodeado de moléculas o iones llamados “ligandos”. Los iones complejos son iones hidratados, esto influye en las reacciones de precipitación, de manera que si tenemos un compuesto precipitado y algún ion de estos forma complejo con otro que añadamos, lo que resultará es la disolución del precipitado a causa de que el equilibrio del precipitado con sus respectivos iones en disolución se ve afectado y tiende espontáneamente a contrarrestarlo desplazándose hacia una de las dos reacciones (directa o invera), en este caso contrarresta el gasto de iones en disolución, aportándolos del precipitado y así, disolviéndolo.
El objetivo de la práctica consiste en disolver un precipitado añadiendo a la disolución compuestos que formen complejos de coordinación con los cationes de sales insolubles, especies que pueden actuar como donantes de pares de electrones
Procedimiento:
Mezclamos en un tubo de ensayo 1,8 ml de HCl 0,1M con 1,8 ml de 0,1M y observamos un precipitado.
A continuación añadimos, con una pipeta Pasteur, 2M hasta que disolvemos todo el precipitado.
En los tubos de ensayo ponemos 4,5 ml de Oxalato sódico y se añade NaCl gota a gota hasta que precipite. Seguidamente añadimos gota a gota HCl 4M a uno de los tubos y AEDT a otro hasta que vemos que se disuelven los precipitados. Por último añadimos NaOH 8M a ambos tubos.
Podemos ver que el de HCl precipita y el de AEDT no.
Cuestiones:
1.- La formación de precipitado viene dada por la adición de HCl, que al ser un ác. fuerte se disocia y aporta iones Cl para la formación de una sal insoluble junto con los iones Ag por la siguiente ecuación:
HCl + AgCl (precipita) + +
El precipitado AgCl se encuentra en equilibrio con sus iones en disolución. El Ag forma un complejo con el NH de la siguiente manera: + Ag( ) que se encuentra disuelto. Al añadir a la disolución consumiremos iones de la disolución y desplazaremos el equilibrio hacia la formación de iones a partir de la sal insoluble hasta que la consumamos y la diluyamos.
a) AgCl (s) + Cl- .
b) El forma Ag( ) en presencia de .
c) Añadiendo formaremos el complejo que consumirá dislueltos y desplazamos el equilibrio a) hasta que se consuma.
Esto sucede análogamente en el caso b) de la práctica.
2.- AgCl + Cl- Kps= ; s = ; s =
s s
+ [ ] = Kps / 0,2 =
0,2M
Descargar
| Enviado por: | Emili Zaera |
| Idioma: | castellano |
| País: | España |
