Química
Química
Introducción
En este informe abordaremos los dos experimentos realizados en laboratorio, una electrolisis y uno llamado árbol de saturno.
En el primero de ellos intentaremos responder todas las interrogantes, con lo que resolveremos nuestras dudas y lograremos una mayor compresión de la electrolisis experimentada y veremos que esta relacionado con la temática de reacciones redox estudiadas en clase.
En tanto en el experimento denominado “Árbol de Saturno” se darán respuestas a las interrogantes planteadas en la guía de trabajo, además se observaran los cambios ocurridos en el árbol después de 1 y 2 días, lo que al cabo de ellos nos daremos cuenta de porque del nombre ya que este parecía un árbol.
Reacciones químicas en medio Gelificado
Electrolisis del Yoduro de Potasio
Materiales
1.- Vaso precipitado de 100 ml
2.- Gelatina
3.- Yoduro de Potasio
4.- Almidón y Fenolftaleína (al 0,1%)
5.- Minas de Grafito
6.- Batería de 9 voltios y alambre de cobre
Procedimiento experimental:
1.- Ponga en un vaso precipitado gelatina al 10%, calentando con suavidad hasta licuarla, mézclela con 1 ml de solución de almidón y 0,5 ml de solución de fenolftaleína.
2.- Instale los 2 electrodos de grafito y enfrié el vaso hasta que se solidifique el electrolito.
3.- Conecte la batería con los alambres.
Datos anexos

El yoduro de potasio es una sal compuesta de un átomo de potasio y otro de yodo. Este compuesto tiene apariencia cristalina blanca y es muy soluble en agua.

El lugol o solución de Lugol es una solución de I2 (1%) en equilibrio con KI (2%) en agua destilada. Fue nombrada en honor al físico francés J. G. A. Lugol.
Este producto se emplea frecuentemente como desinfectante y antiséptico, para cubrir deficiencias de yodo, y para la desinfección de agua en emergencias.
En microbiología, es empleado en la tinción de Gram para retener el colorante cristal violeta. El I2 entra en las células y forma un complejo insoluble en solución acuosa con el cristal violeta.
Este reactivo reacciona con algunos polisacáridos como los almidones, glucógeno y ciertas dextrinas, formando un complejo de inclusión termolábil que se caracteriza por ser colorido, dando color diferente según las ramificaciones que presente la molécula.
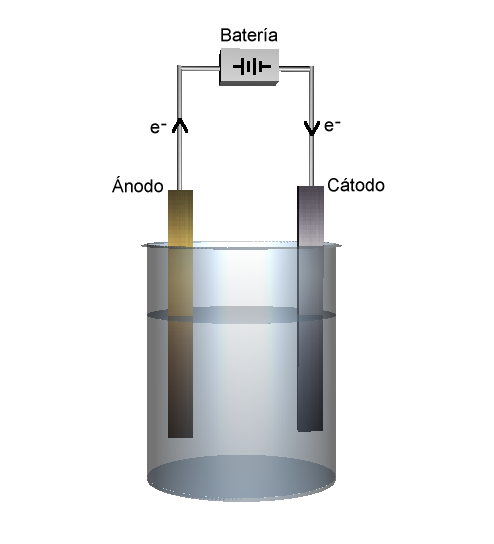
El fenómeno de la electrólisis fue descubierto en 1820 por el físico y químico inglés Michael Faraday. Consiste en la descomposición mediante una corriente eléctrica de sustancias ionizadas denominadas electrolitos. El proceso electrolítico consiste en lo siguiente:
-
Se funde o se disuelve el electrolito en un determinado disolvente, con el fin de que dicha sustancia se separe en iones (ionización).
-
Se aplica una corriente eléctrica continua mediante un par de electrodos conectados a una fuente de alimentación eléctrica y sumergidos en la disolución. El electrodo conectado al polo negativo se conoce como cátodo, y el conectado al positivo como ánodo.
-
Cada electrodo atrae a los iones de carga opuesta. Así, los iones positivos, o cationes, son atraídos al cátodo, mientras que los iones negativos, o aniones, se desplazan hacia el ánodo
Electrolisis: Es el uso de una corriente eléctrica para producir una reacción química.
Cátodo: Es el electrodo negativo. Cationes: Especies químicas cargadas positivamente, que se dirigen al cátodo. Ánodo: Es el electrodo positivo. Aniones: Especies químicas cargadas negativamente, que se dirigen al ánodo.
-
En los electrodos se produce una transferencia de electrones entre estos y los iones, produciéndose nuevas sustancias. Los iones negativos o aniones ceden electrones al ánodo (+) y los iones positivos o cationes toman electrones del cátodo (-).
En definitiva lo que ha ocurrido es una reacción de oxidación-reducción, donde la fuente de alimentación eléctrica ha sido la encargada de aportar la energía necesaria.
Es importante tomar en cuenta estos 2 puntos:
1- Uno nunca debe juntar los electrodos, ya que la corriente eléctrica no va a hacer su proceso y la batería se va a sobrecalentar y se quemará.
2- Uno debe ocupar siempre Corriente continua (energía de baterías) NO Corriente alterna (energía de enchufe)
La reacción inversa de la reacción redox (que produce energía) es la electrolisis, en la cual se aporta energía para disociar elementos de sus moléculas.
La fenolftaleína es un indicador de pH que en soluciones ácidas permanece incoloro, pero en presencia de bases se torna rosa o violeta. Es un sólido blanco, inodoro que se forma principalmente por reacción del fenol, anhídrido ftálico y ácido sulfúrico (H2SO4); sus cristales son incoloros. Tiene un punto de fusión de 254°C.
Su fórmula es C20H14O4.
El cambio de color está dado por la siguiente ecuación química:
| H2Fenolftaleína | ! | Fenolftaleína2- | ! | Fenolftaleína(OH)3- |
No es soluble en agua, con lo que normalmente se disuelve en alcohol para su uso en experimentos. La fenolftaleína es un ácido débil que pierde cationes H+ en solución. La molécula de fenolftaleína es incolora, en cambio el anión derivado de la fenolftaleína es de color rosa. Cuando se agrega una base la fenolftaleína (siendo esta inicialmente incolora) pierde H+ formándose el anión y haciendo que tome coloración rosa.
| Fenolftaleína | ||
| Inferior a pH 7 | Sobre pH 7 | |
| Incoloro | ! | Rosa |
Molécula , (C6H12O6) es una Aldohexosa (Aldehído pentahidroxilado) y un monosacárido. La glucosa es el 2"compuesto orgánico más abundante de la naturaleza, después de la celulosa
Análisis y Aplicación
Escriba la ecuación balanceada de disolución de yoduro de potasio y del agua.
KI + H2O K+ + I- + H2O
Esta ecuación la fundamentamos en base a que el yodo al ser un halógeno y el potasio un metal del grupo I, cuando se produzca electrolisis esta sal se separa en iones debido a que son electrolitos fuertes. Esto se debe que son buenos conductores de electricidad en disolución acuosa.
2K+ + 2I- + 2H2O 2KOH + I2 +H2
Luego el K+ reacciona con H2O formando KOH, y el I- se oxida como I2. Además las burbujas observadas fueron provocadas por el 2H+ + 2 e- H2, el cual se redujo.
Indique cuál es la reacción de oxidación y reducción.
Semi-reacción de oxidación:
I- I2 ya que pierde un electrón, pasa de -1 0.
2I- I2 + 2 e-
Semi-reacción de reducción:
H+ H2 porque gana un electrón, pasa de +1 0.
2H+ + 2 e- H2
Indique cuales son loa aniones y cationes presentes en el electrolito.
Los aniones son aquellas partículas negativas que se dirigen al ánodo (electrodo positivo), en este caso el I- I2. En cambio los cationes son moléculas positivas que son atraídos al cátodo (electrodo negativo), estas serán el 2K+ + 2H2O 2KOH + H2, que rodeando el cátodo reaccionan con el agua para formar KOH, el Hidrogeno se reduce y se convierte en gas, estas son las burbujas que fue posible percibir.
Indique Cuales son las especies químicas que se descargan en el ánodo y en el cátodo, respectivamente.
Lo que ocurre en la reacción química de electrolisis es que se el yoduro de potasio se separa en yodo y potasio, los que son descargados en un electrodo distinto. Las especies químicas se descargan son de la siguiente forma: en el cátodo se descargo el potasio y en el ánodo se descarga el Yodo.
La separación de esa forma de las especies es causa del cambio de color lo que se explica en la pregunta siguiente.
Explique a que se debe el cambio de color en la reacción anódica y en la reacción catódica.
El cambio de color se explica por la presencia de indicadores que reaccionan frente a ciertas sustancias. Como se dijo en la pregunta anterior en el cátodo se descarga el potasio lo que coincide el cambio a color rojo en esa zona y esto ocurre porque el potasio ante la presencia de agua se forma Hidróxido de Potasio (KOH) que es de una sustancia básica, y como consecuencia la fenolftaleína reacciona formando este color. Ahora en el sector del ánodo se pone de un color oscuro (entre negro y café) y se debe a la presencia del yodo que se convierte en yodo molecular (I2), lo que es conocido como lugol y ya que este reconoce la presencia de Almidón y en la solución lo contenía reacciono formando este color.
Observaciones
La realización de esta experiencia no desvela mayores observaciones de las que pueden ser concluidas a través de la resolución de las interrogantes. Dentro de lo que observamos es que pasado un breve lapso de tiempo ocurre la reacción y vemos como cambia en la zona del cátodo al color rojo o rosa de la fenolftaleína y en el otro aparece un color oscuro casi negro el cual luego de la investigación concluimos que es lugol. Además se podía apreciar que pequeñas burbujas de un gas salen de uno de los electrodos lo que corresponde a hidrogeno.
Árbol de Saturno
Materiales:
1.- Silicato de sodio
2.- Ácido acético 1M
3.- Acetato de plomo 1M
4.- Vaso de precipitados de 100 ml
5.- sulfato de cobre II
Procedimiento Experimental:
1.- Mezcle volúmenes iguales de las siguientes soluciones:
Solución 1: 1 ml de acetato de plomo + 10 ml de acido acético
Solución 2: 10 ml de silicato de sodio + 40 ml de agua destilada
La mezcla de las estas dos soluciones será
Solución 3: 10 ml de solución 1 + 10 ml de solución 2
2.- La solución 3 se solidifica en el transcurso de un día.
3.- Una vez sólida se coloca sobre esta masa una lenteja de cinc.
4.- al cabo de 1 o 2 días se formará un precipitado dendrítico similar a un árbol invertido (formado por cristales de plomo).
5.- en un lugar a la lenteja de cinc colocamos un cristal de sulfato de cobre II, los cristales de plomo se recubrirán con una capa de cobre metálico.
Observaciones:
Luego de unos días, pudimos observar como en nuestra solución comenzó a aparecer un cristalizado, que es del cinc que se le agregó al día siguiente, el que formaba una especie de árbol invertido.
Análisis y aplicación:
Observe atentamente y anote los cambios que se producen en el transcurso del día siguiente y después de 2 días.
Al día siguiente, a mezcla que contenía 10 ml de la solución 1 (1 ml de acetato de plomo + 10 ml de ácido acético) más 10 ml de la solución 2 (10 ml de silicato de sodio + 40 ml de agua destilada), se le agregó una granilla de cinc. Esta comenzó a reaccionar, sin dar muchos resultados notorios al día siguiente, pero los que si se fueron dando en el transcurso de más días formándose una especie de árbol invertido negro, el llamado Árbol de Saturno
Escriba la ecuación de disociación del ácido acético, acetato de plomo y sulfato de cobre.
Ácido acético
CH3 CH3COO -
Acetato de plomo
(CH3COO)2Pb CH3COO - 2
Sulfato de cobre
CuSO4 Cu+2 + SO4-2
Indique la reacción de oxidación y reducción. Identifica el oxidante y el reductor.
Pb + CuSO4 - Cu + PbSO4
Pb Pb +2 Semi reacción de oxidación
Cu + 2 Cu Semi reacción de educción
Dados los siguientes valores de potenciales normales de reducción:
| Reaccion | K+/K | Zn+2/Zn | Fe+2/Fe | Ni+2/Ni | Pb+2/Pb | H+/H | Cu+2/Cu |
| Potencial | -2.92 | -0.76 | -0.44 | -0.23 | -0.13 | -0.00 | +0.34 |
a.- Observe los datos (y en orden) de la serie y explique en que se fundamenta la formación del árbol de Saturno.
b.- utilice esta serie para justificar las reacciones de reducción del Pb y Cu.
Conclusión
Luego de haber analizado ambas experiencias logramos tanto en la electrolisis como en el árbol de Saturno lograr comprenderlas, a través de las diversas preguntas en la guía de trabajo, lo que nos permite analizar ambas experiencias y comprenderlas a cabalidad.
Analizando y como conclusión en general hay que decir que si bien son experimentos distintos llegamos a lo medular en ambos que son los dos tipos de reacciones, una de oxidación y otra de reducción.
Como mencionamos en la primera experiencia logramos entender como funciona la electrolisis y en la segunda comprendimos porque se logra formar el árbol de saturno.
Descargar
| Enviado por: | Rkstro |
| Idioma: | castellano |
| País: | Chile |
