Química
Química y sociedad
QUÍMICA Y SOCIEDAD
En nuestra vida cotidiana presenciamos una serie de cambios y procesos que nos demuestran la importancia de la química. Materiales como la crema dental, los jabones han sido elaborados mediante procesos químicos. La comida que ingerimos ha sido elaborada por cambios que se continúan a través de nuestro organismo. La tinta del bolígrafo es producto de un proceso especial de elaboración. El forro de los libros, las pinturas, la tiza, los abonos, los fertilizantes, entre otros, son materiales indispensables para la humanidad en esta época de avances notables y constantes. Para obtener todos estos materiales, el hombre tuvo que realizar muchas investigaciones. El químico se preocupa por descubrir las propiedades características que le permitan hallar la diferencia entre unas sustancias y otras; separar los componentes que forman los cuerpos; investigar procesos de transformación de las sustancias con el fin de obtener materiales más útiles al hombre; hallar la estructura de la materia con lo cual puede explicarse su comportamiento y propiedades.
La Ingeniería química como una disciplina independiente surge después de la revolución industrial; sin embargo, en los últimos 50 años ha jugado un rol crucial en el desarrollo de los pueblos y particularmente en la aplicación de los conceptos de los procesos óptimos a otros campos. La Ingeniería química por sí sola puede dar cuenta de una serie de logros para la humanidad, que van desde las investigaciones del átomo en Du Pont, Hanford, la era del plástico, los fármacos, los catalizadores, los fertilizantes, la petroquímica, etc.
El desarrollo de los procesos químicos industriales ha sido uno de los factores que mas han influido en el crecimiento económico de las ultimas décadas. Sin embargo, el proceso no esta exento de riesgos. La fabricación de productos químicos agresivos para el ser humano y el medio en que vive, utilizados como paso intermedio en la obtención de objetos de consumo, obliga a extremar las precauciones y a exigir fuertes controles y una gran responsabilidad a quienes fabrican y manipulan esas sustancias.
INTRODUCCIÓN A LA QUÍMICA INDUSTRIAL
La química industrial, también conocida con el nombre de química técnica o ingeniería química, es la rama de la química que se dedica a transformar compuestos químicos básicos en otros productos químicos de gran demanda. La industria química se ocupa de la extracción y procesamiento de las materias primas, tanto naturales como sintéticas, y de su transformación en otras sustancias con características diferentes de las que tenían originariamente. Estas transformaciones se llevan a cabo mediante una serie de reacciones químicas muy complejas.
La domesticación del fuego fue lo que permitió a la humanidad manipular las primeras artes químicas, pero hasta el siglo XVI no se percibe una actividad productiva organizada. El aumento del nivel de vida y las demandas crecientes de la población en los países industrializados trajeron consigo nuevos requerimientos energéticos y de suministros. Hoy la química es uno de los pilares de la producción primaria de cualquier país desarrollado.
La preparación industrial de un producto suele ser muy diferente (en cuanto a los procesos utilizados) a la obtención de dicho producto en un laboratorio, pues en éste último se suelen utilizar métodos más sencillos, pero menos eficaces. En un principio las operaciones de la industria química tan sólo diferían de las de los laboratorios en pequeñas modificaciones o aumentos del tamaño de los aparatos y máquinas utilizadas. En la actualidad cualquier proceso químico tiene que seguir una serie de pasos obligados (que asegurarán el perfeccionamiento de dicho proceso) antes de convertirse en proceso industrial (además, no se desarrollará a gran escala hasta que se haya demostrado su rentabilidad): en primer lugar es necesario un estudio detallado en un laboratorio de la viabilidad de las reacciones, estos estudios previos a la utilización de una reacción con fines industriales son esenciales y tienen como objetivo el conocimiento de las condiciones óptimas en las que se debería llevar a cabo una reacción de forma que se obtenga el máximo rendimiento posible en el menor tiempo; tras estos primeros estudios se harán ensayos en plantas o instalaciones piloto, momento en el cual habrá que enfrentarse con los problemas prácticos que se plantean en las industrias; una vez hecho todo esto, el proceso de producción se llevará a cabo en la planta industrial.
DIFERENCIAS FUNDAMENTALES ENTRE LA QUÍMICA DE LABORATORIO Y LA INDUSTRIAL
La principal diferencia entre la industria y el laboratorio es que en la industria se realizan los mismos procesos que en el laboratorio pero a gran escala.
La química de laboratorio se preocupa de investigar y llevar a cabo nuevas formas y procesos para conseguir así un mejor acceso a las sustancias químicas.
Por ello, la química de laboratorio y la química industrial, están íntimamente relacionadas.
En el laboratorio se investiga para aplicar esas investigaciones a la industria.
La química industrial se dedica a la manufactura de elementos químicos y de sus compuestos y derivados.
Todo proceso industrial nace en un laboratorio, donde se hacen los cálculos precisos, pero el proyecto del proceso en una planta de producción debe prever aspectos que no se consideran en un laboratorio antes de la puesta en marcha de un proceso de producción. Para ello se construyen las llamadas plantas piloto, donde se comprueba la viabilidad del proceso de fabricación y se evalúan los rendimientos y los posibles riesgos sobre un funcionamiento muy parecido al que tendría la planta definitiva.
IMPORTANCIA ECONÓMICA Y EFECTOS NOCIVOS QUE OCASIONA LA FALTA DE RACIONALIZACIÓN EN EL USO DE LA QUÍMICA
La Química tiene gran importancia económica ya que mueve grandes cantidades de dinero en todo el mundo.
La medicina es el mejor ejemplo de industria química ya que se ha convertido en un instrumento esencial para la sociedad, las industrias médicas son de las que más dinero mueven y son muy importantes, evidentemente, porque mantienen a salvo nuestra salud.
Desde tiempos inmemoriales la humanidad ha necesitado de los cambios químicos para su supervivencia y progreso, desde el fuego hasta los modernos fármacos.
Transformar las sustancias en otras más valiosas y prolongar la vida de las personas fueron los principales objetivos de la alquimia, que dominó durante mucho tiempo hasta que, por propia necesidad, se pasó a la moderna química.
Los principales objetivos actuales de la química son producir mejores fármacos y la producción de materiales más valiosos.
Aunque la saciedad se ha descontrolado en el aspecto en que producimos muchos desechos y provocamos una alteración del medio ambiente con lluvias ácidas, desechos radiactivos, etc.
Necesitamos tener un desarrollo sostenible en el cual produzcamos lo que podamos reciclar. Derrochar es el primer eslabón de una larga cadena que tiene como resultado final la indeseable contaminación por lo que la sociedad debe asumir la responsabilidad.
LA QUÍMICA INDUSTRIAL DEL AMONIACO Y DEL ÁCIDO NÍTRICO
AMONIACO
El amoniaco, NH3, es un gas a temperatura ambiente. Se trata de un compuesto muy importante en la industria y en la agricultura. La mayor parte de el se utiliza para obtener fertilizantes, productos de limpieza o ácido nítrico.
El amoniaco se obtiene industrialmente combinando el hidrógeno con el nitrógeno.
El hidrógeno se obtiene al reaccionar metano con vapor de agua
Por su parte, el nitrógeno se obtiene quemando hidrógeno en aire. Como el aire esta formado por nitrógeno, oxigeno y pequeñas cantidades de otros gases, al reaccionar el oxigeno con el hidrógeno para formar vapor de agua.
El gas que queda después de condensar el agua es, mayoritariamente, nitrógeno..
El nitrógeno no es muy reactivo. Para que reaccione con el hidrógeno, los dos gases se mezclan y se comprimen, para que las moléculas se aproximen. Después se pasa la mezcla por el conversor, un deposito circular que contiene un catalizador (planchas de hierro caliente).
La reacción de obtención del amoniaco tiene lugar en ambos sentidos; es reversible. Parte del amoniaco que se forma se descompone de nuevo en nitrógeno e hidrógeno. El rendimiento de la reacción es tan solo de un 10%.
El amoniaco se separa del nitrógeno y del hidrógeno disminuyendo la temperatura, ya que licua a -33ºC. El hidrógeno y el nitrógeno que no han reaccionado se devuelven al conversor y el amoniaco se almacena a presión, en estado liquido.
Propiedades del Amoniaco
El amoniaco es el punto de partida para la obtención de muchos compuestos industriales.
Es un gas incoloro y tiene un olor picante característico, que irrita los ojos y es de sabor cáustico. Es muy soluble en agua.
El amoniaco en estado liquido es muy poco conductor de la electricidad. Arde en presencia del oxígeno puro con una llama poco luminosa, desprendiendo vapor de agua y de nitrógeno.
Es estable a temperatura ambiente pero se descompone por la acción del calor.
La reacción del amoniaco con metales, especialmente con alcalino y alcalinoterreos, puede dar lugar a amidas, imidas o nitruros.
Es más ligero que el aire.
Carácter Ácido-Base: en las reacciones químicas el amoniaco puede actuar como base. Así puede aceptar un protón:
H2O + NH3 NH4+ + OH-
Es decir se comporta como una base débil de Brönsted-Lowry, por lo que se utiliza en muchas reacciones como fuente moderada de iones OH-
Carácter Redox
El NH3 solo puede actuar como reductor en las reacciones redox. Así, por ejemplo, a temperatura elevada se oxida con oxigeno molecular:
4 NH3 + 5O2 6H2O + 4NO
Aplicaciones del amoniaco
Se emplea para la obtención de sales amónicas, utilizadas como abono. Otra gran parte de se destina a la obtención de NO, de ácido nítrico y de nitratos. También se utiliza como ya hemos dicho antes, de refrigerante.
Obtención del Amoniaco
1ª Forma: En el laboratorio, el método más corriente de obtener amoniaco es mediante una reacción ácido-base de desplazamiento, esto es, desplazando la base débil de una sal amónica por una base fuerte. Corrientemente se emplea hidróxido de cálcio:
2NH4Cl + Ca(OH)2 CaCl2 + 2H2O + 2 NH3
2ª Forma: A nivel industrial se utiliza el proceso de Haber-Bosch, que consiste en la síntesis a partir de sus elementos:
N2 (g) + 3H2 (g) = 2NH3 H= -92.4 KJ
Esta ecuación es un ejemplo de equilibrio. Por lo que utilizaremos el principio de Le Chatelier para calcular las condiciones optimas. Según éste principio tendríamos que conseguir una temperatura baja y una presión elevada. Pero a una baja temperatura la velocidad de reacción es extremadamente lenta. Por estas causas el proceso de formación del amoniaco se realiza entre los 400-500º C a través de un catalizador de óxido de hierro, y a unas 1000 atm de presión consiguiendo rendimientos de un 50 a un 70%.
ÁCIDO NÍTRICO
El ácido nítrico, HNO3, se obtiene al oxidar el amoniaco. Se utiliza para producir fertilizantes como el nitrato de potasio, y explosivos, como el TNT o la dinamita. También se usa para fabricar nailon o medicamentos. En la obtención del ácido nítrico distinguimos tres etapas:
oxidación del amoniaco a monóxido de nitrógeno, NO, a 900ºC, utilizando para ello una aleación de platino como catalizador.
oxidación del monóxido de nitrógeno a dióxido de nitrógeno, NO2.
reacción del dióxido de nitrógeno y el oxigeno con agua para formar ácido nítrico.
El ácido nítrico puro es líquido a la temperatura ordinaria e incoloro. En estado sólido también es incoloro. Es inestable, en estado líquido está desasociado en pentaoxido de dinitrógeno y agua. Es soluble en agua con gran desprendimiento de calor.
Las disoluciones acuosas de ácido nítrico se comportan frente a metales y a compuestos como óxidos, hidróxidos, carbonatos, etc. Como corresponde a disoluciones acuosas de ácidos fuertes.
Solo algunos metales como Au, Pt, Rh e Ir no son atacados por el ácido nítrico que es un poderoso agente oxidante y otros metales como el Al, Fe y Cr se pasivan por la acción del ácido concentrado. El poder oxidante del HNO3 depende marcadamente de su concentración. A concentraciones menores de 2M, su poder oxidante es virtuosamente nulo.
Es un ácido muy fuerte, presenta la propiedad de los ácidos de neutralizar las bases y de desplazar a otros ácidos más débiles.
Es un ácido muy oxidante. El nº de oxidación del nitrógeno es +5, el máximo que puede tener el nitrógeno, por tanto la tendencia de este es a reducirse. Los productos de la reducción dependen de la concentración del ácido nítrico y de la naturaleza del agente al que se le enfrente.
Aplicaciones del Ácido Nítrico
Se utiliza como base de fabricación de abonos y fertilizantes, explosivo y pinturas especialmente. También se emplea para la preparación de nitratos. Para la formación de agua regia.
Obtención del Ácido Nítrico
Para la obtención del ácido nítrico de forma industrial se utiliza el denominado proceso de Ostwald. Consiste en la oxidación catalítica del amoniaco procedente de la síntesis de Haber, a óxidos de nitrógeno que por acción del agua pasan a ácido nítrico. Podemos dividir el proceso en tres fases:
Oxidación del amoniaco a óxido nítrico: La mezcla gaseosa de amoniaco y aire enriquecido en oxígeno se calienta a unos 800 ºC a través de un catalizador de platino, la reacción es:
4NH3 + 502 4NO + 6 H2O
Oxidación de NO a NO2: El monóxido de nitrógeno pasa a la torre de oxidación donde se añade más aire, oxidándose a dióxido de nitrógeno:
2NO + O2 2NO2
Paso de NO2 a HNO3: El dióxido de nitrógeno formado se conduce a la torre de hidratación donde, siempre en presencia de un exceso de aire, reacciona con el agua.
3NO2 + H2O 2HNO3 + NO
El ácido así obtenido se concentra por destilación, hasta que se obtiene una disolución de punto de ebullición constante, que es el ácido nítrico comercial (68% en peso y densidad 1,4 g/cm3)
INDUSTRIA QUIMICA, TECNOLOGÍA Y MEDIO AMBIENTE
La química industrial tiene un papel muy importante en el incremento de la calidad de vida de la sociedad, pero esta indudable mejora en la calidad de vida tiene un alto precio: la generación de grandes cantidades de residuos que provocan un grave perjuicio al medio ambiente.
Son cuantiosos los estropicios derivados de la gran actividad industrial que se está llevando a cabo en el mundo desarrollado hoy en día, y la presencia de ciertos elementos o productos en grandes cantidades trastorna el equilibrio normal de los ecosistemas y repercute muy negativamente en el medio ambiente.
Pero también ha proporcionado alternativas para evitar el uso de sustancias perjudiciales.
La Química Ambiental es el estudio de las fuentes, de las reacciones, del transporte, de los efectos y del destino de las especies químicas en la atmósfera, en los medios acuáticos, en los suelos y los efectos que la tecnología puede producir sobre ellos.
LA ATMÓSFERA Y SU COMPOSICIÓN
La atmósfera es una capa de gases que rodea la Tierra, es fundamental para la vida pues protege de la radiación ultravioleta procedente del Sol además de suministrar a los vegetales el CO2 necesario para sus funciones fotosintéticas y a los animales el oxígeno necesario para respirar.
Esta capa de gases evita las variaciones extremas de temperatura
Dependiendo de la distancia la tierra la atmósfera presenta unas variaciones tanto de temperatura como en su composición.
Dependiendo de la temperatura la atmósfera puede dividirse en distintas capas:
-
Troposfera: es la más cercana a la tierra, abarca los primeros 15km, contiene todos los gases, en ella se producen todos los cambios climáticos y a medida que se asciende en ella el aire se va enfriando(25º a -55º).
-
Estratosfera: Se extiende de los 15km a los 55km, recibe una mayor radiación solar por lo que alcanza una temperatura mayor que los últimos niveles de la troposfera, en ella se ubica la capa de ozono.
-
Mesosfera: se encuentra a una altura entre los 55km y los 85km. En ella, la temperatura desciende hasta alcanzar los -110°, en su límite con la capa superior. En esta capa ya no es posible encontrar vapor de agua, mientras que los otros gases disminuyen su concentración. En la mesosfera se producen partículas con carga eléctrica, ya sean átomos o moléculas que ganan o pierden electrones. También, se pueden observar estrellas fugaces, que se producen por la caída de meteoritos, que emiten luz al rozar con la capa.
-
Termosfera o Ionosfera: se distingue por tener una composición gaseosa variable; las partículas que la forman son ionizadas, como producto de la radiación ultravioleta. Por la presencia de tantas cargas eléctricas, en la ionosfera la temperatura sube considerablemente y puede llegar a los 1.000°C en su parte más alta.
-
Exosfera: Es la capa más lejana y extensa de la atmósfera se encuentra a parti de los 500km. A este nivel casi no existe oxígeno ni nitrógeno, pero sí gran cantidad de hidrógeno y helio. La densidad de esta capa es muy baja, por la poca cantidad de partículas que en ella existen.
CONTAMINANTES DEL AIRE
Un contaminante del aire es una sustancia presente en la atmósfera en cantidad suficiente para dañar a la población humana a animales , plantas e incluso a los bienes de uso.
Estos contaminantes se dividen en primarios y secundarios:
-Los contaminantes primarios son básicamente cinco: CO, SO2, NOx, compuestos orgánicos volátiles y partículas en suspensión.
Estos contaminantes se hallan concentrados en muchas áreas urbanas e industriales y si en estas áreas se reunen ciertas condiciones climatológicas los efectos se multiplican.
-Los contaminantes secundarios proceden de las reacciones químicas de los contaminantes primarios con otros componentes de la atmósfera. Éstos son: el ácido sulfúrico, el ác. nítrico, los sulfatos y nitratos, el ozono y otros oxidantes.
Las sustancias químicas contaminantes - estimadas en % - que más abundan en la atmósfera son el dióxido de azufre(55%) , monóxido de carbono(91%) , óxidos de nitrógeno(0%) , e hidrocarburos(84%)
Los contaminantes atmosféricos pueden ser bien de origen natural o bien antropogénico.
De origen natural
Óxidos de azufre:
El SO2 proviene, principalmente, de la oxidación - del sulfuro de hidrógeno originado en la descomposición de materia orgánica y ocasionalmente de erupciones volcánicas e incendios forestales( menor).
H2S(g) + 3/2 O2(g) ===== SO2(g) + H2O(g)
Monóxido de carbono:
El CO proviene, principalmente, de la oxidación del metano originado por la descomposición anaerobia de la materia orgánica y de incendios de grandes masas forestales. El N2O se produce en la naturaleza por procesos microbiológicos llegando a alcanzar las 0,25 ppm, considerado con un valor no contaminante. Los hidrocarburos volátiles provienen, principalmente, de los grandes bosques de coníferas y extensiones arbóreas, además del metano - gas de los pantanos- procedente de la descomposición anaerobia de materia orgánica, que suele estar en la atmósfera en concentración de 1ppm aproximadamente.
De origen antropogénico
Óxidos de azufre:
-El SO2 representa aproximadamente el 45% , principalmente de la combustión de carbones ( 1 a 3% de S la mayoría en forma de FeS2 o pirita) y productos derivados del petróleo, y en procesos metalúrgicos como la tostación de sulfuros.
El SO2 se oxida por acción del oxígeno atmosférico a SO3 y también por el radical hidróxido producido por reacciones fotoquímicas , según la reacción: SO2(g) + 2 OH(g) ==== SO3(g) + H2O(l)
El SO3 reacciona con el agua atmosférica para dar ácido sulfúrico; éste forma pequeñas gotas que pueden ser arrastradas por los vientos cientos de kilómetros antes de caer a tierra ( lluvia ácida).
SO3(g) + H2O (l) ==== H2SO4(ac)
Las lluvias ácidas constituyen actualmente una preocupación mundial porque corroen los metales destruyen el equilibrio de la Naturaleza y son muy peligrosas para la salud humana. En gran parte son causadas por el azufre de los carburantes, dado que el azufre está presente en los combustibles fósiles ( petróleo, y sobre todo carbón). Al quemarse este se desprende dióxido de azufre SO2, que se mezcla con la lluvia y forma ácido sulfuroso. Si bien su acidez es muy débil la lluvia ácida pone en peligro el equilibrio ecológico de la superficie terrestre. En otros subproductos de la combustión se encuentra el anhídrido sulfuroso, que además puede oxidarse en el aire para dar anhídrido sulfúrico (otro compuesto gaseoso formado por la combinación con el oxígeno). Este último, al humedecerse con la humedad atmosférica da lugar a la formación de ácido sulfúrico que puede ser vertido a la tierra a través de la lluvia.
El ácido nítrico formado en la atmósfera a partir de óxidos de nitrógeno generados en las tormentas y desprendidas por muchas fábricas de productos químicos contribuyen también a la lluvia ácida.
El uso industrial del amoniaco en equipos de refrigeración y aire acondicionado provoca, en este caso, la neutralización de la lluvia ácida al ser éste una base. podemos
El fenómeno de las lluvias ácidas ( que en algunos casos pueden alcanzar la acidez del vinagre) afecta a parte del norte de Europa y a Estados Unidos y representa una tremenda amenaza ambiental, en particular para los lagos y explotaciones agrícolas. Incluso los monumentos de piedra sufren importantes degradaciones por esta causa tanto mayor cuanto más próximo se encuentren a las zonas industriales. Son los países industrializados los que en mayor medida.
Monóxido de carbono:
-El CO aparece- unas tres cuartas partes - como consecuencia de la combustión incompleta -déficit de oxígeno- en motores de explosión, gasolina y diesel, llegando a alcanzar una concentración en algunas zonas de grandes ciudades de hasta 100 ppm .
C8H18 (l) + 12,5 O2(g) ===== 8 CO2(g) + 9 H2O(l)
C8H18(l) + 11,5 O2(g) ======= 6 CO2(g) + 2 CO(g) + 9 H2O(l)
La oxidación del CO a CO2 es demasiado lenta, y por tanto su concentración es significativa.
para evitar tales concentraciones, los automóviles modernos incorporan un reactor catalítico denominado catalizador que consiste en una cámara metálica que contiene un catalizador químico para acelerar la reacción.
2CO(g)+ O2(g)==== 2CO2(g)
El monóxido de carbono se convierte en dióxido de carbono, con lo que se reducen considerablemente las emisiones de monóxido de carbono a la atmósfera.
Los óxidos de nitrógeno (NOx):
-Concretamente NO y NO2. La mayoría provienen de la combustión de combustibles fósiles tanto en instalaciones fijas como móviles. La mayoría se emite en forma de NO ( puede alcanzar los 0,4 ppm ) debido a la reacción entre el oxígeno y el nitrógeno. El NO posteriormente se oxida a NO2.
Los óxidos de nitrógeno contribuyen a la formación de contaminantes secundarios dando origen a la niebla fotoquímica.
Además los óxidos de nitrógeno contribuyen a la lluvia ácida. El dióxido de nitrógeno reacciona con el agua atmosférica y produce ácido nítrico, HNO3.
N2(g) + O2(g) ==== 2 NO(g)
4 NO2(g) + 2 H2O(l) + O2(g) ==== 4 HNO3(ac)
Hidrocarburos:
-Los hidrocarburos presentes en la atmósfera debido a la actividad humana se estiman en un 16 % y provienen sobre todo, de los combustibles quemados a altas temperaturas, como ocurre en los automóviles y en menor grado debido a la industria. Como consecuencia aparece el llamado smog fotoquímico; se produce al interaccionar los hidrocarburos, sobre todo etileno y propileno con óxidos de nitrógeno, fuerte radiación solar y con inversión térmica; se forman entonces productos como el ozono, peróxidos, aldehidos, cetonas , ácidos y sustancias irritantes de los ojos, como el nitrato de peroxiacetilo y la acroleína.
El "smog" (niebla fotoquímica) es un término de la contaminación del aire que se usa diariamente. En realidad, el smog es ozono a nivel del suelo formado por la reacción de los contaminantes con la luz solar. La siguiente figura muestra los factores que intervienen en la creación del smog.
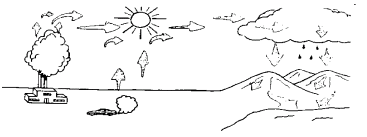
El agente más influyente para la aparición del smog es la actuación en la atmósfera del óxido nítrico (NO) y del dióxido de nitrógeno (NO2).
Otros componentes minoritarios:
-Las dioxinas , el plomo, los CFC, los POPs( contaminantes orgánicos persistentes) son otros contaminantes peligrosos para el medio ambiente. Existen otros contaminantes como el amoniaco, cloro, flúor, fluoruro de hidrógeno, sulfuro de hidrógeno, ácido cianhídrico, pesticidas, polvo de amianto, y la mayoría de los productos químicos industriales producidos, que tienen impacto a nivel local, justo en las zonas donde se producen, pero tienen poca importancia a nivel global.
El plomo aparece, principalmente, como consecuencia de los aditivos que se añaden a las gasolinas, que una vez quemadas lo liberan a la atmósfera. También aparece como residuo de viejas pinturas a base de este metal. Los CFC , no son tóxicos, ni inflamables, ni corrosivos, más conocidos como freones, se han utilizado, principalmente en máquinas de refrigeración, como gas refrigerante, en la fabricación de espumas rígidas y también flexibles , para materiales de empaque, propelentes, etc. Cuando éstos se liberan a la atmósfera no se descomponen, ya que son muy estables, hasta que alcanzan la estratosfera, donde la radiación ultravioleta rompe el enlace C-Cl liberando el radical cloro que ataca al ozono, originando una reacción en cadena. Como consecuencia la concentración de ozono disminuye - filtro de protección natural contra la radiación ultravioleta- con el consiguiente peligro para la biosfera.
LA CAPA DE OZONO
La capa de ozono es la zona de la atmósfera situada de 19 a 48 km por encima de la superficie de la Tierra. En ella se producen concentraciones de ozono de hasta 10 partes por millón (ppm). El ozono se forma por acción de la luz solar sobre el oxígeno. Esto lleva ocurriendo muchos millones de años, pero los compuestos naturales de nitrógeno presentes en la atmósfera parecen ser responsables de que la concentración de ozono haya permanecido a un nivel razonablemente estable.
El ozono es un compuesto inestable de tres átomos de oxígeno, el cual actúa como un potente filtro solar evitando el paso de una pequeña parte de la radiación ultravioleta (UV) llamada B que se extiende desde los 280 hasta los 320 manómetros (nm).
La radiación UV-B puede producir daño en los seres vivos, dependiendo de su intensidad y tiempo de exposición; estos daños pueden abarcar desde irritación a la piel, conjuntivitis y deterioro en el sistema de defensas, hasta llegar a afectar el crecimiento de las plantas y dañando el fitoplancton, con las posteriores consecuencias que esto ocasiona para el normal desarrollo de la fauna marina
A nivel del suelo, unas concentraciones tan elevadas de O3 son peligrosas para la salud, pero dado que la capa de ozono protege a la vida del planeta de la radiación ultravioleta cancerígena, su importancia es inestimable. Por ello, los científicos se preocuparon al descubrir, en la década de 1970, que ciertos productos químicos llamados clorofluorocarbonos, o CFC (compuestos del flúor), usados durante largo tiempo como refrigerantes y como propelentes en los aerosoles, representaban una posible amenaza para la capa de ozono. Al ser liberados en la atmósfera, estos productos químicos, que contienen cloro, ascienden y se descomponen por acción de la luz solar, tras lo cual el cloro reacciona con las moléculas de ozono y las destruye. Por este motivo, el uso de CFC en los aerosoles ha sido prohibido en muchos países. Otros productos químicos, como los halocarbonos de bromo, y los óxidos nitrosos de los fertilizantes, son también lesivos para la capa de ozono.
Durante varios años, a partir de finales de la década de 1970, los investigadores que trabajaban en la Antártida detectaron una pérdida periódica de ozono en las capas superiores de la atmósfera por encima del continente. El llamado agujero de la capa de ozono aparece durante la primavera antártica, y dura varios meses antes de cerrarse de nuevo. Otros estudios, realizados mediante globos de gran altura y satélites meteorológicos, indican que el porcentaje global de ozono en la capa de ozono de la Antártida está descendiendo. Vuelos realizados sobre las regiones del Ártico, descubrieron que en ellas se gesta un problema similar. En 1985, una convención de las Naciones Unidas, conocida como Protocolo de Montreal, firmada por 49 países, puso de manifiesto la intención de eliminar gradualmente los CFC de aquí a finales de siglo. En 1987, 36 naciones firmaron y ratificaron un tratado para la protección de la capa de ozono. La Comunidad Europea (hoy Unión Europea) propuso en 1989 la prohibición total del uso de CFC durante la década de 1990.
LA QUÍMICA DEL CARBONO
La química de los compuestos del carbono es en la actualidad la rama de las ciencias químicas que crece con mayor rapidez. La variedad de productos derivados del carbono puede resultar prácticamente ilimitada debido a las propiedades singulares de dicho átomo y, por tanto, constituye una fuente potencial de nuevos materiales con propiedades especiales, de medicamentos y productos sanitarios, de colorantes, de combustibles, etc.
La materia viviente es, en parte, materia constituida por derivados del carbono. Las transformaciones que sufren los seres vivos, y que observamos a simple vista, se corresponden, desde un punto de vista molecular, reacciones químicas de las sustancias biológicas. Azúcares, grasas, proteínas, hormonas, ácidos nucleicos, son algunos ejemplos de sustancias, todas ellas compuestos del carbono, de cuya síntesis y degradación en el interior de los organismos vivos se ocupa la bioquímica.
El isótopo del carbono más común es el carbono 12; en 1961 se eligió este isótopo para sustituir al isótopo oxígeno 16 como medida patrón para las masas atómicas, y se le asignó la masa atómica 12.
Los isótopos carbono 13 y carbono 14 se usan como trazadores en la investigación bioquímica. El carbono 14 se utiliza también en la técnica llamada método del carbono 14 , que permite estimar la edad de los fósiles y otras materias orgánicas. Este isótopo es producido continuamente en la atmósfera por los rayos cósmicos, y se incorpora a toda la materia viva. Como el carbono 14 se desintegra con un periodo de semidesintegración de 5.760 años, la proporción entre el carbono 14 y el carbono 12 en un espécimen dado, proporciona una medida de su edad aproximada.
Medicamentos
El mundo de los medicamentos ha constituido en el pasado y constituye en la actualidad una parte importante de la investigación y el desarrollo de productos derivados del carbono. Su importancia en orden a mejorar la esperanza de vida de los seres humanos y sus condiciones sanitarias hace de este área del conocimiento científico una herramienta imprescindible para la medicina.
Los fármacos actúan en el organismo a nivel molecular y es precisamente el acoplamiento entre la molécula del fármaco y el receptor biológico, es decir, el sitio de la célula o del microorganismo sobre el cual aquél actúa, el último responsable de su acción curativa. Pero para que ese acoplamiento sea posible ambos agentes, fármaco y receptor, tienen que presentar una cierta complementariedad tal y como sucede con una cerradura y su correspondiente llave. Los receptores biológicos suelen ser moléculas de gran tamaño y por este motivo son las cadenas carbonadas de los compuestos orgánicos las que pueden poseer una estructura geométrica que mejor se adapte a la porción clave del receptor; tal hecho, junto con la presencia de grupos funcionales con acciones químicas definidas, son responsables de la abundancia de sustancias orgánicas entre los productos farmacéuticos.
Los productos farmacéuticos proporcionan un alto rendimiento económico gracias a su gran especificidad y pequeña producción
Polímeros orgánicos
Los polímeros orgánicos son compuestos formados por la unión de dos o más unidades moleculares carbonadas idénticas que reciben el nombre de monómeros. La unión de dos monómeros da lugar a un dímero, la de tres a un trímero, etc.
Los polímeros pueden llegar a contener cientos o incluso miles de monómeros, constituyendo moléculas gigantes o macromoléculas.
Existen en la naturaleza diferentes sustancias que desde un punto de vista molecular son polímeros, tales como el caucho o las proteínas; pero en el terreno de las aplicaciones los más importantes son los polímeros artificiales. Su síntesis en los laboratorios de química orgánica ha dado lugar a la producción de diferentes generaciones de nuevos materiales que conocemos bajo el nombre genérico de plásticos. La sustitución de átomos de hidrógeno de su cadena hidrocarbonada por otros átomos o grupos atómicos ha diversificado las propiedades de los plásticos; la investigación en el terreno de los polímeros artificiales ha dado como resultado su amplia implantación en nuestra sociedad, sustituyendo a materiales tradicionales en una amplia gama que va desde las fibras textiles a los sólidos resistentes.
Caucho y cauchos sintéticos
Caucho: ( materia prima); látex producido por varias moraceas y eufobiaceas intertropicales, entre las que se destaca la Hevea Brasiliensis.
Cuando por cortes o incisiones se rompen los conductos lactiferos de los arboles productores de caucho, estos segregan un liquido lechoso y turbio que contiene el caucho en suspención y dividido en pequeñas gotitas de aspecto emulsionado. Como la secreción es relativamente abundante la misma se recoge en recipientes especiales en forma de pequeños baldes que se cuelgan al termino de las incisiones; luego el jugo recolectado es sometido a un tratamiento para solidificarlo por evaporación o coagulación, ahumado, etc. en el mismo lugar de la cosecha.
El caucho es el cuerpo sólido que tiene el mayor coeficiente de dilatación conciso y que aumenta considerablemente con la vulcanización.
Un corte reciente de caucho crudo, o sea sin vulcanizar se puede volver a unir soldándose entre si con solo presionar uno contra otro. Una vez vulcanizado pierde esta propiedad pero adquiere una mayor elasticidad, pudiendo alargarse hasta seis veces su longitud primitiva.
El alargamiento del caucho vulcanizado es acompañado de una elevación de temperatura y en cambio se produce un enfriamiento cuando retorna a su estado normal. Por síntesis se han elaborado diferentes productos de propiedades físicas parecidas a las del producto vegetal.
Caucho natural y cauchos sintéticos.
El caucho es un hidrocarburo de gran importancia que se obtiene del látex de ciertos arboles de la zona tropical. Cuando se calienta el látex o se le añade ácido acético, los hidrocarburos en suspención, con pequeñas cantidades de otras sustancias se coagulan y pueden extraerse del liquido. El producto obtenido es el caucho bruto del comercio, viscoso y pegajoso, blando en caliente y duro y quebradizo en frío. Al estirarlo, no vuelve a adquirir después la forma primitiva.
El producto, observado ya por colon en las indias occidentales, permaneció prácticamente sin valor hasta que en 1839, Charles Goodyear descubrió que amasando bien el caucho con azufre y calentándolo a una temperatura superior a 100 ºC, el azufre se combina químicamente con el caucho y el producto que resulta tiene propiedades mucho más útiles; no se deforma por el calor, no es quebradizo en frío y sobre todo, no es pegajoso. A demás, si se estira un trozo, recupera después de la tensión su forma primitiva. Los anillos del S8 se abren y se combinan con los dobles enlaces de las moléculas de caucho formando puentes de cadenas de azufre de una molécula de caucho a otra y dando lugar a una trama total. Este proceso se llama vulcanizacion. Distintas sustancias como el negro de humo y óxidos de zinc y plomo, y muchos productos orgánicos, actúan de acelerantes de la vulcanización, dando a demás un caucho más tenaz y duradero ( cámaras para ruedas de automóvil). El caucho natural se considera como un polímero del isopreno.
La formación de los distintos cauchos sintéticos se basa en la polimerización del butadieno o de homólogos (isopreno) o derivados (cloropreno) que tiene la misma estructura.
Caucho sintético
Puede llamarse caucho sintético a toda sustancia elaborada artificialmente que se parezca al caucho natural. Se obtiene por reacciones químicas, conocidas como condensación o polimerización, a partir de determinados hidrocarburos insaturados. Los compuestos básicos del caucho sintético, llamados monómeros, tienen una masa molecular relativamente baja y forman moléculas gigantes denominadas polímeros. Después de su fabricación, el caucho sintético se vulcaniza.
El origen de la tecnología del caucho sintético se puede situar en 1860, cuando el químico británico Charles Hanson Greville Williams descubrió que el caucho natural era un polímero del monómero isopreno, cuya fórmula química es CH2-C(CH3)CH-CH2. Durante los setenta años siguientes se trabajó en laboratorio para sintetizar caucho utilizando isopreno como monómero. También se investigaron otros monómeros, y durante la I Guerra Mundial químicos alemanes polimerizaron dimetilbutadieno (de fórmula CH2-C(CH3)C(CH3)-CH2), y consiguieron sintetizar un caucho llamado caucho de metilo, de pocas aplicaciones.
Hubo que esperar hasta 1930 para que dos químicos, el estadounidense Wallace Hume Carothers y el alemán Hermann Staudinger, investigaran y contribuyeran al descubrimiento de los polímeros como moléculas gigantes, en cadena, compuestas de un gran número de monómeros. Entonces se consiguió sintetizar caucho de monómeros distintos al isopreno.
La investigación iniciada en Estados Unidos durante la II Guerra Mundial condujo a la síntesis de un polímero de isopreno con una composición química idéntica al caucho natural.
Tipos de caucho sintético: Se producen varios tipos de caucho sintético: neopreno, buna, caucho de butilo y otros cauchos especiales.
a) Neopreno: Uno de los primeros cauchos sintéticos logrados gracias a la investigación de Carothers fue el neopreno, el polímero del monómero cloropreno, de fórmula CH2-C(Cl)CH-CH2. Las materias primas del cloropreno son el etino y el ácido clorhídrico. El neopreno fue desarrollado en 1931 y es resistente al calor y a productos químicos como aceites y petróleo. Se emplea en tuberías de conducción de petróleo y como aislante en cables y maquinaria.
b) Buna o caucho artificial: Químicos alemanes sintetizaron en 1935 el primero de una serie de cauchos sintéticos llamados buna o cauchos buna, obtenidos por copolimerización, que consiste en la polimerización de dos monómeros denominados comonómeros. La palabra buna se deriva de las letras iniciales de butadieno, uno de los comonómeros, y natrium (sodio), empleado como catalizador. En la buna N, el otro comonómero es el propenonitrilo (CH2-CH(CN)), que se produce a partir del ácido cianhídrico. La buna N es muy útil en aquellos casos en los que se requiere resistencia a la acción de aceites y a la abrasión. También se obtiene caucho industrialmente por copolimerización de butadieno y estireno (buna S).
c) Caucho de butilo: Este tipo de caucho sintético, producido por primera vez en 1949, se obtiene por copolimerización de isobutileno con butadieno o isopreno. Es un plástico y puede trabajarse como el caucho natural, pero es difícil de vulcanizar. Aunque no es tan flexible como el caucho natural y otros sintéticos, es muy resistente a la oxidación y a la acción de productos corrosivos. Debido a su baja permeabilidad a los gases, se utiliza en las cámaras interiores de los neumáticos.
d) Otros cauchos especiales: Se han desarrollado numerosos tipos de cauchos con propiedades específicas para aplicaciones y usos especiales. Uno de estos cauchos especiales es el coroseal, un polímero de cloruro de vinilo (CH2-CHCl). Estos polímeros son resistentes al calor, la corrosión y la electricidad, y no se deterioran por la acción de la luz ni por un almacenamiento prolongado. El coroseal no se puede vulcanizar, pero mientras no se le someta a altas temperaturas, se muestra más resistente a la abrasión que el caucho natural o el cuero.
Otro tipo de caucho especial es el tiocol, que se obtiene por copolimerización de dicloruro de etileno (CHCl-CHCl) y tetrasulfuro de sodio (Na2S4). Puede trabajarse y vulcanizarse como el caucho natural y es resistente a la acción de los aceites y los disolventes orgánicos usados en barnices; se emplea para aislamientos eléctricos pues no se deteriora con la luz ni la electricidad.
Muchos otros tipos de caucho sintético se producen con métodos parecidos a los antes descritos. La introducción de algunos cambios en los procesos de polimerización ha mejorado la calidad de los productos y abaratado costos. Uno de los mayores avances ha sido la utilización del petróleo como aditivo, bajando los costes al poder conservarse grandes cantidades de caucho sintético almacenado. Gracias a ello se ha conseguido fabricar neumáticos de larga duración. Otros dos avances importantes son el desarrollo de la espuma de caucho sintética, que se usa en tapicería, colchones y almohadas, y el caucho bruto de superficie arrugada, para la industria del calzado.
Baquelita
Baquelita es un nombre general para la resina de fenol, utilizada para el aislamiento del calor y la electricidad. Es un tipo de plástico, que tiene la propiedad de secado super rápido para convertirse en algo parecido al concreto. Todos los movimientos físicos de un objeto al ser cubierta por baquelita pueden ser impedidos.
Leo Hendrik Baekeland (1863-1944) fue el químico estadounidense de origen belga, que inventó hacia 1906 la resina sintética conocida posteriormente como baquelita. Nació en Gante, en cuya universidad estudió. Emigró a Estados Unidos en 1889, nacionalizándose con posterioridad. Fabricó papel fotográfico y consiguió un nuevo tipo de papel (velox) que se podía revelar con luz artificial. Fundador delos plásticos modernos, recibió varios premios, incluida la medalla Nichols de la Sociedad Americana de Química en 1909 y en 1940 la medalla Franklin del Instituto Franklin.
Es un polímero duro y quebradizo que sirve para recubrir los mangos de algunas herramientas y enchufes eléctricos.
3)PVC
Siglas con que se designa el policloruro de vinilo, -(-CH2 - CHCl- )n, polímero sintético de adición que se obtiene por polimerización del cloruro de vinilo. Su masa molecular relativa puede llegar a ser de 1.500.000. El cloruro de vinilo, CH2 = CHCl, es la materia prima para la preparación del PVC. La polimerización se efectúa en suspensión acuosa, utilizando un jabón como emulsionante y un persulfato como iniciador, y transcurre en las tres etapas típicas de las reacciones por radicales libres: iniciación, propagación y terminación.
El PVC es un plástico duro, resistente al fuego, a la luz, a los productos químicos, a los insectos, a los hongos y a la humedad. Es ignífugo, no se rompe ni se astilla, ni se mella fácilmente. Todas estas propiedades, y el hecho de que no requiera ser pintado y que pueda reciclarse, implican un coste bajo de mantenimiento y un menor impacto ambiental.
Su rigidez permite utilizarlo en la fabricación de tuberías, láminas y recubrimientos de suelos. Se hace flexible al mezclarlo con un plastificador, generalmente un poliéster alifático, siendo utilizado como aislante de tendidos eléctricos, como cuero sintético, para envases de alimentos y artículos impermeables. Es ligero, inerte y completamente inocuo. Resistente al fuego (no propaga la llama), impermeable, aislante eléctrico, acústico y térmico. Resistente a la intemperie, de elevada transparencia, protector de alimentos y otros productos envasados, incluidas las aplicaciones médicas (por ejemplo plasma y sangre). Económico en cuanto a su relación calidad-precio y reciclable.
Teflón
El teflón o PTFE es un polímero en el que se repita la unidad o monómero F2C-CF2. Fue descubierto por casualidad por Roy J. Plunkett mientras trabajaba para la empresa Du Pont en 1938.
Algunas de laspropiedades del teflóen son: es capaz de resistir temperaturas de unos 300° C durante largos periodos casi sin sufrir modificaciones. Es resistente (insoluble) a muchos disolventes orgánicos.
Su descubridor relata: “Para la solución de mis problemas estaba interesado en la producción de tetrafluoroetileno (TFE o Freon 1114). Hasta entonces el TFE solo había sido sintetizado en pequeñas cantidades en estudio de laboratorio. Yo quería disponer de unas 100 libras de este material.
Después de unos cuantos experimentos de laboratorio, yo había diseñado una planta piloto para la producción de la candidata de TFE deseada desde diclorotetrafluoroetano.
El TFE fue colocado en cilindros y guardado en una caja refrigerada con CO2 sólido (nieve carbónica).
Un día, con la ayuda de mi ayudante Jack Rebok estaba vaporizando TFE desde un pequeño cilindro que contenía aproximadamente 2 libras de TFE. El TFE gaseoso que emergía desde un cilindro situado en un plato de balanza era pasado por unos medidores de flujo e introducido en la cámara de reacción, donde el TFE reaccionaba con otros productos químicos.
Ese día en particular, poco después de que el experimento comenzara, mi ayudante me avisó que el flujo de TFE se había detenido. Comprobé el peso del cilindro y me encontré con que contenía una gran cantidad de material de lo que yo creía que era TFE. Abrí la válvula completamente e hice pasar un alambre por la válvula de apertura, pero el gas no salía. Cuando sacudí el cilindro y me di cuenta de que el material estaba sólido dentro, quité la válavula y así pudo salir el polvo blanco del cilindro. Finalmente con la ayuda de una sierra, el cilindro fue abierto y salió una gran cantidad de polvo blanco. Enseguida fue obvio para mi que el TFE había polimerizado y que el polvo blanco era un polímero de TFE.
Siguiendo este descubrimiento, inmediatamente inicie los pasos necesarios para caracterizar el polvo blanco y determinar la forma por la que pudo formarse.
En unas pocas semanas, las pruebas de laboratorio mostraron que el polímero era inerte a todos los disolventes, bases y ácidos disponibles.
Mientras me daba cuenta que el PTFE (politetrafluoroetileno) era un material inusual, no sabía que hacer con él. Sin embargo fui afortunado por estar asociado con una compañía que tenía un gran interés en los polímeros y que mantenía varios científicos e ingenieros trabajando en el campo de la química de los polímeros”.
Características físicas de estos materiales:
El caucho se caracteriza por su elasticidad y firmeza. El PVC se caracteriza por ser inerte, ligero impermeable, aislante, de elevada transparencia y de no grandes costos. Se usa principalmente para la fabricación de cañerías. El teflón es un polímero altamente resistente, capaz de resistir mas de 300° C, casi sin sufrir cambios. Es resistente a la mayoría de ácidos y bases y a muchos disolventes orgánicos. La baquelita es un polímero duro y quebradizo que se usa para cubrir mangos y enchufes eléctricos.
CINÉTICA QUÍMICA
Es la parte de la química-física que estudia la velocidad de las reacciones y la trayectoria para llegar de los reactivos a los productos. La velocidad de reacción se da en unidades de moles/l.seg. (concentración/unidad de tiempo).
Al trabajar con moléculas gaseosas podremos utilizar unidades como presión/unidad de tiempo.
La velocidad de una reacción se expresa más generalmente como:
v = k [A] [B]
k: constante de velocidad es numéricamente igual a la velocidad de la reacción si la concentración de los reactivos es igual a 1. Físicamente indica la influencia numérica que tienen la temperatura y la naturaleza de los reactivos en la reacción que estemos estudiando.
y : órdenes de reacción. Son números de factores de concentración de los que depende la velocidad de la reacción. No se pueden predecir, son experimentales.
FACTORES QUE INFLUYEN EN LA VELOCIDAD DE UNA REACCION
1. Naturaleza de los reactivos (enlaces, grupos funcionales...)
2. Concentración de las especies reactivas.
3. Temperatura.
4. Grado de disgregación de los reactivos.
5. Presencia de catalizadores (factor fundamental), tanto para acelerar como para retardar la reacción . Un catalizador no consigue que se realice una reacción que no se da.
INFLUENCIA DE LA CONCENTRACION EN LA VELOCIDAD DE REACCION
Vamos a ver las ecuaciones que rigen la velocidad de la reacción en relación con las concentraciones de los reactivos.
Si la concentración no influye para nada hablaremos de reacciones de orden cero. Estas reacciones son poco frecuentes pero hay un grupo de reacciones que son las descargas de gases sobre superficies metálicas (fenómeno en el que se basan las bombillas). Independientemente de la concentración del gas será la velocidad de desaparición del metal siempre y cuando la superficie del metal esté completamente cubierta de gas.
INFLUENCIA DE LA TEMPERATURA EN LA VELOCIDAD
Antiguamente se había visto que la velocidad de una reacción aumenta a medida que aumentaba la temperatura. Fue Arrhenius el primero que encontró una ecuación que relacionaba las constantes de velocidad y la temperatura. Encontró que la velocidad cumplía que:log K = f (1/T) expresado en grados Kelvin. De estos datos empíricos llegó a :K = A*e-Ea/RT
A: factor de frecuencia. Nos mide el número de choques que existen entre los reactivos cuando tenemos 1 mol de dichos reactivos por cm2 (tiene las mismas unidades que K). Esta idea sobre A está basada en la teoría de colisiones que nos decía cómo se comportaban las moléculas chocando en distintas direcciones lo que provoca una variación en la velocidad de reacción.
Ea: Para explicar el significado de esta magnitud recurrimos a la teoría del complejo activado en el que cobra gran importancia la energía de las moléculas. Sólo aquellas moléculas con una determinada energía (energía de activación) serán capaces de sufrir la reacción. Cuanto más alta sea la energía de activación menos moléculas conseguirán alcanzarla, y por ello menos moléculas sufrirán la reacción.
A medida que aumenta la temperatura la Ea del proceso será alcanzada por más moléculas por ello la velocidad de su reacción será mayor.
CATALIZADORES
Son sustancias que varían la velocidad de la reacción. Normalmente los catalizadores son aceleradores de la velocidad, pero también en algunos casos los catalizadores retardan la reacción. La función de los catalizadores es modificar la forma de pasar de los reactivos a los productos, pero los catalizadores nunca consiguen que se de una reacción que anteriormente no se daba.
Características de los catalizadores:
- Una pequeña cantidad de catalizador, puede catalizar mucho reactivo.
- En principio no se consumen.
-Según en el estado de agregación en que se encuentren con relación al reactivo los dividiremos en:
1. Catálisis homogenea: Cuando el catalizador y el reactivo se encuentran en el mismo estado de agregación. Es la catálisis menos frecuente, un ejemplo puede ser la descomposición del agua oxigenada.
2. Catálisis heterogenea: El catalizador se encuentra en distinto estado de agregación que los reactivos. Este tipo de catálisis se utiliza mucho en ingeniería química ya que los reactivos suelen ser gases o reactivos en disolución y el catalizador suele ser un sólido.
3. Autocatálisis: uno de los productos de la reacción sirve como catalizador de la reacción.
4. Catálisis bioquímica: constituyen los catalizadores conocidos como enzimas, sin su presencia no se darían las reacciones biológicas de la vida.
CONCLUSIÓN
La enorme variedad y cantidad de sustancias químicas que entran en el medio ambiente, debido a una desmesurada producción, está afectando a los individuos que formamos parte de él en mayor o menor grado. Las consecuencias tardarán mucho tiempo en observarse, aunque ya se han manifestado los efectos tóxicos sobre los organismos a corto plazo. A muy largo plazo no es posible predecir las consecuencias que puedan producirse. La solución a este problema no es nada sencilla. intereses económicos y personales dificultan a veces la prohibición de algunas sustancias tóxicas.
Las campañas publicitarias de las multinacionales del sector a favor del uso de sus productos por parte de los consumidores y la falta de información y formación de éstos, contribuye a la proliferación en el mercado de tanta variedad de sustancias tóxicas. Es preciso informar a la población del riesgo que conlleva el uso irracional de estos productos y fomentar el uso alternativo de productos naturales de menor toxicidad, como es la agricultura y ganadería de origen biológico o ecológico.
Incrementando la formación medioambiental en todos los niveles del sistema educativo, se obtendrían resultados positivos que permitirían un desarrollo sostenible entre el progreso tecnológico y la conservación de nuestro entorno. Es tarea de todos contribuir a conservar y preservar nuestro medio ambiente.
Descargar
| Enviado por: | Power Ponch |
| Idioma: | castellano |
| País: | España |
