Electrotecnia y Electrónica
Pilas primarias y secundarias
PILAS PRIMARIAS Y SECUNDARIAS
Hay dos maneras de producir electricidad para aplicarla a usos prácticos: bien mediante máquinas llamadas dinamos o generadores de corriente eléctrica, cuando se trata de un consumo apreciable para instalaciones fijas; o bien mediante el empleo de baterías de pilas secas o de acumuladores, si se trata de aparatos portátiles o vehículos automóviles.
Una pila transforma la energía química en energía eléctrica; parte de esa energía química se transforma en calor (energía calorífica) y el resto en corriente eléctrica.
Existen dos clases de pilas: la primaria, cuya carga no puede renovarse cuando se agota, excepto reponiendo las sustancias químicas de que está compuesta, y la secundaria, que sí es susceptible de reactivarse sometiéndola al paso más o menos prolongado de una corriente eléctrica continua, en sentido inverso a aquél en que la corriente de la pila fluye normalmente. La pila seca común que se emplea, por ejemplo, en las lámparas portátiles es una pila primaria.
En la fabricación de una pila primaria se pueden emplear diversas sustancias químicas, pero el principio que rige su funcionamiento será siempre el mismo. Así en la pila primaria, hay dos metales diferentes, o bien un metal y carbón (estos elementos son designados electrodos), y un líquido, denominado electrolito. Uno de estos elementos llamado el cátodo, o sea el polo negativo, es generalmente de cinc; el positivo, denominado ánodo, es casi siempre de carbón. Las reacciones químicas que tienen lugar, hacen que el cátodo se disuelva poco a poco en el electrólito, lo cual pone en libertad a electrones que, de encontrar un conductor o sistema que conecte a ambos electrodos, por donde puedan circular, producen una corriente eléctrica.
HISTORIA.
Origen de la Pila Voltaica:
En 1780 Luis Galvani, profesor de anatomía de la Universidad de Bolonia, Italia, al realizar un experimento, observó que las ancas de una rana recién muerta se crispaban y pataleaban al tocárselas con dos barras de metales diferentes. La explicación del fenómeno la dio poco tiempo después Alejandro Volta, profesor de física de la Universidad de Pavía, Italia, quien descubrió que la causa de tales movimientos crispantes de las ancas de la rana se hallaban en el paso de una corriente eléctrica producida por los dos metales diferentes; investigó como producir electricidad por reacciones químicas y en 1800, después de una amplia experimentación, inventó un dispositivo que se conoce como pila voltaica. Colocó una serie de pequeñas placas de cinc y plata, en pares, una arriba de la otra, separando cada par de placas por una tela humedecida con agua salada; el conjunto produjo una corriente eléctrica y fue este el origen de la primera pila eléctrica. Pronto la perfeccionó reemplazándola por una pila de dos elementos; cobre y cinc, sumergidos en una solución de ácido sulfúrico contenida en un recipiente.
En esta sencilla forma de pila primaria, las placas de cinc y de cobre están separadas por el electrolito. Si se conectan con un alambre, la corriente eléctrica fluye a través del conductor, pero tan pronto como el circuito se interrumpe porque el alambre se desconecta, deja de fluir. Esta pila no dura indefinidamente, ya que el ácido sulfúrico ataca al cinc, y cuando éste se consume, la pila se agota. Para reactivarla, será necesario reponer la placa de cinc y el ácido del electrólito. Debido a las reacciones químicas que tienen lugar dentro de la pila, se desprenden pequeñas burbujas de hidrógeno que se adhieren al electrodo de cobre y forman una capa aislante; cuando esto sucede, la corriente no pasa y se dice que la pila está polarizada. Para eliminar este inconveniente, se agregan ciertas sustancias químicas que se combinan con el hidrógeno y evitan los efectos polarizantes.
En tiempos pasados se usaron diversos tipos de pilas primarias para el funcionamiento de aparatos telefónicos, telegráficos, alarmas contra incendios, y otros sistemas de señales. En la actualidad, excepto en lugares sumamente alejados, la corriente eléctrica para estos fines se obtiene ya casi siempre directamente de las líneas de transmisión.
Pilas Galvánicas:
Una aplicación realmente útil de lo visto antes, es aprovechar el traspaso de electrones en forma espontánea. Esto se puede hacer por medio de un hilo conductor, pero se debe tener en cuenta el mantener separados los átomos de cobre de los de plata para, de esta forma, evitar la entrega directa de electrones.
En la figura de abajo se muestra un esquema de un dispositivo en el cual se logra hacer pasar los electrones desde los átomos de cobre hasta los iones de plata, pasando por un hilo conductor.
Esta es la conocida pila galvánica o voltaica, un generador de corriente eléctrica que se produce por el flujo espontáneo de electrones desde el electrodo 1 al electrodo 2.
El electrodo 1 toma carga negativa al recibir los electrones cedidos por los átomos de cobre. En cambio, el electrodo 2, del que los iones Ag+ retiran electrones, toma carga positiva.
El electrodo donde se produce la oxidación, en este caso en electrodo 1, se denomina ÁNODO. Esta es la ecuación:
Cu(s) ð Cu+2 (aq) + 2 e-
El electrodo donde se produce la reducción, en este caso el electrodo 2, toma el nombre de CÁTODO.
2 Ag+(aq) + 2 e- ð 2 Ag (s)
La reacción global de la pila, la misma que vimos con las reacciones redox, es la suma de las dos semireacciones, la anódica y la catódica es la siguiente:
2 Ag+ (aq) + Cu (s) ð 2 Ag (s) + Cu+2 (aq)
En esta pila galvánica, al igual que en todas, el ánodo es el electrodo negativo y el cátodo el electrodo positivo.
Para que funcione correctamente esta pila galvánica, los compartimentos deben permanecer eléctricamente neutros. A medida que el cobre se oxide, la disolución que rodea al ánodo va tomando carga positiva, por los iones Cu+2 que se forman. Además, a medida que los iones Ag+ se van reduciendo a plata neutra, la disolución que rodea al cátodo va tomando carga negativa, porque van quedando menos iones Ag+ que de NO3-.
Para que los compartimentos se mantengan eléctricamente neutros, se utiliza un puente salino, este consiste en un tubo que contiene un electrolito ajeno a las reacciones que ocurren en los electrodos. A medida que la pila funciona, los iones negativos del puente salino se difunden hacia el compartimento donde se forman los iones Cu+2, mientras que los positivos lo hacen hacia el compartimento donde se consumen los iones Ag+. De esta forma se produce una especie de equilibrio eléctrico.
Los extremos del puente salino deben cerrarse con tapones porosos para evitar la entrega inmediata de todos los iones.
En este caso se ha puesto un ejemplo en particular de reacción redox espontánea, pero para construir una pila galvánica, se puede usar cualquier otra reacción redox espontánea, y el voltaje obtenido dependerá de la reacción y de las concentraciones de las mismas.
POTENCIAL ESTANDAR DE REDUCCION.-
El voltaje, o fuerza electromotriz (f.e.m.), suministrada por una pila galvánica, se designa por Epila, y es la diferencia de potencial entre sus dos electrodos.
La Epila es igual a Ecat (potencial cátodo) - Ean (potencial ánodo). En una pila galvánica, el cátodo está cargado positivamente con respecto al ánodo, por lo cual Ecat > Ean.
El potencial de los electrodos, y la f.e.m. de la pila, dependen de las concentraciones de todas las especies que intervienen en las semireacciones de electrodos. Por esto, se denomina fuerza electromotriz estándar o normal, al valor de Epila cuando las concentraciones de todos los iones implicados en la reacción de la pila es 1 M, la presión de los gases, 1 atm, y la temperatura, 25ºC. Esta fuerza electromotriz estándar o normal se denomina como Eºpila.
En el caso que ya conociéramos los potenciales estándar del cátodo y del ánodo, o sea, en las condiciones antes mencionadas, podríamos obtener la fuerza electromotriz estándar de la pila con la siguiente formula:
Eºpila = Eºcat - Eºan.
Para asignar valores a los potenciales de los distintos electrodos se debe escoger uno de ellos como referencia y asignarle un valor arbitrario. Esto se debe hacer porque no hay modo de medir el potencial absoluto de un electrodo, porque sólo pueden medirse diferencias entre los potenciales de dos electrodos.
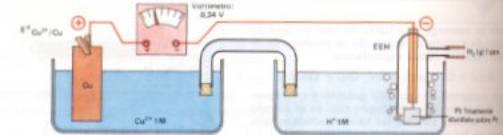
El electrodo elegido para esta función de referencia es denominado electrodo estándar o normal de hidrógeno o, abreviadamente, EEH. Consta de un electrodo de platino sobre el que se burbujea hidrogeno gaseoso a 1 atm, y que está sumergido en una disolución, a 25ºC, que contiene iones H+ en concentración 1 M. El electrodo de platino está recubierto de partículas de platino muy finamente divididas, cuyo objeto es catalizar la reacción de electrodos. Por convenio, al EEH se le asigna un potencial de 0,00 voltios. La reacción que ocurre en la superficie de platino es:
2 H+(aq, 1 M) + 2 e- ðð H2 (g, 1 atm) EºH+/H2 = 0 V (a 25ºC).
Con EEH como referencia, odemos asiganr un valor al potncial de cualquier otro electrodo. Por ejemplo, consideremos un electrodo formado por una barra de cobre sumergida en una disolución 1 M de iones Cu+2, a 25ºC. Podemos conectarlo al EEH y formar una pila galvánica.
La f.e.m. de esta pila, medida con un voltímetro, es de 0,34 V y se trata de Eºpila ya que todas las especies se encuentran en condiciones estándar. Además, el electrodo de cobre aparece acrgado positivamente respecto al de platino. Esto indica que el electrodo de cobre actúa como cátodo y el EEH actúa de ánodo. Ambos procesos se puedden describir como se indica a continuación:
Cátodo: Cu+2 (aq) + 2 e- ð Cu (s)
Ánodo: H2 (g) ð 2 H+ (aq) + 2 e-
Reacción global: Cu+2 (aq) +H2(g) ð Cu(s) + 2 H+ (aq)
Entonces la f.e.m. estándar de la pila es:
Eºpila = EºCu+2 / Cu - EºH+ /H2 = 0,34 V = EºCu+2 / Cu - 0,00
Y, por lo tanto,
EºCu+2 / Cu = 0,34 V
El potencial estándar del electrodo de Cu+2/Cu es +0,34 V. Recuerda que es un valor relativo, no absoluto; esto significa que el potencial estándar del electrodo Cu+2 /Cu es 0,34 V más alto que el del EEH. Así, si al EEH le hubiéramos asignado un potencial de 1 V, entonces EºCu+2 / Cu sería +1,34 V.
El EEH también puede actuar de cátodo. Este es el caso de la pila construída cnectando una barra de cadmio, sumerfgida en una disolución de 1 M de iones Cd+2, con el EEH.
Un voltímetro nos dice que la f.e.m estándar de una pila vale 0,40 V. Ahora, el electrodo del platino del EEH está cargado positivamente respecto del electrodo de cadmio. Por tanto el EEH actúa de cátodo, y el electrodo de cadmio, de ánodo.
Cátodo: 2 H+ (aq) + 2 e- ð H2 (g)
Ánodo: Cd (s) ð Cd+2 (aq) + 2 e-
Reacción global: 2 H+ (aq) + Cd (s) ð H2 (g) + Cd+2 (aq)
Entonces:
Eºpila = EºH+ /H2 - EºCd+2 /Cd = 0,40 V =0,00 - EºCd+2 /Cd
EºCd+2 /Cd = -0,40 V
El valor negativo de EºCd+2 /Cd indica que el electrodo de Cd es el ánodo, y el EEH el cátodo. Esto significa que los iones Cd+2, en concentración 1 M, tienen menos tendencia a reducirse que los iones H+, en concentración 1 M.
En general, si el potencial de un electrodo es positivo, actuará de cátodo al conectarlo con el EEH, produciéndose en él la reducción. Por el contrario, si es negativo, actuará de ánodo y en el se dará la oxidación. Por lo tanto, el valor del potencial de un electrodo es una medida de la tendencia en que en él se produzca una reducción. Por esta razón, los potenciales del electrodo así medidos se denominan potenciales de reducción.
TIPOS DE PILA:
Clasificación:
Las pilas se pueden dividir en dos tipos principales de estas, primarias o secundarias. Una pila primaria produce energía consumiendo algún químico que esta contiene. Cuando este se agota, la pila ya no produce mas energía y debe ser reemplazada. Por ejemplo en este grupo encontramos a las pilas de zinc-carbono.
Las pilas secundarias, o pilas de almacenamiento, obtienen su energía transformando alguno de sus químicos en otro tipo de químicos. Cuando el cambio es total, la pila ya no produce mas energía. Sin embargo, esta puede ser recargada mandando una corriente eléctrica de otra fuente a través de ella para así poder volver a los químicos a su estado original. Un ejemplo de este grupo es la batería de auto o pila de ácido-plomo.
Nombrando los tipos de pilas debemos mencionar las pilas experimentales, estas aunque aun se pueden clasificar en alguno de estos dos grupos, deben mencionarse aparte ya que son hechas a pedido y responden a necesidades especificas. Por ejemplo, una pila que deba alimentar a radiotransmisor en una región montañosa en una central autónoma, este tipo de pilas debería poder soportar grandes periodos de tiempo, ser muy confiable y probablemente soportar temperaturas extremas. O el claro ejemplo de las pilas usadas en los transbordadores espaciales ya que estas no pueden ser reemplazadas luego del lanzamiento.
Pilas primarias:
Sistema de dióxido de Zinc-Manganeso: Este es el tipo más usado de pilas en el mundo. Su usos típicos son, linternas, juguetes, walkmans, etc... Hay tres variantes para este tipo de pila: la pila Leclanché, la pila de cloruro de zinc, y la pila alcalina. Todas entregan un voltaje inicial de 1.58 a 1.7 volts, el cual declina con el uso hasta un punto de 0.8 volts aprox. La pila Leclanché es la más económica de estas, fue inventada en 1866 por un ingeniero francés (la pila lleva su nombre Charles Leclanché). Se convirtió en un éxito instantáneo debido a su constituyentes de bajo presupuesto. El ánodo de este tipo de pila es una hoja de aleación de zinc, esta aleación contiene pequeñas cantidades de; plomo, cadmio y mercurio. El electrolito consiste en una solución acuosa y saturada de cloruro de amonio conteniendo 20% de cloruro de zinc. El cátodo esta compuesto de dióxido de manganeso impuro, mezclado con carbón granulado, para creas un cátodo húmedo con un electrodo de carbón.
Aunque fue patentada en 1899 la pila de cloruro de zinc es realmente una adaptación moderna a la pila de Leclanché. La gran diferencia esta en que gracias a sellados de plástico esta pila a podido terminar con el uso de cloruro de amonio. También el dióxido de manganesos de alta pureza. Este tipo de pila tiene una más larga duración que la pila de Leclanché. También esta pila puede traer confiabilidad satisfactoria sin usar mercurio en la aleación de zinc.
La más alta densidad energética (wats por cm cubico) de las pilas de zinc-manganeso se puede encontrar en pilas con un electrolito alcalino el cual permite una construcción completamente distinta al resto de su tipo. Esta estuvieron disponibles comercialmente durante la década de los 50. El cátodo de un dióxido-grafito de manganeso muy puro y un ánodo de una aleación de zinc enriquecida son asociados con un electrolito de hidróxido de potasio y puesto en una lata de acero. Aunque el mercurio contenido en la aleación de zinc solía ser de hasta un 6 a 8 porciento, actualmente se ha logrado reducir este índice a un impresionante 0.15%, para así poder reducir el impacto ambiental que estas producen. Esta de más decir que este tipo de pila es altamente superior a ambas de las descritas anteriormente.
Pilas de dióxido de manganeso-magneseo:
Este sistema funciona bien para aplicaciones especializadas. Se parece mucho a la pila de cloruro de zinc pero tiene 0.3 volts mas por pila. Las pilas de dióxido de manganeso-magneseo tienen una larga vida, alta densidad energética, son livianas las cuales las hacen ideales para el uso de pilas para el poder de los radiotransmisores de las radios militares. Una desventaja de este tipo de pila es su funcionamiento en bajas temperaturas.
Pilas de mercurio con óxido-zinc:
Este sistema ocupa un electrolito alcalino. Ha sido largamente usada para el uso en pilas “botón” o las comúnmente usadas para relojes etc... Tienen una densidad energética de aproximadamente 4 veces mas que las pilas de zinc-manganeso. Es muy confiable y da casi siempre 1.35 volts, y gracias a esto se usa como una pila de referencia.
Pilas de plata con óxido-zinc:
Otra pila de tipo alcalina. Esta pila exhibe un cátodo de oxido de plata y un ánodo de polvo de zinc. Debido a que puede relativamente soportar altas cargas y tiene una casi constante, 1.5 volts de producción, este tipo de pila también es usado frecuentemente en relojes etc... También podemos encontrarla en algunos torpedos de uso militar, debido a su gran fiabilidad y capacidad.
Pilas de Litio:
El área de investigación de las pilas que ha atraído mas la investigación en los últimos años ha sido el área de las pilas con un ánodo de litio. Debido a su alta actividad química se deben usar electrolitos no acuosos como por ejemplo sales cristalinas. Se han hecho pilas que no tienen separación alguna entre el ánodo y el cátodo liquido, algo imposible con pilas de sistema acuoso. Una capa protectora se forma automáticamente en el litio, pero esta se rompe en la descarga permitiendo voltajes cercanos a los 3.6 volts. Esto permite una gran densidad energética. Sus usos varían desde la aeronáutica, marcapasos a cámaras automáticas.
Pilas de sulfuro Litio-hierro:
Estas pilas en porte miniatura ofrecen grandes capacidades y bajo costo. En operaciones que requieren de 1.5 a 1.8 volts, estas pueden ser un substituto a algunos tipos de pilas alcalinas.
Pilas de dióxido de litio-manganeso: Estas poco a poco van ganando aceptación. Tienen un voltaje de 2.8 volts, una alta densidad energética y un costo bajo dentro de las pilas de litio.
Pilas de monofluoruro de litio-carbono:
Estas han sido una de las pilas de litios mas comercialmente exitosas, de larga vida, alta densidad energética, buena adaptación a temperaturas y con un voltaje de 3.2 volts. Sin embargo, el costo de monofluoruro de carbono es alto.
Pilas de Litio-thionyl (lithium-thionyl): este tipo de pila provee la más alta densidad energética disponible comercialmente. El cloruro de thionyl no sirve solo como un solvente del electrolito sino que también como material del cátodo. Su funcionamiento es impresionante, ya sea a temperatura ambiente o hasta -54 grados celcius, por muy debajo del punto donde sistemas líquidos dejan de funcionar. Su uso va de equipos militares, vehículos aerospaciales hasta los famosos beepers.
Pilas de dióxido de litio-sulfuro: Este tipo de pila ha sido extensivamente usado en los sistemas de energía de emergencia de muchos aviones entre otros usos. El cátodo consiste en un gas bajo presión con otro químico como electrodo salino; muy parecido al funcionamiento del sistema anterior. Este sistema funciona increíblemente bien, pero se ha encontrado que aveces luego de su uso en frío libera gases tóxicos tales como dióxido de sulfuro.
Pilas de aire-depolarizado.
Una manera muy practica de obtener alta densidad energética es usar el oxigeno en el aire como “liquido” del material del cátodo. Si es juntado con un ánodo tal como el zinc, larga vida a bajo costo, pueden ser obtenidos. La pila, eso sí, debe ser construida de manera tal de que el oxigeno no entre en contacto con el ánodo, el cual atacaría.
Pilas de zinc-aire:
El diseño y principio de estas pilas es relativamente simple, pero su construcción no lo es, ya que el electrodo de aire debe ser extremadamente delgado. Se han hecho muchos estudios y grandes avances se han hecho en el aire del sellado del aire y la optimización de este tipo de pilas.
Pilas de aluminio-aire:
Estas no han tenido una gran aceptación comercial, pero su pequeñísimo peso y su gran densidad energética potencial han hecho que grandes estudios se hayan llevado acabo en esta área, tales como prolongar la vida de esta pila entre otros. Si estos problemas son resueltos podríamos ver grandes aplicaciones para este tipo de pilas en el futuro, incluidos su uso en autos eléctricos o incluso camiones.
Existen muchos otros tipos de pilas primarias usadas a más pequeña escala por ejemplo pilas de las cuales se sabe su rendimiento exacto como la pila de zinc-mercurio o sulfato-mercurio (1.434 volts) o las pilas de cadmio-mercurio o sulfato-mercurio (1.019 volts). O pilas tal como las de cloruro de magneseo-plata o cloruro de magneseo-plomo las cuales se ocupan en las operaciones submarinas donde el electrolito es el agua salina en el cual se encuentran sumergidas las pilas.
Pilas secundarias:
También llamadas pilas de almacenamiento.
Pilas de ácido-plomo:
Este tipo de pila ha sido la pila recargable mas ampliamente usada en el mundo. La mayoría de este tipo de pilas son construidas de planchas de plomo o celdas, donde una de estas, el electrodo positivo, esta cubierto con dióxido de plomo en una forma cristalina entre otros aditivos. El electrolito esta compuesto de ácido sulfúrico, y este participa en las reacciones con los electrodos donde sulfato de plomo es formado y lleva corriente en forma de iones. Estudios demuestran que la pila de plomo-ácido tiene una densidad energética de aproximadamente 20 veces mayor que la de las pilas de niquel-cadmio o niquel-hierro.
La razón por la cual este tipo de pila ha sido tan exitosa es que tiene un gran rango de entregar gran o poca corriente; una buena vida de ciclo con una gran fiabilidad para cientos de ciclos, facilidad de recargar, su bajo costo en comparación al resto de las recargables, alto voltaje (2.04 volts por celda), facilidad de fabricación y la facilidad de salvataje de sus componentes.
Pilas alcalinas de almacenamiento:
En las pilas de almacenamiento de este tipo la energía es derivada de la reacción química en una solución alcalina. Este tipo de pilas usan diversos materiales como electrodos tal como los que nombraremos a continuación.
Pilas de hidróxido de niquel-cadmio:
Estas son las pilas portátiles más comunes que existen. Tienen la característica de poder dar corrientes excepcionalmente altas, pueden ser rápidamente cargadas cientos de veces, son tolerantes al abuso de sobrecarga. Sin embargo, comparadas con otros tipos de pila primarias e incluso con otras de su tipo, estas pilas son pesadas y tienen una limitada densidad energética. Estas pilas funcionan mejor si es que son dejadas a descargarse completamente antes de cargarse nuevamente, sino puede producirse un fenómeno conocido como el efecto de la memoria donde las celdas se comportan como si estas tuvieran menos capacidad para la cual fueron hechas. Su uso es muy variado podemos encontrarlas desde los sistemas de partida para los motores de un avión hasta en el walkman que uno esta usando. Este tipo de pila se comporta bien bajo temperaturas frías.
Pilas de hidróxido de niquel-zinc: están bajo investigación y si su vida puede ser alargada podrían ser un viable substituto para las pilas de niquel-cadmio.
Pilas de hidróxido de niquel-hierro: este tipo de pilas puede proveer miles de ciclos, pero no al recargar necesitan mucha energía y al funcionar se calientan mas de lo deseado.
Pilas de hidróxido de niquel-hidrógeno:
Estas pilas fueron desarrolladas principalmente para el programa espacial de los EE.UU. Los estudios demuestran que aleaciones de niquel pueden reversiblemente disolver o soltar hidrógeno en proporcionalmente a cambios en la presión y temperatura. Este hidrogeno serviría como un material de ánodo. Hay especulación de que este tipo de pila podría reemplazar a la de niquel-cadmio en alguna aplicaciones.
Pilas alcalinas recargables de dióxido de zinc-manganeso: Este tipo de pilas fueron diseñadas para actuar como substitutos en sistemas donde se requieran cantidades moderadas de energía. Su gran densidad energética y su bajo costo incitan a mas estudios.
Pilas de oxido de plata-zinc:
Aunque son caras, estas pilas son usadas cuando la densidad energética, el tamaño, y el peso son fundamentales. Después de años de que su uso fue restringido a minas y torpedos su uso se ha ido diversificando hasta llegar a la exploración submarina y sistemas de comunicaciones.
Pilas secundarias (o de almacenamiento) de litio:
Este tipo de pila muestra una gran promesa a futuro ya que su energía teóricamente va de 600 a 2,000 wats por hora por kg. Algunos elementos con los cuales se investiga son: disulfito de litio-titanio, dióxido de litio-manganeso y disulfito de litio-molibdeno.
Pilas secundarias (o de almacenamiento) de sodio-sulfuro:
Mucha experimentación se ha llevado a cabo con este tipo de pila que funciona al rededor de los 350 grados C'. Aun se deben resolver bastantes problemas relativo a su estabilidad. Especialmente cuando se toma en cuenta que necesita ser enfriada y calentada entre usos. Pero su economía y la entrega de 2.3 volts hacen que este sistema sea extremadamente atractivo, especialmente en el área de los automóviles eléctricos.
VENTAJAS Y DESVENTAJAS DE LAS PILAS.-
Hoy en día, las pilas ya son parte de nuestro diario vivir. Siempre usamos aparatos de nuestra vida cotidiana que usan pilas o están relacionados con una.
Además, la tecnología nos ha servido cada vez mas para poder crear pilas de mayor duración y efectividad para que así cumplan su objetivo en mejor forma.
Las pilas son tan usadas en nuestra vida diaria que su desaparición significarían desde que alguien no despertara debido a que no le sonó el despertador hasta la muerte de alguien que usaba marcapasos.
Por ejemplo, hoy en día la computación cada día está más avanzada y más interiorizada en la sociedad. Pero ¿qué sería de un computador sin pila? No podríamos ni siquiera prenderlo ya que al hacerlo, no sabría que hacer ni que programa ejecutar ya que esa memoria que es almacenada gracias a la pila, se habría perdido. O la información que guardamos en el disco duro desaparecería ya que éste necesita una pila también.
Otra ventaja de la pila, es la posibilidad que le ha dado a millones de personas de seguir viviendo, ya que un marcapaso está compuesto por una pila, y es precisamente de esa pila de lo que depende la vida de aquella persona.
Ejemplos de ventajas de las pilas más banales, pero no por eso menos importantes, sería fijarse en cuantos de los aparatos de los que usamos a diario usan pilas. No podríamos tener relojes, radios, televisores, otros aparatos portátiles, en fin una serie de aparatos con los cuales ya estamos acostumbrados a vivir.
Pero creemos que lo importante de las ventajas y desventajas de las pilas, es nombrar en este trabajo las desventajas con sus soluciones ya que frecuentemente son menos conocidas y no preocupantes. Las ventajas en general siempre se tienen en cuenta.
Las pilas no son inofensivas. Lo mejor es saber distinguir entre los distintos tipos de pilas que hay en el mercado y cuales son sus "contraindicaciones".
En general, se venden 5 tipos de pilas no "recargables" compuestas por los siguientes minerales:
1- carbón - zinc
2- alcalinas
3- cloruro de zinc
4- óxido de plata
5- óxido de mercurio
Las dos primeras son las más comunes; las usamos para radios, linternas, "walk-man", etc.
Ambas contienen diferentes porcentajes de mercurio. Las otras tres también se venden mucho y son las baterías, botón de los relojes, calculadoras, cámaras de fotos. El porcentaje de óxido de mercurio en éstas puede llegar al 50% de su peso total. En ambos grupos existe un elemento altamente contaminante: el mercurio.
Cuando uno arroja pilas con mercurio a la basura, estas van a parar junto con el resto de los residuos a la tierra. Y a pesar de estar descargadas, seguirán descargando ese mineral a su alrededor. Si multiplicamos las pilas que usa cada habitante por la cantidad de habitantes, nos daremos cuenta con horror, cómo estamos contaminando nuestra tierra con mercurio. O sea, que la posibilidad de ingesta de este mineral no es un mal lejano. Puede provocar daños cerebrales, en los riñones y en la función motor.
La mayoría (no todas) de las pilas y baterías "recargables" de ahora, carecen de mercurio. Sin embargo contienen níquel y cadmio, dos metales pesados altamente tóxicos.
La exposición al níquel puede destruir los tejidos de las membranas nasales. Mientras los estudios sobre el cadmio, lo califican como cancerígeno y causante de trastornos en el aparato digestivo. Además de resultar altamente peligroso para las embarazadas.
Jamás hay que tirar las pilas al inodoro o al río debido a que tienen un altísimo poder de contaminación en el agua.
En cuanto al destino final de las pilas, no es posible hoy en nuestro país y en muchos otros, pensar en el reciclado, no quedando otra alternativa que el almacenamiento en condiciones controladas.
Para las pilas alcalinas, no existe tecnología de reciclado desarrollada. En cuanto a las pilas de mercurio, que sí es posible reciclar, el problema es que el proceso es tremendamente costoso.
A corto y mediano plazo, no se vislumbra otro método posible que sustituir los metales tóxicos por otros que no presenten peligros, pero las alternativas que hasta ahora se han manejado, no ofrecen una solución universalmente practicable. En Alemania, existe desde 1986, un convenio entre el Ministerio de Medio Ambiente y los fabricantes, a fin de reducir el contenido de mercurio en las pilas. En España se busca una línea de pilas sin mercurio, y en diferentes países europeos se viene estudiando el problema relativo al poder contaminante que ellas poseen.
Las pilas son generadores portátiles que convierten la energía química en eléctrica. Por sus características químicas, pueden considerarse residuos nocivos con presencia de metales pesados.
Las pilas alcalinas, están compuestas por dióxido de manganeso y zinc, y las comunes por zinc y carbono.
Respecto a las microfilms, existen diferentes clases: las constituidas por zinc-aire, las alcalinas, las de óxido de plata, las de litio y 1as de óxido de mercurio, habiendo una larga lista de otros componentes.
Según estudios especializados, una micro pila de mercurio, puede llegar a contaminar 600.000 litros de agua, una de zinc-aire12.000 litros, una de óxido de plata 14.000 litros y una pila común 3.000 litros.
Al descomponerse la capa protectora que las recubre, se liberan los metales que contienen, y allí se produce la contaminación.
CONCLUSIONES.-
Como hemos visto existen muchas formas de pilas, y en potencia existen muchas mas combinaciones posible por realizar. Gracias a las pilas se han logrado muchos avances como en el transporte, telecomunicaciones, en lo que sea las pilas han estado presente en la mayoría de los inventos y de seguro no estaríamos donde estamos sin ellas.
En la actualidad las pilas siguen siendo usadas para variadísimas formas de uso.
Ahora mismo los satélites en órbitas funcionan gracias a ellas, y cualquier otro objeto ya sea un objeto o invento que utilice las pilas.
En el futuro se veran mas y grandes avances gracias a la pila, y también se vera el desarrollo de esta, ya sea en el desarrollo de pilas más económicas o la construcción de las pilas con un alto grado de confiabilidad y una densidad energética muchísima más alta de las que tenemos en la actualidad.
Descargar
| Enviado por: | Giovanny Montoya |
| Idioma: | castellano |
| País: | Colombia |
